斑马鱼在转基因动物研究中的应用
2013-12-23刘丽丽王健吴巍王海胜闫艳春
刘丽丽 王健 吴巍 王海胜 闫艳春
(中国农业科学院研究生院,北京 100081)
1981年美国俄勒冈大学著名遗传学家George Streisinger在《Nature》杂志上发表关于斑马鱼人工雌核发育的研究论文,标志着斑马鱼开始进入实验室模式生物研究领域,至今已有超过30年的历史。20世纪90年代中国开始参与斑马鱼研究。近几年,随着斑马鱼模式生物南方中心、北方中心和国家种质资源库相继成立,中国斑马鱼研究也开始进入高速发展阶段。由于体积小、代时短、胚胎透明、体外发育等特点,斑马鱼在模式生物研究中的地位越来越重要。随着显微注射、重组体构建以及荧光标记等技术的快速发展,转基因斑马鱼已经广泛用于脊椎动物基因表达调控、发育分化、形态发生、人类疾病、药物筛选和环境检测等研究领域。本文将就斑马鱼在转基因动物研究中的应用进行介绍,并对该领域存在的问题进行总结。
1 常见模式生物
1.1 模式生物的发展历史
模式生物(model organism)能够代表一类生物的基本特点,结构相对简单并易于进行试验操作,因此普遍用于遗传学、发育生物学、生理学和分子细胞学等方面的研究。其普遍特点是:首先,生理特征能够代表生物界的某一大类群;其次,试验材料容易获得,并易于在实验室内饲养、繁殖速度快,研究维持费用低;最后,容易进行试验操作,特别是遗传学分析[1]。一般认为模式生物的应用源于格里高·约翰·孟德尔(Gregor Johann Mendel)以豌豆为材料对遗传学的研究。1866年孟德尔曾发表文章说他的试验是“解决问题的唯一方法”。此后对模式生物的选择遵循两个方面的原则:一是该物种在系统进化中的地位符合研究目的,二是该物种特性适于特定研究的试验需要[2]。在漫长的科学研究历史中,各领域发展了多种模式生物,如大肠杆菌、酿酒酵母、秀丽隐杆线虫、海胆、果蝇、拟南芥及小鼠等。模式生物的应用大大促进了基础生命科学和实验技术的发展。为阐明模式生物的遗传背景,促进基因组研究,人类基因组计划(HGP)最先提出模式生物基因组计划,并初步确定了6种模式生物:大肠杆菌、酵母、线虫、果蝇、拟南芥和小鼠。
1.2 模式生物的各自特点及应用领域
自从莱德伯格(Joshua Lederberg)应用大肠杆菌(Escherichia coli,E. coli)进行遗传学研究以来[3],大肠杆菌迅速成为广泛应用的原核模式生物。它具有遗传背景清楚、操作技术简便、成本低、易于大规模培养等特点和优点,而且还特别适合作为外源基因表达的宿主。因此,大肠杆菌是目前应用最广泛、最成功的克隆原核基因的表达体系。酿酒酵母(Saccharomyces cerevisiae)作为最简单的低等单细胞真核生物之一,是研究细胞周期、胚胎形态发生、染色体稳定性和衰老的优秀模型,哈特维尔(Leeland H. Hartwell)和纳斯(P. M. Nurse)以酿酒酵母为材料,为揭示细胞周期的调控机理作出了重要贡献。前者提出了细胞周期关卡(cell-cycle checkpoint)的概念,并确定了大量的控制细胞周期的基因(cdc),后者从粟酒酵母(S. pombe)中分离到第一个基因cdc2,并提出来相关的调控体系[4]。秀丽隐杆线虫(Caenorhabditis elegans)结构非常简单,一条雌雄同体的秀丽隐杆线虫只有不超过1 000个细胞,遵循特定的分裂模式。同时,它还具有多细胞生物的基本特征,如复杂的器官系统(complex organ system)、社会行为、性行为和学习行为等,为传染性疾病[5]和多种人类疾病[6]的研究提供模型。许多生物进化的保守机制都是通过秀丽隐杆线虫阐明的,包括程序性细胞死亡(programmed cell death)[7]、胰岛素信号[8]、衰老[9]和神经生物学(neurobiology)[10],也使自然免疫和RNA干扰(RNAi)机制的研究取得了巨大进展[11]。20世纪70-80年代,基于对果蝇(Drosophila melanogaster)的研究工作,兴起了胚胎学和分子生物学,从此果蝇成为遗传学研究最重要的材料之一。试验中分离鉴定到大量的果蝇突变体,促进了动物发育学和疾病的研究。拟南芥(Arabidopsis thaliana)是植物界最重要的模式生物,在研究器官发育、植物干细胞生 物 学[12]、图 式 形 成(pattern formation)[13]、先天免疫(innate immunity)[14]、昼夜节律(circadian rhythm)[15]、各种性征的自然突变[16]以及诸多发育机制中都取得了重要的进展。由于与人类的近亲关系,小鼠(Musmusculus)是人类基因组研究最主要的模式生物之一,也是哺乳动物研究领域最重要的模式生物,广泛用于发育学、分子生物学、分子遗传学、免疫学和生物医学等研究领域[17]。小鼠为人类疾病的研究,包括癌症、动脉粥样硬化、高血压、糖尿病、骨质疏松和青光眼等作出巨大贡献。同时,基因组的靶标操作[18]、正向遗传突变筛选[19]和体外成像技术[20]的高速发展也使小鼠成为干细胞研究的主要模式生物之一。
2 斑马鱼作为模式生物的优越性
作为模式生物,斑马鱼(Danio rerio)不仅有脊椎生物的一般特点,而且具备诸多技术优势:饲养简单、成本较低、繁殖力强、胚胎透明、个体较小、时代时间短、遗传信息丰富、拥有大量实验室突变系、可进行正向和反向遗传分析等[21,22]。
斑马鱼个体较小,可以在较小的空间里繁殖高密度的种群,利于节省试验成本。时代时间较短,仅3-4个月,有助于长期的遗传学研究。实验室条件下,斑马鱼可常年产卵,允许连续大规模繁殖后代。通常,雌性每周可产卵一次,每次产卵50-200枚。胚胎发育快,受精后24 h(hpf)身体成型,大部分器官96 hpf内发育完全。斑马鱼胚胎个体小,可在微孔反应板上培养;与哺乳动物胚胎在子宫内发育的情况不同,斑马鱼是体外发育(图 1),便于人工操作,如通过控制培养液直接对胚胎进行水处理(water treatment);胚胎透明度高,且发育快速,易于观察,适于进行显微注射。斑马鱼全基因组测序已于2005年完成(http://zebrafish.org/zirc/home/guide.php),丰富的遗传信息为确定斑马鱼各种生物学参数的标准值、鉴定试验突变体提供了依据。基于实验室研究的迅速发展,现已获得多种具有不同特性的斑马鱼突变品系,能满足不同试验需求[23]。
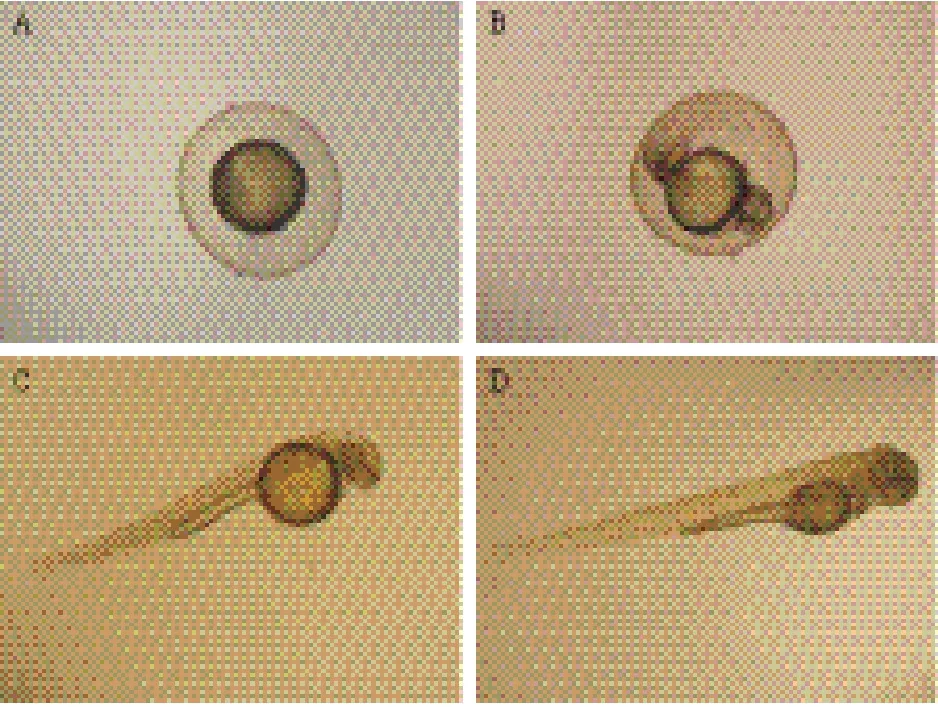
图1 斑马鱼体外受精
丰富的遗传信息、充足的突变体材料和多种技术优势使斑马鱼成为脊椎生物发育学、遗传学、生态学、基础生物医药学、毒理学等多个领域的优秀模式生物。(1)斑马鱼体外受精,胚胎透明度高,可活体观察表型变化,进行表型筛选 。(2)高度的光学透明性也允许在保持胚胎完整的条件下,甚至活体条件下,对相关基因的时空表达模式进行观察分析。如通过整体胚胎原位杂交技术检测基因转录产物的表达[24],或通过免疫组化技术检测基因翻译产物的表达,其他技术如RT-PCR、免疫共沉淀也可用于斑马鱼基因表达信息研究[25]。(3)后代数目大、胚胎体积小、发育快,允许斑马鱼用于高通量筛选,而且许多人类疾病在胚胎早期即表现病变性状[26],其在表形筛选方面的独特优势使斑马鱼成为发现新药的有效药理学工具[27]。(4)斑马鱼还用于研究传染性和遗传性人类疾病的研究,如分歧杆菌病[28]和神经性疾病[29]。(5)可利用斑马鱼进行正向遗传筛选发现疾病中基因的新功能。斑马鱼是迄今为止唯一能进行大规模正向遗传筛选的脊椎动物[30]。(6)斑马鱼也是常用的脊椎动物毒理学模型,用作生态毒理学测试物种,检测水质中化学物质对鱼类生存、生长和繁殖状况的影响。但基于动物权益维护和环境保护的需要,目前斑马鱼胚胎毒理学测试仅作为备用手段用于减少或代替实时监测 。
但实验室养殖斑马鱼也有困难,该种群易发生微孢子虫病和分枝杆菌病,这两种难治愈且不易根除的传染性疾病[31]。此外,斑马鱼生物学和生态学的信息还十分有限[32],基因组数据库也不完善,不能满足当前研究的需要。目前斑马鱼的反向遗传学手段应用较少,使用特殊设计并合成的吗啉代寡聚核糖核酸(morpholino)可以暂时性的抑制目的基因的表达。
3 斑马鱼转基因技术的发展现状
20世纪80年代,中国科学院朱作言领导的实验室在世界上率先开展了鱼类基因工程定向育种研究,建立了完整的转基因鱼理论模型和完善的试验技术体系,为转基因鱼育种奠定了理论基础[33]。30年来,斑马鱼转基因技术的迅速发展为斑马鱼基础理论研究和实际应用奠定了基础。目前,实验室有几种技术成功用于斑马鱼转基因研究。
3.1 显微注射技术
斑马鱼胚胎显微注射技术是进行基因瞬时表达、过量表达、降低表达、制备转基因斑马鱼或诱发突变的重要手段,该方法操作相对简单、效果可靠,是斑马鱼转基因研究的主要方法,获得转基因斑马鱼种系的频率为10%-30%[34]。一般认为,质粒DNA注射到受精卵细胞质后立即形成大分子量多联体(concatemers),并可能参与基因重组[35]。但是外源基因的多联体整合,容易为染色体内重组提供条件,最终可能导致外源基因表达的改变。
3.2 GAL4/UAS系统和Tol2转座子
显微注射技术通常使用含标记蛋白的质粒载体(如pEGFP-N1),现在一些其他类型的载体也用于斑马鱼转基因研究。GAL4/UAS转录激活系统可以同时表达两个外源基因,以提高其在宿主细胞中表达水平[36],并越来越多的用于斑马鱼基因调控和转录沉默机制的研究。通常斑马鱼中使用的Tol2转座子去除了内部原有的转座酶编码区域并用EGFP基因序列代替,注射时将其与转座酶一起转到斑马鱼受精卵中,转座酶以一定几率完整切割转座元件,这些转座元件随之整合到斑马鱼基因组中。有学者将Gal4/UAS与Tol2元件联合使用,成功实现了斑马鱼基因组水平上的插入表达[37]。
3.3 拟型反转录病毒和杆状病毒介导法
拟型反转录病毒也已经成功用于斑马鱼研究,它的插入效率比Tol2转座子更高,而且与显微注射相比,使用该方法得到的转基因奠基者(transgenic founder)之间表达范围的差异性比较小。尽管如此,由于逆转录病毒转基因技术所需的构建、包装、效价评定和转染耗时较长,因此该技术不能用于常规转基因斑马鱼的构建和启动子及基因功能的分析[38]。重组杆状病毒介导法是一种更新的方法。杆状病毒可以高效地转导哺乳动物细胞,Huang等[39]对杆状病毒加以改进:使用巨细胞病毒早早期启动子(CMV-IE),以加强型绿色荧光蛋白(EGFP)作报告基因。结果发现重组杆状病毒可以将外源基因高效地导入已分化的鱼类细胞,转基因细胞培养15 d内荧光持续较高亮度,继续培养一段时间可观察到荧光细胞的数目并未减少。
3.4 荧光标记
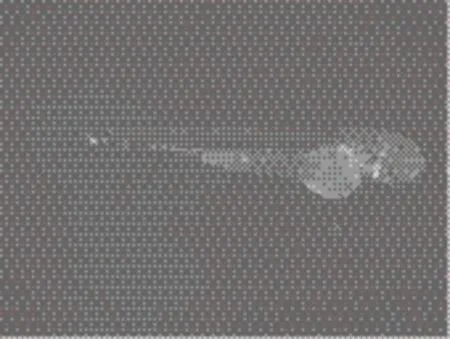
图2 转基因斑马鱼(5 dpf,受精后5 d)在激发光下表达荧光
随着绿色荧光蛋白(GFP)的发现及其晶体结构的破解,GFP越来越多地作为报告基因用于转基因研究。除野生型GFP外,现已发展了3种突变体,EGFP、GFP-S65T和RS-GFP[40]。GFP作为报告基因无需底物,现象明显易于观察,反应更敏感,成为转基因斑马鱼报告基因的理想选择(图2)。2003年,新加坡国立大学宫之远教授成功将绿色、红色、黄色和橙色荧光蛋白与肌肉特异性mylz-2启动子融合,成功构建了在骨骼肌高度表达荧光蛋白的各色转基因斑马鱼品系,日光和紫外灯下都可以肉眼观察到转基因斑马鱼发出荧光[41]。
4 转基因斑马鱼的应用前景
由于胚胎体积小、透明度高、发育快等特点,斑马鱼成为研究脊椎动物基因表达调控和发育分化、形态发生、人类疾病、药物筛选和环境检测等领域最重要的模式生物之一。
4.1 转基因斑马鱼用于基因表达和发育调控研究
以斑马鱼为模式生物,利用转基因技术,科学家们对脊椎动物热生物学进行了系统的研究,包括温度对斑马鱼生长发育、繁殖和性别分化的影响,温度对生理节律、动物行为的调节,温度对基因表达(如热激蛋白)的影响等。此外,对生物钟系统、细胞周期、神经发育学都有广泛的研究。孟安明,林硕[42]利用斑马鱼GATA-2基因5'侧翼调控序列和GFP基因,获得了只在中枢神经细胞表达GFP或在神经细胞和表层细胞都表达GFP的转基因斑马鱼种系,同时还进一步证实了GATA-2基因在胚胎发育中的时空表达谱。
4.2 活体形态发生和细胞迁移研究
为观察胰外分泌腺细胞的分化、增殖和形态发生,用弹性蛋白酶A启动子调控GFP在斑马鱼胰腺外分泌腺中特异性表达,发现胰腺在发育早期是一个紧密结合的实体,然后沿肠向后延伸[43]。Kawakami等[44]将GFP融合斑马鱼nanos1基因3' UTR,合成RNA后注射到几种硬骨鱼体内,成功观察到原生殖细胞向生殖脊迁移,但是这种方法目前并不能适用于所有硬骨鱼类。
4.3 人类免疫性疾病、自体吞噬和神经性疾病的研究
斑马鱼遗传操作简单,已经成功用于多种人类疾病模型的构建,在研究人类疾病发病机理、治疗手段等方面作出了卓越贡献。例如,通过斑马鱼启动子表达显性突变基因,构建荧光重组体,瞬时过表达和反义基因敲除技术的应用,对人类中央核性疾病、亨廷顿舞蹈症、多谷氨酰胺疾病和老年痴呆症等多种疾病进行了深入研究[45]。
4.4 荧光鱼筛查突变体、阻断特殊发育途径的小分子或抑制正常发育的毒素
Wan等[43]将elaA:gfp转入猥因子接受缺陷型斑马鱼突变体slow muscle omitted,发现猥因子为外分泌腺形态发生所必需,但不影响细胞分化。对该转基因品系进行吗菲林基因敲除和毒剂介导的细胞切除,发现胰腺外分泌腺发育依赖Islet-1基因。注射elaA启动子驱动的白喉毒素DTA导致外分泌细胞选择性消融,但内分泌腺和其他内胚层发育来的器官不受影响。该研究成功揭示了猥因子和白喉毒素对胰腺正常发育的重要影响。基因荧光标记鱼类与反求遗传学方法联合起来可以分析在特殊的发育途径中已知基因的作用规律。
4.5 转基因斑马鱼用于生态环境监测
近年来,国内外运用转基因斑马鱼检测水体环境中的重金属毒性、环境激素、综合毒性和有机污染物毒性等,成效显著,日益受到关注。目前主要通过3种途径使用转基因斑马鱼对环境污染物进行监测[46]。第一种方法是使用整合了大量大肠杆菌穿梭载体的转基因斑马鱼检测环境诱变剂,如以荧光定位的转换来测试诱变剂的活性;第二种方法是使用受到不同环境污染物,如芳烃、重金属或环境雌激素污染影响的启动调控元件,利用该元件诱导荧光或荧光酶的表达;第三种方法是利用组织特异性表达的荧光鱼筛选随特殊发育途径产生特殊作用的环境毒素。
在受热、重金属等压力胁迫条件下,生物体细胞中的热激蛋白HSP会在保护和修复途径中发挥重要作用。Seok等[47]利用斑马鱼转基因技术研究硫酸铜对人类HSP70启动子的特异性激活,表明斑马鱼可以作为转基因生物传感器检测环境中的异生毒性物质。纪喜文等[48]构建了一种GFP 转基因斑马鱼报告系统。利用芳香烃反应元件AHRDtk 控制报告基因绿色荧光蛋白在斑马鱼体内的表达,通过显微镜观察转基因斑马鱼体内的绿色荧光表达情况,可以直观判断水环境中是否含有该类化学物质。上海复旦大学的研究人员[49]经过多年研究,成功构建了卵黄蛋白原1(vtg1)启动子调控绿色荧光蛋白表达的转基因斑马鱼品系,可以简便直观快速地监测环境中的雌激素类物质,如β-雌二醇(E2)、氯化镉(CdCl2)、玉米烯酮和雌三醇(E3)等。
5 斑马鱼转基因技术待解决的问题
由于斑马鱼基因组为二倍体,目前鉴定到的许多同源基因,尚不能确定是真正的同源基因还是由于注释不完整而对同一基因的不同解释,所以斑马鱼数据库亟待完善。斑马鱼转基因技术最主要的问题仍然是基因转化效率问题。目前最可靠、最普遍的方法是显微注射,该方法对操作人员的技术水平要求很高,在操作精确的条件下,转化率最高也仅维持在30%左右。另一个问题是嵌合体问题。由于基因整合的随机性和多样性,转基因鱼亲本是携带外源基因的嵌合体,外源基因在各个性腺细胞基因组内的整合的数量与位点不尽相同,由此导致子代群体在携带外源基因(包括数量和整合位点)上出现分离[33]。其他问题包括因使用其他物种的启动子序列可能导致的转基因沉默,外源基因整合位点的随机性,外源基因整合形成多联体等。
综上所述,斑马鱼因具有体积小、代时短、胚胎透明、体外发育等独特的优势,使之成为转基因动物研究领域最重要的模式生物之一,在研究基因表达、发育调控、形态发生、细胞迁移、人类疾病、发育毒素、环境监测、药物筛选等领域作出巨大贡献。作为新型模式生物,转基因斑马鱼在各领域得到广泛应用的同时,其理论研究和操作技术都亟待发展:外源基因在斑马鱼胚胎细胞内的重组机制尚不明确;基因转化效率有待提高;转基因斑马鱼体系的代系维持需要加强,同时还需要寻找更加高效灵敏的报告基因。随着研究理论和技术手段的日趋成熟,模式生物斑马鱼研究将引起更多关注并在更多的科学研究中发挥重要作用。
致谢:感谢中国科学院遗传与发育生物学研究所吴乃虎研究员在本文写作过程中给予指导和修正;感谢北京大学生命科学院张博实验室在试验研究过程中给予大力支持与帮助。
[1] 郭炳冉.发育生物学模式生物[J].生物学教学, 2008, 33(9):61-62.
[2] Müller B. Model organisms-A historical perspective[J]. Journal of Proteomics, 2010, 73(11):2054-2063.
[3] Lederberg J. Genetic recombination in Escherichia coli:disputation at Cold Spring Harbor, 1946-1996[J]. Genetics, 1996, 144(2):439-443.
[4] Hartwell LH. Yeast and cancer[J]. Bioscience Reports, 2004, 24(4-5):523-544.
[5] Yu ZY, Zhang J, Yin DQ. Toxic and recovery effects of copper on Caenorhabditis elegans by various food- borne and water- borne pathways[J]. Chemosphere, 2012, 87(11):1361-1367.
[6] Shi YC, Liao VHS, Pan TM. Monascin from red mold dioscorea as a novel antidiabetic and antioxidative stress agent in rats and Caenorhabditis elegans[J]. Free Radical Biology and Medicine, 2012, 52(1):109-117.
[7] Horvitz H. Worms, life, and death(Nobel lecture)[J]. Chembiochem, 2003, 4(8):697-711.
[8] Tatar M, Bartke A, Antebi A. The endocrine regulation of aging by insulin-like signals[J]. Science, 2003, 299(5611):1346-1351.
[9] Kenyon CJ. The genetics of ageing[J]. Nature, 2010, 464:504-512.
[10] Colon-Ramos DA. Synapse formation in developing neural circuits[J]. Current Topics in Developmental Biology, 2009, 87:53-79.
[11] Elliott SL, Sturgeon CR, Travers DM, Montgonery MC. Mode of bacterial pathogenesis determines phenotype in elt-2 and elt-7 RNAi Caenorhabditis elegans[J]. Developmental& Comparative Immunology, 2011, 35(5):521-524.
[12] Stahl Y, Simon R. Plant primary meristems:shared functions and regulatory mechanisms[J]. Current Opinion in Plant Biology, 2010, 13(1):53-58.
[13] Petricka JJ, Benfey PN. Root layers:complex regulation of developmental patterning[J]. Current Opinion in Genetics & Development, 2008, 18(4):354-361.
[14] Ryan CA, Huffaker A, Yamaguchi Y. New insights into innate immunity in Arabidopsis[J]. Cell Microbiol, 2007, 9(8):1902-1908.
[15] Mas P, Yanovsky M. Time for circadian rhythms:plants get synchronized[J]. Current Opinion in Plant Biology, 2009, 12(5):574-579.
[16] Alonso-Blanco C, Aarts M, Bentsink L, et al. What has natural variation taught us about plant development, physiology, and adaptation[J]. Plant Cell, 2009, 21(7):1877-1896.
[17] Dwinell MR, Lazar J, Geurts AM. The emerging role for rat models in gene discovery[J]. Mammalian Genome, 2011, 22(7-8):466-475.
[18] Hogan B. A shared vision[J]. Developmental Cell, 2007, 13(6):769-771.
[19] Gondo Y, Fukumura R, Murata T, et al. Next-generation gene targeting in the mouse for functional genomics[J]. Bmb Reports, 2009, 42:315-323.
[20] Nowotschin S, Eakin G, Hadjantonakis A. Live-imaging fluorescent proteins in mouse embryos:multi-dimensional, multi-spectral perspectives[J]. Trends in Biotechnology, 2009, 27(5):266-276.
[21] Chen S, Zhu Y, Xia W, et al. Automated analysis of zebrafish images for phenotypic changes in drug discovery[J]. Journal of Neuroscience Methods, 2011, 200(2):229-236.
[22] Nathan DL, Wolfe SA. Forward and reverse genetic approaches for the analysis of vertebrate development in the zebrafish[J]. Developmental Cell, 2011, 21(1):48-64.
[23]http://zfin.org/action/fish/search.
[24] Long Y, Li Q, Zhong S, et al. Molecular characterization and functions of zebrafish ABCC2 in cellular efflux of heavy metals[J]. Comparative Biochemistry and Physiology, Part C, 2011, 153(4):381-391.
[25] Xu X, Zhang L, Weng S, et al. A zebrafish(Danio rerio)model of infectious spleen and kidney necrosis virus(ISKNV)infection[J]. Virology, 2008, 376(1):1-12.
[26] Williams A, Sarkar S, Cuddon P, et al. Novel targets for Huntington's disease in an mTOR-independent autophagy pathway[J]. Nature Chemical Biology, 2008, 4:295-305.
[27] Hill AJ, Teraoka H, Heideman W, et al. Zebrafish as a model vertebrate for investigating chemical toxicity[J]. Toxicological Sciences, 2005, 86(1):6-19.
[28] Prouty MG, Correa NE, Barker LP, et al. Zebrafish-Mycobacterium marinum model for mycobacterial pathogenesis[J]. FEMS Microbiology Letters, 2003, 225(2):177-182.
[29] Fleming A, Rubinsztein DC. Zebrafish as a model to understand autophagy and its role in neurological disease[J]. Biochimica et Biophysica Acta, 2011, 1812:520-526.
[30] McGonnell IM, Fowkes RC. Fishing for gene function—endocrine modelling in the zebrafish[J]. Journal of Endocrinology, 2006, 189:425-439.
[31] Lawrence C. Advances in zebrafish husbandry and management[J]. Methods in Cell Biology, 2011, 104:429-451.
[32] Spence R, Gerlach G, Lawrence C, et al. The behavior and ecology of the zebrafish, Danio rerio[J]. Biological Reviews, 2008, 83:13-34.
[33] 朱作言, 许克圣, 谢岳峰, 等.转基因鱼模型的建立[J].中国科学B辑, 1989, 2:147-155.
[34] Udvadia AJ, Linney E. Windows into development:historic, current, and future perspectives on transgenic zebrafish[J]. Development Biology, 2003, 256(1):1-17.
[35] 陈建泉, 成国祥, 徐少甫.显微注射外源DNA在早期胚胎中的命运[J].细胞生物学杂志, 1999, 21:23-26.
[36] Akitake CM, Macurak M, Halpern ME, Goll MG. Transgenerational analysis of transcriptional silencing in zebrafish[J]. Developmental Biology, 2011, 352(2):191-201.
[37] Asakawa K, Kawakami K. The Tol2-mediated Gal4-UAS method for gene and enhancer trapping in zebrafish[J]. Methods, 2009, 49(3):275-281.
[38] Linney E, Hardison NL, Lonze BE. Transgene expression in zebrafish:a comparison of retroviral-vector and DNA-injection approaches[J]. Developmental Biology, 1999, 213(1):207-216.
[39] Huang F, Cao S, Cui X, et al. Efficient gene delivery into fish cells by an improved recombinant baculovirus[J]. Journal of Virological Methods, 2011, 173(2):294-299.
[40] 林爱星, 刘小军, 陈永福.绿色荧光蛋白及其在转基因表达检测中的应用[J].农业生物技术学, 1997, 5:280-285.
[41] Gong Z, Wan H, Tay TL, et al. Development of transgenic fish for ornamental and bioreactor by strong expression of fluorescent proteins in the skeletal muscle[J]. Biochemical and Biophysical Research Communications, 2003, 308(1):58-63.
[42] 孟安明, 林硕.利用GATA-2调控成分制备组织特异性表达GFP的转基因斑马鱼[J].科学通报, 1999, 21:2283-2287.
[43] Wan H, Korzh S, Li Z, et al. Analyses of pancreas development by generation of gfp transgenic zebrafish using an exocrine pancreasspecific elastaseA gene promoter[J]. Experimental Cell Research, 2006, 312(9):1526-1539.
[44] Kawakami Y, Saito T, Fujimoto T, et al. Visualization and motility of primordial germ cells using green fluorescent protein fused to 3'UTR of common carp nanos-related gene[J]. Aquaculture, 2011, 317(1-4):245-250.
[45] Fleming A, Rubinsztein DC. Zebrafish as a model to understand autophage and its role in neurological disease[J]. Biochimica et Biophysica Acta, 2011, 1812(4):520-526.
[46] 吴玉萍, 熊茜, 张广献, 等.斑马鱼基因工程的研究进展[J].遗传学报, 2004, 31(10):1167-1174.
[47] Seok SH, Park JH, Baek MW. Specific activation of the human HSP70 promoter by copper sulfate in mosaic transgenic zebrafish[J]. Journal of Biotechnology, 2006, 126(3):406-413.
[48] 纪喜文, 田雪, 徐殿胜.一种新型转基因斑马鱼毒物检测系统的建立[J].化学与生物工程, 2010, 9:69-72.
[49] Chen H, Hu J, Yang J, et al. Generation of a fluorescent transgenic zebrafish for detection of environmental estrogens[J]. Aquatic Toxicology, 2010, 96(1):53-61.
