源于中间偃麦草的抗条锈基因YrCH223的遗传分析及SSR定位
2013-12-23畅志坚张晓军詹海仙
刘 洁,畅志坚,李 欣,张晓军,詹海仙
(1.山西大学生命科学学院,山西太原030006;2.山西省农业科学院作物科学研究所,山西太原030032)
小麦条锈病是由条锈菌(Puccinia striiformis f.sp.tritici)引起的全球性小麦病害之一,历史上曾多次流行成灾,严重为害我国小麦的安全生产[1-2]。实践证明,筛选和培育抗病品种是防治小麦条锈病最为经济、安全和有效的方法,而优异的小麦条锈病抗源及抗病基因是抗病育种的基础[3]。虽然国际上已经正式命名了45个位点的52个小麦抗条锈病基因(Yr1~Yr49)[4-5],但其中大多数抗病基因具有生理专化性,这些抗病基因往往因病菌小种的变异而很快“丧失”抗性。特别是2002年以来,条锈菌条中32号(CYR32)、条中33号(CYR33)小种成为我国当前最主要的流行毒性小种后,只有为数不多的几个抗病基因Yr5,Yr10,Yr15,Yr24,Yr26 和Yr41 等仍保持抗性,大多数抗病基因都“丧失”了抗性[3,6]。抗病基因的单一化和病原菌毒性变异导致了推广品种不断“丧失”抗病性,从而造成病害的大流行。针对小麦生产品种的抗锈性“丧失”问题,人们曾提出了各种不同的解决办法,如基因轮换、基因合理布局、培育多系品种、抗病基因组成复杂化、持久抗病性利用等,但最终都离不开对抗条锈新基因的挖掘和利用[7]。因此,挖掘不同类型的抗病基因,并开发其紧密连锁的分子标记,对于拓宽小麦抗源的遗传基础、加速抗病育种进程、逐步实现我国小麦条锈病的可持续控制具有十分重要的意义。
小麦的野生近缘植物是小麦宝贵的基因资源库,从小麦的近缘种属导入抗病新基因是实现小麦抗源多样化、解决抗病性丧失的有效途径[8]。中间偃麦草(Thiuopyrum iutermedium,2n=6x=42,JJSS)是在小麦遗传改良中利用较为广泛的一个小麦野生近缘植物,它具有多花、多实、优质、耐盐碱、抗旱、抗多种病害等优良特性[9],而且其J/JS组染色体与小麦具有一定的同源性,易与小麦同源染色体发生重组[10],许多育种学家已聚焦其特性的利用,现已将其对小麦锈病、黄矮病和根腐病的抗性基因成功地导入小麦,育成品种且大面积推广[11]。而抗条锈病基因的鉴定及利用鲜有报道。CH223是山西省农业科学院畅志坚研究员以普通小麦与中间偃麦草杂交获得的八倍体小偃麦新类型——TAI7047为抗源,通过J/JS组染色体与小麦染色体之间的异源重组,向普通小麦导入偃麦草的抗病基因而育成的兼抗小麦条锈病、白粉病的抗病新种质[12-13]。本试验进一步研究了CH223新抗源中抗条锈病基因的来源、抗性遗传方式,并对抗性基因进行了染色体定位。这对该抗病基因的有效利用、拓宽小麦遗传资源具有重要意义。
1 材料和方法
1.1 材料
CH223为源于晋麦33/TAI7047//京411///京411的BC2F6世代的小偃麦高代品系,由山西省农业科学院作物科学研究所分子标记实验室育成。系谱中的TAI7047为来自中间偃麦草(Z1141)的八倍体小偃麦,晋麦33和京411均为感病的小麦品种。TAI7047选自杂交组合太原768/Z1141//晋春5号[14],由中国科学院遗传与发育研究所李振声院士选育、钟冠昌研究员提供,其野生亲本中间偃麦草由山西省农业科学院作物科学研究所孙善澄研究员提供。
用于抗性遗传分析的材料有:CH223,感病品种台长29,SY95-71及其杂种F1,F2,BC1和F2∶3家系,以及用于SSR标记定位分析的中国春缺体-四体、双端体材料,均由山西省农业科学院作物科学研究所重点实验室提供。
抗性鉴定所用条锈菌系(小种)CYR32,CYR33由电子科技大学生命科学与技术学院杨足君教授提供。
1.2 苗期及成株期抗性鉴定
1.2.1 苗期抗性鉴定 2008—2009年,用国内目前毒力最强的条锈菌流行小种CYR32,CYR33对CH223及其系谱材料进行了苗期接种与抗性鉴定。鉴定材料包括:CH223,SY95-71,台长29,中间偃麦草,TAI7047,晋麦33,京411,晋春5号,太原768以及抗病对照八倍体小偃麦中4和感病对照铭贤169。具体接种采用扫抹法,将预先繁殖好的CYR32,CYR33的新鲜菌种接种于一叶期麦苗上,并罩上用铁丝架撑开的透明塑料布以防污染。分小种接种后的幼苗在10℃黑暗保湿24 h后,置于18℃/12℃(白天/晚上)、光照12~14 h/d、光强5 000~8 000 lx、相对湿度60%~80%的条件下培养。待感病对照品种铭贤169到发病盛期时,按0(免疫)、0;(近免疫)、1(高抗)、2(中抗)、3(中感)、4(高感)6级常规分级标准,逐株调查记载各材料的反应型,必要时辅以“+,-”表示同级内反应型偏重或偏轻的发病类型。
1.2.2 成株期抗性鉴定 CH223成株期抗性鉴定于2009—2011年在成都市新都区四川省农业科学院基地试验场进行。供试材料CH223和感病品种台长29,SY95-71及其杂交、回交所获得的F1,F2,BC1群体和F2∶3家系按以下播种方法种植于大田。双亲、F1各播1行,每行20粒,BC1点播104粒,F2点播221粒,F2∶3家系及亲本种植1个重复,行长1.2 m,每行点播15粒,行距0.25 m。为确保发病充分,每10行种植1行铭贤169作感病对照,并且试验材料四周种植绵阳11诱发材料。所用小麦条锈菌种为CYR32,待感病对照充分发病后调查记载,成株抗性评价在抽穗期进行,开花期复查一次,反应型记录标准与苗期的相同。双亲和F1按行观察,F2,BC1及F2∶3家系分单株调查抗感并逐一记录,根据F1的反应型及F2,BC1群体和F2∶3家系中抗、感单株分离比例,确定控制抗性的基因对数和显隐性,并用卡方检验进行分离比适合度测验,确定CH223所含抗条锈基因的数目及互作方式。
1.3 抗病池和感病池的建立
参照SDS法[15]提取亲本和F2分离群体单株幼嫩叶片总DNA,根据Michelmore等[16]介绍的集群分离分析法(bulked segregation analysis,BSA),在F2群体中选取10株抗病株和10株感病株,将其DNA分别等量混合建立F2群体的抗病池、感病池。
1.4 PCR 扩增和SSR 分析
根据Röder等[17]、Somers等[18]和GrainGenes database(http://www.wheat.pw.usda.gov)提供的微卫星引物序列,首先选取GWM,WMC,BARC,CFD,CFA和GDM系列的SSR引物581对,由北京华大基因公司合成。经过以抗病亲本、感病亲本、抗病池、感病池的DNA为模板初筛SSR引物之后,增补了部分以上系列和GPW系列的SSR引物。
PCR反应总体系为20μL:含有2μL 10×Buffer(10 mmol/L Tris-HCl,pH值8.3,50 mmol/L KCl,1.5 mmol/L MgCl2),0.2 mmol/L dNTP,1 U Taq 酶,0.25μmol/L引物和80~100 ng模板DNA。反应扩增程序为:94℃变性5 min;94℃变性45 s,50,55℃或60℃(因引物不同而异)复性45 s,72℃延伸1 min,共35个循环;最后72℃延伸10 min,4℃保存备用。PCR反应在PTC-200型热循环仪上进行。
扩增后的每个产物加入等体积的Loading Buffer(4 g/mL蔗糖;1 mg/mL溴酚兰和1 mg/mL二甲苯青)充分混匀,每个样品取4~6μL在8%非变性聚丙烯酰胺凝胶(Acr∶Bis=29∶1)中恒定电压150 V下电泳2 h左右,硝酸银染色显影。
1.5 数据分析
SSR扩增带型数据用Mapmaker/EXP 3.0软件分析标记与抗病基因的连锁关系,用Kosambi mapping函数将重组值转换为遗传距离,用Mapdraw2.1绘制连锁图。
2 结果与分析
2.1 苗期条锈抗性鉴定分析
对1.2.1中所述材料接种鉴定的结果表明,CH223,TAI7047和中间偃麦草的抗性表现与抗病对照中4相同,均对小麦条锈生理小种CYR32和CYR33表现免疫或近免疫反应;而其余的小麦亲本材料则对这2个生理小种表现出4级侵染型高度感病反应(表1)。由此推断,CH223携带的抗条锈基因很可能来源于中间偃麦草。

表1 抗病品系CH223、八倍体小偃麦及其亲本的抗条锈性鉴定结果
2.2 成株期抗条锈性遗传分析
2009—2010年用小麦条锈菌种CYR32对抗病亲本(CH223)、感病亲本(台长29和SY95-71)及这2个抗感杂交组合的杂种F1,F2,BC1和F2∶3家系等供试材料诱发鉴定,结果表明,抗病材料CH223对该高致病力菌种抗性稳定,表现为完全免疫;各杂交组合的F1单株对CYR32的反应型也为0,0;级,呈现免疫或近免疫反应,与CH223的抗性反应一致;而感病亲本台长29与SY95-71则表现为高度感病,反应型为4级,说明CH223对条中32号小种(CYR32)抗性反应受显性基因控制。
CH223与不同感病亲本的F2分离群体中,抗感分离明显,其分离比均符合R∶S=3∶1的1对显性核基因的遗传分离模式(χ2<χ20.05,1=3.84)。其中,CH223×台长29杂交组合的221株F2植株中,162株抗病,59株感病,其χ2=0.34,P=0.56,表明抗感的分离比符合3∶1。同样,215株来自SY95-71×CH223杂交组合F2植株中,抗病株157株,感病株58株,其抗感分离比也符合3∶1(χ2=0.45,P=0.50)。在鉴定的98株BC1(SY95-71/CH223//SY95-71)单株中,53株抗病,45株感病,其χ2=0.65,P=0.42,符合1∶1的分离比(表2)。
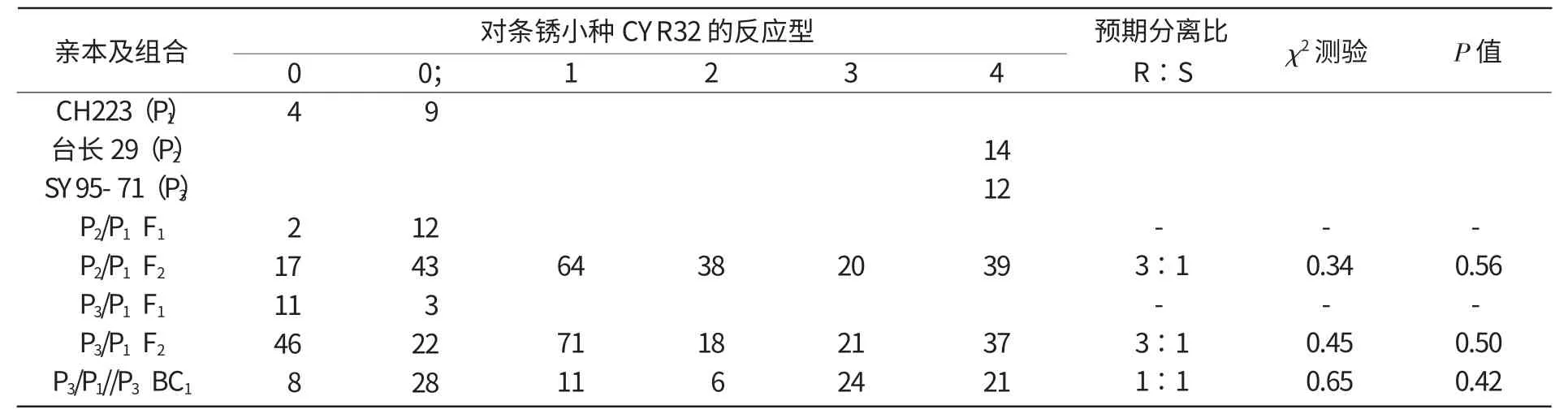
表2 抗×感杂交组合各世代对条中32 号小种的抗性表现及分离
2010—2011年,将CH223分别与台长29和SY95-71杂交的2个F2群体分行种植于大田并接种了条锈菌CYR32,成株期调查F2∶3家系结果显示,来自杂交组合CH223×台长29的221个F2∶3家系中,抗病不发生抗性分离(YrYr)的53个,抗感分离(Yryr)的111个,感病且不分离(yryr)的57个;来自CH223×SY95-71杂交组合的215个F2∶3家系中,全抗(YrYr)的58个,抗感分离(Yryr)的113个,全感(yryr)的44个。χ2检验结果分别为χ2(1∶2∶1)=0.92和χ2(1∶2∶1)=2.39。均符合1∶2∶1的显性单基因分离模式(表3)。
以上结果充分说明,衍生于中间偃麦草的抗病品系CH223对条锈菌CYR32菌系的成株抗性受1对显性核基因控制。
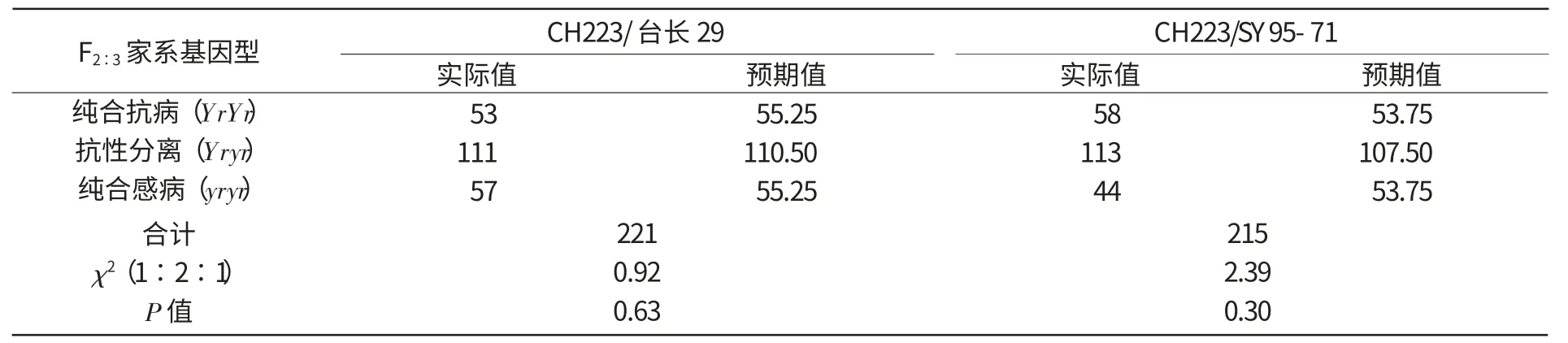
表3 抗×感杂交组合的F2∶3株系对条中32号小种的抗性表现及分离
2.3 抗病基因分子标记筛选及定位
试验中选取了杂交组合CH223×台长29的F2群体用于SSR分析,该分离群体有221个单株。利用平均分布于小麦基因组各条染色体上的581对小麦SSR引物对抗感亲本进行分析,其中,只有引物Xgwm540 和Xwmc47 的扩增产物在抗感亲本及抗感池之间表现出一致的多态性。且经分离群体验证,Xgwm540 和Xwmc47 均与抗病基因连锁。
在Somers等[18]整合的小麦微卫星遗传图谱上,Xgwm540 和Xwmc47 同时在5B和4B染色体上均有扩增位点,为进一步明确与抗病基因连锁的标记带在染色体上的确切位置,实验室又增加了一些4B与5B染色体上的SSR引物进行筛选,同时用整套21个中国春缺体-四体材料和双端体材料进行确定。结果发现,在缺体-四体材料中,引物Xgwm540 和Xwmc47 在N4BT4A上均无相应的扩增带型,而在N5BT5D材料上均有扩增带型。与此同时,又筛选出引物Xwmc310在抗感亲本和抗感池之间有一致的多态性,这个SSR引物只被定位于4B染色体上,因此推断CH223的抗条锈病基因位于4B染色体上。初定位于4B染色体上之后,又选取58对位于4B上的SSR引物进行分析,发现引物Xbarc1096,Xgpw7272 在抗感亲本和抗感池间也呈现出一致的多态性,经F2分离群体的221个单株验证,这5对引物均与抗病基因紧密连锁(图1显示了其中3对引物与抗病基因连锁的多态性),其连锁性在CH223×台长29的F2∶3家系分析中也得到了进一步的验证,该抗病基因命名为YrCH223。通过Mapmaker/EXP 3.0软件分析,5对SSR标记与YrCH223 处于同一个连锁群中,位置顺序为:
Xgwm540-Xbarc1096-YrCH223-Xwmc47-Xwmc 310-Xgpw7272,遗传距离分别为21.9,8.0,7.2,12.5,11.3cM(图2)。标记Xgwm540,Xbarc1096,Xwmc47,Xwmc310 和Xgpw7272 呈显性遗传,带型分离比符合1∶2∶1的比例。

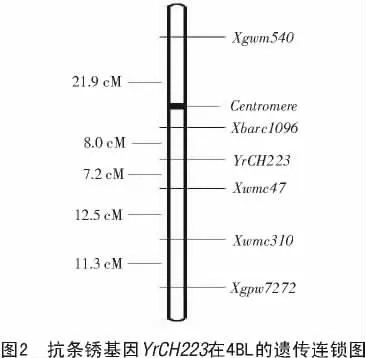
在Somers等[18-19]发表的小麦微卫星图上,Xgwm540,Xbarc1096,Xwmc310,Xgpw7272 和Xwmc47 都被定位在小麦4B染色体上,除Xgwm540 位于4B短臂上外,其余4个均位于4B染色体的长臂上。虽然Xgwm540 同时位于染色体5BS和4BS,Xwmc47 同时位于染色体5AS,5BS和4BL上(http://wheat.pw.usda.gov/cgi-bin/graingenes),根据Mapmaker/EXP 3.0分析结果,推断CH223的抗病基因位于4B上。由于部分与抗病基因连锁的SSR引物在不同的染色体上都有扩增位点,为了进一步证实与抗病基因连锁的标记带是否在染色体4B上,用这5对引物在中国春、中国春缺体-四体N4BT4A和双端体材料Dt4BL上进行扩增,结果显示,5对SSR引物在中国春缺四体N4BT4A上均没有扩增出相应的带型,而双端体材料Dt4BL中除Xgwm540 扩增出条带外,其余4个引物也无相应扩增带(图3)。由此充分说明,与抗病基因连锁的这5对SSR标记均位于4B染色体上,而且Xgwm540 位于4BS上,其余4个SSR引物位于4BL染色体上。通过Mapmaker软件分析,结果表明,抗病基因位于Xbarc1096 和Xwmc310 之间,这2个引物都位于染色体4BL上,因此,推断YrCH223 也位于染色体4BL上。

3 讨论
3.1 抗病基因的来源
CH223是以八倍体小偃麦TAI7047为抗源,通过‘六×八’式杂交、回交选育出的高代抗病新品系。抗性鉴定结果表明,除中间偃麦草、CH223及其抗病亲本TAI7047对当前流行小种CYR32,CYR33免疫外,其余小麦亲本均为高感。由于TAI7047的杂交系谱为太原768/Z1141//晋春5号[13],且其小麦亲本太原768和晋春5号对上述2个条锈菌系亦为高感。由此推断,CH223的抗条锈基因来自中间偃麦草(Z1141)。许多国内外学者利用中间偃麦草创制了异附加系、代换系、易位系的抗病材料,但未见对其抗性基因鉴定的报道。据Hu等[20]和Chang等[21]的报道,在小偃麦代换系中发现一抗条锈基因位于1St染色体上,这个代换系是中间偃麦草的1St染色体代换了小麦的1D染色体,但也未见将其抗性基因整合到小麦基因组中的进一步报道。而国际上已公布的抗条锈基因中,尚未发现有来自中间偃麦草的报道[4-5]。因此,从抗性基因的来源看,CH223所含的抗条锈基因是新基因。
3.2 抗病基因的遗传
通过染色体易位导入外源有益基因是实现种质创新的重要途径。但目前国内外育成的小麦-异源抗病易位系中,绝大多数往往因其遗传补偿性差、细胞学不稳定以及与不良基因的连锁而无法直接用于小麦育种和生产[22]。而对于新抗源CH223抗性遗传分析结果显示,在CH223与感病的小麦品种(系)杂交、回交所获得的F2,BC1,F2∶3杂种群体中,其抗感的分离比例分别符合3∶1,1∶1和1∶2∶1的单显性基因分离模式。这种抗性分离方式符合孟德尔遗传定律,说明CH223不可能含有较大的外源染色体片段,而且通过GISH实验分析也未发现外源DNA杂交信号,所以,推断CH223可能属于含偃麦草抗条锈病基因的小麦-异源渗入系。因而,导入的外源抗病基因遗传较为稳定,有利于该抗条锈新品系的培育和推广。
3.3 抗条锈基因YrCH223 的育种价值
中间偃麦草作为小麦育种的重要资源库,在小麦抗病育种工作中有非常大的应用潜力[14]。据报道,中间偃麦草对小麦多种病害免疫或高抗[9],对当今条锈流行小种CYR32和CYR33也具有极强的免疫力[22-23]。而在迄今为止国际上已命名的抗条锈基因中,除Yr5,Yr10,Yr15,Yr24,Yr26和Yr41 等对当前流行小种仍保持抗性外,其余抗性基因基本都“丧失”了抗性[3,6]。并且在这几个仍保持抗性的基因中,Yr10,Yr15,Yr24,Yr26 均被定位在小麦的1BS上,其中,Yr24 与Yr26 为同一基因[24],Yr15 又与Yr24/Yr26 紧密连锁[25],显然,条锈病抗源比较单一。同时在国际上已公布的抗条锈基因中,尚未发现源于中间偃麦草的报道[4-5]。本研究中抗条锈病新基因YrCH223 的分子鉴定,对于进一步丰富小麦抗病基因的遗传多样化,防止或延缓抗性“丧失”有重要作用。
抗病基因的准确定位有助于抗源的有效利用。SSR标记以其多态性高、信息丰富、操作简单、结果稳定的优点常常被研究人员用于新基因的染色体定位[26]。目前,覆盖整个小麦基因组的微卫星遗传图谱和物理图谱已经建立[16],根据微卫星位点在图谱中的位置,可以快速、准确地把与该位点连锁的基因定位。本研究中则采用SSR标记与BSA相结合的方法筛选到5对与抗病基因连锁的标记,从而将CH223的抗条锈病基因YrCH223 定位于4BL染色体上。由于在小麦的4B染色体上尚未发现有正式命名的抗条锈病基因[4-5],因此,YrCH223 是一个新的抗小麦条锈病基因,并被国际小麦基因命名委员会正式定名为Yr50[27]。在暂时命名的抗条锈病基因中,YrCle,YrMor,YrYam,YrND,YrHVII,YrJu3 等虽定位于小麦染色体4B上[28],但其抗性来源均不是中间偃麦草,这些基因对当前条锈菌优势小种CYR32,CYR33的抗性还有待进一步研究。YrCH223 的分子标记及定位不仅丰富了小麦抗条锈病育种的遗传基础,而且为以后开展小麦分子育种和该抗病基因的图位克隆提供了重要的科学依据。
[1]李振岐,曾士迈.中国小麦锈病[M].北京:中国农业出版社,2002:41-50.
[2]谢皓,陈孝,牛永春,等.小麦新品系YW243条锈病抗性鉴定[J].华北农学报,2002,17(4):59-62.
[3]Wan A M,Chen X M,He Z H.Wheat stripe rust in China[J].Australian Journal Agricultural Research,2007,58:605-619.
[4]McIntosh R,Yamazaki Y,Dubcovsky J,et al.Catalogue of gene symbols for wheat[EB/OL].[2008-08-24].http://wheat.pw.usda.gov/GG2/Triticum/wgc/2008/.
[5] McIntosh R,Dubcovsky J,Rogers J,et al.Catalogue of gene symbols for wheat:2011 supplemen [J/OL].Annual Wheat Newsletters,2011,57:303-321[2011-08-01].http://wheat.pw.usda.gov/ggpages/awn.
[6]杨作民,解超杰,孙其信.后条中32时期中国小麦条锈抗源之现状[J].作物学报,2003,29(2):161-168.
[7]李勇,牛永春.小麦抗条锈基因Yr6 分子标记初步研究[J].华北农学报,2007,22(4):189-192.
[8]Jiang J,Friebe B,Gill BS.Recent advances in alien gene transfer in wheat[J].Euphytica,1994,73:199-212.
[9]王黎明,林小虎,王洪刚,等.中间偃麦草的染色体组及其优良基因向普通小麦的转移[J].中国草地,2005,27(1):57-63.
[10]Chen Q,Conner R L,Laroche A,et al.Molecular cytogenetic evidencefor ahigh level of chromosomepairingamongdifferent genomes in Triticum aestivum-Thinopyrum intermedium hybrids[J].Theor Appl Genet,2001,102:847-852.
[11]孙善澄.小麦与偃麦草远缘杂交的研究[J].华北农学报,1987,2(1):7-12.
[12]王建荣,畅志坚,郭秀荣,等.在小麦育种中利用偃麦草抗病特性的研究[J].山西农业科学,2004,32(3):3-7.
[13]闫金龙,畅志坚,孙美荣,等.小麦新抗源CH223抗条锈性的遗传分析及细胞学鉴定[J].植物保护学报,2010,37(5):419-424.
[14]李振声.小麦远缘杂交[M].北京:科学出版社,1985:72-75.
[15]Sharp PJ,Kreis M,Shewry PR,et al.Location ofβ-amylase sequence in wheat and its relatives[J].Theor Appl Genet,1988,75:286-290.
[16]Michelmore RW,Paran I,Kesseli R V.Identification of markerslinked todiseaseresistancegenesby bulked segregant analysis:a rapid method to detect markers in specific genomic regions using segregation populations[J].Proc Natl Acad Sci USA,1991,88(21):9828-9832.
[17] Röder M S,Korzun V,Wendehake K,et al.A microsatellite map of wheat[J].Genetics,1998,149:2007-2023.
[18]Somers D J,Isaac P,Edwards K.A high-density microsatellite consensusmap for bread wheat(Triticum aestivum L.)[J].Theor Appl Genet,2004,109:1105-1114.
[19]Xue S,Zhang Z,Lin F,et al.A high-density intervarietal map of the wheat genome enriched with markers derived from expressed sequence tags[J].Theor Appl Genet,2008,117:181-189.
[20]Hu L J,Li GR,Zeng ZX,et al.Molecular cytogenetic identification of a new wheat-Thinopyrum substitution line with stripe rust resistance[J].Euphytica,2011,177:169-177.
[21]Chang Z J,Zhang X J,Yang Z J,et al.Characterization of a partial wheat-Thinopyrum intermedium amphiploid and itsreaction to fungal diseases of wheat[J].Hereditas,2010,147:304-312.
[22]Qi L,Friebe B,Zhang P,et al.Homoeologous recombination,chromosome engineering and crop improvement[J].Chromosome Research,2007,15:3-19.
[23]周新力,王保通,尹军良,等.小偃54高温抗条锈病基因的遗传分析[J].西北农林科技大学学报:自然科学版,2011,39(12):129-133.
[24]Li G,Li Z,Yang W,et al.Molecular mapping of stripe rust resistance gene YrCH42 in Chinese wheat cultivar Chuanmai 42 and its allelism with Yr24 and Yr26 [J].Theor Appl Genet,2006,112:1434-1440.
[25]刘亚萍,曹双河,王献平,等.小麦抗条锈病基因Yr24 的SSR标记[J].植物病理学报,2005,35(5):478-480.
[26]方宣钧,吴为人,唐纪良.作物DNA标记辅助育种[M].北京:科学出版社,2001.
[27]McIntosh R A,Dubcovsky J,Rogers W J,et al.Catalogue of genesymbolsfor wheat:2012 supplement[J/OL].Annual Wheat Newsletter,2012,58:271[2012-01-31].http://wheat.pw.usda.gov/ggpages/awn.
[28]井金学,徐智斌,王殿波,等.小偃6号抗条锈性遗传分析[J].中国农业科学,2007,40(3):499-504.
