壁虎醇提物诱导人喉癌细胞Hep2 凋亡的实验研究
2013-12-23崔朝初王建刚段冷昕王彩娥徐新丽
崔朝初,王建刚* ,段冷昕,钱 昕,王彩娥,徐新丽
1河南科技大学医学院药理学与医学分子生物学重点实验室;2 河南科技大学第一附属医院,洛阳471003
中国传统中药材壁虎(天龙)具有抑菌、抗肿瘤、抗惊厥及溶血的功效。大量的基础实验和临床研究证实,在多种恶性肿瘤中壁虎可通过升高bax等基因的表达诱导凋亡,发挥抗肿瘤作用[1]。本课题组前期研究成果也显示壁虎干粉能抑制肿瘤细胞的生长并诱导其凋亡[2,3]。有文献报道壁虎可以用于治疗晚期喉癌[4],但机制尚未明确。本文通过对壁虎干粉进一步提取分离,得到壁虎乙醇提取物(GEE)并对其在喉癌细胞Hep2 中诱导凋亡的作用进行了研究。
1 材料与仪器
1.1 药品与试剂
壁虎(Gekko japonicus ,光明饮片加工厂有限公司);胰酶(Sigma 公司);RPMI-1640 干粉(Gibco 公司);四甲基偶氮唑盐(MTT,Sigma 公司);Hoechst 33258(Sigma 公司);一抗β-actin,一抗caspase-3,一抗VEGF,辣根过氧化物酶标记二抗(Santa Cruz 公司);阿霉素(ADR,浙江海正药业有限公司);PVDF膜(PALL 公司)。
1.2 仪器
二氧化碳培养箱(Sanyo 公司);超净工作台SP2DJ22B 型(金坛市荣华仪器制造有限公司);旋转蒸发仪(上海亚荣生化仪器公司);ELx800 酶标仪(美国伯腾仪器有限公司);胶体磨(上海诺尼轻工机械有限公司);冷冻干燥机(北京博医康实验仪器有限公司);荧光显微镜(Olympus 公司);96 孔、6孔细胞培养板(Costar 公司),Mini trans-blot 电转膜系统(Bio-Rad 公司)。
1.3 细胞株
人喉癌Hep2 细胞株由中国药科大学惠赠,用含10%胎牛血清的1640 完全培养液于37 ℃恒温,5% CO2,95%饱和湿度条件下培养,取对数期细胞进行实验。
2 实验方法
2.1 GEE 的制备
取100 g 干壁虎粉与400 mL 双蒸水混匀置于胶体磨中匀浆,然后4 ℃离心取沉淀。将所得沉淀溶于400 mL 一定浓度的乙醇溶液中后置于4 ℃冰箱。每0.5 h 搅匀一次,4 h 后离心取上清。减压旋转蒸发除去乙醇,冷冻干燥得到7.2 g 金黄色固体,称之为壁虎乙醇提取物(GEE),贮存于-20 ℃冰箱备用。
2.2 MTT 法测定细胞活性
分别将GEE 干粉溶于含10%胎牛血清的1640完全培养液,使GEE 浓度分别为125、150、200、250、300、400、500 μg/mL 备用。将处于对数生长期的Hep2 细胞以每孔1 ×104个接种于96 孔板,每孔200 μL。过夜培养后弃上清,将配置好的不同浓度(125、150、200、250、300、400、500 μg/mL)的GEE 溶液分别加入培养板并设置空白对照组(只加含10%胎牛血清的1640 完全培养液),每孔200 μL,分别培养24、48、72 h。结束前4 h 每孔加入5 mg/mL MTT 溶液20 μL。培养结束后弃上清,每孔加二甲基亚砜(DMSO)200 μL,避光轻微振荡10 min。于酶标仪490 nm 波长处测定各孔的吸光度A,并按下式计算抑制率:抑制率(%)=[1-(A实验组/A阴性对照)]×100%,实验重复3 次。
2.3 Hoechst 33258 荧光染色法观察Hep2 细胞的形态学改变
将处于对数生长期的Hep2 细胞以2 ×105/孔接种于铺有盖玻片的6 孔板中,用不同浓度(100、200、250 μg/mL)的GEE 及0.5 μg/mL ADR 分别处理48 h,并设置阴性对照组(CONTROL)。培养结束后弃上清,细胞爬片用PBS 洗涤三次,于10 μg/mL的Hoechst 33258 染色液中避光孵育10 min,取出细胞爬片用PBS 洗涤3 次,于荧光显微镜下观察。
2.4 Western blot 法检测caspase-3、VEGF 蛋白的表达
将处于对数生长期的Hep2 细胞以2 ×105/孔接种于6 孔板,分别用ADR(0.5 μg/mL)和不同剂量的GEE(100、200、300 μg/mL)处理并设置阴性对照组(CONTROL)。培养48 h 后,弃上清,每孔分别加入100 μL 蛋白裂解液裂解,在冰浴下静置裂解10 min,收集蛋白并定量。95 ℃加热5 min 后,每组分别取等量蛋白上样,进行SDS-PAGE 电泳。电泳结束后取出凝胶,于4 ℃下250 mA 电流转印150 min 至PVDF 膜,脱脂奶粉封闭1 h 后,分别加入一抗β-actin、caspase-3、VEGF 于37 ℃孵育1 h,加二抗,于37 ℃孵育1 h,DAB 显色。
2.5 统计分析
3 实验结果
3.1 GEE 对Hep2 增殖的抑制作用
MTT 结果(图1)显示125、150、200、250、300、400、500 μg/mL 的GEE 在不同程度上均能抑制Hep2 细胞的增殖,其抑制作用随浓度增加、时间的延长而加强,呈剂量和时间依赖性。GEE 作用24、48、72 h 后 其IC50值分 别为336. 858、237. 949、188.991 μg/mL。

图1 GEE 对Hep2 细胞增殖的抑制作用Fig.1 The anti-proliferative effect of GEE on Hep2 cells
3.2 Hep2 细胞的形态学改变
Hoechst 33258 荧光染色后,由图2 可知,未经药物处理的CONTROL 组(A 组),细胞呈弥漫性均匀荧光,且荧光较弱。在各用药组中,Hep2 细胞在形态学上发生明显改变,核固缩呈致密的颗粒状强荧光,尤其是GEE 高剂量组(E 组)出现凋亡的典型形态学变化,可见清晰的凋亡小体。

图2 GEE 诱导Hep2 细胞发生的形态学改变Fig.2 The morphological changes of Hep2 cells treated with GEE
3.3 GEE 对Hep2 中caspase-3、VEGF 蛋白表达的影响
如图3 所示,随着GEE 浓度的增加,caspase-3蛋白的表达明显升高,VEGF 蛋白表达明显降低,表现为剂量依赖性。ADR、GEEH、GEEM、GEEL 各组与control 相比均有统计学意义(P <0.01)。
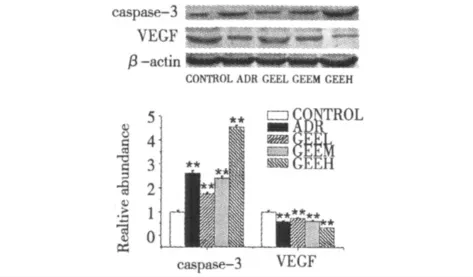
图3 GEE 对Hep2 细胞中caspase-3、VEGF 蛋白含量表达的影响Fig.3 The protein expression of caspase-3,VEGF in Hep2 cells treated with GEE
4 讨论
目前对于肿瘤的治疗,临床上主要采用以化疗为主的综合性治疗。常规化疗药有严重的毒副反应及耐药现象的发生,使其应用和疗效受到了限制,因此开发无毒副作用的天然药物治疗肿瘤已成为众多研究者的焦点[5]。传统中药壁虎的抗肿瘤作用已经得到证实,但研究的并不深入,其有效成分和作用机制尚未阐明,在Hep2 细胞中的抗肿瘤作用研究较少。本文研究了GEE 组分在人喉癌hep2 细胞中诱导凋亡的作用。结果显示GEE 对Hep2 细胞增殖有抑制作用且能使其发生典型的凋亡形态学变化。125~500 μg/mL 的GEE 在作用24、48、72 h 后IC50值分别为336.858、237.949、188.991 μg/mL。
细胞增殖过度和细胞凋亡异常是肿瘤发生的生物学基础。因此,如何调控凋亡相关基因或其产物,诱导细胞进入凋亡是肿瘤治疗取得成功的关键[6]。Caspase-3 是细胞凋亡过程中的主要效应因子,大多数触发细胞凋亡的因素,最终均需要通过激活caspase-3,进而通过裂解包括procaspase 2、6、7、9,以及Bcl-2、PARP (poly ADP-ribose polymerase),ICAD (inhibitor of caspase-activated deoxyribonuclease),gelsolin 和fodrin 等组分诱导细胞凋亡[7]。有研究证实,caspase-3 基因的突变和缺失可增加肿瘤发生的几率[8]。本研究结果显示,随着GEE 剂量的增加,caspase-3 蛋白表达逐渐增多,提示GEE 可剂量依赖性调控caspase-3 蛋白的表达,诱导Hep2 细胞的凋亡。
VEGF 是促进内皮细胞生长的特异性有丝分裂原,可增加转录潜能,还具有增加血管通透性的效应。VEGF 与其受体结合后可释放多种因子,促进血管内皮细胞分裂增殖,从而为肿瘤的浸润、转移创造条件。此外,抑制VEGF 蛋白的表达还可引起线粒体色素C 的释放及caspase-3 蛋白表达的增加,进而诱导凋亡的发生[9]。目前,在众多恶性肿瘤中VEGF 已成为重要的治疗靶点[10]。本研究结果表明,随着GEE 剂量的增大,VEGF 蛋白表达减少。
综上所述,GEE 组分可能通过上调caspase-3 和抑制VEGF 蛋白的表达而诱导Hep2 细胞的凋亡。但GEE 成分复杂,究竟是何种物质发挥作用及其机制有待进一步的研究。
1 Liu YJ(刘玉军),Li G(李刚),Ma R(马睿),et al. Latest research progress of Gekko on antitumor effect. Chin J Exp Tradit Med Formulae(中国实验方剂学杂志),2011,17:262-263.
2 Liu F,Wang JG,Wang SY,et al.Antitumor effect and mechanism of Gecko on human esophageal carcinoma cell lines in vitro and xenografted sarcoma 180 in Kunming mice.World J Gastroenterol,2008,14:3990-3996.
3 Liu F(刘菲),Wang SY(王淑英),Li Y(李艳),et al.The inhibition effect of dry geckko in esophagus cancer cells and s180 bearing mice. J Chin Med Mater(中药材),2008,31:1304-1307.
4 Hu XM (胡熙明). Chinese tradition medicine of folk prescription (中国中医秘方大全).Shanghai:Wenhui Publishing House,1996.635-636.
5 Jiang ZY(姜子瑜),Hua HQ(华海清).Progress on prevention and treatment of Chinese medicine to molecular mechanism of liver cancer.China J Chin Mater Med(中国中药杂志),2009,34:1310-1313.
6 Wong RS. Apoptosis in cancer:from pathogenesis to treatment.J Exp Clin Cancer Res,2011,30:87.
7 Porter AG,Janicke RU.Emerging roles of caspase-3 in apoptosis.Cell Death Differ,1999,6(2):99-104.
8 Ghavami S,Hashemi M,Ande SR,et al.Apoptosis and cancer:mutations within caspase genes. J Med Genet,2009,46:497-510.
9 Ge YL,Zhang X,Zhang JY,et al.The mechanisms on apoptosis by inhibiting VEGF expression in human breast cancer cells.Int Immunopharmacol,2009,9:389-395.
10 Sullivan LA,Brekken RA. The VEGF family in cancer and antibody-based strategies for their inhibition.MAbs,2010,2:165-175.
