大肠杆菌微球包封效率及稳定性的研究
2013-12-23李再新赵志平刘章琴陈欲云
张 智,李再新 ,赵志平,刘章琴,陈欲云
四川理工学院 化学与制药工程学院,自贡643000
聚合物微球(Polymeric microspheres)系利用天然或合成的高分子材料(统称为囊材)作为囊膜壁壳,将固体或液体药物包囊成直径为1~500 μm 的微小球体。微球技术将蛋白、多肽等类药物制备成以微球为载体的长效缓控释制剂,通过皮下、肌肉或口服给药,借助压力、pH 值、酶解、温度或提取等方法,使药物在一定时间内缓慢释放出来,达到药物长效控释作用[1]。在疫苗研制领域,微球是一种具有佐剂效应的控释系统,同时具备佐剂特征和控释作用,已广泛应用于疫苗的传送系统[2,3]。壳聚糖与海藻酸钠均为优良的天然高分子材料,具有无毒、生物相容性好、可生物降解、易成膜及成型等特点,常作为制备微球的良好材料。其中海藻酸钠荷负电,壳聚糖荷正电,两者可通过静电相互作用形成微球,已经广泛用作于疫苗、药物和生物制品等的载体[4,5]。将微球作为大肠杆菌疫苗的传送载体,主要是利用微球的包封、缓释和佐剂效果,延长疫苗在体内的作用时间,提高免疫的效果,同时还可以提高大肠杆菌疫苗在体外的稳定性,防止外界环境对大肠杆菌的破坏作用。本文以壳聚糖和海藻酸钠为材料,通过探索大肠杆菌微球的不同制备方法,期望制备的微球对大肠杆菌的稳定性、包封率和缓释作用达到最佳效果,为大肠杆菌疫苗的动物免疫奠定基础。
1 材料和仪器
1.1 试验菌种
大肠杆菌菌种(由本实验室选育)。
1.2 主要试剂
壳聚糖和海藻酸钠均购自上海生工;无水氯化钙(Cat.No.C3306,Sigma);碳酸钙、液体石蜡、冰乙酸、醋酸钠和菜籽油等化学试剂均购自成都科龙化工试剂厂,均为分析纯。
1.3 主要仪器
SW-CJ-2F 型超净工作台,上海成顺仪器仪表有限公司;HZ150L 型恒稳培养振荡器,武汉瑞华仪器有限责任公司;IJ-I 型精密增力电动搅拌器和OHP-9160B 智能型电热恒温培养箱,均购自上海琅玕实验设备有限公司;H-1850R 型台式高速冷冻离心机,湖南湘仪离心机仪器有限公司;Multiskan Mk3 酶标仪,Thermo Fisher Scientific 公司;UPH-II-20T 优普超纯水制造系统,成都超纯科技有限公司;101-3AB 恒温鼓风干燥箱,天津泰斯特仪器有限公司;H6500i荧光显微镜,重庆光电仪器有限公司。
2 实验方法
2.1 菌种活化与扩大培养
取实验室冻存菌种接种于EMB 平板,37 ℃培养18 h,在EMB 平板上挑选呈紫黑色带金属光泽的单菌落转接种于LB 培养基,37 ℃恒温培养过夜,次日按1‰接菌,37 ℃恒温培养至对数生长期(约3 h)。
2.2 涂板计数
采用倍比稀释法逐步稀释,从10-1逐步稀释到10-10,并涂板。将培养皿倒置放入电热恒温培养箱(37 ℃)培养18~24 h 后,观察大肠杆菌菌落数,即得菌悬液大肠杆菌的数量。
2.3 微球的制备
2.3.1 方法一
按Polk A 等[6]方法进行大肠杆菌微囊制备,并略作改进。取1.2 mL 海藻酸钠溶液(25.0 g/L)加入到2.0 mL 大肠杆菌混悬液中,混匀并静置20~30 min 使气泡完全消失。在60 rpm 的机械搅拌情况下,用注射器将海藻酸钠和大肠杆菌混合溶液缓慢滴加到50.0 mL 壳聚糖-氯化钙混合溶液(0.1 M氯化钙,0.6 mg/mL 壳聚糖,pH 4.5)中。微球将瞬时成型,而后将其在室温条件下放置8~10 h。随后离心获得微球并用去离子水洗2~3 次后,在室温中干燥,并进行目视检查和拍照。
2.3.2 方法二
按Goosen MFA 等[7]方法进行大肠杆菌微囊制备,并略作改进。称取3.0 g 海藻酸钠,用超纯水定容至100 mL 制成3.0%的海藻酸钠溶液。称取5.5 g 无水氯化钙固体,用超纯水定容至1 L 配制成0.05 M 的氯化钙溶液。用海藻酸钠溶液混悬培养好的大肠杆菌,然后将上述混合液按1∶5 的比例用注射器滴加至含0.2% Tween-80 的菜籽油中,并用精密增力电动搅拌器以600 rpm 的速度搅拌10 min,制成W/O 型乳剂。然后再将0.05 M 氯化钙溶液快速轻巧地沿烧杯壁加至乳剂中,600 rpm 继续搅拌,使破乳(所加氯化钙溶液体积约为乳剂体积的4倍)的同时生成海藻酸钙微球并沉淀析出。离心收集微球样品,并用无菌水洗涤2~3 次,彻底除去菜籽油,无菌水重悬微球,并目视检查和拍照。
2.3.3 方法三
采用乳化-内部凝胶化法[8]制备大肠杆菌微球,并略作改进。在2.0%海藻酸钠溶液20.0 mL 中(注意:配置过程中稍加热以使海藻酸钠充分的溶解)加入碳酸钙粉末1.5 g(注意:海藻酸钠溶液趁热时缓慢加入碳酸钙粉末,以免成团),用数显恒温电热套磁力搅拌器搅匀后,再加入2 mL 大肠杆菌混悬液(缓慢成滴加入),得均匀的O/W 型乳液。将乳液倒入含2.0%司班-80 的25 mL 液体石蜡中,用精密增力电动搅拌器以200 rpm 的速度搅拌10 min,分散成均匀的O/W/O 型复乳。搅拌下将10.0 mL 液体石蜡(含冰醋酸1.2 mL)倒入复乳中,在酸性环境下分解出的Ca2+可引发凝胶化反应使海藻酸钠液滴固化形成大肠杆菌海藻酸钙凝胶微球。静置半小时后,用纱布过滤,将滤布上的沉淀加入1.0%吐温-80 溶液25.0 mL(加吐温时需加热溶解才能达到去油的效果),搅匀后再用纱布过滤,重复2 次,收集大肠杆菌海藻酸钙凝胶微球。
配制含0.5%壳聚糖的50.0 mL 醋酸钠-醋酸pH 4.5 缓冲液(醋酸钠1.8 g,冰醋酸980.0 μL,纯化水稀释至100.0 mL,再加0.5 g 壳聚糖,搅拌至溶解,用纱布过滤除去少量的不溶物),加入上述所得的大肠杆菌海藻酸钙凝胶微球,反应10 min,纱布过滤,置于10.0 mL 生理盐水中终止反应,再次用纱布过滤,收集沉淀即得微球,并目视检查和拍照。
2.4 镜检微球形态大小
将消毒好的载玻片从酒精瓶内取出一片,用打火机点燃,去除酒精,待其载玻片冷却后取一定量制备好的含菌微球在荧光显微镜下进一步观察。
2.5 微球包封率
本实验采用扣除法测微球的包封率,公式即为:

未被包封的大肠杆菌主要包括油相中未被包进的大肠杆菌和在最终形成微球时混合液体中剩余的大肠杆菌。检测油相中大肠杆菌的量时,取100.0 μL 放入EP 管逐步稀释摇匀,再从各管中取出50.0 μL 涂布于LB 固体培养基平板上,将培养皿倒置放入电热恒温培养箱(37 ℃,16 h)培养并计数(混合液体中菌的检测方法与检测油相的相同)。
2.6 微球大肠杆菌的释放
将2.0 g 大肠杆菌海藻酸钙-壳聚糖微球放入10.0 mL 生理盐水中,摇匀后再从中取出1.0 mL 置于10.0 mL 磷酸盐缓冲液(PBS,pH 7.4,含0.5 %十二烷基硫酸钠)中,在37 ℃、100 rpm 的条件下搅拌,每间隔一定时间取出100.0 μL PBS 释放液。将取出的100.0 μL PBS 释放液放入EP 管以10 倍的比例逐步稀释,摇匀后,取出50.0 μL 涂布于LB 固体培养基平板上,将培养皿倒置放入电热恒温培养箱(37 ℃,16 h)培养并计数,重复设置10 个平板。
2.7 微球的稳定性
将大肠杆菌海藻酸钙-壳聚糖微球置于4 ℃的环境中,每放置一段时间后,取出50.0 mg 置于1.0 mL PBS 缓冲液中,缓慢搅拌1 h。取50.0 μL 涂布于LB 固体培养基平板上,将培养皿倒置放入电热恒温培养箱(37 ℃,16 h)培养并计数,重复设置10个平板。
2.8 数据处理
采用t-检验。
3 实验结果
3.1 微球的制备
方法一所得的颗粒虽较圆整,但粒径较大(>5 mm),不利于注射(如图1A),达不到微球的标准;方法二所得的颗粒有些不圆整,粒径也较大(>5 mm),不利于注射用(如图1B),亦达不到微球的标准;方法三采用乳化-内部凝胶化法制备的颗粒细小,目视呈乳状(如图1C)。进一步将方法三制备的颗粒进行显微镜检,如图1D 可以看出此方法获得的颗粒虽均匀性不够,但比较圆整,粒径较小,大多数微球的粒径为50~180 μm 之间,其平均粒径为100 μm,达到微球的要求。
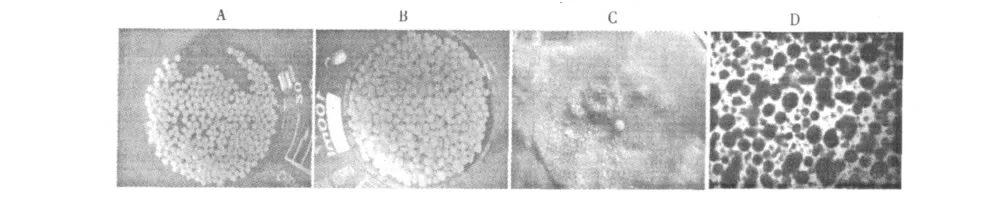
图1 不同制备方法制备的微球形态Fig.1 Images of microspheres made by three different methods
3.2 微球包封率
采用菌落计数法计数按上述方法三制得微球的制备过程中油相和水相大肠杆菌数,推测微球内菌数,结果如(表1)所示,微球的包封率可以达到93.09%。
表1 包封率测定值(n=10,±s)Table 1 Amount of E.coli loaded on alginate-chitosan microspheres (n=10,±s)
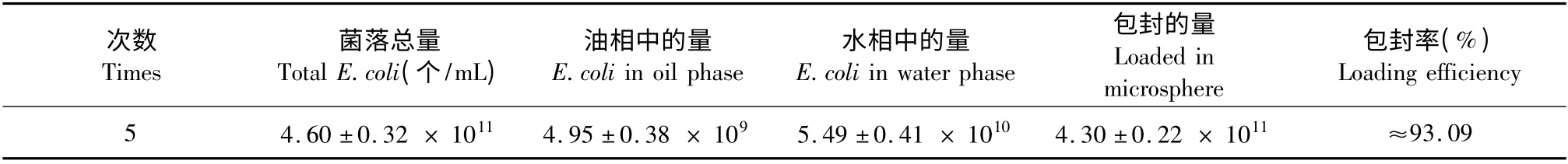
表1 包封率测定值(n=10,±s)Table 1 Amount of E.coli loaded on alginate-chitosan microspheres (n=10,±s)
次数Times菌落总量Total E.coli(个/mL)油相中的量E.coli in oil phase水相中的量E.coli in water phase包封的量Loaded in microsphere包封率(%)Loading efficiency 5 4.60 ±0.32 × 1011 4.95 ±0.38 × 109 5.49 ±0.41 × 1010 4.30 ±0.22 × 1011 ≈93.09
3.3 微球大肠杆菌体外的释放
包封大肠杆菌活菌的海藻酸钙-壳聚糖微球在PBS 缓冲溶液中释放大肠杆菌,在不同的时间点取样品,涂布在LB 培养基表面,培养。从图2 可见在4~48 h 内大肠杆菌释放速度平缓,在48~80 h 期间大肠杆菌的释放速度加快,最多可以达到3.20 ×108/mL。并且暗示微球有保护大肠杆菌的作用。

图2 海藻酸钙-壳聚糖微球不同时间释放大肠杆菌情况(n=3,±s)Fig.2 E.coli released from calcium alginate-chitosan microspheres in different time (n=3,±s)
3.4 微球的稳定性
按照方法三制备的大肠杆菌海藻酸钙-壳聚糖微球放置在4 ℃冰箱中,8、16、32、64 d 取出,涂布培养,计数菌落,从图3 可知,每隔一定时间,储存的微球中释放出来大肠杆菌菌落数变化不显著,暗示制得的微球在一定时间内相对稳定。
3 讨论
由壳聚糖、海藻酸盐等制备的缓释微球是近年来研究较为广泛的生物微球体系,具有良好的生物相容性和生物可降解性等特点,是较为理想的药物载体[4,9]。陈莉敏等[10]利用壳聚糖和海藻酸钠通过复凝聚法将萘普生制成微球,得出在壳聚糖浓度∶海藻酸钠浓度为1∶1,pH 值为4.0,搅拌速度为300 rpm,反应温度为35 ℃条件下,萘普生成球工艺达到最佳。但不同药物分子大小和理化特征与微球壁材之间的相互作用有可能影响微球的载药性能。大肠杆菌菌体大小在0.5~2.0 μm 之间,相对于其它抗原、蛋白多肽等分子个体较大,将灭活或减毒的菌体与壳聚糖等微球壁材制备成微球,其方法、工艺和微球性质具有显著的差异,但目前还未见这方面的研究报道。在本文,我们以天然高分子材料壳聚糖和海藻酸盐为微球壁材,探索了大肠杆菌微球的制备方法及其微球性质。结果发现采用方法一和方法二制备的大肠杆菌微球体积过大,尽管我们试图通过改进缓慢滴加、高速搅拌等多种方式,但均不能改善成球过大缺点。在方法三中,我们采用乳化-内部凝胶化法来制备大肠杆菌海藻酸钙-壳聚糖微球,发现其制备的微球颗粒较小且粒性较好。进一步考察其包封率,发现包封效果较好,表明大肠杆菌与海藻酸钙-壳聚糖凝胶有较好的相容性。虽然海藻酸钙-壳聚糖凝胶可能形成较大的空隙,但大肠杆菌胞体也较大,因此,在大肠杆菌释放过程中随着凝胶的溶解,大肠杆菌缓慢释放,但前期释放平缓,后期加速,这一特殊现象有待于进一步研究。通过大肠杆菌海藻酸钙-壳聚糖微球稳定性的研究,发现在低温条件下微球中的大肠杆菌稳定存活,表明海藻酸钙-壳聚糖微球对大肠杆菌的活性具有一定的保护作用。我们的这些研究结果为大肠杆菌微球疫苗的制备和动物免疫实验打下了坚实基础。
1 Li LL(李琳琳),Chen D(陈东),Ding MH(丁明慧),et al.Preparation and controlled drug release properties of magnetic microcapsules. Acta Phys-Chim Sin(物理化学学 报),2007,23:1969-1973.
2 Oyewumi MO,Kumar A,Cui Z. Nano-microparticles as immune adjuvants:correlating particle sizes and the resultant immune responses.Expert Rev Vaccines,2010,9:1095-1107.
3 Singh M,Chakrapani A,O'Hagan D. Nanoparticles and microparticles as vaccine-delivery systems.Expert Rev Vaccines,2007,6:797-808.
4 Li S(李沙),Hou XP(侯新扑). Studies on the formation mechanism of alginate-chitosan microcapsule and its drugloading and release properties on macromolecular drug. Acta Pharm Sinica(药学学报),2003,38:380-383.
5 Kang ML,Cho CS,Yoo HS. Application of chitosan microspheres for nasal delivery of vaccines.Biotechnol Adv,2009,27:857-865.
6 Polk A,Amsden B,Yao KD,et al.Controlled release of albumin from chitosan/alginate microcapsules. J Pharm Sci,1994,83:178-185.
7 Goosen MFA,King GA,Mcknight CA,et al.Animal cell culture engineering using alginate polycation microcapsules of controlled membrane molecular weight cut-off.J Membr Sci,1989,41:323-343.
8 Poncelet D,Lencki R,Beaulieu C,et al. Production of alginate beads by emulsification/internal gelation. I. Methodology.Appl Microbiol Biotechnol,1992,38:39-45.
9 Matricardi P,Meo CD,Coviello T,et al.Recent advances and perspectives on coated alginate microspheres for modified drug delivery.Expert Opin Drug Deliv,2008,5:417-425.
10 Chen LM(陈莉敏),Li ZL(李柱来),Wang J(王津).Preparation technology and characterization of naproxen microspheres.Nat Prod Res Dev(天然产物研究与开发),2007,19:878-880.
