鸦胆子中苦木内酯类化合物的制备分离和化学表征
2013-12-23周中流黄诗瑶梁燕君何妙玲冯宗财夏敬民
周中流 ,黄诗瑶,梁燕君,何妙玲,冯宗财,夏敬民
1湛江师范学院 化学科学与技术学院制药工程系;2 湛江师范学院 广东高校新材料工程技术开发中心,湛江524048
鸦胆子为苦木科植物鸦胆子(Brncea Javaniea L.Merr)的灰黑色长圆形或卵形的干燥成熟果实,是民间传统常用中药,该药材原植物主产于我国南方沿海热带和亚热带地区。文献报道[1,2],中药鸦胆子中主要含有苦木内酯,脂肪酸和生物碱等成分。我国传统中医将其用于清热、燥湿、杀虫、解毒。据报道,鸦胆子具有抗疟、抗炎和抗肿瘤等作用[3]。
国内外文献有关鸦胆子活性成分的报道[1,2],发现其果实中含有多种具有抗肿瘤活性的苦木内酯类化合物。鸦胆苦素D 具有抗虐和抗肿瘤活性,鸦胆苦醇对S180瘤株有边缘活性[1,2]。目前市场上还未有高纯度的鸦胆苦素D、鸦胆苦醇和鸦胆因H 对照品,限制了鸦胆子的深入开发和应用。本文采用制备型高效液相色谱法(Pre-HPLC),在30 min 的分离时间内完成分离,制备了鸦胆苦素D、鸦胆苦醇与鸦胆因H 三个成分。通过熔点测定法、高效液相色谱对获得的产品进行分析,产品纯度达到98%以上,可以作为鸦胆苦素D、鸦胆苦醇与鸦胆因H 对照品使用。本方法制备的鸦胆苦素D,鸦胆苦醇与鸦胆因H 具有高效快速、产品纯度高的特点,可以作为制备高纯度的鸦胆苦素D,鸦胆苦醇及鸦胆因H 对照品提供参考。
1 仪器、试剂与材料
Waters Delta 4000 制备型高效液相色谱仪,Empower 色谱工作站;Waters 2695-2996 高效液相色谱分析仪,配二极管阵列检测器(美国Waters 公司);X-4 数字显示显微熔点测定仪(北京泰克仪器有限公司);甲醇和乙腈均为色谱纯(Fisher chemicals 公司);水为屈臣氏蒸馏水;其他试剂均为分析纯。中药鸦胆子粗提物经AB-8 型大孔树脂和硅胶柱层析自制。3 种苦木内酯均为实验室自制(经UV、NMR、MS、IR 鉴定,HPLC 纯度不低于98%),符合定量要求。中药鸦胆子药材购自广东,经广西师范大学生命科学院唐绍清教授鉴定为植物Brncea Javaniea L.Merr 干燥果实。
2 方法与结果
2.1 色谱条件
制备型HPLC 条件:自填Microsorb C18柱(50 mm × 200 mm,5 μm);流动相:甲醇-水(体积比40∶60),流速100 mL/min;检测波长:270 nm;进样量:2 mL。
分析型HPLC 条件:Microsorb C18色谱柱(4. 6 mm × 150 mm,5 μm);流动相:甲醇-水(体积比为40∶60),流速1 mL/min;检测波长:270 nm;进样量:10 μL。
2.2 样品处理
将10 kg 鸦胆子干燥果实,经过95%乙醇回流提取,所得浸膏分散于水中,用石油醚萃取三次,残余水液稀释过AB-8 大孔吸附树脂,依次用水、40%、95%乙醇洗脱,收集95%乙醇洗脱液,减压蒸干,得到鸦胆子苦木内酯粗提物450 g;苦木内酯粗提物450 g 再经过硅胶柱层析(100~200 目,柱长45 cm,内径3 cm),得到富含鸦胆苦素D、鸦胆苦醇与鸦胆因H 的干浸膏37 g。称取该干浸膏10 g 甲醇溶解,配置成浓度为20 mg/mL 的溶液,过0.45 μm 微孔滤膜,供样品分析和制备使用。
2.3 样品分析

图1 样品的HPLC 图Fig.1 HPLC chromatogram of sample
取按照“2.2”方法处理后的样品溶液适量,用甲醇稀释10 倍后进行分析,以鸦胆苦素D、鸦胆苦醇与鸦胆因H 对照品为对照,对色谱图中的峰进行指认,见图1。
2.4 制备色谱条件的优化
制备色谱条件的优化从样品的溶解开始。通过分析型色谱来优化分离条件,然后应用线性放大技术在制备色谱中放大。通过优化色谱条件使目标化合物与干扰成分在分析型色谱中的分离度Rs大于2,确保分析型色谱条件放大后经简单调整即可在制备型色谱中达到满意的效果。在用反相制备色谱制备对照品时,一般来说,小的保留因子k 对制备分离更有利。本实验中鸦胆苦素D、鸦胆苦醇与鸦胆因H 的k 分别约为2.3、4.5 和5.7。
制备色谱流动相的流速、进样量分别按照公式计算:Fp=Fa× (Dp/Da)2,Lp=La× (Dp/Da)2(式中Fp为制备型色谱流动相流速,Fa为分析型色谱流动相流速,Dp为制备柱的直径,Da为分析柱的直径,Lp为制备型色谱进样量,La为分析型色谱进样量)[4,5]。参照上述文献报道的方法,并结合实际制备过程中的成本以及产品纯度,进一步调整得到了“2.1”下制备色谱的条件。
2.4.1 样品溶解条件的选择
选择溶解样品的溶剂,应该对样品有良好的溶解度,不干扰样品的分离,且容易处理。本文比较了甲醇、乙腈、丙酮、水、二甲基亚砜等溶剂,发现样品在甲醇中溶解度很好。本实验采用甲醇为溶剂,配成浓度为20 mg/mL 的样品溶液。
2.4.2 流动相的选择
分析型液相色谱向制备型液相色谱转化时,本研究采用放大公式Xp= Xa· rp2· CL/ ra2(Xp为制备型色谱流速,Xa为分析型色谱流速,rp为制备型柱半径,ra为分析型柱半径,CL为制备型色谱柱与分析型色谱柱的长度比)。通过优化甲醇-水的比例、流动相流速使样品达到需要的分离效果。根据本实验中分析与制备色谱柱的规格,制备色谱中流动相理论流速应为113 mL/min,实际实验中采用的流速为100 mL/min。
2.4.3 最佳进样量的选择
进样量的改变由样品溶液的浓度和进样体积两方面决定。在样品浓度一定的情况下,通过增大进样体积来增大进样量。当进样量增加时,目标化合物与相邻成分的分离度会逐渐降低,影响目标化合物的分离,进样量达到一定量时,相邻成分无法分离[5]。
在样品质量浓度为20 mg/mL 条件下,考察了不同进样体积(0.5~5 mL)对分离度的影响。结果表明,0.5~2 mL 进样体积范围内,目标成分与干扰成分分辨率逐渐降低,峰重叠加重;当进样体积大于2 mL 后,目标成分与干扰成分重叠严重,无法选取适当的切割位置,使分离的纯度无法保证。因此,本实验采用2 mL。
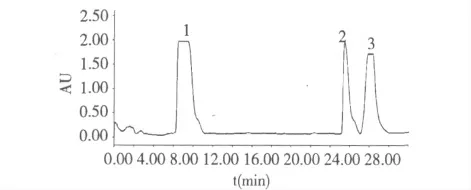
图2 样品制备HPLC 图Fig.2 Preparative HPLC chromatogram of sample
2.5 产品纯度的检测
2.5.1 高效液相色谱分析
对照品定性分析,制备色谱所得的化合物为鸦胆苦素D、鸦胆苦醇与鸦胆因H,再经高效液相色谱检测(按“2.1”部分分析型HPLC 条件),采用峰面积归一法,鸦胆苦素D 的纯度为99.17%,鸦胆苦醇的纯度为99.02%,鸦胆因H 的纯度为98.75%。外标法定量,测得的产品质量分数分别为:98.58%、98.03%和98.01%。
2.5.2 熔点的测定
测得所制备的鸦胆苦素D、鸦胆苦醇与鸦胆因H 的熔点分别为:285~286 ℃、272~274 ℃、283~284 ℃。
2.6 结构鉴定
鸦胆苦醇:片状结晶(甲醇-氯仿),mp:272~274 ℃,FeCl3反应呈阳性;1H NMR (400 MHz,C5D5N)δ :1.24 (3H,s,H-18),2.10 (2H,m,H-6),1.71 (3H,s,H-19),1.90 (3H,s,H-4'),2.10 (3H,s,H-5'),2.13(1H,m,H-19),2.14,3.16 (2H,m,H-1),2.91 (1H,d,J = 12.6 Hz,H-5),3.61,4.92(2H,m,H-20),3.62 (3H,s,H-23),4.01 (1H,m,H-11),4.12 (1H,m,H-12),4.90 (1H,m,H-7),5.72 (1H,s,H-2'),5.90 (1H,m,H-15);13C NMR(100 MHz,C5D5N)δ :50.3 (C-1),193.0 (C-2),146.1 (C-3),128.5 (C-4),42.7 (C-5),29.9 (C-6),83.4 (C-7),41.8 (C-8),42.9 (C-9),46.2 (C-10),73.4 (C-11),76.3 (C-12),83.1 (C-13),51.2(C-14),68.4 (C-15),168.1 (C-16),16.3 (C-18),13.5 (C-19),74.7 (C-20),171.2 (C-22),53.1 (C-23),165.4 (C-1'),116.3 (C-2'),158.4 (C-3'),20.4 (C-4'),
27.1 (C-5')。以上波谱数据和理化性质与文献[6,7]报道的鸦胆苦醇基本一致。
鸦胆苦素D:无色粉末,mp:285~286 ℃,FeCl3反应呈阴性;1H NMR (400 MHz,C5D5N)δ :5.97(1H,m,H-3),1.87 (3H,s,H-22),1.06 (3H,s,H-18),1.25 (3H,s,H-19);13C NMR (100 MHz,C5D5N)δ :81.0 (C-1),199.0 (C-2),124.6 (C-3),164.2 (C-4),44.1 (C-5),26.9 (C-6),74.2 (C-7),47.2 (C-8),49.3 (C-10),80.4 (C-11),81.6(C-12),78.3 (C-13),83.5 (C-14),69.1 (C-15),172.1 (C-16),22.3 (C-17),18.3 (C-18),11.4 (C-19),70.1 (C-20)。上述波谱数据与文献[6,7]报道基本一致,确定为鸦胆苦素D。
鸦胆因H:白色结晶,mp:283~284 ℃;1H NMR(400 MHz,C5D5N)δ :1.07 (3H,s,H-18),1.66,2.17 (2H,m,H-6),1.93 (3H,s,H-19),2.91 (1H,bd,J=13 Hz,H-5),3.69,4.95 (2H,d,J=7.5 Hz,H-20),3.71 (1H,d,J =6.5 Hz,H-12),4.36 (1H,s,H-1),4.38 (1H,d,J=6.4 Hz,H-11),5.24 (1H,m,H-7),5.88 (1H,m,H-15),5.96 (1H,s,H-3);13C NMR (100 MHz,C5D5N)δ :83.6 (C-1),199.0(C-2),125.6 (C-3),163.7 (C-4),43.9 (C-5),28.5 (C-6),79.4 (C-7),51.1 (C-8),45.8 (C-9),48.6 (C-10),76.1 (C-11),78.3 (C-12),84.7 (C-13),84.1 (C-14),71.2 (C-15),175.3 (C-16),11.8 (C-18),22.4 (C-19),70.7 (C-20),65.0 (C-22)。以上波谱数据与理化性质文献报道[7]的鸦胆因H 基本一致。
3 讨论
随着鸦胆苦素D、鸦胆苦醇与鸦胆因H 药理作用研究的不断深入,该类化合物及其对照品的需求量也日益增加。本试验采用制备型高效液相色谱法分离得到上述三个苦木内酯单体,不仅能够得到高纯度的化合物单体,而且快速简便、操作方便、便于收集,纯度均大于98%,可作为对照品使用。本文对鸦胆子中苦木内酯类化合物进行制备分离,为进一步大量制备鸦胆子中其它重要活性苦木内酯提供了思路,也为天然产物中分离高纯度的化合物单体提供了参考。
1 Ding CX(丁晨旭),Suo YR(索有瑞).Research progress on chemical compounds of Brucea javanica L.Merr and its biological activity. Chin Tradit Pat Med(中成药),2006,28:117-120.
2 Sun R(孙蓉),Yang Q(杨倩). Research development on toxicity of fructus Bruceae Based on efficacy and material basis.Chin J Pharm (中国药物警戒),2010,7:159-161.
3 Shen JG(沈建国),Zhang ZK(张正坤),Wu ZJ(吴祖建),et al.Antiviral effect of Ailanthus altissima and Brucea javanica on tobacco mosaic virus.Chin J Chin Mater Med (中国中药杂志),2007,32:27-29.
4 Li JJ(刘婧靖),Luo XB(罗旭彪),Chen B(陈波),et al.Isolation and purification of nuciferine by preparative HPLC.Chin Tradit Herb Drugs (中草药),2006,37:55-57.
5 Gao MZ(高明哲),Yuan XY(袁晓艳),Xiao HB(肖红斌).Preparation of asiaticoside and madecassoside from the extract of Centella asiatica (L.)Urb using preparative high performance liquid chromatography.Chin J Chrom (色谱),2008,26:362-365.
6 Xie HY(谢慧媛),Deng HN(邓胡宁),Huang SX(黄淑霞),et al.Studies on the chemical components of Brucea javanica.Chin Tradit Pat Med (中成药),1998,21:398-400.
7 Yang ZQ(杨正奇),Xie HY(谢慧媛),Wang JR(王金锐),et al. Chemical studies of the active antitumor components from the fruits of Brucea javanica (L.)Merr.Nat Prod Res Dev (天然产物研究与开发),1996,8(2):35-39.
