N-263 对钨和钼的萃取机理研究与平衡pH 的选择
2013-12-23徐志昌
徐志昌,张 萍
(清华大学核能与新能源技术研究院,北京 102201)
0 引 言
通过液- 液萃取法[1-5]实现化学性质相似元素,钨和钼之间的分离是许多作者梦寐以求的研究方向。其中,按照萃取机理可以划分为优先萃取钨[2,3,6]和优先萃取钼[1,4]等两类。前者,常用的萃取剂有三烷基甲基氯化铵(季铵盐,国产牌号是N-263)和叔胺盐(三烷基氯化胺,国产牌号是N-235)。它们的萃取反应属于阴离子交换(类似固体阴离子交换树脂)。后者,利用钨和钼对硫离子[1]以及过氧化氢[4]络合常数之间的差别,即钼的优先络合性质,实现钼的优先萃取。
比较而言,优先萃取少量钼,或者需要引入硫离子,或者引入过氧化氢,其经济性和环保性受到新的挑战,引起节外生枝的麻烦,因而不被看好。在优先萃取钨的工艺中,只需适当调整平衡pH 即可。对于钨酸钠溶液而言,为了减少酸的消耗,N-263 比N-235 更胜一筹。
本实验数据表明,在N-263 萃取钨的过程中,水相pH 值必然会改变。问题是人们对于改变的原因、控制规律的认识以及如何利用这些规律,都存在差距。在现有发表的文献里,绝大多数作者都将萃取前后的pH 值混为一谈,进而产生了许多误判,甚至产生错误结论:不加络合剂条件下,采用N-263深度分离钨钼至今仍未实现有效分离;pH =6 的条件下,单级萃取分离钨钼的效果较好[6]。在季胺盐萃钨过程中,钼与钨无法分离。
钨钼同多酸络合物化学已经指出:它们的络合物组成,将随着水溶液中氢离子与钨钼离子的克分子比值的改变而变化,届时,N-263 对钨和钼的萃取反应亦随之改变。因此,改变萃取平衡的根本原因是溶液的pH 值。这就是说,平衡水相的pH 值才是决定萃取容易元素与萃取困难元素之间的萃取分配与分离系数的最重要的因素之一;萃取前水相的pH 值只是影响水相pH 的升高或降低。正确掌握pH 值升高或降低的规律,准确控制平衡水相的pH值将成为萃取分离参数中最重要的因素之一。
本实验发现,与料液相比,萃取残液的pH 值,或者会升高,或者会降低。此类pH 值的变化,取决于萃取体系所发生的萃取反应。例如,阴离子萃取体系:季铵盐萃取剂,N-263 与钨酸根之间的萃取反应,不仅取决于初始水相的pH 值,而且还与萃取剂的初始分子组成密切有关。初始萃取剂分子组成,可以是氯根形式,也可以是氢氧根形式。再碱性水相体积下,不同的萃取剂组成将发生如反应式(1)和(2)不同的萃取反应。

萃取反应式(1)表明,如果季铵盐分子为氯根形式,那么萃取反应后,水相中的钨酸钠转化并生成了氯化钠(中性盐,pH =7)。萃取平衡后水相pH值将下降。反应式(2)表明,如果N-263 分子,为碱性形式,那么,萃取反应后,水相中的钨酸钠转化为氢氧化钠(碱性盐pH≥7),那么平衡水相的pH值必定升高。因此,平衡pH 值的变化是萃取终点必然出现的客观存在。
1 试验方法
1.1 化学试剂
有机相组成是:20%N-263 +10%TBP +70%日用煤油(A);航空煤油(B)。分子形式是氯根形式(A);氢氧根形式(B)。水相组成分为两种,其中之一(A)的钨和钼的浓度分别是17.88 g/L、2.51 g/L(W/Mo=7.124 ∶1),另一种溶液的钨、钼浓度分别是6.60 g/L、17.57 g/L(0.376 ∶1)。
1.2 试验方法
(A)室温下将一定相比的有机相和水相置于分液漏斗内,然后手动混合3 min 后分相,分相后,测定平衡水相的pH 值,并分析水相中钨和钼的浓度,有机相金属浓度采用差减法计算。
(B)室温下,将一定相比的有机相和水相溶液在35 ℃下恒温,然后合并采用单臂搅拌桨混合5 min后分相。最后,测定平衡水箱pH 值以及水相中钨和钼的浓度,用差减法计算有机相中浓度。据此计算各种分配比以及钨和钼之间的分离系数。
2 试验结果
2.1 萃取反应的平衡pH 变化的数据
为了查明萃取反应过程中pH 值的变化,表1和表2 列举了萃取前后pH 值及其变化的测量数据。数据表明,如果萃取液是酸性,那么平衡pH 上升;反之,如果萃取液是碱性,则平衡pH 下降。萃取前水相pH 越酸,平衡pH 上升越大。因此,为了减少pH 值的变化幅度,应当尽量将水溶液的pH 调整到接近中性。

表1 萃取前后水相pH 值及其变化的数据
相比,A/O=1 ∶1;10 ℃;5 min。有机相组成是:20%N-263 +10%TBP+70%航空煤油。分子形式是氯根形式。水相:钨和钼的浓度分别是17.88 g/L,2.51 g/L。
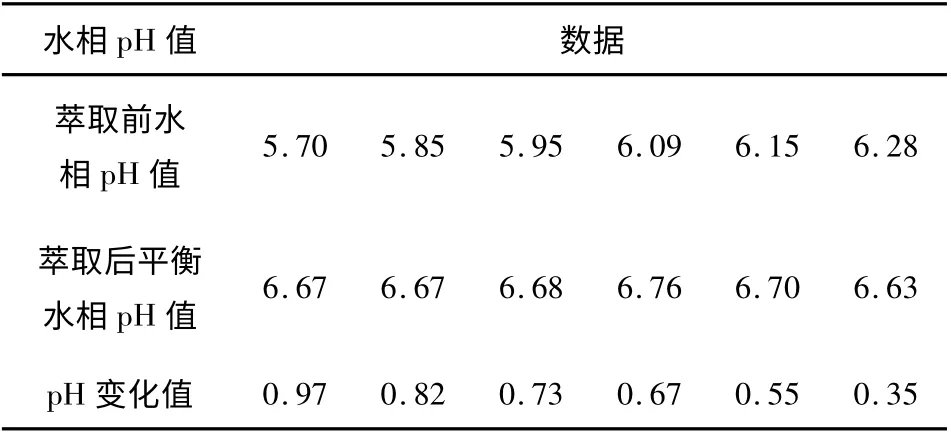
表2 萃取前后水相pH 值及其变化的数据
相比,A/O=2/1,35 ℃;5 min。有机相组成是:20%N-263 +10%TBP+70%航空煤油。分子形式是氢氧根形式;溶液的钨、钼浓度分别是6.60 g/L、17.57 g/L。
2.2 萃取相比对平衡pH 的影响
表3 表4、表5、表6 是相比对平衡pH 的影响数据。数据表明,相比对平衡pH 同样有较大影响。但是,萃取前水相pH 值越是接近7,则平衡pH 的变化越小。很显然,为了减少平衡pH 的变化,萃取前水相pH 应当控制在接近中性。

表3 萃取相比与萃取平衡pH 值的变化
有机相:20%N-263 +10%TBP +70%日用煤油;水相:XW=27.88 g/L;XMo=2.51 g/L,H2SO4调节pH 值,10 ℃,3 min。
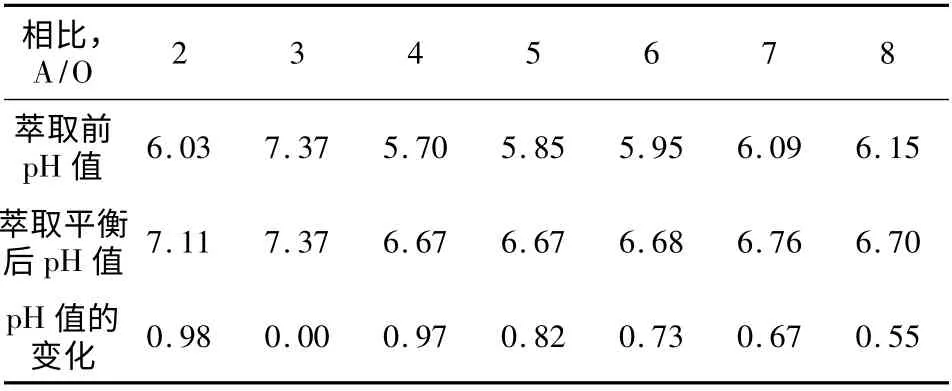
表4 萃取相比与萃取平衡pH 值的变化

表5 萃取相比与萃取平衡pH 值的变化

表6 洗涤相比与平衡水相pH 值的变化关系
有机相:20%N-263 +10%TBP +70%航空煤油,R4NCl,水相:1 mol/NH4Cl,H2SO4调节酸度。35 ℃,5 min。
2.3 最佳萃取平衡pH 的控制
表7 和表8 是pH 对N-263 萃取分离钨和钼的影响数据。数据表明,萃取平衡为中性条件下,钨钼才能够获得最佳的萃取和分离效果。无论是水相溶液中钨浓度大于钼(XW/XMo=11.1∶1)的情况下,或者是钨浓度小于钼的情况下(XW/XMo=0.38 ∶1),都使轻相中难萃钼与易萃钨之间的比值发生逆转。前者轻相中的难萃钼含量由0.09下降到0.04;后者轻相中的难萃钼含量由2.66 降为1.13。
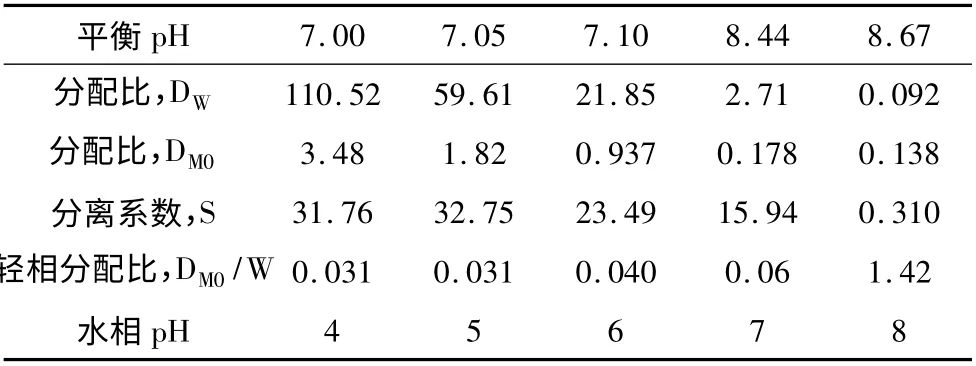
表7 pH 对N-263 萃取分离钨和钼的影响
水相:XW=27.88 g/L,XMo=2.51 g/L;有机相:20%N-263 + 10% TBP + 70% 日用煤油,10 ℃,3 min。
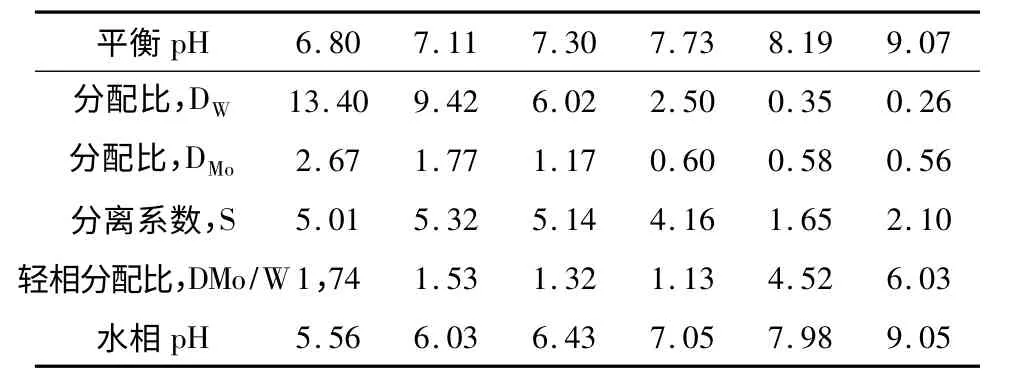
表8 pH 对N-263 萃取分离钨和钼的影响
水相XW=6.69g/L,XMo=17.57g/L;有机相:205N-263 +10%TBP+70%航空煤油,35 ℃,3 ~5 min
2.4 N-263 萃取反应式随着平衡pH 的改变
表9 表示萃取反应式随着平衡pH 而改变的结果。由表可见,钨和钼的金属络离子随着平衡pH而发生变化,从而导致萃取反应式也发生变化。水相生成物化学式随着水相阴离子和N-263 的化学式而变化,生成中性盐或者生成碱,为了操作方便,应当选择氯根型为宜。反应式表明,pH=7 时,钨和钼络阴离子的饱和容量分别由96.19 g/L 和41.83 g/L 变成93.78 g/L 和62.74 g/L。很显然,为了提高选择性萃取功能,以及提高它们的萃取能力,应当选择平衡pH=7。

表9 萃取反应式随着平衡pH 的改变
3 讨 论
3.1 萃取反应决定pH 值的升高或降低
水相中钨和钼的络合物化学以及有机相萃取剂分子的结构理论已经表明,萃取反应不仅受制于水相中钨和钼的络合物组成,而且受制于有机相中萃取剂分子的组成。已经知道,随着水相酸度的变化,钨和钼的络合物组成亦随着变化;随着转型的不同,有机相中萃取剂分子组成亦随之变化。因此,毋庸置疑的是依据水相和有机相两方面因素来确定萃取机理。表10 给出了不同pH 值条件下的钨和钼的络合物组成。由表10 可见,钨和钼同多酸络合物中原子数目随着pH 值的降低而增加。
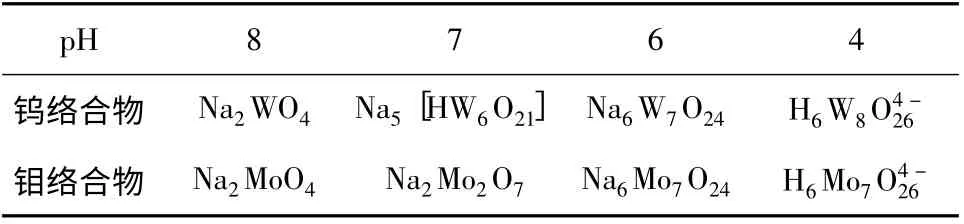
表10 不同pH 值条件下钨和钼的络合物组成
另一方面,萃取剂,N-263 在萃取前的化学组成,其中的阴离子,可以是氯根形式、硫酸根,也可以是羟基形式或碳酸根形式。但是,它们经过萃取反应平衡所产生的生成物是完全不同的。前者为中性盐:氯化钠、硫酸钠;后者为碱性:氢氧化钠、碳酸钠。
表达式(3)和表达式(4)显示了钨和钼络合物组成和离子价态随着pH 值的逐步降低而变化的规律。其中,在钨的络合物中,钨的同多酸数目逐步增加的规律(从6 增加到8);在钼的络合物中,钼的同多酸数目明显增加,从2 增加到8。
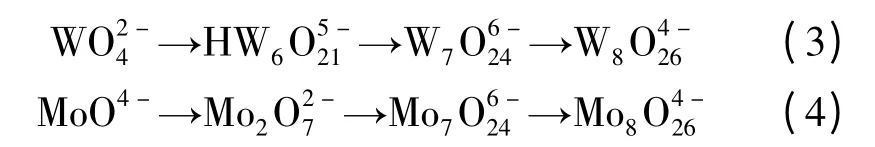
3.2 钨和钼萃取分离的最佳pH 选择
表10 表明,根据钨和钼络合物组成随着pH 的变化可以看出,钨酸钠在酸化过程中,随着[H+/W]比值的升高(pH 降低),其化学组成将由W逐步转化为聚合数不同的同多酸根。由表10 可见,在萃取平衡酸度为7 的条件下,钨酸根转变成负5 价的六钨酸根,而此时的钼转变成负2 价的二钼酸根,二者的离子价态相差负3 价。通常,价态越高,萃取反应的平衡常数越大;价态越低,萃取反应的平衡常数越小。而在其余pH 条件下,钨和钼同多酸络合物价态差距都较小。这就是萃取反应选择pH=7 的理论依据。
另一方面,萃取剂,N-263 的分子式不同,其中包括氯根型核羟基型等两种。前者,萃取反应后的生成物为氯化钠;后者萃取反应的生成物为氢氧化钠,因此,前者能够维持平衡pH=7;后者,则使平衡pH 升高。为了操作和控制的方便,选择萃取剂为氯根形式,这是十分合理的。
3.3 负载有机相转型的选择
N-263 萃取钨的化学反应式,不仅受制于水相钨的络合物形式,而且,受制于有机相萃取剂的组成。已经知道,钨在中性(pH=7)条件下,生成仲钨酸铵([HW6O21]5-),因此,此时的萃取反应式取决于萃取剂的化学组成,其中包括不同的阴离子形式,即氯根、氢氧根以及碳酸根等。反应式表明,水相盐的化学式,只有氯根型的转为氯化化钠,其余的或者转为氢氧化钠(反应式(4),或者转成碳酸钠反应式(5)。后者,对于分相,对于pH 值升高的控制,多有不便,故不予推荐。

反应式(3)、(4)和(5)表明,饱和容量的计算,按照6 ∶5 =1.2,即88.24 g/L,如果,取70%的饱和度,那么,应当为61.77 g/L。
3.4 负载有机相的洗涤
经过萃取过程,钨获得了优先的萃取,同时又有少量钼进入负载有机相。应当进一步通过洗涤,将钼从负载有机相洗涤出去。洗涤的方法分成还原性洗涤以及络合性洗涤。从理论方面看,钨的最佳萃取应当选择为中性。为了控制萃取平衡水相的pH值,能够维持在中性附近,那么,需要将水相pH 保持在酸性,平衡后即可达到中性。反之,如果水相pH 为碱性,那么,平衡pH 更加为碱性,结果造成不良的萃取条件和不良的萃取结果。
3.5 反萃取以及结晶反萃取
洗涤后的负载有机相中的钨,可以通过氯化铵的碱性溶液反萃取下来,反萃取液经过蒸发结晶,最终获得合格产品仲钨酸铵(APT)。也可以直接通过结晶反萃取获得APT 产品。这是今后的发展方向。要从反萃取设备方面解决三相分离问题,即除去有机相与水相之间的分离以及液相与晶体固相的分离。
4 结 论
通过上述液-液萃取分离钨和钼的的试验,依据现有萃取化学和络合物化学的理论,我们可以得出以下结论:
4.1 最佳平衡pH 的选择
影响N-263 萃取和分离钨和钼效果的最重要的因素是最终平衡水相的pH 值。这是因为平衡pH 决定了钨和钼络合物的组成和价态以及萃取反应的平衡常数。实验表明,水相平衡pH =7 的条件下,钨的萃取优势明显高于钼。在此条件下,钨的分配系数以及钨和钼之间的分离系数最大。
此外,值得注意的是有机相中萃取剂的阴离子形式,可以是氯根,也可以是硫酸根,但不是氢氧根或碳酸根。因为,前者,萃取反应所生成的盐为中性盐(pH=7),氯化钠和硫酸钠;后者,萃取反应的生成物为碱性化合物(pH≥8),氢氧化钠和碳酸钠。后者,钨和钼将以负2 价阴离子状态存在。它们的萃取反应平衡常数、分配系数和分离系数等的差异变小,这正是萃取分离所不希望的结果。
4.2 提高萃取相比与负载有机相饱和度
如上所述,氯化物季铵盐,N-263 在pH =7 的萃取工艺条件下,钨具有明显的萃取优势,因此,充分利用萃取优势,通过相比的调节,尽量提高钨在负载有机相中的饱和度,尽可能利用萃取优势排挤钼,这是工艺选择的要求。试验表明,根据初始水相中钨的浓度以及有机相中N-263 的浓度,取70%的饱和度来进行萃取控制。
4.3 采用还原洗涤与络合洗涤进一步除钼
稀有金属化学理论告诉我们,钼元素具有容易被还原与容易被络合的优势。这两条优势就成为去除负载有机相中的微量钼元素的理论依据。通常,采用有机还原剂,例如,抗坏血酸、羟胺、联二胺等对钼的优势还原,易将钼离子还原为低价,从而被洗涤。
此外,钼元素具有优势络合的特性。其中,最常见的络合剂有硫离子、过氧化氢等。硫代钼酸盐以及钼的过氧化氢络合物具有优势被洗涤的特性。因此,无论是还原洗涤或者是络合洗涤,都是明显有效的洗涤剂。
4.4 蒸发结晶与结晶反萃取
洗涤后的负载有机相中的钨,通过反萃取,转入水相,再经过蒸发和结晶,制得合格的仲钨酸铵(APT)产品。在此结晶过程中,钼元素获得了进一步的净化。反萃取的另一个条件是结晶反萃取,这时,反萃取体系将出现三相。其中包括,有机相和水相以及固相-晶体。这对萃取设备提出了更高的要求。
[1] 龚伯凡,张启修. 基于硫代钼酸盐分离钨钼的研究小结[J].中国钨业,1995,(8):10-14.
[2] 顾 珩,汪剑岭,王继民,等.高钼钨酸钠溶液萃取分离钨钼的研究[J].稀有金属与硬质合金,1997,(2):7-10.
[3] 张贵清,张启修.一种湿法冶金清洁生产工艺[J]. 稀有金属,2003,27(2):254-257.
[4] 欧 惠,张贵清,关文娟,等.混合萃取剂双氧水络合分离钨钼的初步研究[J]. 中国钨业,2011,26(3):34-36.
[5] 卢 博,乔 珊,张小林.萃取法分离钨钼研究进展[J].硬质合金,2011,28(2):130-135.
[6] 卢 博,谢方浩,邓声华,等.N-263 仲辛醇-煤油体系采取分离钨钼[J].硬质合金,2011,28(5):311-315.
[7] 李伟宜,张 礼.液液萃取法分离钨钼的研究[J].稀有金属与硬质合金,1989,17(2):21-24.
