大黄素阻抑人乳腺癌MCF-7 细胞增殖和细胞周期进程*
2013-12-23李梦佳马莲顺杨亚萍朱玮玮陈丽新王立伟朱林燕杨海峰
李梦佳, 马莲顺, 杨亚萍, 朱玮玮, 陈丽新, 王立伟, 朱林燕△, 杨海峰
(暨南大学1医学院药理学系,2分析测试中心,3医学院生理学系,广东 广州510632;4广州中医药大学第二附属医院,广东省中医院病理科,广东 广州510120)
乳腺癌是女性常见的恶性肿瘤之一,近年来我 国乳腺癌发病率增高,逐渐成为严重威胁女性健康的严重疾病。乳腺癌的治疗手段以手术和化疗为主,然而肿瘤对传统的细胞毒性化疗药物产生耐药从而导致化疗失败是目前乳腺癌药物治疗较为突出的问题。大黄素(emodin)是从中药材大黄中提取的一种天然的蒽醌类衍生物,是大黄、虎杖、何首乌等多种中药的有效活性成分。大黄素因其多重的生物学活性(如血管舒张、免疫抑制、保护肝脏、抗肿瘤作用),得到广泛的关注[1]。大黄素对多种肿瘤细胞的增殖均有显著的抑制作用,如人肺癌A549 细胞、髓系白血病HL-60 细胞、肝癌SMMC-7721 细胞等,是一种潜在的抗肿瘤药物[2-4]。但国内鲜有大黄素抗乳腺肿瘤方面的报道。本实验以人乳腺癌MCF-7 细胞为研究对象,通过流式细胞术检测用药后肿瘤细胞周期及凋亡的变化情况,并采用原子力显微镜(atomic force microscope,AFM)观察细胞膜超微结构的改变来研究大黄素的抗肿瘤作用,从而为大黄素治疗乳腺癌的临床应用提供实验依据。
材 料 和 方 法
1 主要药物、试剂和仪器
大黄素(广东省食品药品检验所);MTT(sigma);DMEM 培养基(Gibco),10% 胎牛血清(Gibco);Annexin V-PI 凋亡试剂盒(南京凯基生物科技有限公司);AFM(BioScope Catalyst ScanAsyst,Bruker);流式细胞仪(FACS Aria,BD)。
2 方法
2.1 细胞培养 将MCF-7 接种于含10%胎牛血清、青霉素(1 ×105U/L)和链霉素(100 mg/L)的DMEM 培养基中,置5%CO2、37 ℃的孵箱中常规培养,细胞贴壁生长,每3 d 传代。用0.25%胰蛋白酶+0.02%乙二胺四乙酸消化,收集对数生长期细胞进行实验。
2.2 MTT 法检测大黄素对MCF-7 细胞增殖的影响
取对数生长期的细胞,按每孔4 ×103个接种96 孔培养板,37℃、5%CO2培养箱中培养16 ~18 h 后,加入不同浓度的大黄素(μmol/L):0、6.25、12.5、25、50和100,每组均设6 个复孔。37 ℃、5%CO2培养48 h加入MTT (终浓度0.5 g/L),置于37 ℃继续培养4 h。弃培养基,每孔加DMSO 100 μL,水平摇床振荡使细胞内蓝紫色结晶充分溶解。10 min 后酶标仪上测定570 nm 波长处的吸光度(A570)。按以下公式计算大黄素对肿瘤细胞的杀伤作用,细胞生长抑制率(%)=(1 -加药组细胞A 值/对照组细胞A 值)×100%,绘制量效曲线并计算IC50值。
2.3 细胞周期变化及凋亡率的检测 采用流式细胞术分析。设定空白组和大黄素组,收集经大黄素作用48 h 后的MCF-7 细胞,PBS 缓冲液洗涤2 次,离心去上清,加入4 ℃预冷的95%乙醇,4 ℃固定过夜,离心后弃上清液,PBS 洗1 次,加PI 染色剂避光染色15 ~20 min,用流式细胞术检测细胞周期各时相的变化及凋亡率。
2.4 Annexin V/PI 双染法检测细胞凋亡率 设定空白组和大黄素组,48 h 后收集MCF-7 细胞,PBS 缓冲液洗涤2 次(4 ℃),按照试剂盒的说明加入Annexin V-FITC,混匀室温避光孵育10 min,离心重悬后加入PI,用流式细胞术分析。细胞凋亡率(%)=Annexin V+PI-细胞百分比+Annexin V+PI+细胞百分比。
2.5 AFM 样品制备及成像 取对数生长期细胞,用培养液调整细胞浓度为1 ×108/L,接种于6 孔培养板中,置于37℃、5% CO2培养箱中培养24 h 后,设定空白组、大黄素组,48 h 后用PBS 洗涤MCF-7 细胞并重悬,滴于玻片上,自然铺展,吸附2 h。后用pH 7.4 PBS 缓冲液冲洗,用1% 戊二醛溶液固定15 min,用蒸馏水冲洗3 次,室温自然晾干后上机观察。利用Olympus 倒置显微镜观察细胞的分散情况,用AFM 对样品进行扫描成像。通过测量细胞核高度,反映经药物作用后细胞核是否发生坍塌肿胀等变化,并利用Nanoscope Analysis 软件分析细胞膜表面的粗糙程度,反映细胞膜超微结构的变化。
3 统计学处理
采用SPSS 13.0 统计分析软件处理。数据以均数±标准差(mean ±SD)表示,组间均数比较采用方差分析,以P <0.05 为差异有统计学意义。
结 果
1 大黄素抑制MCF-7 细胞增殖
48 h 后对照组每孔细胞大约铺满80%,细胞成团生长,分布均匀,状态良好。大黄素呈剂量依赖性抑制MCF-7 细胞增殖,当药物浓度为12.5 μmol/L时,生长抑制率为(13.65 ±0.36)%,与对照组相比差异显著(P <0.05),当药物浓度为100 μmol/L,生长抑制率高达(74.61 ±3.63)%。非线性回归分析得出大黄素对MCF-7 细胞增殖抑制的IC50值为50.55 μmol/L,见图1B,因此选用大黄素浓度50 μmol/L 进行后续实验。
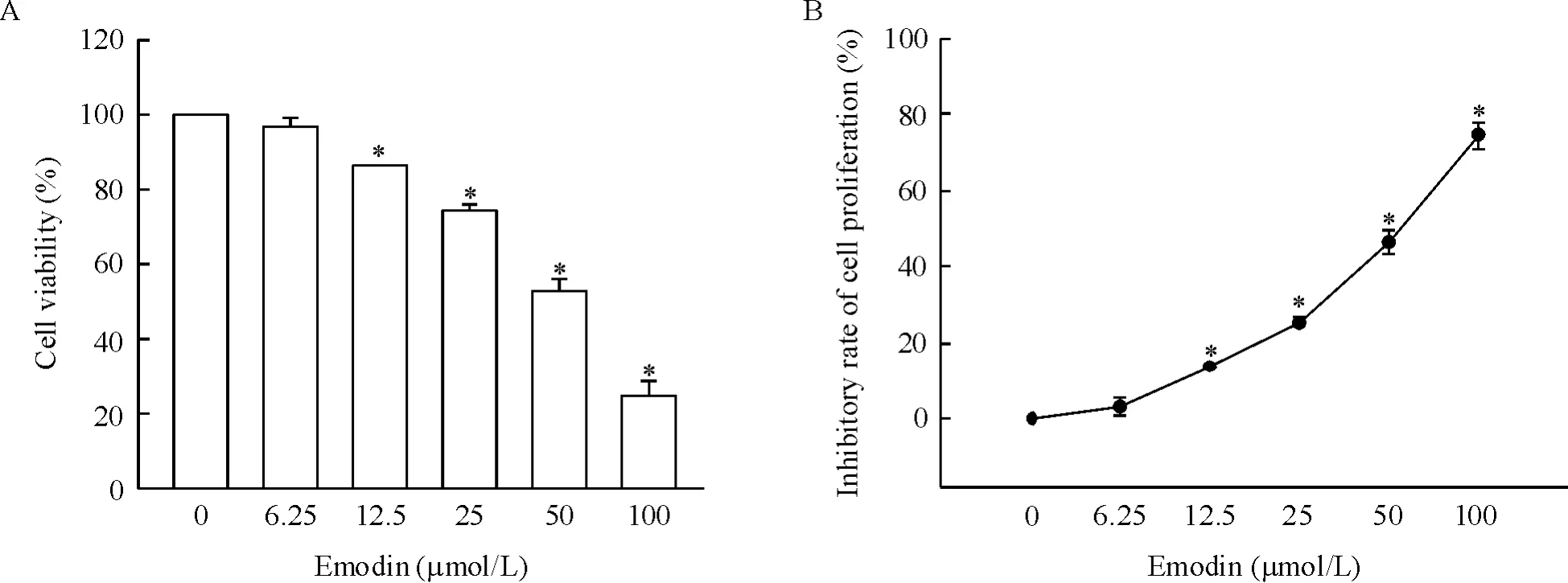
Figure 1. Effects of emodin on the proliferation of human breast cancer MCF-7 cells (MCF-7). A:effect of emodin on the viability of MCF-7 cells;B:inhibition of MCF-7 cell proliferation by emodin.Mean±SD. n=3. * P <0.05 vs 0 μmol/L.图1 大黄素对MCF-7 细胞增殖的影响
2 大黄素阻抑MCF-7 细胞于G0/G1 期
流式细胞术检测结果表明大黄素可阻抑MCF-7细胞于G0/G1期(图2),MCF-7 细胞经50 μmol/L 大黄素作用48 h 后,G0/G1期细胞数量达(73.15 ±0.07)%,与对照组[(52.55 ±3.61)]%比较差异显著(P <0.05),见表1。而S 期的细胞数量仅(15.95±2.76)%,与对照组[(35.65 ±6.71)%]比较f 显著降低(P <0.05)。此外,图2 中G0/G1期峰前并没有明显的亚峰,提示大黄素可能对MCF-7 细胞凋亡的影响较小。
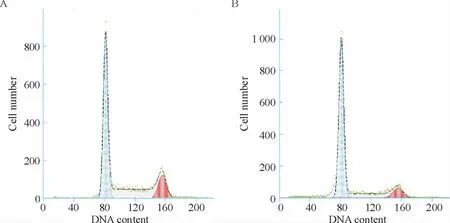
Figure 2. Effects of emodin on the cell cycle distribution of MCF-7 cells.A:control;B:emodin (50 μmol/L).图2 大黄素对MCF-7 细胞周期分布的影响
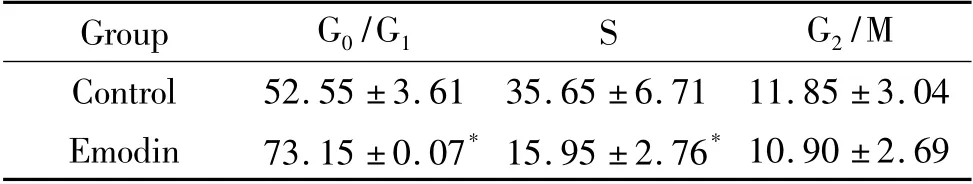
表1 大黄素阻滞MCF-7 细胞周期于G0/G1 期Table 1. Emodin induced cell cycle arrest at G0/G1 phase (%.Mean±SD.n=3)
3 大黄素对MCF-7 细胞凋亡的影响
进一步用Annexin V/PI 双染法检测大黄素是否可诱导MCF-7 细胞的凋亡。50 μmol/L 大黄素作用48 h,细胞的凋亡率为(6.35 ±1.93)%,与对照组细胞[(3.46 ±2.23)%]相比无显著差异,见图3。
4 大黄素影响MCF-7 细胞膜的超微结构
应用AFM 扫描成像,获得了各组单个细胞的超微形貌图和三维结构图。对照组的细胞铺展的舒展,核区饱满,膜表面平坦光滑,见图3A、B;与对照组相比,50 μmol/L 大黄素作用48 h 后MCF-7 细胞形态明显不同,细胞逐渐萎缩,伪足数量明显减少,细胞核明显坍塌,细胞表面粗糙,核区高度明显降低,见图3D、E;利用Nanoscope Analysis 软件测量核区高度:对照组细胞的核高度显著高于加药组(P <0.05),见图3C、F。
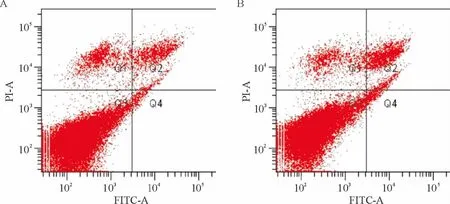
Figure 3. Effect of emodin on the apoptosis of MCF-7 cells.A:control;B:emodin (50 μmol/L).图3 大黄素对MCF-7 细胞凋亡的影响
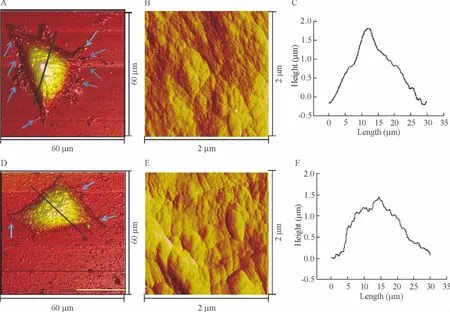
Figure 4. AFM morphological images of MCF-7 cells treated with 50 μmol/L emodin for 48 h. A ~C:control;D ~F:50 μmol/L emodin. A,D:three-dimensional morphological images (60 μm ×60 μm);B,E:ultrastructure (2 μm ×2 μm);C,F:the height profiles at the lines indicated in A,D.图4 大黄素对MCF-7 细胞膜超微结构的影响
为进一步探索大黄素对细胞膜超微结构的影响,通过Nanoscope Analysis 软件测量得到三维结构参数值:细胞膜表面的平均粗糙度(average roughness,Ra)和均方粗糙度(root mean square roughness,Rq)。大黄素组的细胞表面褶皱增多,粗糙度明显增大,其Rq[(50.12 ± 11.11)nm]和Ra [(40.61 ±9.30)nm],与对照组的Rq[(29.39 ±6.09)nm]和Ra[(22.51 ± 4.64)nm]比较有显著差异(P <0.05),见表2。

表2 大黄素对MCF-7 细胞膜超微结构的影响Table 2. Ultrastructural parameters of MCF-7 cells treated with emodin (nm.Mean±SD.n=9)
讨 论
大黄素是从大黄中提取的一种天然的蒽醌类衍生物,是蓼科大黄属植物的根及根状茎中的活性成分,也是大黄中的主要有效成分,其药理作用广泛[5]。近年来,大黄素在诱导肿瘤细胞凋亡、影响肿瘤细胞生长周期和抑制肿瘤转移中的作用受到关注。Kawai 等[6]首先发现大黄素能够抑制小鼠白血病L1210 细胞的生长,随后发现大黄素对多种肿瘤细胞的增殖均有抑制作用,但其抗肿瘤的机制并不相同。
本实验通过流式细胞术检测用药后肿瘤细胞周期及凋亡情况,并采用AFM 观察大黄素对细胞膜超微结构的影响,结果表明大黄素对人乳腺癌MCF-7细胞的增殖有明显的抑制作用,并且随着浓度的增加,抑制作用增强,存在一定的量效关系。有文献报道,大黄素通过将人胃癌SCG-7901 细胞阻滞于G2/M 期并诱导其凋亡来发挥其抗肿瘤作用[7],而对于人结肠癌HT-29 细胞,大黄素则将其细胞周期阻滞于S 期来发挥其抗肿瘤作用[8]。进一步探讨大黄素抑制MCF-7 细胞增殖的机制发现,大黄素可阻抑MCF-7 细胞的细胞周期于G0/G1期,而Annexin V/PI 双染结果显示大黄素对MCF-7 细胞无明显诱导凋亡的作用。以上实验结果表明大黄素主要通过影响细胞周期从而抑制MCF-7 细胞的增殖。
AFM 具有高分辨率、高灵敏度的优点,近年来原子动显微镜亦用于肿瘤细胞的成像研究,可作为检测肿瘤细胞的凋亡以及评估抗肿瘤药物疗效的工具。本实验通过AFM 观察大黄素对MCF-7 细胞超微形貌的影响,进一步在单细胞水平上明确大黄素是否具有抗肿瘤作用。结果显示,大黄素作用后,细胞逐渐萎缩,核区发生明显坍塌。细胞周围的丝状伪足也开始减少,说明大黄素作用于细胞后,可能干扰了细胞的侵袭作用,减弱了细胞间的信息传递。而且大黄素作用后,细胞膜表面的粗糙度与对照组相比明显增加。粗糙度是细胞形貌的超微结构重要参数之一,已证实细胞表面粗糙度的大小与细胞骨架的完整性及细胞表面糖基蛋白等变化相关[9],我们推测粗糙度的增加可能是药物作用于细胞膜表面分子,使细胞的骨架发生重排,导致细胞呈现不同的形貌,而这些形貌变化又与细胞黏附、增殖等特性密切相关[10-12]。通过AFM 得到的数据在纳米级水平上为揭示细胞的生理病理状态提供了可视化依据,同时为实现通过单细胞诊断癌症提供有用的数据支持。
我们的实验表明,大黄素可通过影响细胞周期、破坏细胞膜超微结构而对人乳腺癌MCF-7 细胞有显著的杀伤作用,为临床应用大黄素治疗乳腺癌提供实验依据。
[1] Wang S,Chen T,Chen R,et al. Emodin loaded solid lipid nanoparticles:Preparation,characterization and antitumor activity studies[J]. Int J Pharm,2012,430(1-2):238-246.
[2] 邵 勤,官 阳,杨木兰,等. 大黄素抑制PDGF 诱导的肝癌细胞增殖[J]. 中华肿瘤防治杂志,2007,14(7):514-517.
[3] 廖子君,宋永春,陈晓泉. 大黄素对人肺腺癌A-549 细胞增殖周期影响的实验研究[J]. 中华肿瘤防治杂志,2007,14(5):342-344.
[4] 范仁根,田力平,钱海鑫,等. 大黄素对人肝癌细胞smmc-7721 的作用及机制[J]. 中华实验外科杂志,2005,22(7):881.
[5] 刘 薇,王一飞,刘中秋. 大黄素在人肝肠微粒体的葡萄糖醛酸化反应[J].中国病理生理杂志,2012,28(9):1681-1685.
[6] Kawai K,Kato T,Mori H,et al. A comparative study on cytotoxicities and biochemical properties of anthraquinone mycotoxins emodin and skyrin from Penicillium islandicum sopp[J]. Toxicol Lett,1984,20(2):155-160.
[7] 刘贵忠,杨文修,王新宇,等. 大黄素、芦荟大黄素、大黄酸诱导肿瘤细胞凋亡的信号转导通路[J].哈尔滨师范大学自然科学学报,2004,20(4):95-98.
[8] 曹燕亚,左文英,张 俊,等.大黄素对人结肠癌HT-29细胞体外增殖的抑制作用[J].上海中医药杂志,2012,46(9):81-84.
[9] Stolz M,Gottardi R,Raiteri R,et al. Early detection of aging cartilage and osteoarthritis in mice and patient samples using atomic force microscopy[J].Nat Nanotechnol,2009,4(3):186-192.
[10]Li QS,Lee GY,Ong CN,et al. AFM indentation study of breast cancer cell[J]. Biochem Biophys Res Commum,2008,374(4):609-613.
[11]陈 勇,蔡继业,邢少璟,等.多种肿瘤细胞表面超微结构的原子力显微镜观察及药物对细胞膜表面超微结构影响的初步研究[J].电子显微学报,2003,22(2):100-104.
[12]柳佳利,王 珣,林 熙,等.原子力显微镜观察青蒿琥酯对人胃癌细胞株SCG-7901 膜表面形貌的影响[J].中国病理生理杂志,2012,28(6):974-979.
