靶向泛素连接酶SIAH2 的shRNA 对人肝癌细胞株HepG2 细胞周期和凋亡的影响*
2013-12-23贺兴波黄才斌
肖 海, 贺兴波, 黄才斌, 刘 瑶△
(赣南医学院1病理学教研室,2第一附属医院医务科,3第一附属医院消化科,江西 赣州341000)
原发性肝癌(hepatocellular carcinoma,HCC)是一种全球高度恶性的肿瘤,大多数肝癌患者在发现症状时已处于病程的中晚期阶段,错过了手术治疗的最佳时机[1]。我们前期研究发现:原发性肝细胞癌组织中检测到泛素连接酶SIAH2(seven in absentia homolog 2)的高表达[2]。我们推测,SIAH2 可能是一个促进肝癌发生发展的癌基因。本研究利用RNA干扰技术抑制肝癌细胞中SIAH2 的表达,观察其对HepG2 细胞增殖、周期和凋亡的影响,为以SIAH2 为靶标的肝癌基因治疗提供实验依据。
材 料 和 方 法
1 材料
人肝癌细胞株HepG2 由本室保存;pGenesil-SIAH2 重组质粒由本室前期构建;Lipofectamine 2000购自Invitrogen;RPMI-1640 培养液和胎牛血清购自Gibco;MTS 试剂盒购自Promega;Annexin V-PE/ 7-氨基放线菌素D(7-aminoactinomycin D,7-AAD)细胞凋亡检测试剂盒购自南京凯基生物发展技术有限公司;细胞周期检测试剂盒购自碧云天生物技术研究所。RNA 提取液购自武汉祥云博生物工程技术有限公司,cDNA 第1 链合成试剂盒、蓝色预染PCR Mix以及DNA markerⅡ购自天根生化科技(北京)有限公司。兔抗人SIAH2 及GAPDH 单克隆抗体购自Santa Cruz;山羊抗兔IgG-HRP 购自武汉兴华基因生物科技有限公司;ECL 为Pierce 产品。
2 方法
2.1 细胞培养及质粒瞬时转染 HepG2 细胞在含10%胎牛血清的RPMI-1640 培养基(含1 ×105U/L青霉素和100 mg/L 链霉素)中培养,于37 ℃、5%CO2及饱和湿度条件下培养,每3d 传代1 次。用去内毒素质粒纯化试剂盒提取质粒pGenesil-SIAH2 和pGenesil-1,其含量和纯度测定按分子克隆所述。通过Lipofectamin 2000 转染处于对数生长期的HepG2细胞,每1 ×106个细胞转染4 μg 质粒。转染pGenesil-SIAH2 细胞的HepG2 细胞命名为HepG2-SIAH2细胞;未转染任何质粒的HepG2 细胞为阴性对照;转染空载体pGenesil-1 的HepG2 细胞命名为HepG2-neo 细胞;脂质体对照组命名为HepG2-Lipo 细胞。转染后24 h 在倒置荧光显微镜观察瞬时转染各组细胞的荧光强度。
2.2 RT-PCR 检测SIAH2 mRNA 的表达 提取转染后72 h HepG2-SIAH2、HepG2-neo、HepG2-Lipo 和正常HepG2 细胞总RNA,按试剂盒要求逆转录合成cDNA。SIAH2(152 bp)上游引物5’-GAT CCA CAT GAA CGC ACG-3’,下游引物5’-GAG GGA AGC CAC GTG TAA AC-3’;内参照GAPDH(258 bp)上游引物5’-AGA AGG CTG GGG CTC ATT TG-3’,下游引物5’-AGG GGC CAT CCA CAG TCT TC-3’。PCR反应条件:94 ℃预变性2 min;94 ℃30 s,48 ℃30 s,72 ℃30 s,共35 个循环,末次循环后72 ℃10 min反应结束,扩增产物于1 % 琼脂糖凝胶电泳观察。
2.3 Western blotting 检测SIAH2 蛋白的表达 按试剂盒要求提取转染后72 h HepG2-SIAH2、HepG2-neo、HepG2-Lipo 和正常HepG2 细胞总蛋白并定量。取40 μg 总蛋白变性5 min,进行12% SDS-PAGE 电泳,按照marker 切去需要的凝胶转移至PVDF 膜上。用含10% 脱脂奶粉的TBS 4 ℃封闭过夜,加入特异性SIAH2 和GAPDHⅠ抗(浓度均为1∶1 000),37 ℃孵育1 h;室温TBST 漂洗4 次,每次15 min。Ⅱ抗(1∶2 000)37 ℃孵育1 h,室温漂洗4 次,每次15 min。反应信号经化学荧光底物发光,X 线胶片曝光。
2.4 MTS 细胞增殖实验 分别用0.25%胰蛋白酶消化并收集HepG2 细胞,调整细胞浓度为1 ×108cells/L,取100 μL/well 接种至96 孔板。脂质体转染操作同前所述。HepG2-SIAH2、HepG2-neo、HepG2-Lipo 和正常HepG2 细胞分别在转染后12 h、24 h、48 h 和72 h 将对应96 孔板换液并加入100 μL/well RPMI-1640 培养液及10 μL/well MTS。室温、5% CO2及饱和湿度条件下培养4 h,酶标仪读取A490数据。细胞生长抑制率(%)= (1 - 实验孔A值/对照孔A 值)×100%。
2.5 细胞周期分析 分别用0.25%胰蛋白酶消化并收集转染后48 h 的HepG2-SIAH2、HepG2-neo、HepG2-Lipo 和正常HepG2 细胞,调整细胞浓度为1 ×109cells/L;制备的单细胞悬液用体积分数为70%乙醇固定,4 ℃保存过夜,染色前用PBS 洗去固定液;加50 μL RNase A 37 ℃水浴30 min;再加200 μL PI 染色均匀,4 ℃避光30 min;上流式细胞仪检测,记录激发波长为488 nm 处红色荧光。
2.6 细胞凋亡检测 分别用0.25%胰蛋白酶消化并收集转染后48 h 的HepG2-SIAH2、HepG2-neo、HepG2-Lipo 和正常HepG2 细胞,调整细胞浓度为1 ×109cells/L;加入200 μL Binding Buffer 悬浮细胞;加入5 μL Annexin V-PE 混匀后,加入5 μL 7-AAD混匀,室温避光反应5 ~15 min;在1 h 之内上流式细胞仪检测。
3 统计学处理
采用SPSS 17.0 统计软件,数据以均数±标准差(mean±SD)表示,组间比较用单因素方差分析,以P <0.05为差异有统计学意义。
结 果
1 荧光显微镜下观察各组细胞转染情况
HepG2 细胞瞬时转染重组载体pGenesil-SIAH2和空载体pGenesil-1 24 h 后,均可见明显的绿色荧光。脂质体组和未转染任何质粒的HepG2 仅见到微弱的荧光,见图1。
2 RT-PCR 检测SIAH2 mRNA 表达水平
RT-PCR 结果显示,HepG2-SIAH2 细胞SIAH2 mRNA 表达量(0.02 ±0.02)显著低于正常HepG2 细胞(0.11 ±0.05)、HepG2-neo 细胞(0.13 ±0.04)和HepG2-Lipo 细胞(0. 12 ± 0. 01)(均P <0. 05)。HepG2-neo 细胞、HepG2-Lipo 细胞和正常HepG2 细胞之间,差异无统计学意义(P >0.05),见图2。
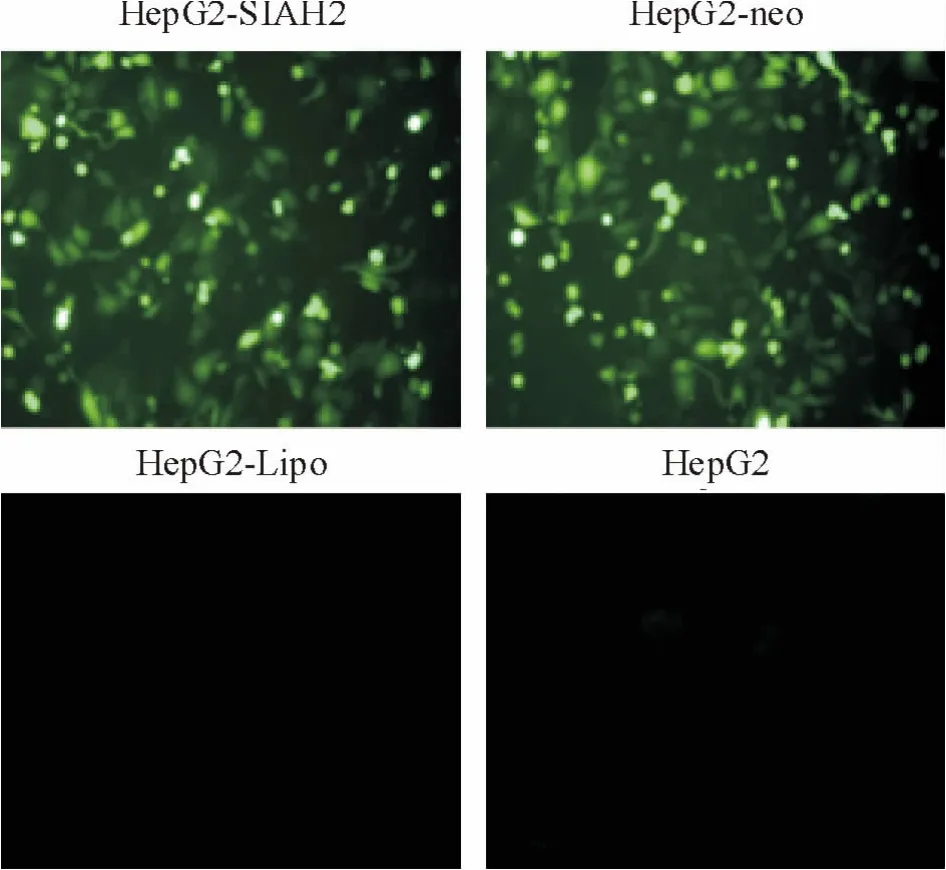
Figure 1. Detection of transfection efficiency by fluorescence microscopy (×200).图1 荧光显微镜下观察各组细胞的转染效率
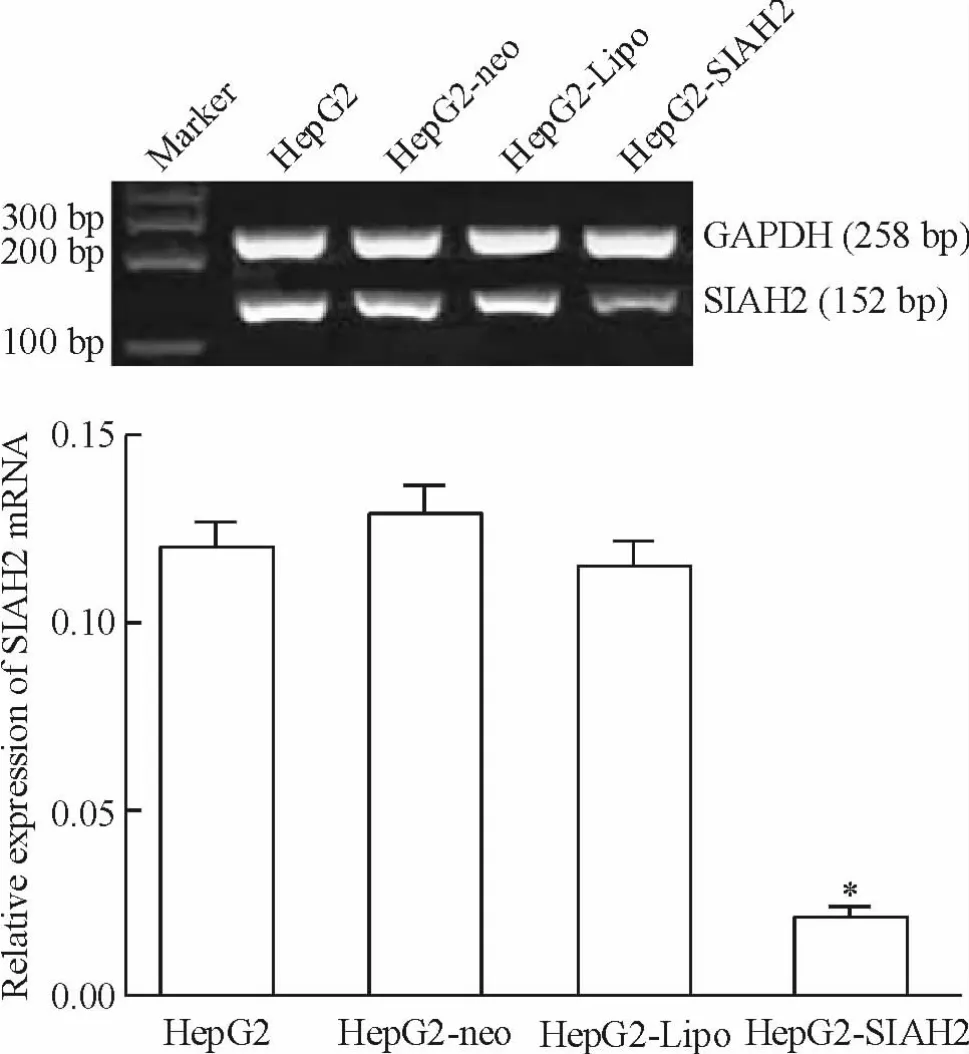
Figure 2. The expression of SIAH2 mRNA in each group after transfection. Mean ± SD. n =3. * P <0.05 vs other groups.图2 各组细胞转染后SIAH2 mRNA 相对表达量
3 Western blotting 检测SIAH2 蛋白表达水平
Weatern blotting 结果显示,HepG2-SIAH2 细胞SIAH2 蛋白表达量(0.68 ± 0.01)显著低于正常HepG2 细胞(1.09 ±0.02)、HepG2-neo 细胞(1.05 ±0.04)和HepG2-Lipo 细胞(1.04 ± 0.04)(均P <0.05)。HepG2-neo 细胞、HepG2-Lipo 细胞和正常HepG2 细胞之间,差异无统计学意义(P >0.05),见图3。
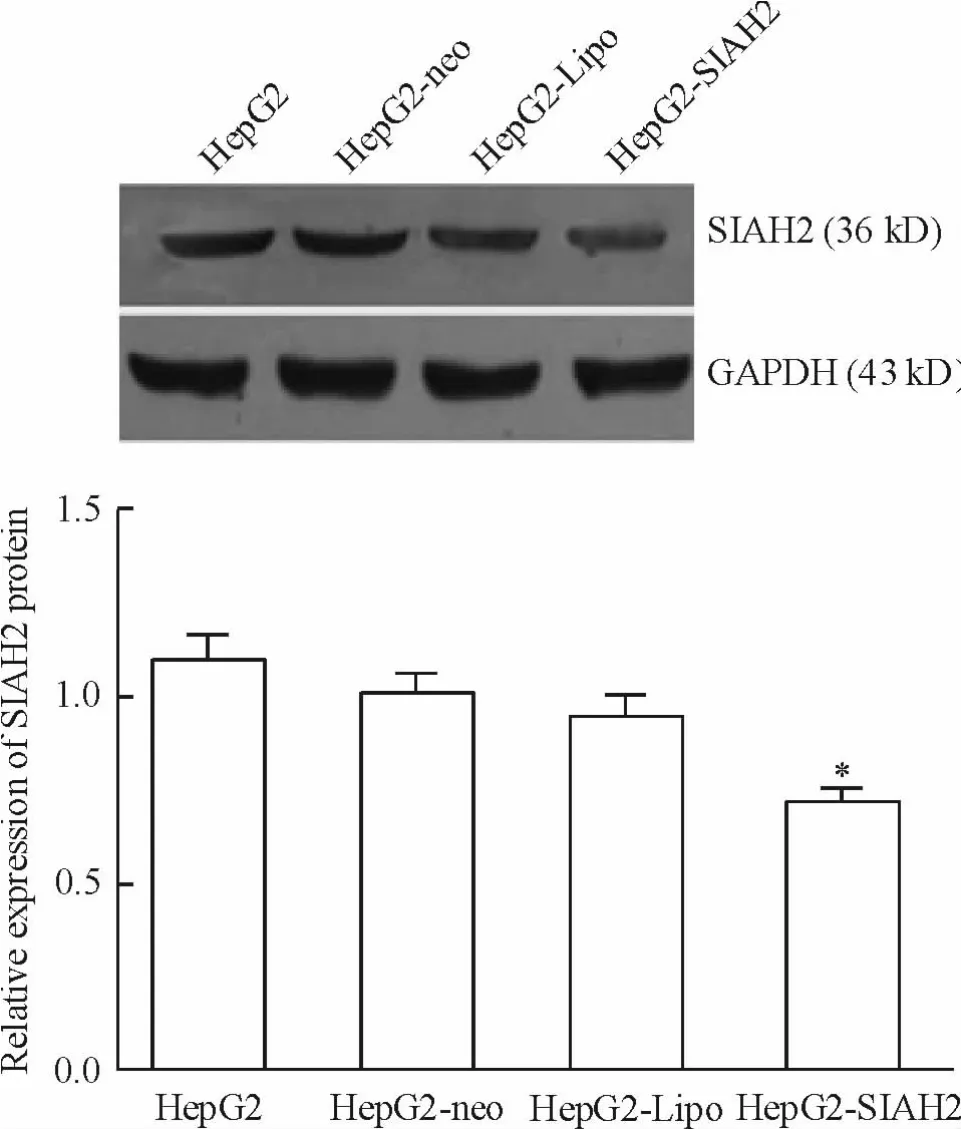
Figure 3. The expression of SIAH2 protein in each group after transfection. Mean ± SD. n =3. * P <0.05 vs other groups.图3 各组细胞转染后SIAH2 蛋白相对表达量
4 pGenesil-SIAH2 抑制HepG2 细胞的增殖
用MTS 比色法检测各组细胞转染后12 ~72 h的生长情况,发现pGenesil-SIAH2 转染组细胞增殖速度较其它各组明显减慢,各时点吸光度值明显低于HepG2-neo、HepG2-Lipo 和正常HepG2 细胞(P <0.05)。HepG2-neo、HepG2-Lipo 和正常HepG2 细胞之间差异无统计学意义(P >0.05)。转染pGenesil-SIAH2 24 h 细胞吸光度值开始下降,细胞增殖抑制率为36.3% ±2.3%;48 h 抑制效果最明显,抑制率为55.2% ±4.2%;48 h 后抑制效应减弱,增殖速度有所提高,但仍低于其它各组;72 h 细胞抑制率为51.1% ±1.2%,各时点吸光度值见表1。
5 pGenesil-SIAH2 对HepG2 细胞周期的影响
流式细胞术检测各组细胞周期的变化,与HepG2 细胞[G1期(44.62 ±0.23)%,S 期(25.66± 0.16)%]、HepG2-neo 细 胞[G1期(46.87 ±0.12)%,S 期(25.71 ±0.87)%]和HepG2-Lipo 细胞[G1期(45.29 ±0.35)%,S 期(25.92 ±0.66)%]相比较,HepG2-SIAH2 细胞G1期细胞显著增多,S 期细胞显著减少[G1期(49.68±0.25)%,S 期(22.94 ±0.66)%],细胞明显阻滞于G1期(P <0.05),见图4。

表1 MTS 法检测pGenesil-SIAH2 转染对HepG2 细胞增殖的影响Table 1. Effects of pGenesil-SIAH2 transfection on the proliferation of HepG2 cells measured by MTS assay(Mean±SD.n=3)
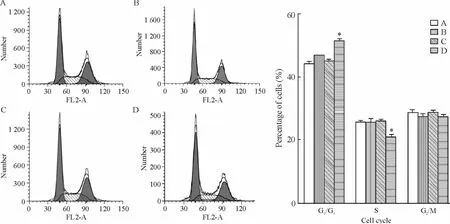
Figure 4. The cell cycle of HepG2 cells measured by flow cytometry. A:HepG2;B:HepG2-neo;C:HepG2-Lipo;D:HepG2-SIAH2.Mean±SD.n=3. * P <0.05 vs other groups.图4 流式细胞术检测各组细胞细胞周期的变化
6 pGenesil-SIAH2 对HepG2 细胞凋亡的影响
Annexin V-PE/7-AAD 流式细胞术可将实验样本中的正常、早期凋亡、晚期凋亡和坏死细胞区分开来,即左下象限(LL)为活细胞(Annexin V-/7-AAD-),右下象限(LR)为早期凋亡细胞(Annexin V+/7-AAD-),右上象限(UR)为晚期凋亡和坏死细胞(Annexin V+/7-AAD+)。流式结果显示,与HepG2、HepG2-neo 和HepG2-Lipo 组相比,HepG2-SIAH2 组早期凋亡率明显增高,差异显著(P <0.05)。HepG2、HepG2-neo 和HepG2-Lipo 组之间,差异无统计学意义(P >0.05),见图5。
讨 论
泛素化修饰是近几年在细胞内发现的一种与磷酸化作用相似的蛋白质翻译后修饰方式,与细胞生命活动、神经系统退行性变、免疫应答、炎症反应均有着密切的关系,特别在精细调控细胞周期,抑制或促进细胞凋亡以及激活转录因子的表达等方面发挥了重要作用,是蛋白质发挥功能的重要调节机制之一[3]。泛素化修饰主要发生在赖氨酸残基的侧链,其过程是在泛素激活酶E1 和泛素结合酶E2 协同下,泛素连接酶E3 募集特异的靶蛋白和E2,并介导泛素与靶蛋白共价结合,形成多聚泛素链,26S 蛋白酶体随后识别并降解带有多聚泛素链的靶蛋白[4]。E3 泛素连接酶也可以通过单泛素化方式修饰靶蛋白,调节靶蛋白功能。当E3 发生功能性突变时,其对靶蛋白的调控能力丧失可引起癌蛋白聚集、抑癌蛋白异常降解、细胞凋亡受阻或/和增殖加速,从而导致肿瘤的发生发展[5-6]。
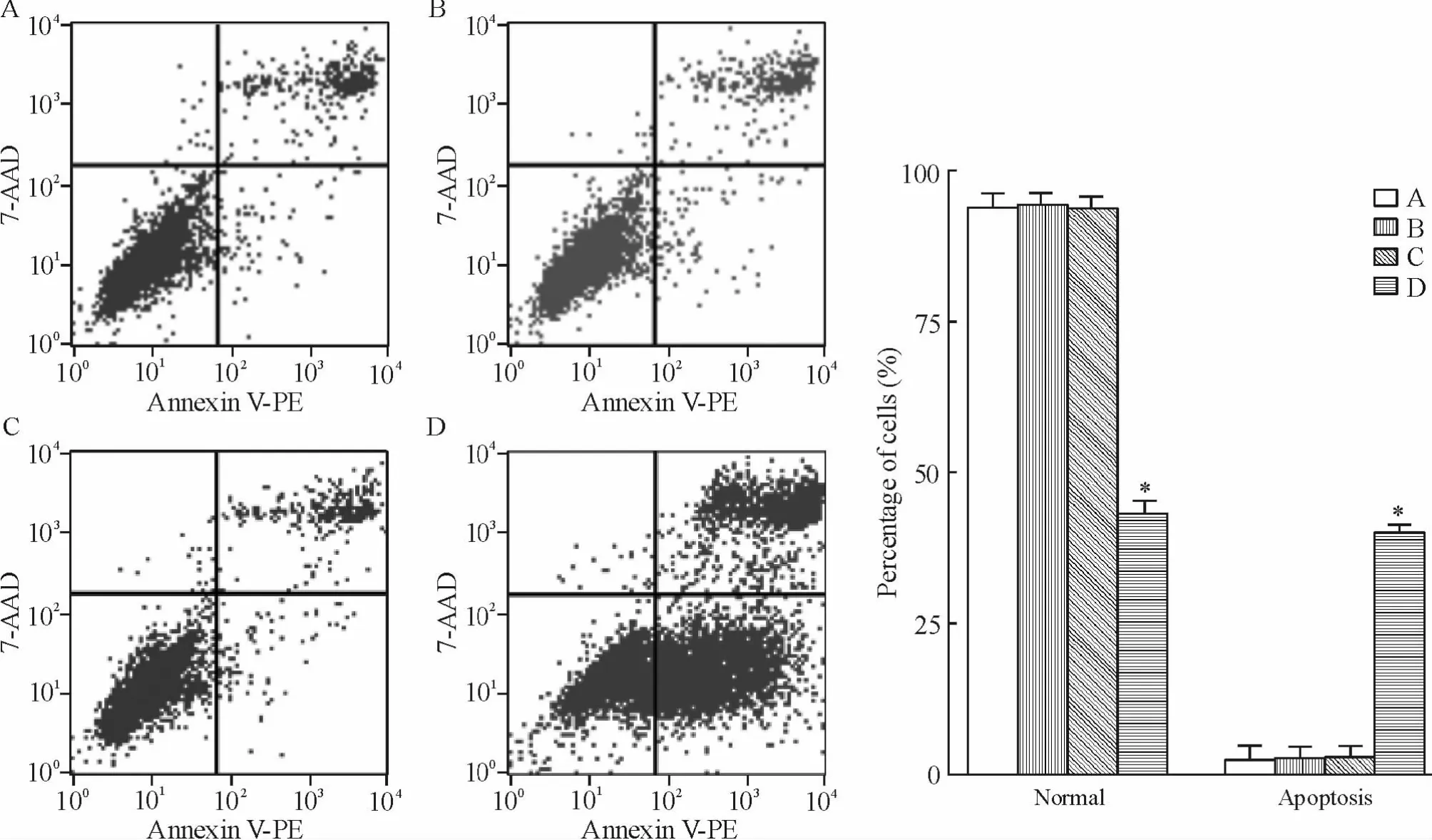
Figure 5. The apoptotic rate of HepG2 cells detected by flow cytometry. A:HepG2;B:HepG2-neo;C:HepG2-Lipo;D:HepG2-SIAH2.Mean±SD.n=3. * P <0.05 vs other groups.图5 流式细胞仪检测各组细胞凋亡率的变化
SIAH 是在哺乳动物中发现的一种E3 泛素连接酶家族成员,其C 末端为底物结合域(substrate binding domain,SBD),中间由2 个高度保守的的锌指结构域组成,N 末端含有40 ~80 个氨基酸残基和典型的环指结构域(ring finger domain)。人类SIAH2定位于染色体3q25,编码324 个氨基酸[7]。研究发现:胰腺癌和肺癌组织的中检测到SIAH2 高表达,且SIAH2 的表达水平与肿瘤的临床病理分期和分化程度相关;SIAH2 在BxPC3、Panc-1 等胰腺癌细胞及BZR、A549 等肺癌细胞中有高表达;抑制SIAH2 可显著抑制人胰腺癌或肺癌裸鼠皮下移植瘤的生长[8-9]。功能结构域缺陷的SIAH2 或SIAH2 的RNA干扰载体可降低磷酸化ERK 的活性,抑制细胞增殖,诱导细胞凋亡[10]。我们的前期研究发现:SIAH2在肝癌组织中的表达阳性率高于相应癌旁组织,差异有统计学意义。SIAH2 表达水平与肝癌患者TNM分期具有相关性,与患者的性别、年龄、甲胎蛋白水平、肿瘤大小、血清HBsAg(hepatitis B surface antigen)水平和是否伴随肝硬化不存在相关性[2]。上述研究结果提示,SIAH2 可能作为一个癌基因,在肝癌发病过程中发挥了重要作用。
本研究中,我们将前期筛选到的特异性靶向SIAH2 的RNA 干扰载体pGenesil-SIAH2 转染HepG2细胞,RT-PCR 和Western blotting 结果证实SIAH2 mRNA 和蛋白表达水平显著下调。MTS 结果显示转染pGenesil-SIAH2 的HepG2 细胞生长受到抑制。采用流式细胞术分析RNA 干扰对HepG2 细胞的增殖和细胞周期的影响,结果显示pGenesil-SIAH2 转染48 h 后,G1期细胞比例明显高于其它组,提示沉默SIAH2 基因可阻止G1期细胞进入S 期,造成G1期细胞聚集,S 期细胞减少,从而抑制HepG2 细胞增殖[11]。
在凋亡的早期阶段,分布在细胞膜脂质双层内侧的磷脂酰丝氨酸(phosphatidylserine,PS)由脂膜内侧翻向外侧,从而被PS 特异的Annexin V 探针所标记。将Annexin V 进行荧光素PE 标记,利用荧光显微镜或流式细胞仪可检测细胞凋亡的发生[12]。核酸染料7-AAD 对细胞膜完整的活细胞和早期凋亡细胞是拒染的,而对膜完整性被破坏的晚期凋亡细胞或坏死细胞可以染色。因此,Annexin V-PE 结合7-AAD 双染后,流式细胞术检测结果呈现3 个细胞群,即左下象限(LL)正常细胞、右下象限(LR)早期凋亡细胞和右上象限(UR)晚期凋亡和坏死细胞。在本研究中,我们发现HepG2-SIAH2 细胞早期凋亡率较其它各组明显升高。虽然凋亡早期细胞膜的完整性未遭到破坏,但胞内早已启动了凋亡机制,比如线粒体膜电位的丧失、细胞色素C 进入胞浆、细胞内钙离子浓度升高以及启动蛋白水解酶层叠级联反应等。凋亡晚期阶段,细胞在蛋白水解酶等凋亡效应分子的作用下,胞膜完整性遭到破坏,细胞皱缩,染色质浓缩,DNA 裂解为长度不等的片段(180 ~200 bp 整倍数),最后形成由细胞膜包裹的凋亡小体并被其它细胞所吞噬。细胞处于坏死阶段时,细胞肿胀直至破裂并释放出内含物,常引起炎症反应。因此,相对于晚期凋亡和坏死而言,早期凋亡能更灵敏地体现凋亡诱导因素作用下,细胞内部发生的一系列分子生物学事件。
综上所述,利用RNA 干扰技术下调SIAH2 基因表达后,HepG2 细胞生长速度减慢,增殖受抑且凋亡率增加。接下来我们将建立人肝癌裸鼠皮下移植瘤模型,探讨SIAH2 作为肝癌基因治疗靶点的可行性,为进一步阐明SIAH2 的分子生物学功能及其与肝癌发病的相关性,研制高效、特异的新型抗肿瘤药物提供实验依据。
[1] Bosch FX,Ribes J,Cleries R,et al. Epidemiology of hepatocellular carcinoma[J]. Clin Liver Dis,2005,9(2):191-211.
[2] 刘 瑶,廖跃光,黄才斌,等. 肝细胞癌组织中PEG10、SIAH2 的表达及其意义[J]. 临床与实验病理学杂志,2012,28(4):371-373.
[3] 杨 娜,侯巧明,南 浩,等. 泛素连接酶的结构与功能研究进展[J]. 生物化学与生物物理学进展,2008,35(1):14-20.
[4] 杨东叶,刘凯于,余泽华. 泛素连接酶E3[J]. 细胞生物学杂志,2005,27(3):281-285.
[5] 倪晓光,赵 平. 泛素-蛋白酶体途径与恶性肿瘤关系的研究进展[J]. 中华肿瘤防治杂志,2007,14(19):1512-1519.
[6] Confalonieri S,Quarto M,Goisis G,et al. Alterations of ubiquitin ligases in human cancer and their association with the natural history of the tumor[J]. Oncogene,2009,28(33):2959-2968.
[7] Wen YY,Yang ZQ,Song M,et al. SIAH1 induced apoptosis by activation of the JNK pathway and inhibited invasion by inactivation of the ERK pathway in breast cancer cells[J]. Cancer Sci,2010,101(1):73-79.
[8] Schmidt RL,Park CH,Ahmed AU,et al. Inhibition of RAS-mediated transformation and tumorigenesis by targeting the downstream E3 ubiquitin ligase seven in absentia homologue[J].Cancer Res,2007,67(24):11798-11810.
[9] Ahmed AU,Schmidt RL,Park CH,et al. Effect of disrupting seven-in-absentia homolog 2 function on lung cancer cell growth[J]. J Natl Cancer Inst,2008,100(22):1606-1629.
[10]Möller A,House CM,Wong CS,et al. Inhibition of Siah ubiquitin ligase function[J]. Oncogene,2009,28(2):289-296.
[11]余海浪,刘安玲,周珏宇,等. 靶向COLIA1 基因的shRNA 对人乳腺癌MDA-MB-231 细胞增殖与凋亡的影响[J]. 中国病理生理杂志,2012,28(12):2182-2186.
[12]刘晓兵,郭晓红,刘立新,等. siRNA 沉默Smad3 对肝星状细胞增殖与凋亡的影响及其机制研究[J]. 中国病理生理杂志,2011,27(7):1376-1381.
