兔眼蓝莓组织培育苗高效快繁技术
2013-12-22邱义兰陈冰心邓喜艳黄雄军刘如石
邱义兰,陈冰心,邓喜艳,黄雄军,吴 婷,刘如石*
(1.湖南师范大学生命科学学院,中国长沙 410081;2.长沙智博生物科技有限公司,中国长沙 410200)
蓝莓属杜鹃花科越橘属(Vaccinum)植物中的蓝果类型,为多年生落叶或者常绿小果类灌木型果树.蓝莓果实富含花青素、不饱和脂肪酸、鞣酸及钙、钾、锌、铁等元素,B 族维生素在蓝莓果中含量尤为突出.蓝莓具有很高的保健功能,被国际粮农组织列为五大健康食品之一,堪称世界水果之王,是近几年来发展最迅速的集营养与保健于一身的第3 代果树品种[1-4].
兔眼蓝莓(Vaccinium ashei Reade)是越桔属中经济价值较高的一种,品质佳,口感好,其生态适应性、长势和抗病虫性较强,无论高地还是低地、粘土或沙土上均能生长,非常适合我国南方栽培.随着引种规模日益扩大,优良种苗需求量急剧增加,种苗生产供不应求.组织培养凭借其无性繁殖的独特优势,可以迅速去除病毒和更新品种,保留品种的本来特性,变异性小,并且可在较小空间和较短时间内快速地获得大量无性系组培苗,成为蓝莓脱毒和快速繁殖的主要途径.作者就兔眼蓝莓建立了一种高速快繁的有效方法.
1 材料与方法
1.1 材料
植物材料为智博生物科技公司种植园种植的兔眼蓝莓品种——杰兔.外植体材料为当年生幼嫩枝.
1.2 方法
1.2.1 无菌苗的获得 以田间生长的当年生嫩枝为初始外植体,摘除叶片.用洗衣粉水溶液洗净灰尘等污物后,自来水冲洗.转到超净工作台上,先后用体积分数为75%乙醇和1 g/L 氯化汞对外植体分别进行50 s 与10 min 的表面灭菌,接着用无菌水冲洗4 次(每次约2 min),最后用无菌滤纸吸去外植体表面水分.将枝条切成1~2 cm 长的单芽茎段,在无菌条件下将单芽茎段接种于WPM(改良)+1.0 mg/L ZT+20 g/L 蔗糖+9 g/L日产琼脂粉的培养基(pH=5.2)上诱导侧芽萌发(图1A).培养条件为:温度(25 ±2)℃、光强2 500 Lx、光周期16 h 光照/8 h 黑暗.30 d 后茎段腋芽伸长约4~6 cm,叶片数量达7~9 枚(图1B).WPM 培养基具体改良方法:以Ca(NO3)2·4H2O、KNO3代替原WPM 培养基中的CaCl2、K2SO4.
1.2.2 丛生芽的诱导与增殖 待茎段叶芽伸长后,切下转接于以改良WPM 为基本培养基,加蔗糖20 g/L,日产琼脂粉8.8 g/L,附加不同浓度的ZT 和(或)6-BA 的增殖培养基(pH=5.2)中,具体是:0.5 mg/L ZT,1.0 mg/L ZT,2.0 mg/L ZT,5.0 mg/L ZT,0.5 mg/L 6-BA,1.0 mg/L 6-BA,0.5 mg/L6-BA+1.0 mg/L ZT,1.0 mg/L 6-BA+1.0 mg/L ZT.培养条件同上.

图1 A:单芽茎段诱导侧芽的萌发;B:培养30 d 后伸长的茎段腋芽;C:叶片叶尖端先暗培养20 d 后光照培养10 d 形成的重生苗(箭头所示);D:叶片叶柄端先暗培养20 d 后光照培养10 d 形成的重生苗(箭头所示);E:叶片离体培养50 d 后形成的重生苗Fig.1 A:Germination of the stems with single axillary bud;B:Elongated axillary buds of the stems cultured for 30 d;C:Regeneration plantlets from the tip part of the blades cultured first for 20 d in the dark and then for 10 d in the 15 h lighting and 9 h darkness(arrow);D:Regeneration plantlets from the petiole part of the blades cultured first for 20 d in the dark and then for 10 d in the 15 h lighting and 9 h darkness(arrow);E:Regeneration plantlets from the blades in vitro cultured for 50 d
1.2.3 叶片再生体系的建立 以改良WPM+1.0 mg/L ZT+20 g/L 蔗糖+9 g/L 琼脂粉(pH=5.2)为培养基,取无菌苗植株上碧绿的叶片,按不同的叶片切法、不同培养方式、不同浓度的ZT,筛选最合适的叶片再生体系.4 种不同的叶片切法:垂直叶片主脉切取叶片的1/2、1/3、2/3 以及全叶,背面朝下,叶尖与叶柄分开放置,接种于培养瓶内,每瓶10 片左右,每个处理组重复8~10 瓶.不同培养方式:暗培养时间分别为0、7、20、30 d,每个处理重复15~20 瓶(暗培养温度为(25 ±2)℃).几种浓度ZT(mg/L):0.5、0.8、1.1、1.4、1.7、2.0.30 d 后观察记录叶片的出芽率与生长状况,计算诱导重生苗率=诱导重生苗形成的叶片数/接种叶片数,从而获得最佳的叶片再生体系.培养条件同上.
1.2.4 试管苗生根培养 剪取苗高约2.0 cm 左右的单芽茎段,改良WPM 为基本培养基,另添加蔗糖20 g/L,琼脂9 g/L,pH 值5.3 左右.从不同盐浓度(WPM、1/2WPM、1/4 WPM、1/8 WPM)、不同活性炭质量浓度(0、0.5、1.0、1.5、2.0 g/L)、不同IBA 质量浓度(0.1、0.2、0.4、0.6、0.8 mg/L)的培养基中筛选出最适宜的生根培养基.培养条件同上.
1.2.5 炼苗 炼苗时,提前3 d 打开瓶盖进行过渡.移栽后在组培室条件下保持湿度100%的塑料棚中培养20 d,然后在湿度80%、透光度70%的室外条件下过渡7 d 再逐步通风换气.15 d 后,完全揭去棚膜.2 周后统计成活率.炼苗时,每套基质的栽植量不少于50 株.各试验的重复次数不少于3 次.几种炼苗基质为:V(草炭)∶V(河沙)=1∶1;V(草炭)∶V(田土)=1∶1;V(草炭)∶V(石英砂)=2~3∶1;V(草炭)∶V(珍珠岩)=1~2∶1;全部采用水苔藓.
2 结果与分析
2.1 丛生芽的诱导与增殖
将获得的无菌苗转接到几种增殖培养基上进行比较.图2 的结果表明,改良WPM+ZT 的增殖效果明显优于改良WPM+6-BA 和改良WPM+6-BA+ZT 的组合.在WPM+ZT 中,不定芽的发生率与培养基中的ZT有密切的关系.当ZT 质量浓度为1 mg/L 时,10 d 左右在苗茎基部开始出现丛生芽,20 d 后增殖率超过6倍,经几次继代后,增殖率高达40~50 倍,丛生芽粗壮,生长势头好,呈鲜嫩状.当ZT 质量浓度升高到2 mg/L时,丛生芽开始生长和分化的时间与1 mg/L 时相差不大,其增殖率稍有增加.当ZT 质量浓度高于2 mg/L 时,再生苗开始生长和分化现象提前,多数分化出来的新梢枝上出现2 次枝,增殖率超过12 倍,苗长势较弱且同时出现玻璃化苗现象.WPM 与其他激素组合效果均差于WPM+ZT 组合.使用6-BA 时,0.5 mg/L 和1 mg/L 两种质量浓度差异不大,丛生芽均会在两周后出现生长和萌芽态势,增殖率为4~5 倍,其丛生芽生长缓慢,叶小且发红.而对于6-BA+ZT 组合,10 d 后出现少量愈伤,增殖率为6~8 倍,丛生芽生长速度慢.因此,从增殖率、丛生芽长势、玉米素成本等方面进行综合考虑,继代培养基以改良WPM+1 mg/L ZT 为最佳.
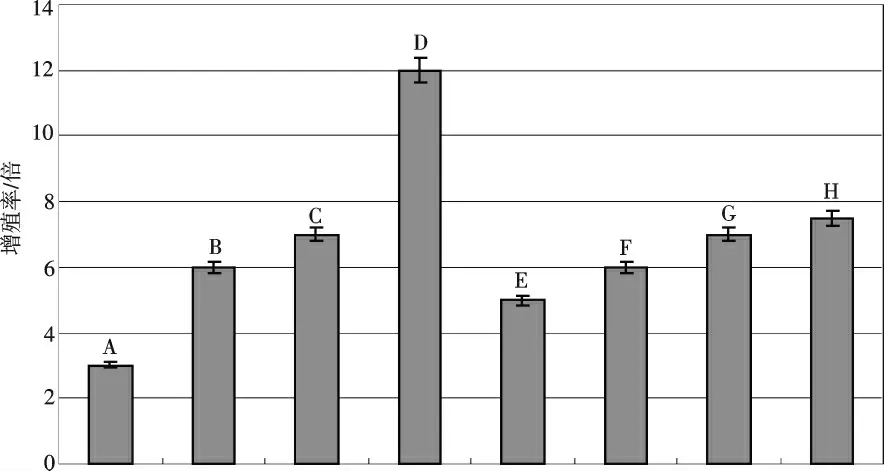
图2 不同增殖培养基上茎段的增殖率Fig.2 Reproductive rate of stems in different reproduction culture medium
2.2 叶片再生体系的建立
2.2.1 叶片不同部位对重生苗诱导的影响 离叶尖1/3、1/2、2/3 和全叶,按垂直叶片主脉方向将叶片切成二部分,叶片背面朝下接种于培养瓶内,30 d 后统计叶片重生率,结果见表1.从表1 中可以看出,离叶尖1/3处切法的诱导重生苗率最高,达到50%以上,而全叶的诱导重生苗率最低,仅26.1%.在几种叶片切法中,叶尖端的重生苗诱导率比叶柄端高(图1C,D,E).在同一植物体甚至相同器官组织中的不同细胞,其内源植物生长激素水平以及对外源植物生长调节剂的亲和力或敏感度存在差异[5].作者在研究中发现完整叶片培养过程中形成的愈伤组织很少,叶片被切割后在切口处形成的愈伤组织较多(该结果在本文中未显示),从而推测,前者对玉米素敏感度可能低于后者,叶片被切割后叶尖端对玉米素的敏感度可能高于叶柄端,因此全叶的诱导重生苗率最低,叶尖端的重生苗诱导率比叶柄端高.
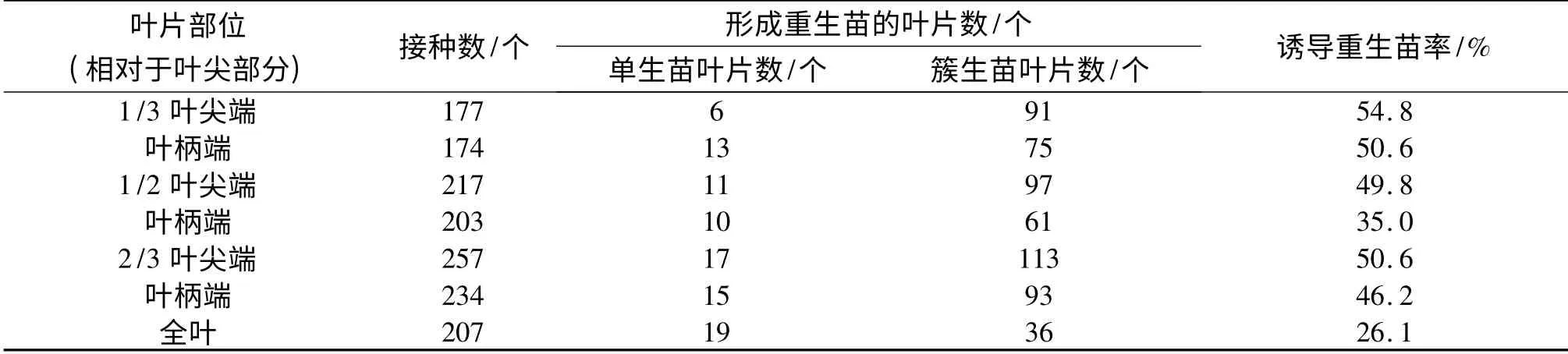
表1 叶片不同部位对重生苗诱导的影响Tab.1 Effects of different blade position on induction of regeneration seedlings
2.2.2 不同暗培养时间对叶片重生苗诱导的影响 在建立植物再生体系的研究中,暗培养是某些植物外植体重生苗的重要影响因素.不同暗培养时间对叶片重生苗诱导的影响见表2.从表2 可以看出,随着暗培养时间的延长,重生苗诱导频率呈增高趋势,不经暗培养直接在光照条件下的叶片重生率仅为29.3%,暗培养20 d 后的叶片重生率高达93.2%.当暗培养时间超过30 d 后,虽然叶片重生率超过90%,但由于叶片重生苗在暗培养时形成白化畸形苗,其有效苗数反而减少.由此可见20 d 的暗培养时间最为适宜.

表2 不同暗培养时间对叶片重生苗诱导的影响Tab.2 Effects of different time of dark culture on induction of regeneration seedlings of the blade
2.2.3 ZT 浓度对诱导叶片重生苗的影响 ZT 是一种高活力的细胞分裂素,具有打破植株顶端优势、促进腋芽萌发、诱导不定芽形成的作用.将离叶尖1/3 处按垂直叶片主脉方向将叶片切成叶尖端和叶柄端2 部分,研究不同浓度的ZT 对叶片重生苗的诱导作用,结果见表3.从表3 可以看出,0.5~2.0 mg/L ZT 均能诱导叶片不经愈伤组织直接出芽,植株的变异性减少.不同浓度的ZT 对叶片重生苗诱导的效果存在明显差异.0.5 mg/L ZT 对叶片重生苗的诱导率低,尚不足50%,叶片的叶尖端主要诱导簇生苗,叶柄端主要诱导单生苗;随着ZT 浓度的升高,叶片重生苗的诱导率增加,在1.7 mg/L ZT 时达到最高,叶片的叶尖端与叶柄端的重生苗诱导率分别达到93.8%和79.5%,且主要为簇生苗,在2.0 mg/L ZT 时均有所下降.因此,诱导叶片形成重生苗的最佳ZT 质量浓度为1.7 mg/L.
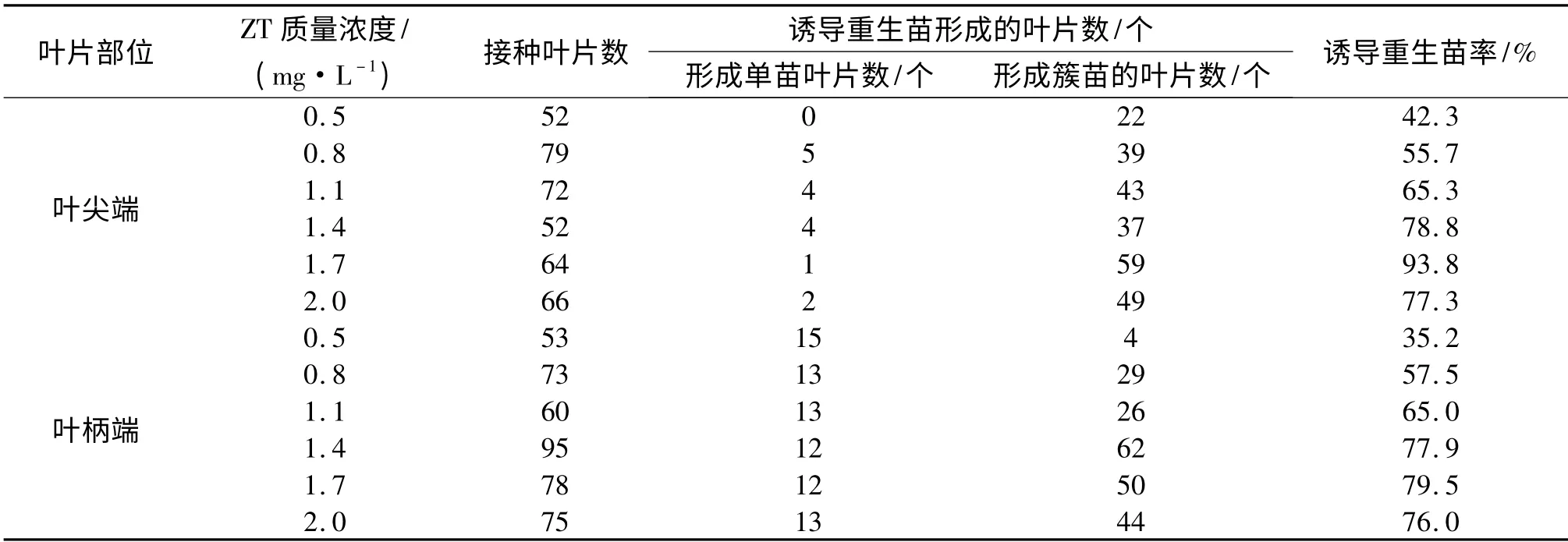
表3 不同质量浓度ZT 对诱导叶片重生苗的影响Tab.3 Effects of different mass concentration of ZT on induction of regeneration seedlings of the blade
2.3 试管苗的瓶内生根
2.3.1 盐浓度对生根的影响 单个芽苗在不同盐浓度的生根培养基中的生根诱导率存在差异.从表4 可以看出,高盐浓度不利于芽苗生根,大量元素不减少时仅在茎切段形成愈伤组织;大量元素减半时,在20 d 左右开始生根,生根率达40%;大量元素减少到原来的1/4 时,开始生根的时间为10 d 左右,生根率提高到90%以上,苗长势强,叶色绿;而大量元素减少到原来的1/8 时,第8 天左右就开始生根,生根率也达到了90%以上,由于营养物质的缺乏,苗长势弱,叶色黄且无光泽.因此适当降低盐浓度有利于生根且不影响苗的生长.
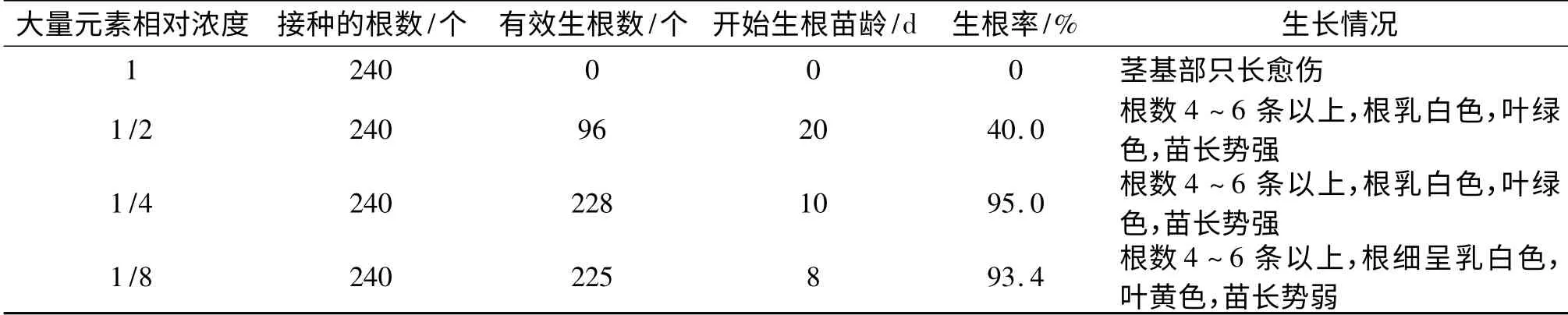
表4 不同盐浓度对生根的影响Tab.4 Effects of different salinity on rooting
2.3.2 活性碳和生长素对生根的影响 活性碳对组培苗瓶内生根具有重要影响.由表5 可看出,当培养基中无活性碳时,插入培养基中的茎基部均先长愈伤组织然后生根,由于茎根之间维管束不通,不久茎即停止生长,叶色发红脱落,苗长势差.活性炭对杰兔生根具有促进作用,但是存在不同的浓度效应:效果最好的是1.0 g/L 活性碳,在0.1~0.8 mg/L IBA 的有效生根率均达到80%以上,特别是在0.1 mg/L IBA 时生根率达到了90%以上,茎基部产生愈伤组织较少或不产生愈伤组织,茎生长正常,10 d 左右可见茎基部有根形成,45 d 左右长出4~6 条根,根长达6 cm 左右;效果其次的是1.5 g/L 活性碳,在0.1 mg/L IBA 时其有效生根率也达到了80%以上;当培养基中的活性碳为2.0 g/L 时,有效生根率明显降低,有效根数和根长也减少.
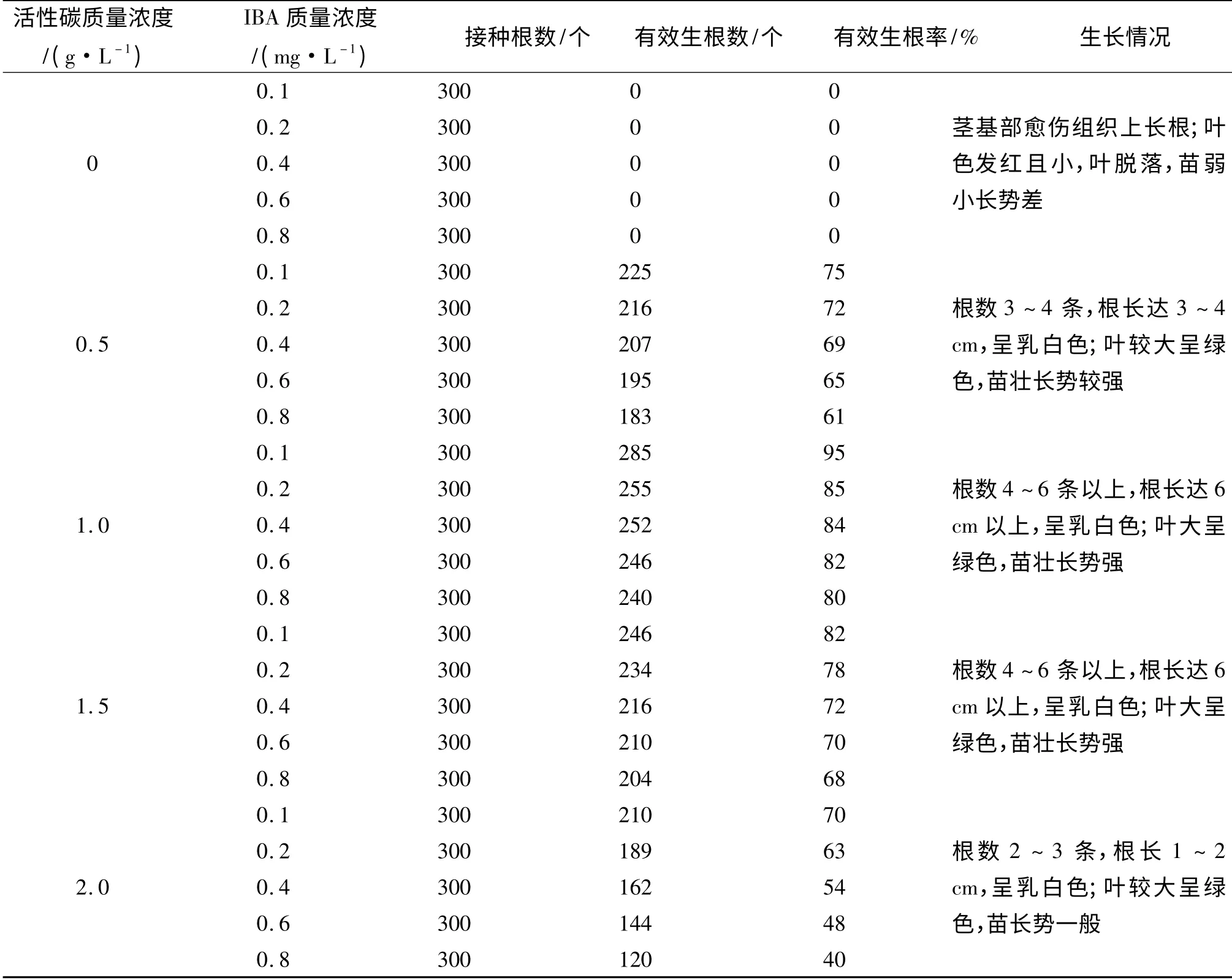
表5 活性碳及IBA 浓度对组培苗瓶内生根的影响Tab.5 Effects of different concentration of active carbon and IBA on rooting in the culture bottle
另外,IBA 浓度对杰兔生根具有明显作用,表5 的结果表明,低浓度的IBA 更有利于杰兔生根,在活性碳质量浓度为0.5~2.0 g/L 的培养基中,0.1 mg/L IBA 的有效生根率均达到70%以上,随着IBA 浓度的升高,有效生根率降低.
综合以上结果,杰兔瓶内生根培养基中最佳的活性炭和IBA 质量浓度分别为1.0 g/L 和0.1 mg/L,有效生根率高达95%.
2.4 炼苗基质的优化
剪取2 cm 左右长的无菌苗新梢在生根培养基中生长,约45 d 左右苗高长至5~6 cm 时,生根率达95%.对生根苗移栽在5 种不同基质上,1.5 个月后统计成活率.从图3可看出,水苔藓的效果最好,成活率高达100%,苗木的生长量达3cm 以上,新增叶片6~8 枚.效果其次的是体积比为2~3∶1 的草炭与石英砂组合,其成活率为86%,苗木的生长量较高.体积比为1∶1 的草炭与河沙基质的成活率仅为52%,但成活苗的质量却很高,表现为生长墩实、植株健壮、生长量与“草炭+石英砂”相当.草炭+园土基质与草炭+珍珠岩基质的效果居中.
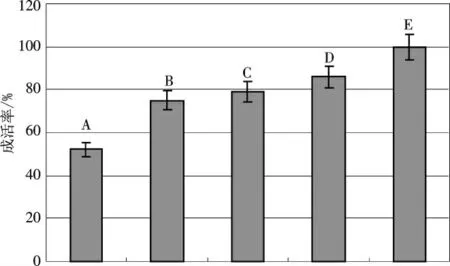
图3 不同炼苗基质对试管苗成活率的影响Fig.3 Effects of different refine seedling substrates on survival ratio of tissue culture seedling
3 讨论
已有研究表明,蓝莓快繁的培养基以改良WPM 的效果最好[6],且在芽的诱导和增殖中细胞分裂素的作用至关重要[7-8].玉米素是一种高活力的细胞分裂素,因此,作者主要采用了改良WPM 培养基,重点探讨了玉米素的效应.本研究表明,利用1 mg/L ZT进行增殖培养,增殖倍数达到6 倍以上,且丛生芽生长健壮,生长速度快;2 mg/L ZT 的增殖倍数稍高于1 mg/L ZT;5 mg/L ZT 的增殖倍数高达12 倍,然而玻璃化现象的出现使有效苗数减少.由于ZT 价格贵,结合生产成本考虑,1 mg/L ZT 的增殖效率最佳,通过几次继代,其增殖倍数可达30~40 倍.
叶片离体再生体系的建立具有以下两个方面的优势,一方面由于叶片数量多和采集时对母体伤害小,可以在短时间内获得大量的无菌苗;另一方面它又是利用生物工程技术转导外源基因进行品种创新的基础.到目前为止,国内外关于蓝莓叶片再生的研究主要集中于高丛、矮丛多个品种[8-10],有关兔眼蓝莓叶片再生的研究未见报道.本研究以杰兔无菌苗叶片为材料,建立了兔眼蓝莓高效的叶片再生体系.按垂直叶片主脉方向离叶尖1/3 处将叶片切成二部分,同时接种于改良WPM+1.7 mg/L ZT 的培养基中,先暗培养20 d 后光照培养,叶片的叶尖端和叶柄端均能不经愈伤组织形成再生苗,保持了再生苗的优良特性.将叶尖端和叶柄端的再生率合起来,叶片再生率高达173.3%.由于组培苗叶片的数量多和高的叶片再生率,再结合茎的增殖培养,其增殖倍数非常可观,远远高于前人在兔眼蓝莓增殖研究中的结果[11-16].
组织培养过程中,试管苗的生根好坏将直接影响到试管苗的质量和移栽成活率.随着蓝莓组织培养技术的越来越成熟,许多蓝莓品种试管苗瓶内生根已成为可能,但是存在品种差异[15-16].本研究采用1/4WPM(改良)+1.0 g/L 活性碳+0.1 mg/L IBA 配方,能使新梢在10 d 左右开始生根,生根率高达95%,苗健壮且生长速度快,大约45 d 就可出瓶炼苗,该结果优于以往的研究[17].在炼苗方面,国内报道的多种配方均以考虑如何为蓝莓生长提供适宜的pH 值,他们以草炭土或其类似物为基本介质,再附加支撑材料调节基质的通透性[13,17-19].蓝莓组培苗小而弱,根纤细,移栽较其它植物组培苗困难.移栽成活的关键是小环境保湿和基质通气性好,以保证小植株不失水并有利于根的再生长.本研究采用塑料小拱棚保湿和水苔藓为炼苗基质,由于水苔藓的通透性非常好,其pH 为5.0 左右且富含有机质,幼苗成活率高达100%,幼苗生长快且健壮,炼苗效果明显优于国内已报道的以草炭土为基本介质的炼苗基质.因此,本研究从叶片再生、增殖培养、生根培养到炼苗这几个环节进行了一系列的优化,建立了一套可高效、快速、持续获得优良的兔眼组培种苗的技术体系,有助于我国蓝莓栽培产业化发展.
[1]CONNER A M,LUBY J J,TONG C B S.Variability in antioxidant activity in blueberry and correlations among different antioxidant assays[J].J Am Soc Hort Sci,2002,127(2):238-244.
[2]CONNER A M,LUBY J J,TONG C B S,et al.Genotypic and environmental variation in antioxidant activity,total phenolics and anthocyanin content among blueberry cultivars[J].J Am Soc Hort Sci,2002,127(1):89-97.
[3]LYRENE P M,VORSA N,BALLINGTO N R.Polyploidy and sexual polyploidization in the genus Vaccinium[J].Euphytica,2003,133(1):27-36.
[4]HANCOCK J F,LYRENE P,FINN C E,et al.Blueberries and cranberries[C]//HANCOCK J F(ed).Temperate fruit crop breeding.Berlin:Springer,2008:115-149.
[5]MINOCHA S C.Plant growth regulators and morphogenesis in cell and tissue culture of forest trees[C]// BONGA J M,DURZAN D J(ed).Cell and tissue culture in forestry(Vol.I).Dordrecht:Martinus Nijhoff,1987:50-66.
[6]WOLFE D E,ECK P,CHIN C.Evaluation of seven media for micropropagation of highbush blueberry[J].HortScience,1983,18(6):703-705.
[7]SHARON G B,CHEE K,CHIN C.Regeneration of blueberry plantlets from leaf segment[J].Hortscience,1988,23(4):763-766.
[8]CHENG L,PETE C,LISA J R,et al.Adventitious shoot regeneration from leaf explants of southern highbush blueberry cultivars[J].Plant Cell Tiss Organ Cult,2010,103(1):137-144.
[9]DEBNATH S C.A two-step procedure for adventitious shoot regeneration on excised leaves of lowbush blueberry[J].In Vitro Cell Dev Biol Plant,2009,45(2):122-128.
[10]韩婷婷,孙周平.矮丛蓝莓叶片的愈伤组织诱导及植株再生[J].西北植物学报,2010,30(3):615-620.
[11]刘树英,张志东,吴 林,等.兔眼越桔芽增生诱导培养基及激素的筛选[J].吉林农业大学学报,2002,24(1):55-57.
[12]刘树英,安 伟,孔令学,等.兔眼越橘芽的诱导及再生[J].吉林农业大学学报,2004,26(6):632-635.
[13]朱忠荣,聂 飞.兔眼蓝浆果组织培养研究初报[J].贵州林业科技,2003,31(4):20-21.
[14]张长青,李广平,朱士农,等.兔眼越橘茎段快繁高效技术研究[J].果树学报,2007,24(6):837-840.
[15]刘 捷,吴小锋,刘学平,等.蓝浆果的组织培养及离体微繁技术研究[J].江苏农业科学,2007(5):101-103.
[16]王大平.兔眼蓝莓试管苗生根培养的研究[J].北方园艺,2010(16):140-142.
[17]黄文江,周守标,阚显照,等.越橘属植物克隆的体外繁殖[J].中国野生植物资源,2005,24(2):62-64.
[18]马艳丽.越橘组培快繁技术研究[J].吉林林业科技,2005,34(1):3-5.
[19]刘庆忠,赵红军.越桔高效栽培与加工利用[M].北京:中国农业出版社,2003:59-60.
