不同污染条件下微生物矿化固结Zn2+的作用及机理
2013-12-22陆兆文钱春香许燕波王明明
陆兆文 钱春香 许燕波 王明明
(东南大学材料科学与工程学院,南京211189)(东南大学江苏省土木工程材料重点实验室,南京211189)
重金属对环境的污染是一个全球性的问题,而土壤的重金属污染尤其严重.重金属污染土壤的主要途径有以下2种:① 工业废气中的重金属扩散沉降累积于周围的土壤之中;② 工厂污染造成河流海洋等重金属水污染,将这些废水灌溉农田会造成土壤重金属污染[1-3].
微生物修复重金属污染处理具有时间短、投资少、无二次污染、操作简单等优点,引起了人们的广泛关注和重视.微生物修复重金属污染的机理非常复杂,主要有以下2种:① 细胞代谢.某些途径可使金属生物沉淀或通过生物转化使其低毒或易于回收.② 生物吸附.将活细胞、无生命的生物体、金属结合蛋白和多肽或生物多聚体作为生物吸附剂,空泡吞饮重金属离子或使其发生沉淀和氧化还原反应.
目前,国内外主要利用微生物对重金属的吸附作用原理来处理重金属污染[4-5],也有微生物矿化重金属离子产生沉淀的研究报道.van Roy等[6]发现硫酸盐还原菌可通过2种途径将硫酸盐还原为硫化物:① 在呼吸过程中,硫酸盐作为电子受体被还原;② 在同化过程中,利用硫酸盐合成氨基酸(如胱氨酸和蛋氨酸),再通过脱硫作用使S2-分泌于体外,S2-可以和重金属Cd2+形成沉淀.Fujita等[7]利用细菌对尿素的分解作用,使得分解产物和Sr共沉淀固结在方解石矿物中,修复被Sr污染的地下水.然而,这些研究仍然停留在实验室阶段,无法应用于大面积修复,而且其机理过于复杂,目前尚未完全探明,只能大致推测.

1 实验
1.1 菌液培养
实验材料包括菌种A、培养基、ZnCl2溶液、CuCl2溶液以及PbCl2溶液.培养基中包含5.0 g/L的蛋白胨和3.0 g/L的牛肉膏.
将菌种A接种至培养基中,于摇床中30 ℃下振荡培养(转速为170 r/min),初始pH值为7.0,培养24 h后取出.
1.2 矿化产物
缓慢掺入浓度为2 mol/L的ZnCl2溶液,迅速产生沉淀,将其过滤、烘干,待定性分析.所得沉淀为白色细状粉末,取样分别进行X射线衍射分析和扫描电子显微镜观测.
1.3 多种污染条件下的矿化效果
当pH<5或pH>9时,菌种A的酶活性会受到较大的影响,因此,在实际应用中,需将pH值调节到5~9.当环境温度低于20 ℃时,菌种的酶活性也会降低,故建议将温度设置在20 ℃以上.复合污染条件下,酶活性可能会受到影响.
考虑到以上因素,本实验中通过改变溶液的pH值、温度、Zn2+浓度,并考虑其他重金属离子(Pb2+, Cu2+)复合污染情况,研究微生物矿化固结Zn2+的作用效果与机理.
2 结果与讨论
2.1 矿化机理分析
为了定性分析所得沉淀物质,对样品进行X射线衍射分析及扫描电子显微镜观测,结果见图1.

图1 微生物矿化锌离子产物分析
由图1(b)可知,矿化产物XRD图谱的特征衍射峰与纯碱式碳酸锌Zn5(OH)6(CO3)2一致,证明产物主要为碱式碳酸锌.由图1(a)可知,产物的形状不规则,颗粒尺寸分布不均匀且团聚严重,说明生物矿化过程中晶体生长过程受到外界高分子有机物的调控作用.




然而,在碱式碳酸锌的沉积过程中,外界条件(如环境pH值、温度、反应物浓度、复合污染条件等因素)都可能会影响矿化效果,甚至矿化产物形貌.
2.2 pH值对矿化效果的影响
实验中,将体系的pH值分别调整至9, 7, 5,对样品进行X射线衍射分析和扫描电子显微镜观测.
从图2中可以看出,在不同的pH值下,沉淀物质都为碱式碳酸锌.当pH=5时,特征衍射峰的强度比pH=7, 9时弱,说明在pH=5时,碱式碳酸锌结晶较差.而在pH=7, 9时,衍射峰强度相似,说明当pH≥7时,碱式碳酸锌结晶较好,基本不受pH的影响.
从图3中可以看出,矿化产物的形貌发生了变化,尤其是晶粒的尺寸差别较大.随着pH值的降低,矿化产物的粒径逐渐变小.为了进一步确定不同pH值下锌矿化产物粒径的分布,对矿化产物进行粒径分析,结果见图4.

图2 不同pH值下锌离子产物的XRD谱图
由图4可以看出,当pH=9时,矿化产物的平均粒径约为95 μm;当pH=7时,平均粒径约为80 μm;当pH=5时,平均粒径仅为30 μm左右.这一结果与SEM的结果一致.由此可见,当pH值较低时,矿化产物不稳定,极易被分解,不利于晶体成核以及晶粒的生长,故整体粒径较小.

图3 不同pH值下锌离子产物的SEM照片
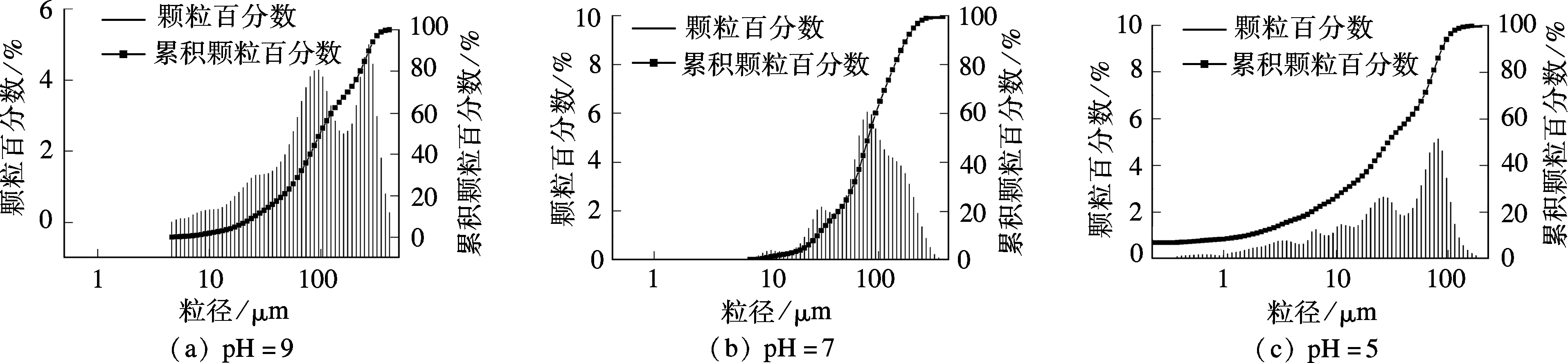
图4 不同pH值下的矿化粒径分布图
2.3 温度对矿化效果的影响
在15~40 ℃范围内,随着温度的升高,微生物菌种A的酶活性也逐渐升高.在一定的时间内,同样菌液用量下会分解产生更多的底物和碳酸根离子,从而对矿化率产生影响.
将培养好的菌液,分别置于20和30 ℃的恒温水槽中,完成Zn2+的矿化沉积实验.基于底物分解量和矿化率,研究温度对微生物矿化固结Zn2+的影响(理论生成量以Zn2+矿化产物为Zn5(OH)6(CO3)2计算),结果见表1.

表1 不同温度下的矿化率
由表1可知,20 ℃时的矿化率相比30 ℃时降低22%,这是因为温度会影响碳酸盐矿化菌粉的脲酶活性:一方面不利于脲酶的稳定性;另一方面也影响着脲酶分解底物反应的进行.因此,温度越低,越不利于脲酶的活性,微生物矿化固结Zn2+的效果越差.
2.4 Zn2+浓度对矿化效果的影响
取1 L培养好的菌液,加入8 g底物(固体),根据重金属的污染情况再加入不同浓度的ZnCl2溶液,充分反应后,将产物过滤、烘干,对所得样品进行X射线衍射分析和扫描电子显微镜观测.3组样品的矿化产物成分均为Zn5(OH)6(CO3)2.不同Zn2+浓度下的SEM照片见图5.当ρ(Zn2+)=65 mg/L时,矿化产物呈小球状,粒径较小;当ρ(Zn2+)=650,6 500 mg/L时,矿化产物形貌类似;当Zn2+浓度更低时,没有足够的Zn2+供晶体继续生长,限制了晶粒的长大.

图5 不同Zn2+浓度下的SEM照片
在不同Zn2+浓度下,菌液的酶活性以及矿化率见表2.由表可知,从底物分解量来看,Zn2+浓度对脲酶的分解能力影响不大,说明污染体系中Zn2+浓度的高低对微生物矿化固结Zn2+几乎没有影响.
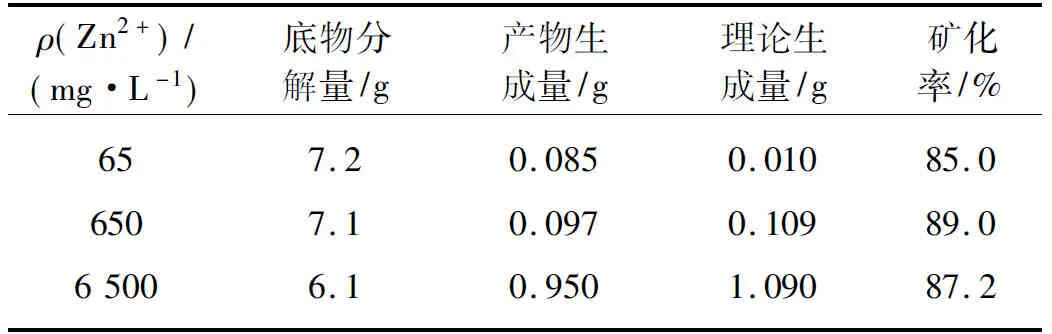
表2 不同Zn2+浓度下Zn5(OH)6(CO3)2的矿化率
2.5 Pb2+,Cu2+对矿化效果的影响
取300 mL培养好的菌液,加入24 g底物,然后向底物中分别加入100 mL 浓度为0.1 mol/L的CuCl2, ZnCl2, PbCl2溶液,过滤烘干矿化产物.对矿化产物进行X线衍射分析和扫描电子显微镜观测,结果见图6.
从图6中可以看出,反应生成了圆球块状和长棒状2种矿化产物.图7为其XRD谱图.由图可知,仅存在Pb2+矿化产物PbCO3的衍射峰,并没有Zn2+,Cu2+混合矿化产物的衍射峰.究其原因主要是:① 在Pb2+, Zn2+, Cu2+混合污染条件下,Zn2+, Cu2+的混合矿化产物结晶不好,故没有出现明显的衍射峰;② PbCO3的衍射峰很强,在它的干扰下,Zn2+, Cu2+混合矿化产物的衍射峰无法显示出来.

图6 Pb2+, Cu2+, Zn2+混合条件下矿化产物的SEM照片

图7 Pb2+, Cu2+, Zn2+混合条件下矿化产物的XRD谱图
为了进一步确定矿化产物的成分,对其进行能谱分析.Pb2+矿化产物的形态及能谱分析结果见图8;Cu2+,Zn2+混合矿化产物的形态及能谱分析见图9.由图8和图9可知,Pb的矿化产物呈长棒状,而Zn2+, Cu2+的混合矿化产物呈圆球块状.由此表明,在Pb2+, Cu2+, Zn2+混合离子条件下,Pb2+单独矿化结晶,Zn2+和Cu2+的矿化产物则结合在一起.

图8 混合条件下Pb2+矿化产物的形态及能谱分析

图9 混合条件下Cu2+与Zn2+混合矿化产物的形态及能谱分析
3 结论
1) 在环境pH值为5, 7, 9的条件下,形成的矿化产物形貌不同,矿化产物粒径也有较大差别.当pH=9时,平均矿化粒径约为95 μm;当pH=7时,平均矿化粒径约为80 μm;当pH=5时,平均矿化粒径仅为30 μm左右.因此,pH值较低的反应环境不利于晶体成核以及晶粒的生长.
2) 不同矿化固结温度下得到的矿化产物不同.当温度为20 ℃时,沉积出的Zn5(OH)6(CO3)2结晶不好,颗粒细小,为团聚无定形状;当温度为30 ℃时,颗粒呈块状,粒径较大,且分布较均匀.由此可见,温度的升高有利于脲酶分解底物反应的进行以及矿化产物的沉积和成型.
3) 不同的污染浓度会导致矿化效果不同.当ρ(Zn2+)=65 mg/L时,矿化产物呈小球状,粒径仅为几微米;当ρ(Zn2+)=650, 6 500 mg/L时,两者的矿化产物形貌相似.由此可见,当Zn2+浓度较低时,没有足够的Zn2+供晶体继续生长,限制了晶粒的长大.此外,Zn2+浓度对脲酶的分解能力影响不大.
4) 在Pb2+, Zn2+, Cu2+混合污染条件下,Pb2+单独矿化结晶,Zn2+和Cu2+的矿化产物则结合在一起.
)
[1]杨苏才, 南忠仁, 曾静静. 土壤重金属污染现状与治理途径研究进展[J]. 安徽农业科学, 2006, 34(3): 549-552.
Yang Sucai, Nan Zhongren, Zeng Jingjing. Current situation of soil contaminated by heavy metals and research advances on the remediation techniques[J].JournalofAnhuiAgriculturalSciences, 2006,34(3): 549-552. (in Chinese)
[2]韦朝阳, 陈同斌. 重金属超富集植物及植物修复技术研究进展[J]. 生态学报, 2001, 21(7): 1197-1203.
Wei Chaoyang, Chen Tongbin. Hyperaccumulators and phytoremediation of heavy metal contaminated soil: a review of studies in China and abroad[J].ActaEcologicaSinica, 2001,21(7): 1197-1203. (in Chinese)
[3]Tessier A, Campbell P G C, Bisson M. Sequential extraction procedure for the speciation of particulate trace metals[J].AnalyticalChemistry, 1979,51(7): 844-851.
[4]滕应, 黄昌勇. 重金属污染土壤的微生物生态效应及其修复研究进展[J]. 土壤与环境, 2002, 11(1): 85-89.
Teng Ying, Huang Changyong. Ecological effect of heavy metals on soil microbes and research advances on the mechanisms of bioremediation[J].SoilandEnviromentalScinences, 2002,11(1): 85-89.(in Chinese)
[5]Gadd G M, Fry J C.Microbialcontrolofpollution[M]. Cambridge, UK: Cambridge University Press, 1992: 59-84.
[6]van Roy S, Vanbroekhoven K, Dejonghe W, et al. Immobilization of heavy metals in the saturated zone by sorption and in situ bioprecipitation process[J].Hydrometallurgy, 2006,83(1/2/3/4): 195-203.
[7]Fujita Yoshiko, Redden George D, Ingram Jani C, et al. Strontium incorporation into calcite generated by bacterial ureolysis[J].GeochimicaetCosmochimicaActa, 2004,68(15): 3261-3270.
[8]成亮, 钱春香, 王瑞兴, 等. 碳酸盐矿化菌株A固结土壤Cd2+的生物矿化过程[J]. 硅酸盐学报, 2008, 36(S1): 215-221.
Cheng Liang, Qian Chunxiang, Wang Ruixing, et al. Bioremediation process of Cd2+removal soil by bacteria A biomineralization[J].JournaloftheChineseCeramicSociety, 2008,36(S1): 215-221. (in Chinese)
[9]王瑞兴,钱春香,吴淼,等.微生物矿化固结土壤中重金属研究[J].功能材料, 2007, 38(9): 1523-1527.
Wang Ruixing, Qian Chunxiang, Wu Miao, et al. Study on heavy metals in soil mineralized by bacteria[J].JournalofFunctionalMaterials, 2007,38(9): 1523-1527. (in Chinese)
[10]王瑞兴, 钱春香, 王剑云. 微生物沉积碳酸钙研究[J]. 东南大学学报: 自然科学版, 2005, 35(S1): 192-195.
Wang Ruixing, Qian Chunxiang, Wang Jianyun. Study on microbiological precipitation of CaCO3[J].JournalofSoutheastUniversity:NaturalScienceEdition,2005,35(S1): 192-195. (in Chinese)
