重组人细胞色素P450 2C9在毕赤酵母中的胞内表达
2013-12-22吴云华孙鹏宇
吴云华,孙鹏宇
(中南民族大学 生命科学学院,国家民委生物技术重点实验室,武汉 430074)
细胞色素P450(CYP450)酶系是一类血红蛋白超级家族,因其还原形态与CO结合后在450nm处有最大吸收波长而得名.CYP450依赖于氧气与NADPH催化内源性和外源性化合物,以氧化和过氧化发挥作用.CYP2C9是 P450酶第二亚家族中的一个重要成员,占肝微粒体P450蛋白总量的20%[1,2],约16%的临床药物由CYP2C9代谢[3].
巴斯德毕赤酵母(Pichiapastoris)表达系统为近年来发展起来的优良酵母表达系统,它是一类甲醇营养型酵母,在表达真核细胞外源蛋白时,不仅生长快、操作简便、成本低,还具备哺乳类动物细胞的翻译后加工和修饰的功能,适用于表达有生物活性的蛋白[4].细胞色素P450可在大肠杆菌中表达,但只有少数P450在毕赤酵母中成功表达[5- 9].本实验利用穿梭表达载体pPIC3.5k在毕赤酵母中表达P450,分析其作用性质,为研究细胞色素P450在毕赤酵母中的表达和催化能力奠定一定的基础.
1 材料和方法
1.1 材料和试剂
大肠杆菌DH5α、毕赤酵母GS115菌株和质粒pPIC3.5K由本实验室保存.DNA连接酶T4,限制性内切酶EcoR I、NotI,DNA聚合酶Pyrobest(TAKARA公司),遗传霉素G418(Invitrogen公司),抗His标签鼠单克隆抗体(康为世纪公司),山羊抗鼠IgG二抗(Protein tech 公司),超敏ECL化学发光底物试剂(博士德生物公司),蜗牛酶、酸洗玻璃珠(Sigma公司).培养基(LB、YPD、MD、BMGY、BMMY)的配制均依照Invitrogen公司毕赤酵母操作手册.
1.2 重组菌株的构建和胞内表达
1.2.1 pPIC3.5K-2C9表达质粒载体的构建
P450 2C9片段用带有EcoR I位点,插入kozak真核表达加强序列的上游引物为CCGGAATTCGCCACCATGGCTCGACAATCTTCT,带有NotI位点并插入6×His标签的上游引物为ATAAGAATGCGGCCGCTCAGTGATGGTGATGGTGATGGACAGGAATGAAGCAC.PCR反应条件为:94℃预变性4 min,32个循环(94℃变性30 s,56.3℃退火30 s,72℃延伸2 min),72℃延伸7 min.
PCR产物和pPIC3.5K表达载体用EcoR I和NotI双酶切,凝胶回收目的片段,T4连接酶16℃连接过夜.热激转化至大肠杆菌DH5α中,转化的菌液涂于氨苄青霉素LB平板,37℃培养过夜.挑取生长的单菌落为模板PCR扩增,提取含有目的片段的重组质粒DNA,将EcoR I和NotI双酶切验证成功的菌落送公司测序.
1.2.2重组转化子的筛选和PCR验证
按Invitrogen 毕赤酵母表达手册,用SalI对重组质粒 (pPIC3.5K-2C9)和空载体(pPIC3.5K )分别线性化,再用电击法转化毕赤酵母感受态细胞 GS115,并将转化菌体均匀涂布于MD固体培养基.SalI线性化质粒转化GS115后,多在HIS4位点上发生重组,转化子多为Mut+表型,由于质粒含有AOX1基因序列,可能在AOX1位点发生重组,破坏野生型AOX1基因,产生MutS转化子,故将HIS+转化子按顺序分别先后点种于MM和MD平板,比较其生长情况以检测Mut+转化子.
待MD 平板长出HIS+的转化子之后,加入 1~2 mL 无菌水重悬转化子,转移到50 mL无菌离心管剧烈震荡,打散细胞,分光光度计测定细胞浓度(1OD600= 5×107/mL),稀释细胞悬液,按1×105/mL细胞涂布含不同G418浓度(0,2.0,4.0 mg/mL)的YPD 平板上,30℃培养,2~5d后筛选具有高G418抗性且生长良好的菌株.挑取检测后的HIS+转化子用蜗牛酶37℃处理菌体,SDS碱裂解法提取酵母基因组DNA进行PCR.用引物5′-AOX:5′-GCAAATGGCATTCTGACATCC-3′,3′AOX1:5′-AGGCAAATGGCATTCTGACATCC-3′来验证转化子,PCR反应条件为:预变性95℃ 5 min,30个循环(95℃变性1 min,55℃退火1 min,72℃延伸1.5 min),72℃延伸7 min.
1.2.3 P450 2C9毕赤酵母的胞内表达
经PCR验证的GS115-pPIC3.5K-2C9重组菌株和GS115-pPIC3.5K空载体菌株按照Invitrogen公司毕赤酵母操作手册在BMGY培养基中培养至OD600=2~6后转接到诱导培养基BMMY中.30℃,275 r/min培养,每24 h加入0.5% (V/V)的甲醇并分别取24,48,72,96 h样品分析表达水平.
1.3 重组蛋白的定性检测
1.3.1 细胞裂解和SDS-PAGE
收集不同诱导时间菌体于室温2000×g离心15 min,重悬于buffer A(50 mmol/L磷酸钾缓冲液,PH 7.6,20%甘油,1mmol/L PMSF)至0.5g /mL,在液氮速冻后贮存于-80℃.细胞于冰上解冻后,2000×g 4℃离心10 min收集细胞,重悬于buffer B (50 mM磷酸钾缓冲液,PH 7.6,20%甘油,1 mmol/L PMSF,1mmol/L EDTA,10 mmol/L β-巯基乙醇)至0.5g湿菌体细胞/mL.
加入等量酸洗玻璃珠,涡旋1min,冰上放置1min,重复10次破碎酵母细胞.收集破碎后细胞混合物,取部分于14 000×g 4℃离心30 min,分别收集上清,并将沉淀重悬于buffer B[10].取细胞混合物、上清和沉淀于冷冻干燥机浓缩3 h,SDS-PAGE分析浓缩液.
1.3.2 Western blot分析
浓缩后细胞破碎样品的上清、混合液和沉淀与SDS-PAGE上样缓冲液混合后进行SDS-PAGE电泳分离.蛋白样品电转至硝酸纤维素膜上进行Western blot检测.膜浸于封闭液(5g/100 mL脱脂奶粉,10 mmol/L Tris-HCl,150 mmol/L NaCl,pH 8.0,0.05% Tween-20)封闭2 h.加入抗His标签鼠单克隆抗体(稀释5000倍)4℃孵育过夜.加入过氧化物标记的山羊抗鼠IgG二抗(稀释5000倍)与一抗结合,杂交箱中孵育1 h.将膜置于保鲜膜上,混合0.5 mL超敏化学发光底物试剂 ECL 1与0.5 mL ECL 2,将混合后的工作液加至膜的蛋白质面,准确反应1min后,将膜置于另一保鲜膜上,于化学发光检测器中曝光不同的时间,记录化学发光图像.
2 结果
2.1 重组表达载体pPIC3.5K-2C9的载体构建
2.1.1 菌落PCR验证
挑取10个经氨苄青霉素筛选成功的单菌落直接PCR,结果如图1所示,有5个单菌落可扩增约1500 bp的CYP2C9目的片段,说明重组表达载体pPIC3.5K-2C9的载体构建成功.
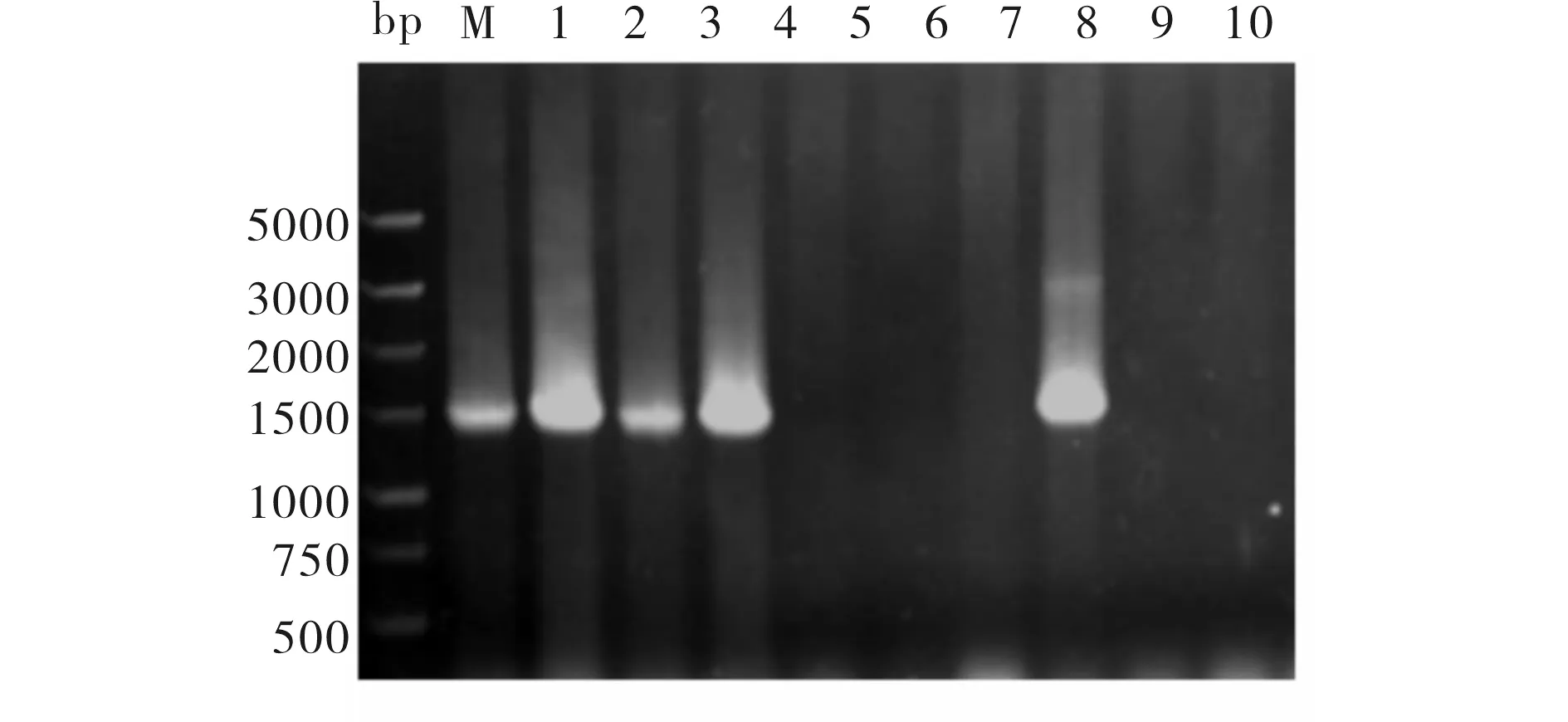
M)5000bp DNA Marker;1~10)10个单菌落PCR扩增产物
2.1.2 重组质粒的双酶切鉴定
用EcoRI和NotI双酶切结果如图2所示,可见9000 bp的pPIC3.5K质粒和1500 bp的CYP2C9目的片段,进一步验证重组质粒构建成功.
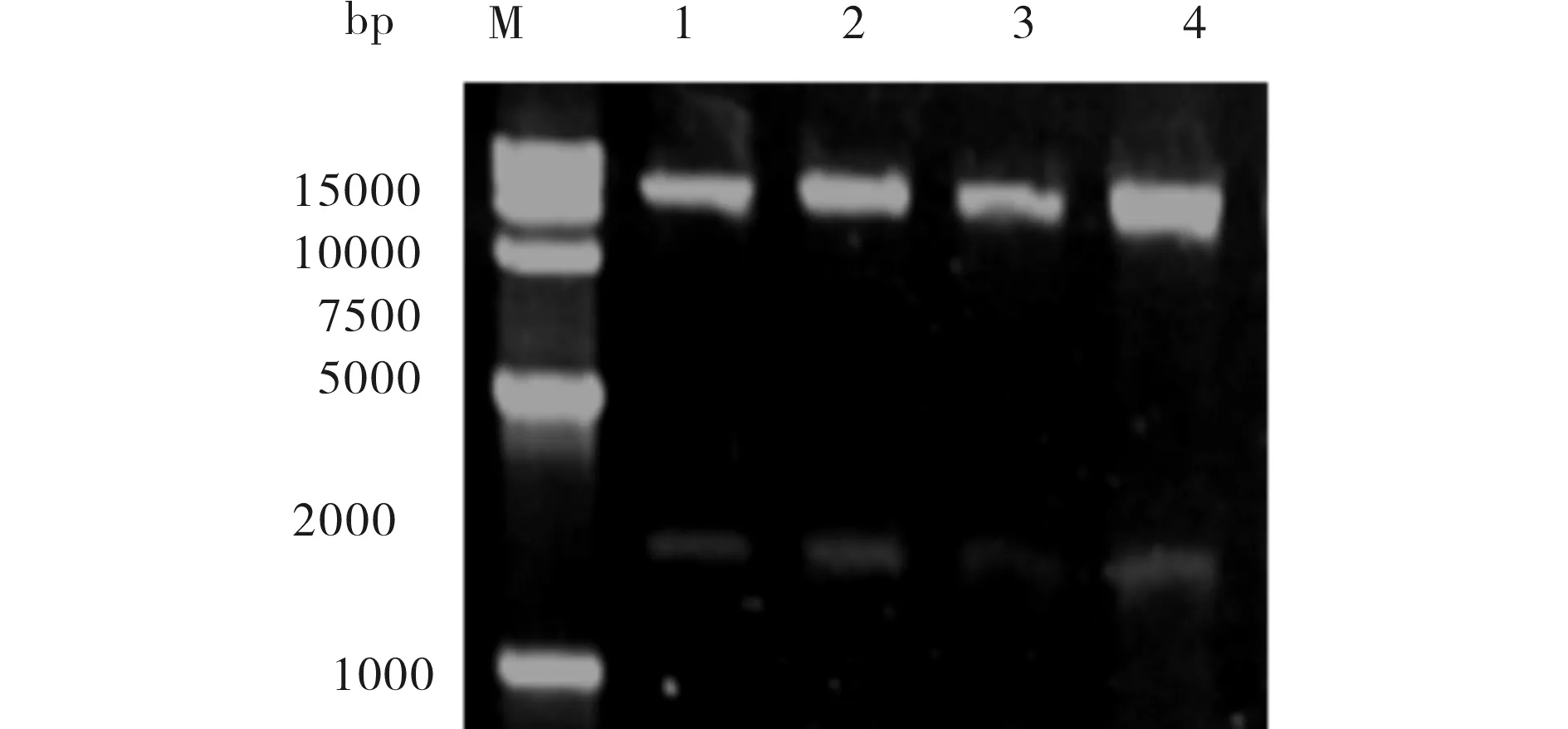
M)15 000 bp DNA Marker;1~4)重组pPIC3.5K-2C9质粒
2.1.3 测序验证
鉴定正确的重组质粒送基因公司双向测序,结果表明目的片段插入位点和碱基序列正确,说明CYP2C9基因序列已成功地插入到载体pPIC3.5K的指定位点.
2.2 表达载体pPIC3.5K-2C9的电转化
2.2.1Mut+表型的筛选
如图3所示,分别点种于MM和MD平板的HIS+转化子在两种平板上生长情况没有明显区别,说明转化子没有发生MutS表型的突变.

1)MD平板上生长的转化子;2)MM平板上生长的转化子
2.2.2 高抗性重组菌株的筛选
高抗性重组菌株的筛选结果如图4所示,收集的转化子5 d后在2.0,4.0 mg/mL的YPD平板上生长.分别得到10个和2个生长较迅速的大菌落,估计是高拷贝整合菌株,分别用于后续的蛋白质的表达.
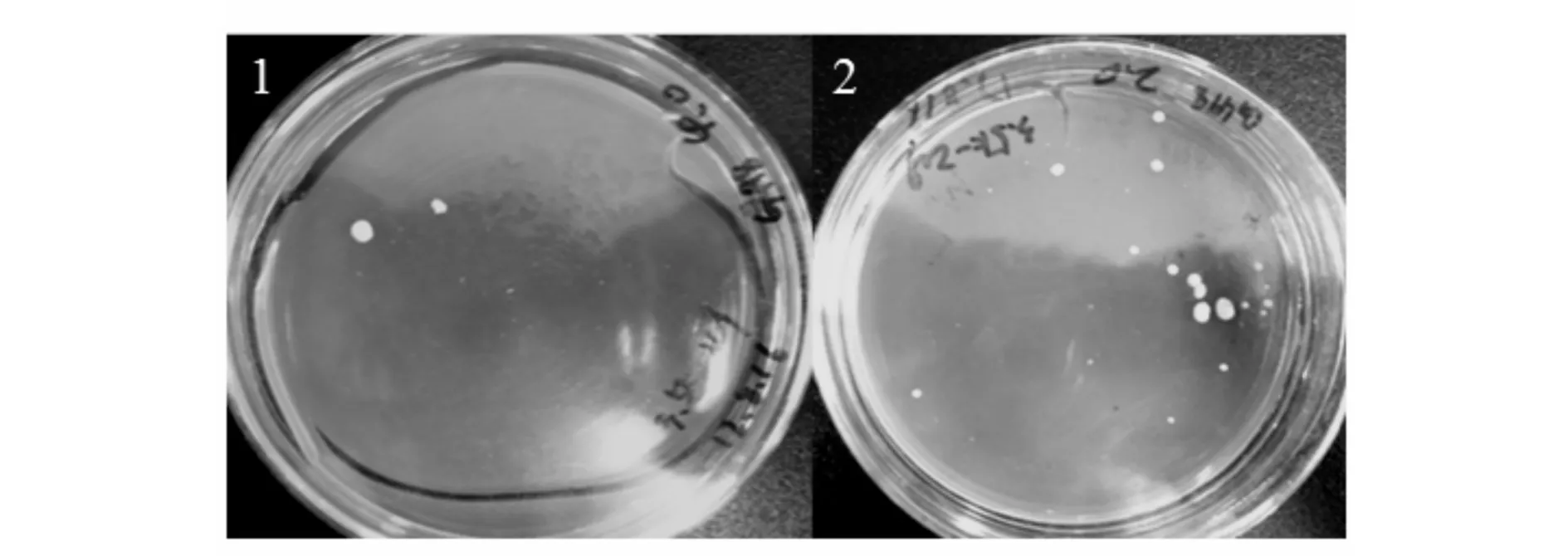
1)4.0mg/mL的YPD平板生长的转化子;2)2.0 mg/mL的YPD平板生长的转化子
2.2.3 重组菌株基因组的PCR验证
提取重组的基因组DNA,用AOX1引物和CYP2C9特异引物以基因组DNA为模板进行PCR扩增,结果见图5.由图5可见,用AOX1引物可扩增出约2200 bpAOX1基因和1700 bp(1500 bp目的基因序列+214 bp载体上序列)的目的片段;用CYP2C9特异引物可扩增出1500 bp的目的片段,验证了重组子中插入了目的序列并且插入方向正确.
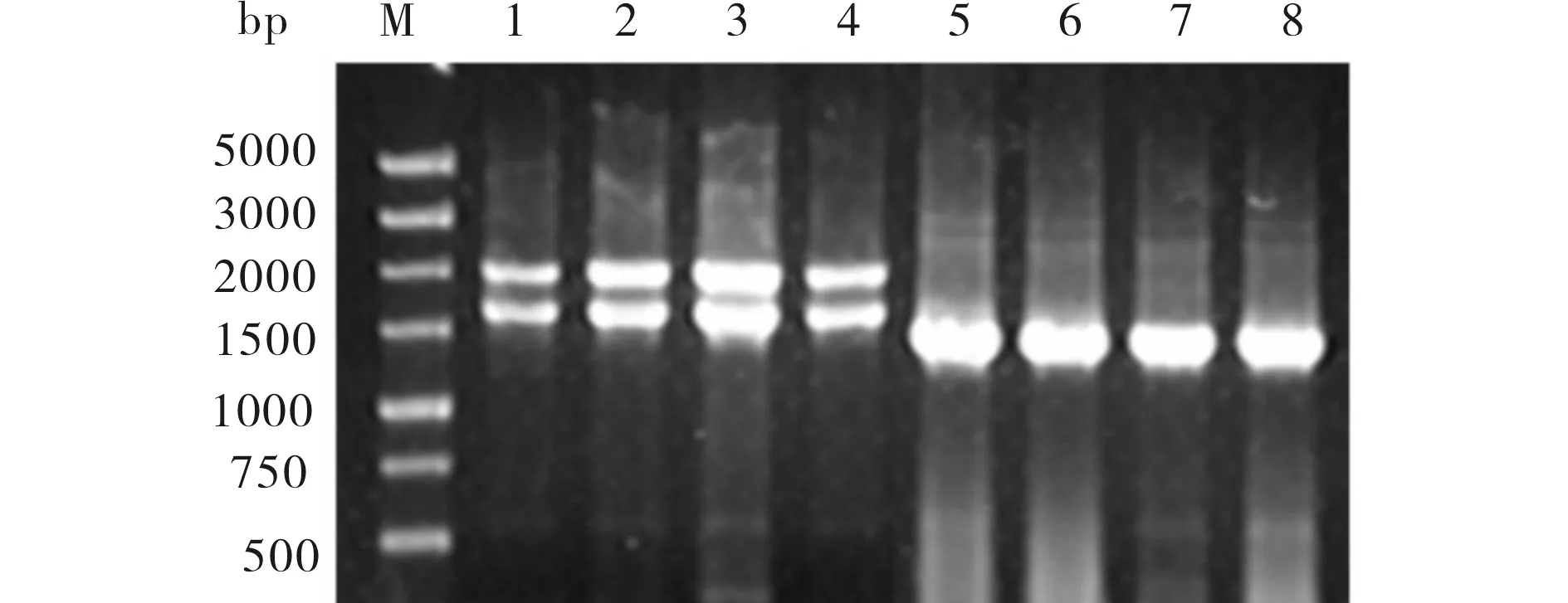
M)5000bp DNA Marker;1~4)AOX1引物扩增基因组DNA;5~8)CYP2C9特异引物扩增基因组DNA
2.3 CYP2C9基因的诱导表达和鉴定
2.3.1 SDS-PAGE电泳检测CYP2C9
利用SDS-PAGE电泳检测CYP2C9结果见图6.如图6所示,在蛋白质相对分子质量标准为55KD处,CYP2C9重组酵母菌的表达细胞上清、混合液、沉淀较阴性对照有差异表达条带,但表达量较低,条带不十分明显.
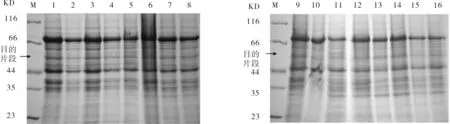
M)蛋白质Marker;1)pPIC3.5K空载上清;2~5)分别为诱导24,48,72,96 h上清;6、9)pPIC 3.5K空载混合;7、8、10、11)分别为诱导24,48,72,96h混合;12)pPIC3.5K空载沉淀;13~16)分别为诱导24,48,72,96 h沉淀
2.3.3 重组蛋白的Western Blot检测
重组的CYP2C9蛋白的Western Blot检测结果见图7.如图7所示,在55KD处有单一条带出现,在上清、沉淀中都有检测到信号,而转化的pPIC3.5K空载体对照菌株未检测到信号,证明CYP2C9成功地在毕赤酵母中表达.

M)蛋白质Marker;1)pPIC3.5K空载上清;2~5)分别为诱导24,48,72,96 h上清;6、9)pPIC 3.5K空载混合;7、8、10、11)分别为诱导24,48,72,96 h混合;12)pPIC3.5K空载沉淀;13~16)分别为诱导24,48,72,96 h沉淀
3 讨论
本实验用人细胞色素P450 2C9成熟肽编码区在毕赤酵母中进行甲醇诱导表达,由 SDS-PAGE 和Western blotting 分析结果表明:人细胞色素P450 2C9 能在毕赤酵母中成功表达,但CYP2C9的表达量较低,SDS-PAGE未能检测到明显的目的蛋白质,推测CYP2C9并不十分适合毕赤酵母表达系统.据现有数据,在毕赤酵母中表达可测水平外源蛋白的概率约为75%.若想获得CYP2C9在毕赤酵母中的高水平表达,还需结合CYP2C9自身特点,如外源基因的结构特点,需符合酵母的偏好密码子[11]、不含易被蛋白水解酶作用的序列、AT含量不能过高、mRNA的非翻译区的长度和序列尽量与AOX基因一致[12];培养条件的优化,包括通气量、诱导剂甲醇的浓度、培养温度[13]、培养时间、pH值等[14],进一步分析研究.
[1]Shimada T,Yamazaki H,Mimura M,et al.Interindividual variations in human liver cytochrome P-450 enzymes involved in the oxidation of drugs,carcinogens and toxic chemicals: studies with liver microsomes of 30 Japanese and 30 Caucasians [J].J Pharmacol Exp Ther,1994,270(1): 414-423.
[2]Inoue K,Yamazaki H,Imiya K,et al.Relationship between CYP2C9 and 2C19 genotypes and tolbutamide methyl hydroxylation and S-mephenytoin 4′-hydroxylation activities in livers of Japanese and Caucasian populations [J].Pharmacogenetics,1997,7(2): 103-113.
[3]Schwarz U I.Clinical relevance of genetic polymorphisms in the human CYP2C9 gene [J].Eur J Clin Invest,2003,33 (Sup 2): 23-30.
[4]余祖华,王红宁.利用巴斯德毕赤酵母表达外源蛋白的研究进展[J].生物技术通讯,2004,15(6): 614-616.
[5]Trant J M.Functional expression of recombinant spiny dogfish shark (Squalus acanthias)cytochrome P450c17 (17 alpha-hydroxylase/C17,20-lyase)in yeast (Pichiapastoris)[J].Arch Biochem Biophys,1996,326(1): 8-14.
[6]Boyle S M,Popp M P,Smith W C,et al.Expression of CYP2L1 in the yeastPichiapastoris,and determination of catalytic activity with progesterone and testosterone [J].Mar Environ Res,1998,46(1/5): 25-28.
[7]Andersen M D,Busk P K,Svendsen I,Møller B L.Cytochromes P-450 from cassava (Manihot esculenta Crantz)catalyzing the first steps in the biosynthesis of the cyanogenic glucosides linamarin and lotaustralin.Cloning,functional expression inPichiapastoris,and substrate specificity of the isolated recombinant enzymes [J].J Biol Chem,2000,275(3): 1966-1975.
[8]Matsuzaki F,Wariishi H.Molecular characterization of cytochrome P450 catalyzing hydroxylation of benzoates from the white-rot fungus Phanerochaete chrysosporium [J].Biochem Biophys Res Commun,2005,334(4): 1184-1190.
[9]Dietrich M,Grundmann L,Kurr K,et al.Recombinant production of human microsomal cytochrome P450 2D6 in the methylotrophic yeastPichiapastoris[J].Chem Bio Chem,2005,6(11): 2014-2022.
[10]Kolar N W,Swart A C,Mason J I,et al.Functional expression and characterisation of human cytochrome P45017α inPichiapastoris[J].J Biotech,2007,129(4): 635-644.
[11]陈 惠,赵海霞,王红宁,等.植酸酶基因中稀有密码子的改造提高其在毕赤酵母中的表达量[J].中国生物化学与分子生物学报,2005,21(2): 171-175.
[12]Sreekrishna K,Brankamp R G,Kropp K E,et al.Strategies for optimal synthesis and secretion of heterologous protein in the methylotrophics yeastPiehiaPastoris[J].Gene,1997,190(1): 55-62.
[13]方曙光,储 炬,张嗣良,等.温度对巴斯德毕赤酵母表达瑞替普酶(reteplase)的影响[J].工业微生物,2007,37(4): 11-15.
[14]黄 晶.RGD-拖丝蛋白基因的构建及其在毕赤醉母中的分泌表达[D].福州:福建师范大学,2008:1-73.
