5-Aza-dC对Molt-4细胞RASSF10基因启动子的去甲基化作用
2013-12-21谢向荣刘善浩戚之琳毕富勇
汪 茗, 章 尧, 谢向荣, 刘善浩, 戚之琳, 毕富勇
(1.皖南医学院生化教研室, 芜湖 241002; 2.弋矶山医院心内科,芜湖 241001; 3.弋矶山医院血液内科, 芜湖 241002)
DNA甲基化异常作为一种表观遗传学现象,是细胞癌变过程中的早期、频发事件,并且是一个可逆的生物学过程。因此甲基化的特异基因可作为肿瘤早期诊断、治疗的分子标志,而对特异基因进行去甲基化处理则可以达到治疗肿瘤的目的[1-2]。RASSF10是最近鉴定出的RASSF家族的新成员[3]。已有报道提示RASSF10的启动子甲基化在甲状腺癌、前列腺癌[3-4]等肿瘤中频繁出现。本研究以人急性淋巴细胞白血病细胞株Molt-4细胞为研究对象,采用MTT、RT-PCR、Western blot、COBRA等方法研究甲基化抑制剂5-氮杂-2′-脱氧胞苷(5-Aza-2′deoxycytidine,5-Aza-dC)对Molt-4细胞的增殖、RASSF10 mRNA、蛋白表达及RASSF10基因启动子甲基化状态的影响。
1 材料和方法
1.1 材料
1.1.1 细胞株 人急性淋巴细胞白血病细胞株Molt-4细胞购自中科院上海细胞生物研究所。
1.1.2 试剂 5-Aza-dC购自Sigma公司;RPMI1640培养基购自Hyclone公司;RNA提取、RT-PCR试剂盒购自TAKARA公司;基因组DNA提取试剂盒购自Qiagen公司;DNA甲基化试剂盒购自Millipore公司;DNA marker 及引物均购自上海生工公司;RASSF10多克隆抗体购自Abgent公司。
1.2 方法
1.2.1 细胞培养 采用含10%胎牛血清的RPMI1640培养液,将Molt-4细胞置于37℃,5% CO2饱和湿度的孵箱中培养。倒置显微镜下观察细胞生长状况。
1.2.2 MTT(四唑盐比色法) 取对数生长期细胞,调整浓度为1×105/mL,接种于96孔板。5-Aza-dC作用24、48、72 h后取出培养板,每孔加入MTT(5 g/L)20 μL, 37℃继续培养4 h后,离心弃上清,加DMSO 150 μL,震荡后酶标仪570 nm下测定各孔的吸光度A,按下式计算细胞增殖抑制率。
细胞增殖抑制率(%)=(A对照-A实验)/A对照×100%
1.2.3 RT-PCR(逆转录-聚合酶链式反应) 5-Aza-dC作用72 h后,Trizol提取总RNA,紫外分光光度计检测RNA纯度(A260/A280>1.8)。两步法RT-PCR按试剂盒说明进行扩增。RASSF10上游引物:5′-GCGCCATGGATCCTTCGGAAAA-3′,下游引物: 5′-GGCAGCGCCTCGTCGTC GTCCT-3′,产物244 bp。GAPDH为内参,上游引物:5′-TGAAGGTCGGAGTCA ACGGATT TGGT-3′,下游引物:5′-CATGTGGGCCATGAGGTCCACCAC-3′,产物984 bp[4]。扩增条件:95℃预变性 3 min;95℃ 30 s,55℃ 30 s,72℃ 1 min,共30个循环;72℃ 10 min,4℃维持。产物经1.5%琼脂糖凝胶电泳后,EB染色,捷达801凝胶成像分析系统对结果进行分析。用ARASSF10/AGAPDH表示RASSF10 mRNA相对水平。
1.2.4 Western blot(免疫印迹法) 收集5-Aza-dC处理72 h后Molt-4细胞的总蛋白,按100 μg/孔上样。10% SDS-PAGE电泳后转膜至NC膜上。5%脱脂牛奶封闭1 h,封Ⅰ抗RASSF10 (1∶500)4℃过夜。次日TBST、TBS洗膜。封HRP标记的羊抗兔Ⅱ抗(1∶2000)45 min,同法洗膜。ECL化学发光,将膜置于暗盒中,暗室内胶片曝光,冲洗胶片。
1.2.5 COBRA(亚硫酸氢钠联合限制性内切酶分析法) 取对照组及10 μmol/L 5-Aza-dC处理72 h后的Molt-4细胞,按DNA提取说明书提取各组细胞基因组DNA,并进行 DNA纯度测定:A260/A280>1.8。按DNA甲基化试剂盒说明书对DNA进行修饰及纯化,并取亚硫酸氢钠修饰的DNA 进行半巢式PCR扩增。扩增方法参考文献[4]。其外部引物RASSF10 COU1:5′-ATAAGTAGAGGAGTTAGTAGGTTAAAGGAGA-3′,RASSF10 COL1: 5′-CCCCCAAAACC CAAAACTATAACTAA A-3′;半巢式PCR内部引物为 RASSF10 COL2: 5′-A AATACAAA AAACTCAA AACCCAA ACCC-3′和 RASSF10 COU1[4]。取PCR 产物(241bp)用10 U TaqI进行消化,将产物进行2% 琼脂糖凝胶电泳。结果判断:样本出现消化的短链DNA条带者说明该基因启动子区存在甲基化,PCR后具有TaqI识别位点,可被TaqI识别并水解;样本未出现消化短链DNA条带者为基因启动子区不存在甲基化,PCR后没有TaqI识别位点,不能被水解;结果介于两者之间的为该基因启动子存在部分甲基化。
1.3 统计学处理 采用SPSS11.5进行统计分析,组间比较用单因素方差分析,组内比较用t检验,P<0.05有显著性差异。
2 结果
2.1 5-Aza-dC对Molt-4细胞增殖的影响 如图1所示,Molt-4细胞经3种不同浓度5-Aza-dC处理后,细胞增殖抑制率均高于对照组,差异有统计学差异(P< 0.01),且不同浓度组之间的区别亦具有统计学意义(P<0.05)。结果提示,5-Aza-dC对Molt-4细胞增殖的抑制作用呈现时间、剂量依赖性。
2.2 5-Aza-dC对RASSF10 mRNA表达的影响 如图2所示,扩增产物经琼脂糖凝胶电泳显示,RASSF10 mRNA在对照组Molt-4细胞中不表达,而经过2.5、5、10 μ mol/L的5-Aza-dC处理后可见RASSF10 mRNA恢复表达,RASSF10表达强度与5-Aza-dC的浓度呈剂量依赖关系。RASSF10相对表达量用ARASSF10/AGAPDH表示,结果如表1所示,差异有统计学意义(P<0.05)。
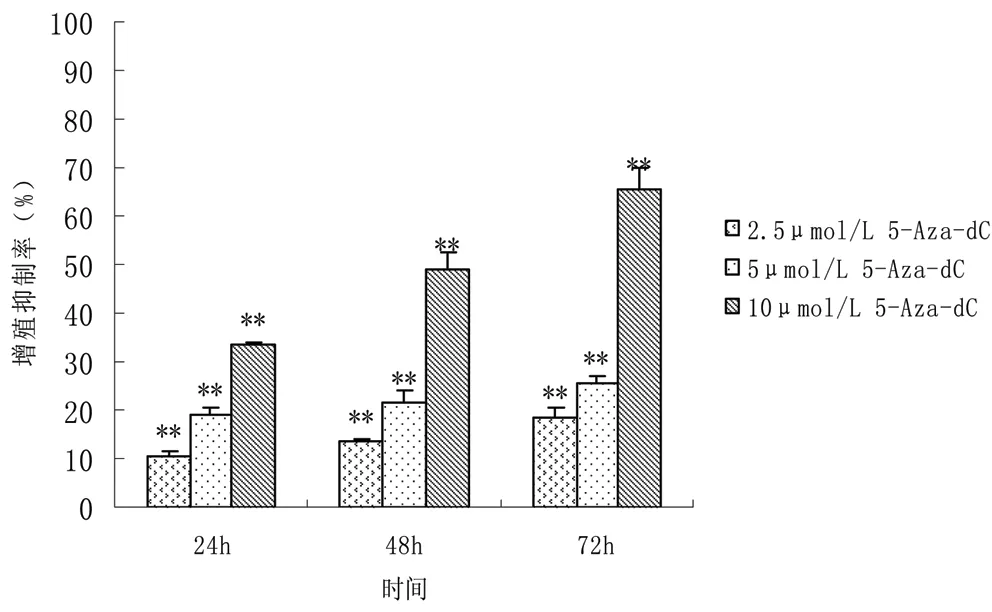
图1 5-Aza-dC对Molt-4细胞增殖的影响

图2 5-Aza-dC对Molt-4细胞RASSF10 mRNA 表达的影响

表1 5-Aza-dC对Molt-4细胞RASSF10 mRNA表达的影响
*—P<0.05, **—P<0.01vscontrol.
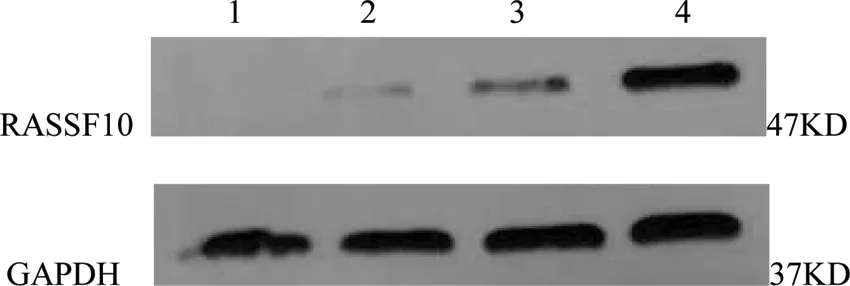
图3 5-Aza-dC对Molt-4细胞RASSF10蛋白表达的影响

表2 5-Aza-dC对Molt-4细胞RASSF10蛋白表达的影响
*—P<0.05, **—P<0.01vscontrol.
2.3 5-Aza-dC对RASSF10蛋白表达的影响 由图3,表2可见,对照组及5-Aza-dC各浓度组细胞的内参GAPDH表达量无显著区别,而对照组细胞无RASSF10表达,5-Aza-dC各处理组的RASSF10蛋白表达量显著上调,与5-Aza-dC浓度有关,差异有统计学意义(P< 0.05)。
2.4 5-Aza-dC对RASSF10基因启动子甲基化状态的影响 COBRA实验检测Molt-4细胞采用5-Aza-dC处理前后RASSF10基因启动子区域甲基化状态,结果如图4所示。对照组消化的DNA条带明显,说明对照组存在启动子甲基化现象,PCR扩增后含有TaqI识别位点,可被TaqI消化水解,出现水解条带。而经10 μmol/L 5-Aza-dC作用72 h后的处理组,可见清晰的未被TaqI消化水解的条带,消化水解的DNA条带不明显。说明启动子有甲基化和非甲基化共存的现象,原先甲基化的RASSF10基因启动子区域大部分被去甲基化了。

图4 5-Aza-dC对Molt-4细胞RASSF10基因启动子甲基化的影响
3 讨论
肿瘤基因启动子区域DNA甲基化是遗传外修饰调控的一种重要方式,它可引起基因表达沉默,从而下调抑癌基因表达,导致肿瘤的发生。近年来,越来越多的研究显示人类众多肿瘤的发生、发展与DNA甲基化的异常有关,基因启动子区CpG岛高甲基化可导致抑癌基因表达沉默进而导致肿瘤发生,这也是白血病发病的重要机制之一[2,5-6]。
Ras相关结构域家族(Ras-association domain family,RASSF)则是Ras激活信号转导通路中的一组负向调节基因,通过调控细胞周期和细胞凋亡而介导肿瘤抑制效应。RASSF至少包括10个成员:RASSF1-10。其中RASSF1-6属于“经典成员”,都含有C末端的RA(Ras-association)结构域和SARAH(Sav/RASSF/Hippo)结构域。而RASSF7-10的N末端都含有RA结构域但是缺乏SARAH结构域,因此被称为“N端RASSF家族”[7-8]。它们参与了很多关键的生物学过程,比如:细胞死亡、增殖、微观的稳定性、启动子的甲基化、对缺氧的反应等。RASSF10是“N端RASSF家族”的新成员,是新近被鉴定出的含一个单独的外显子基因,位于11 p15.2,含有一个大的CpG岛,覆盖了这个基因的大部分[7-10]。目前已有文献报道在人类众多肿瘤中发现RASSF的一些成员频繁失表达,且认为RASSF基因启动子的甲基化是其失表达的重要原因[7-13]。但有关RASSF10甲基化与白血病相关性的研究还比较少,关于急性白血病RASSF10启动子甲基化的研究尚处于初级阶段,本研究探讨了甲基化抑制剂5-Aza-dC在体外对白血病细胞株Molt-4细胞的增殖抑制作用及对RASSF10基因启动子甲基化的影响。
5-Aza-dC是常用的DNA甲基转移酶抑制剂,可通过抑制DNA甲基转移酶1(DNMT1)的甲基转移活性而发挥去甲基化作用。已有研究报道5-Aza-dC可使多种含有CpG岛的高甲基化抑癌基因重新表达,从而使抑癌基因恢复其抑癌的功能。以往研究发现,多个基因启动子区域甲基化而失活的抑癌基因被5-Aza-dC处理后可被重新激活,如RASSF1A基因[14]、p16基因[15]等。本研究采用5-Aza-dC处理急性淋巴细胞白血病细胞株Molt-4细胞,研究发现经过不同浓度5-Aza-dC处理后,Molt-4细胞增殖均受到了明显抑制,5-Aza-dC具有显著抑制白血病细胞增殖的作用。为进一步探讨5-Aza-dC抑制白血病细胞增殖的作用机制,本研究还继续观察了其对抑癌基因RASSF10基因启动子甲基化状态产生的影响。为减少因5-Aza-dC自身对细胞的毒性作用而对实验结果产生的影响,本研究选用的是3种较小的有效浓度来处理Molt-4细胞,结果显示在对照组Molt-4细胞中RASSF10基因启动子是被甲基化修饰的,RASSF10 mRNA、蛋白在Molt-4细胞中不表达,但经过10 μ mol/L 5-Aza-dC处理后,RASSF10基因启动子部分发生去甲基化作用,其RASSF10 mRNA、蛋白重新出现表达,证明了RASSF10基因启动子的高度甲基化修饰是导致抑癌基因RASSF10失表达的主要机制。5-Aza-dC可通过使抑癌基因RASS F10基因发生去甲基化作用,进而使RASSF10重新恢复表达而发挥抗白血病效应。
综上,本研究结果提示甲基化抑制剂5-Aza-dC能使急性淋巴细胞白血病Molt-4细胞RASSF10基因的甲基化程度降低,诱导其重新表达,从而抑制了Molt-4细胞的增殖。实验结果既为RASSF10作为白血病治疗新靶点的确认提供了理论依据,也为急性白血病的去甲基化治疗提供了理论基础。
[1]EI-Osta A.The rise and fall of genomic methylation in cancer[J].Leukemia, 2004, 18 (2) :233-237.
[2]Herman J G, Baylin S B.Gene silencing in cancer in association with promoter hypermethylation[J].N Engl J Med, 2003, 349 (21) :2042-2054.
[3]Hesson L B, Dunwell T L, Cooper W N, et al.The novel RASSF6 and RASSF10 candidate tumour suppressor genes are frequently epigenetically inactivated in childhood leukaemias[J].Molecular Cancer, 2009, 8:42.
[4]Schagdarsurengin U, Richter A M, Wöhler C, et al.Frequent epigenetic inactivation of RASSF10 in thyroid cancer[J].Epigenetics, 2009, 4(8):571-576.
[5]Herman J G, Graff J R, Myohanen S, et al.Methylation-specific PCR: a novel PCR assay for methylation status of CpG islands[J].Proc Natl Acad Sci USA, 1996, 93 (18) : 9821-9826.
[6]Shinawi T, Hill V, Dagklis A, et al.KIBRA gene methylation is associated with unfavorable biological prognos-tic parameters in chronic lymphocytic leukemia[J].Epigenetics, 2012,7(3):211-215.
[7]Sherwood V, Recino A, Jeffries A,et al.The N-terminal RASSF family: a new group of Ras-associa-tion-domain-containing proteins, with emerging links to cancer formation[J].Biochem J, 2009,425 (2):303-311.
[8]Underhill-Day N, Hill V, Latif F.N-terminal RASSF family: RASSF7-RASSF10[J].Epigenetics, 2011,6(3):284-292.
[9]Dammann R, Li C, Yoon J H, et al.Epigenetic inactivation of a RAS association domain family protein from the lung tumour suppressor locus 3p21.3[J].Nat Genet, 2000,25(3):315-319.
[10]Van der Weyden L, Adams D J.The ras-association domain family (RASSF) members and their role in human tumourigenesis[J].Biochim Biophys Acta, 2007,1776(1): 58-85.
[11]Dansranjavin T,Wagenlehner F,Gattenloehner S,et al.Epigenetic down regulation of RASSF10 and its possible clinical implication in prostate carcinoma[J].Prostate, 2012 Mar 13.
[12]Helmbold P, Richter A M, Walesch S, et al.RASSF10 promoter hypermethylation is frequent in malignant melanoma of the skin but uncommon in nevus cell nevi[J].J Invest Dermatol, 2012,132(3 Pt 1):687-694.
[13] Hill V K, Underhill-Day N, Krex D, et al.Epigenetic inactivation of the RASSF10 candidate tumor suppressor gene is a frequent and an early event in gliomagenesis[J].Oncogene, 2011, 30(8):978-989.
[14]Numoto K, Yoshida A, Sugihara S, et al.Frequent methylation of RASSF1A in synovial sarcoma and the anti-tumor effects of 5-aza-2′-deoxycytidine against synovial sarcoma cell lines[J].J Cancer Res Clin Oncol, 2010, 136(1):17-25.
[15]孟春风,朱新江,戴冬秋,等.5-氮杂-2′-脱氧胞苷和曲古抑菌素A对胃癌细胞中P16和hMLH1及MGMT基因启动子甲基化和mRNA表达的影响[J].中华胃肠外科杂志,2009, 12(5):494-497.
