延河流域植物功能性状变异来源分析
2013-12-21温仲明苗连朋
张 莉,温仲明 ,苗连朋
(1.中国科学院教育部水土保持与生态环境研究中心,杨凌 712100;2.中国科学院大学,北京 100049;3.西北农林科技大学水土保持研究所,杨凌 712100;4.西北农林科技大学资源环境学院,杨凌 712100)
植物在漫长的进化过程中,为减小外界环境的不利影响,最大程度地适应并利用周围环境中的各种资源而形成的形态、生理和物候等属性,称为功能性状[1]。它决定着植物对环境变化的响应,并影响生态系统的过程与功能,是联系植物与环境的桥梁,会随着环境变化而变化[2-5]。例如随海拔的升高,同一物种的比叶面积一般会出现减小的趋势,以减小叶面积获取较高的抗冻性,增加叶厚度与叶肉细胞密度提高叶片对强光的保护作用,而叶片的叶绿素组成、含氮量、气孔导度等也会随海拔而变化[6]。降雨梯度则会对植物的分布和性状表现产生影响,Surya K.Maharjan等人对西非雨林31种板材树种的多度分布及性状研究发现,其中80%的板材树种多度随降雨量递增分别呈正态、增加或减少的分布形态,热带雨林环境下植物性状多与降雨量存在正相关或负相关关系,各树种主要通过秋季落叶和增加木质密度提高耐荫性和耐旱性来适应环境[7]。全球尺度的研究则表明,随着年均温的上升,植物叶片的氮、磷含量有下降趋势,氮磷比呈上升趋势[8]。此外,环境控制试验发现温度升高会增加气孔导度,进而降低光合效率和水分利用效率[9]。
但另一方面,植物功能性状也受遗传因素的影响。在植物功能性状研究中,种间差异不可忽略,遗传背景对植物性状的形成与进化极为重要[10-12]。朱璧如等人对内蒙古锡林河流域草地植物的研究数据反映出多种禾本科植物在叶片干物质含量以及叶片的氮、磷含量3种功能性状上表现出很好的一致性。Givnish对不同生境下植物物候特征的研究发现同一科属植物物候特征相似,亲缘物种之间某些功能性状较为接近,认为环境胁迫是否存在决定着适应和进化是否发生,而植物的系统发育背景则决定植物的适应策略和方式[13]。Sun Shucun等人对中国东部温带森林冠层与林下层植物出叶时间与叶片性状的相关性进行研究,其相关性受物种系统发育差异和物种生态适应性影响,排除系统发育背景的影响后相关性更为显著[14]。科是植物分类学中重要的中级单位,相同科属的植物有一定的亲缘关系,具有相似的系统发育背景,在进化过程中保有相似的功能性状。研究表明,植物系统发育背景是植物性状变异的主要来源之一,甚至大于环境梯度的影响,使得单纯的植物性状与环境关系研究存在一定的不确定性[15]。因此,区别植物遗传背景和环境变化对植物性状变异的相对重要性,对于深入揭示植物对环境变化的响应与适应具有重要意义。
黄土丘陵区是我国水土流失最为严重的区域之一,植被恢复重建是水土保持的关键[16-18]。研究该区植物功能性状变异来源,揭示植物性状对环境变化的响应,对于该区植被恢复布局与物种选择具有重要意义。但该区相关研究大多集中在植物各性状之间的关系、植物性状对某些单一环境因子的响应、植物性状在不同功能群间的差异等方面[19-23],少有研究区分遗传背景和环境梯度的相对影响,所研究的植物性状与环境关系不确定性较大。鉴于此,本文以黄土丘陵区延河流域为研究区,试图探明遗传背景和环境梯度对植物性状变异的相对影响,并在排除遗传背景影响的前提下,通过对植物性状与环境因子进行定量分析,揭示该区植物性状对主要环境因子的响应。
1 材料和方法
1.1 研究区概况
延河流域位于陕西北部(东经108°45'— 110°28',北纬36°23'—37°17'),属大陆性半干旱季风气候带,年均降水量约500 mm,年均温约9℃。延河流域是黄河中游河口镇-龙门区间的一级支流,流经志丹、安塞、延安等市县。该流域面积为7687 km2,河网密度约47 km/km2,平均坡度4.4‰。该流域由东南向西北具有一定的温度、降雨梯度,因气候条件的限制,植被分布呈明显的地带性,群落物种组成变化显著,满足植物功能性状变异研究的空间尺度需求。
1.2 野外调查与数据采集
气候条件是影响植物空间分布的主要因素之一,因此本文采样首先考虑气候条件的变化梯度,样点分布见图1。根据邹后远[24]对陕北黄土高原植被区的划分并结合流域自身气候条件,自东南向西北将延河流域划分为3个植被区,即森林区、森林草原过渡区、草原区,本文以植被区反映流域气候条件的变化,并作为控制采样的首要条件;另一方面,由于延河流域地形极其破碎,而地形变化对水热条件具有强烈的再分配作用,本文在各植被区内进行样点选择时,充分考虑地形变化,重点选择在人类活动干扰较轻、自然植被发育较好并且具有典型性、代表性的梁峁顶、阴坡、阳坡分别选取样点,在复杂处可适当增加样点个数。此次野外调查共记19个样点(表1),总共调查了28个科52个属64种植物,物种数或观测值不小于3次的科别以豆科Leguminosae、禾本科Poaceae、菊科Asteraceae、蔷薇科Rosaceae植物为主,4种科别的植物在各样点出现的频度分别为89.5%、100%、94.7%、57.9%,各样点物种调查结果见附表 1。
研究选取了对环境变化敏感且易于观测的叶性状与根性状:(1)比叶面积(SLA),是叶片面积与质量的比值,与植物生长和生存策略紧密相关,可以反映植物获取资源的能力及对环境的适应能力[25];(2)比根长(SRL),为单位质量的根总长,是反映细根形态和生理功能的重要指标,也是体现植物吸收水分养分能力的重要性状之一[26];(3)单位质量叶片氮含量(LN)和单位质量根氮含量(RN),氮是植物生长不可或缺的养分之一,叶氮与根氮含量的变化,对水热变化敏感[8],并且可以反映植物的光合产物分配机制随环境的变化;(4)单位质量叶片磷含量(LP)和单位质量根氮含量(RP),黄土丘陵区土壤中磷含量较缺乏,也成为限制植物生长发育的因素之一。
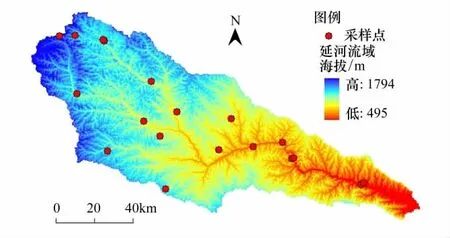
图1 研究区样点分布图Fig.1 Distribution of samples
在野外采样时,每个物种从尽可能多的植株上采集健康、未遮阴的叶片,并从东南西北4个方位采集以消除太阳位置对叶氮含量的影响。叶面积用便携式叶面积仪(Yaxin-1242)直接在野外测定,所采样品还将用于叶干重测定,另采集健康叶片约10 g用于叶片氮磷含量的测定。在植物的基部10—20 cm范围内挖取表土,从中采集直径2 mm以下的细根。所有采集的叶片与根系在野外用自封袋临时保存,并及时带回实验室测定。采集的根系洗净后利用量筒排水法测得体积,而后叶片和根系在105℃下杀青15 min,并在85℃下烘干约48 h至恒重,称得干重,计算SLA=叶面积/叶干重,SRL=根长/根干重。烘干的叶、根粉碎后,用凯氏定氮法测定叶、根氮含量,钼锑抗比色法测定叶、根磷含量。
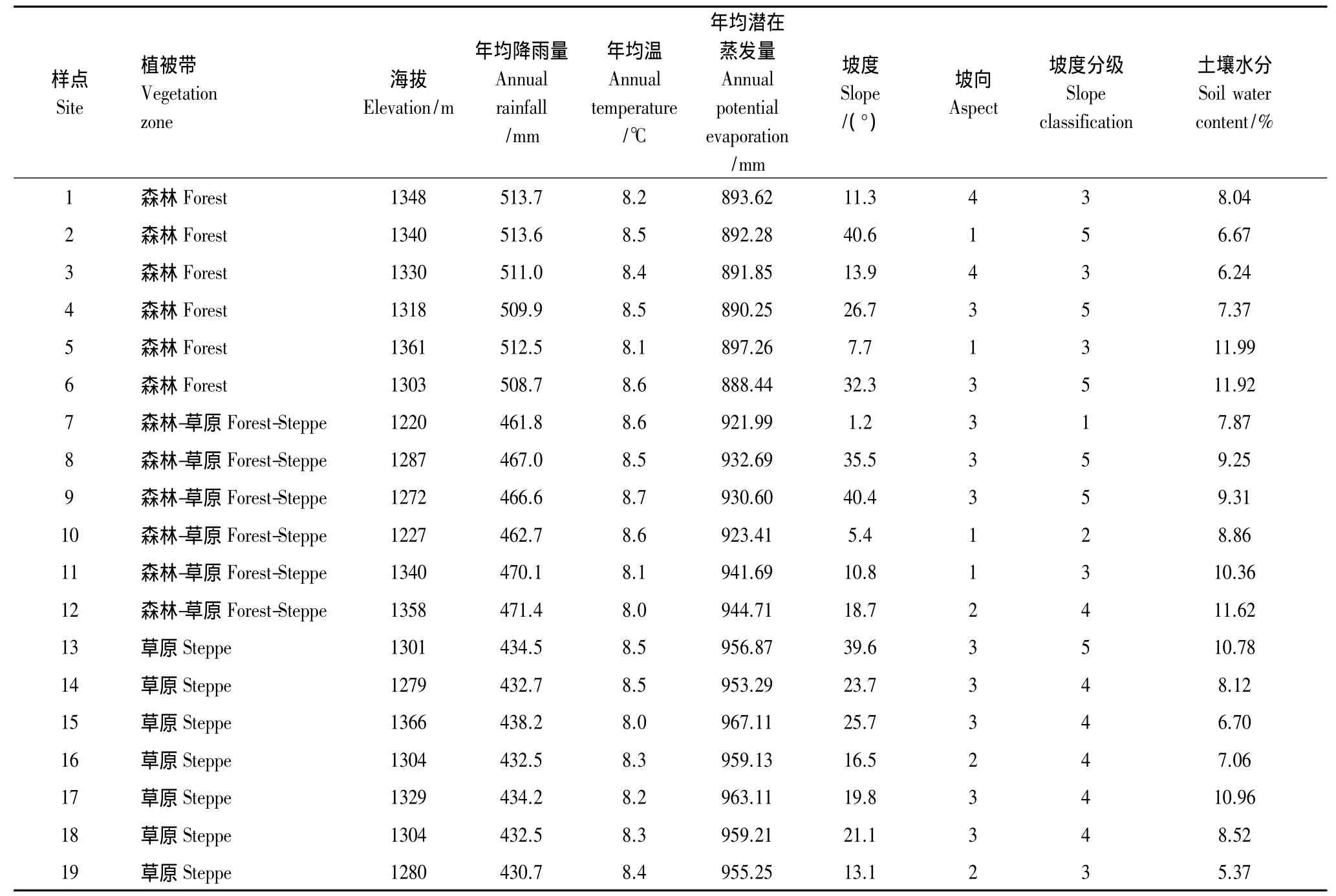
表1 延河流域各植被带样点布设位置与主要气候地形因子Table 1 Geographical locations in different vegetation zones and the main climate and local topography factors of the study sites in Yanhe river catchment
1.3 环境数据的提取
本文所需的水热因子及地形数据主要来自于现有的环境因子专题图,专题图的生成方法参见文献[27]。所有因子都利用各样点记录的经纬度信息从相应的专题图中提取,主要包括年均降雨量(Raver)、年均雨季降雨量(R789)、年均降雨量季节变化(Rsea),年均温(Taver)、生长季年均温(T410)、年均最高温(Th)、年均最低温(Tc)、年均气温季节变化(Tsea),年均潜在蒸发量(Et)。而海拔Dem、坡向Aspect(包括阳坡、半阳坡、阴坡、半阴坡4个坡向)、坡位Positon(包括河道与沟间平地、下坡、中坡位、上坡、峁顶、高平地)、坡度(Slope)由野外实测得到,其中,根据耕地坡度分级标准与水土流失强度对坡度分级,<2°,2—6°,6—15°,15—25°,>25°。
除气候与地形因子外,本文实测了各样点土壤水分(Soil Moisture,SM),表土以下0—200 cm土层每20 cm取一个土样,用烘干法测定其质量含水量(g/g),计算出整个土层的平均含水量。
1.4 数据分析
数据分析前对不服从正态分布的性状数据进行对数转换,以满足统计假设的需要。对各样点植物功能性状按照不同的植被区和主要科别(物种数或观测值不小于3次的科别)进行方差分析,利用Post Hoc多重比较揭示不同植物区气候条件差异和遗传背景的差异能否引起功能性状的变异。并根据前人的研究以及野外实地调查,选取植被区代表气候综合因子,并考虑地形因子(坡度坡向)、土壤水分含量以及遗传背景(用科别区分)的影响,不考虑各个因素之间的交互作用,将以上5个因素作为固定效应处理,利用方差分析,剖析它们对各性状的相对影响。对于每个样点,根据获取的环境数据,所有的气候地形因子分别按照豆科、菊科、禾本科、蔷薇科4种科别对植物功能性状进行逐步回归分析,以探究在排除遗传背景的影响下,植物功能性状与环境梯度的响应关系。以上所有数据分析与成图都在Excel、SPSS 16.0、SigmaPlot 10.0中完成。
2 结果
2.1 植物功能性状对气候条件变化与遗传背景的响应
所调查植物的 SLA、SRL、LN、RN、LP 和 RP 性状值分别为(123.06±6.59)cm2/g、(4.15±0.39)m/g、(17.98±0.70)mg/g、(6.93±0.32)mg/g、(2.45±0.12)mg/g、(1.93±0.06)mg/g。为比较植物功能性状对气候条件变化与遗传背景的响应,本文分别以植被区(代表气候条件单元)及植物科别(代表遗传背景差异)为基础对植物功能性状进行分析比较。结果表明,所测定的6种植物性状,仅比叶面积SLA、叶片质量氮含量LN、根质量磷含量RP在不同植被区之间存在显著差异(图2)。其中,植物比叶面积SLA沿森林区、森林草原过渡区至草原区依次增加,即随降雨量减少、温度下降,植物的比叶面积增加,这与比叶面积一般随降雨量降低而减少的研究结果不一致。植物叶片氮含量则是森林区显著高于森林草原过渡区和草原区,根的质量磷含量表现为森林区显著低于森林草原过渡区和草原区。豆科、菊科、禾本科、蔷薇科植物间性状的多重比较表明(图3),比叶面积SLA、比根长SRL、叶片氮含量LN、根氮含量RN在不同科别之间存在显著差异。比叶面积SLA以豆科植物最高,蔷薇科植物最低;比根长SRL以禾本科植物最高,蔷薇科植物最低;叶片质量氮含量LN以豆科植物最高,禾本科植物最低;根的质量氮含量RN以豆科植物最高,禾本科植物最低,其他性状无显著差异。
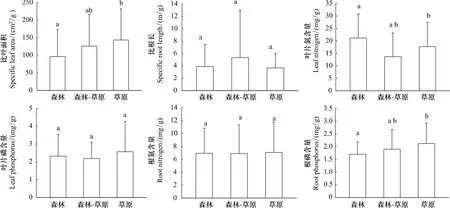
图2 不同植被带(气候条件)植物性状差异Fig.2 The difference of plant traits in different vegetation zone
2.2 植物功能性状变异来源
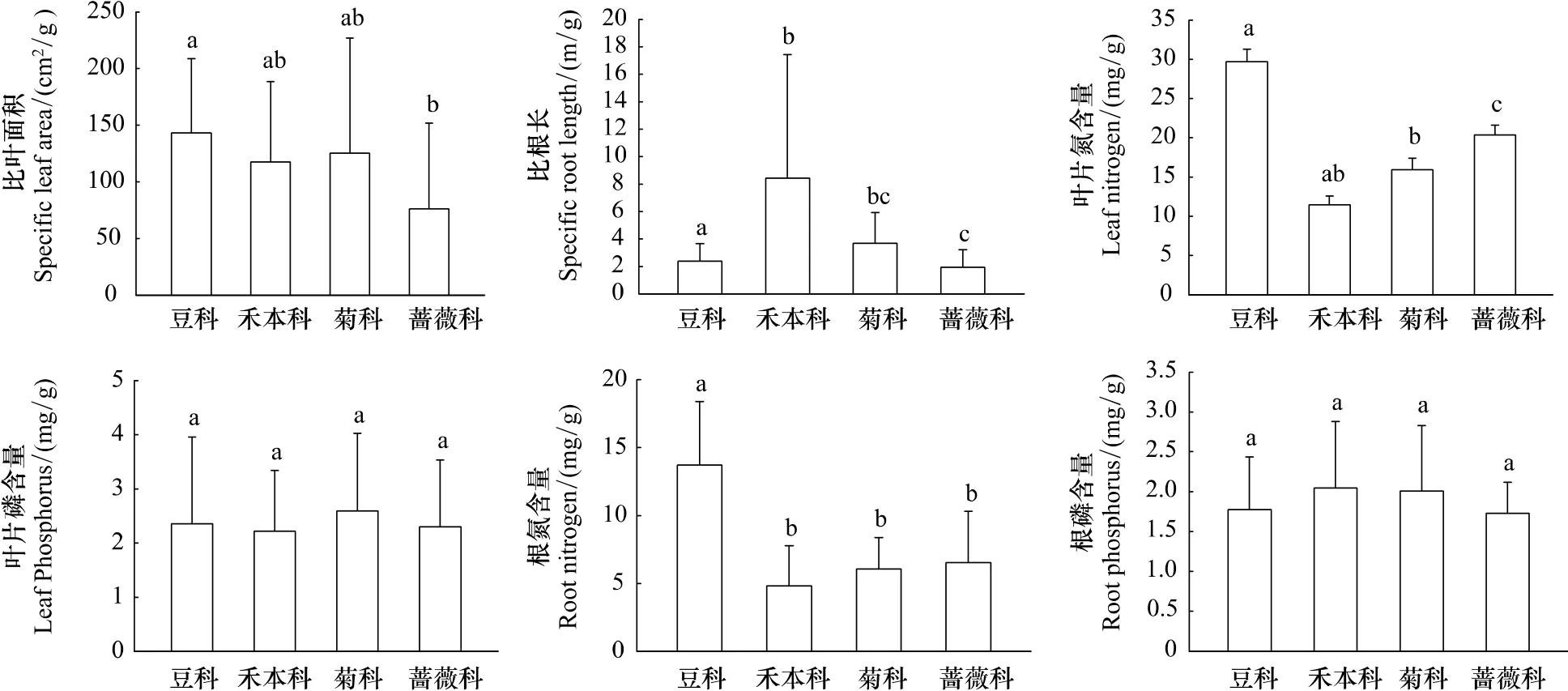
图3 物种水平上不同科别(遗传背景)植物性状差异Fig.3 The difference of plant traits in different genera at species level
上述结果表明,植物功能性状不仅随气候条件而变化,而且受遗传背景的影响。为进一步定量分析环境因素及遗传背景对植物功能性状差异的影响,本文选取植物科别与植被区,并考虑坡度、坡向和土壤含水量共5个因子,分别代表遗传背景、气候条件和局部环境因子,对调查物种的植物功能性状进行多因素方差分析。结果表明,模型对性状变异解释的比例范围在20.08%— 70.40%(表2)。其中,植物科别属性解释的比例占5.58%—42.70%,是性状变异主要来源,对 SRL、LN、RN 有显著影响,解释比例分别为 27.86%、32.78%、42.70%;植被区变化解释比例为0.25%— 11.03%,仅对LP的影响达到显著水平,解释比例为0.33%;坡度对LN、LP、RN 和 RP 均有显著影响,解释比例各占 12.84%、9.01%、2.18%、8.33%;坡向对 SRL、LN、LP、RN 和 RP均有显著影响,解释比例各占 3.05%、11.44%、4.50%、3.20%、7.25%。;土壤水分含量解释比例为 0.32%—10.16%,对 SRL、LN、LP 有显著影响,解释比例各为 3.92%、2.30%、10.16%。
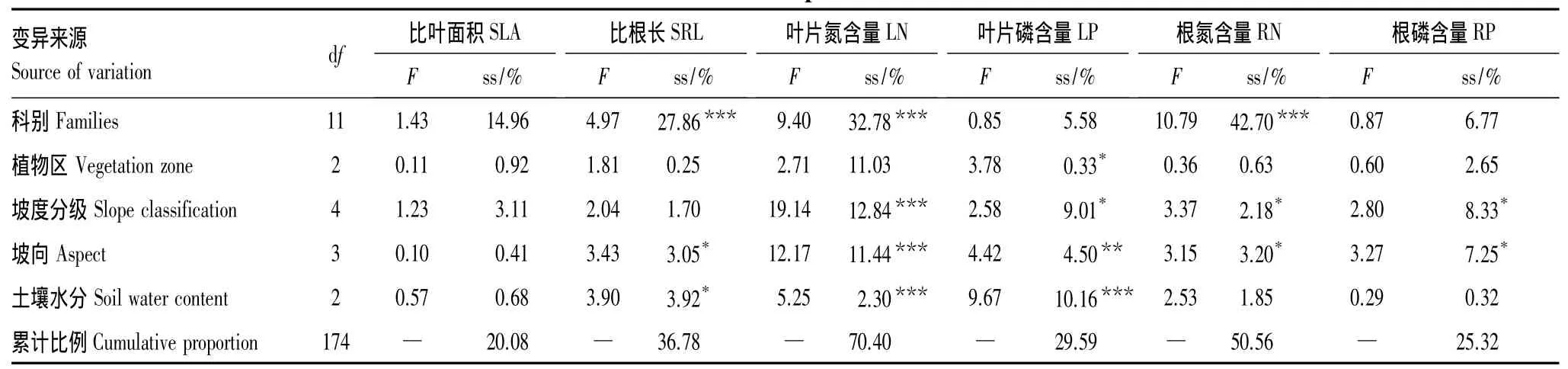
表2 植物性状变异来源Table 2 The source of plant traits variation
2.3 排除遗传背景影响的植物性状对环境因子的响应
根据前述,植物功能性状变异主要来源于遗传背景差异。为探讨剔除遗传背景影响后植物功能性状对环境的响应关系,本文对由专题图获取的温度、降雨量、坡度、坡向、海拔、潜在蒸发量等14个变量,分别按照豆科、菊科、禾本科、蔷薇科4种科别对6种植物功能性状进行线性回归分析。文中仅列出达到统计学显著水平的回归模型(表3)。
4种科别植物的功能性状对环境因素的响应关系存在较大的差异。豆科、禾本科植物的功能性状中SLA、SRL对环境因素响应积极,其中豆科植物两种性状主要受限于植物可利用水分,包括降雨量、土壤含水量情况和坡向对水分的重分配,而禾本科植物的SLA、SRL则受温度的影响较大。禾本科、菊科、蔷薇科植物的根、叶营养元素N、P含量对环境反应也较为敏感,其中禾本科、菊科植物LN受海拔、坡向影响较大,RN对温度响应积极,LP分别受温度和海拔的影响,而蔷薇科植物LN、RP分别受温度和坡向的影响较大。总体而言,各环境因素对植物性状的影响中,气候因素以温度变化为主,而地形因素则以海拔和坡向为主。
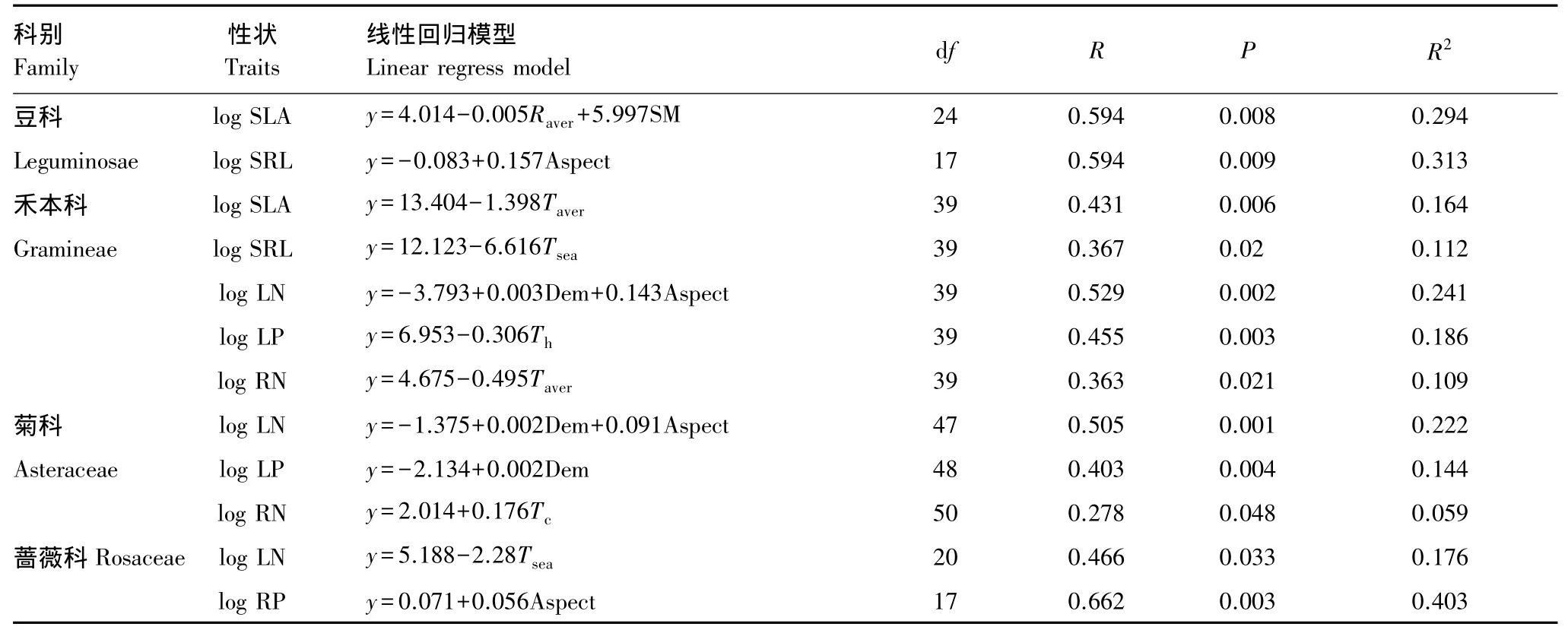
表3 不同科别植物性状逐步回归分析Table 3 Linear regression models of traits in different plant families with environmental factors
3 讨论
3.1 植物功能性状差异来源
植物性状对环境变化的响应建立在系统发育史的基础上。不同植物对环境的敏感性不同,对环境变化的适应策略也不相同,较多研究都反映出遗传背景对植物性状的影响[28-30]。植物适应环境的策略是经过漫长的进化演变而来,植物不可能在极短的时间内进化出另一套完备的性状组合,而只能在已有遗传性状的基础上扬长避短,因此植物性状对环境变化的响应极大地受到遗传背景的限制。就延河流域植物性状变异而言,本文研究表明,遗传背景对3个性状SRL、LN、RN有显著影响,是决定其性状变异的首要因子。流域内植物以豆科、禾本科、菊科和蔷薇科为最主要的科属,各自在其系统发育背景基础上适应环境变化。豆科植物具有自身固氮优势,其SLA、LN、RN分别高出物种平均值16.33%、65.23%、97.78%,能在养分水分逐渐缺乏和土壤侵蚀强度逐渐加大的环境趋势下保持较高的氮含量且支撑相对较高的光合效率和SLA;禾本科植物根系比较发达,其SRL高出物种平均值103.11%,能更好地争夺土壤中的养分、水分;而菊科、蔷薇科植物则能较好地协调各功能性状,使植株整体上更为均衡。可见,不同的遗传背景导致植物适应环境的策略不同,决定了环境变化时植物性状的发展方向不同。
但环境的本底状况也会影响到环境因子与遗传背景对某些植物性状的相对作用。以磷为例,流域内土壤普遍缺磷且磷的可利用性较低,不同科属植物的LP、RP差异不显著,受遗传背景的影响较小,但植物体内磷含量受气候条件和地形条件的影响相对较大,属于环境敏感型性状。同时,环境的变化与扰动对一些功能性状的塑造与保持也极为重要[31-33]。延河流域不同植被区气候条件差异较大,植物性状也存在显著差异。其中,SLA表现出随湿润向干旱环境变化而增加的趋势,森林区植物SLA较草原区植物偏低33.02%,这可能与研究尺度较小有关,但另一方面,SLA的变化在不同科属间差异较大,影响因素各不相同(表3),这也可能是造成SLA变化不一致的原因(见讨论3.2)。而森林区植物RP低于森林草原过渡区和草原区植物19.94%,则与土壤中磷含量受气候条件影响相对较小有关。
3.2 排除遗传背景影响后植物性状对环境因子的响应
环境因子对物种的筛选作用明确了植物功能性状与环境存在相关性,但跨物种分析性状与环境的关系会包含较多的不确定性,植物的种间关系和自身适应策略的差异会使得环境对不同物种性状的影响不一致,可能出现抵消或强化等作用[28]。与同一遗传背景下的植物性状相比,由物种多度加权得到的群落性状虽然更具有代表性,但同时也会因为平均化过程而掩盖性状与环境的响应关系。以群落性状SLA、SRL为例,SLA与14个环境因素不存在显著的回归模型,而SRL回归模型中仅含有海拔因子,log SRL=-0.358+0.001Dem,模型P值为0.035,调整后R2为0.201,与不同科别植物与环境的响应关系有较大差异。对各科植物性状的回归分析避开了遗传背景的限制,反映出相同的系统发育背景下植物对环境变化的响应,不同科属的植物由于各自的环境耐受性不同、生存竞争策略不同,对环境变化的是否产生响应和响应方式也不尽相同。以SLA为例,豆科植物SLA与年均降水量负相关、与土壤平均含水量正相关,且受后者影响较大,而禾本科植物SLA则与年均温度负相关。其中SLA与温度或降水呈负相关关系可能与植物叶密度和叶厚度对温度、降水变化的响应有关,叶密度和叶厚度均与SLA呈负相关,但随温度增加或降水减少,叶厚度增加而叶密度下降,即温度与叶厚度正相关、与叶密度负相关,而降雨与叶厚度负相关、与叶密度正相关,不同科属植物叶密度和叶厚度对温度、降水变化的响应各不相同,叶厚度与叶密度的权衡导致了其SLA与温度或降水的负相关关系[34]。不同的适应策略导致豆科植物在养分缺乏的条件下保持相对优势,而禾本科植物在养分水分都缺乏的条件下存活的可能性更大。环境适应策略的差异利于物种的共存,更好地利用环境中的资源,丰富植物功能多样性和群落的生态多样性。
对不同科属植物性状和环境关系的定量化研究,能更好地反映植物对环境的生存适应策略,细化区域内植物对环境变化的响应。对于预测植被变化趋势和地表覆盖变化对环境的反馈效应,研究植被的演替和恢复均有积极作用。
4 结论
在研究区域植物功能性状对环境变化的响应时,植物系统发育背景是必须考虑的因素,对于某些植物性状,遗传背景对性状变异的影响甚至高于环境变化的影响。通过比较遗传背景与环境变化对性状变异的相对影响,可以找出特定环境敏感性状,利于运用功能性状衡量环境变化。本研究发现LP、RP对环境因子较为敏感,但未探明相应的环境因子。同时,排除植物系统发育背景的影响,对植物性状和环境关系的定量化分析,有利于揭示植物适应环境的机理。
[1]Meng T T,Ni J,Wang GH.Plant functional traits,environments and ecosystem functioning.Journal of Plant Ecology:Chinese Version,2007,31(1):150-165.
[2]Feng Q H,Shi Z M,Dong L L.Response of plant functional traits to environment and its application.Scientia Silvae Sinicae,2008,44(4):125-131.
[3]Gong CM,Bai J,Liang Z S.Advance on indicating functions of plant functional traits to global climate changes.Acta Botanica Boreali-Occidentalia Sinica,2011,31(11):2355-2363.
[4]Meng T T,Ni J,Harrison SP.Plant morphometric traits and climate gradients in northern China:a meta-analysis using quadrat and flora data.Annals of Botany,2009,104(6):1217-1229.
[5]Lienin P,Kleyer M.Plant trait responses to the environment and effects on ecosystem properties.Basic and Applied Ecology,2012,13(4):301-311.
[6]Song L L,Fan JW,Wu SH.Research advances on changes of leaf traits along an altitude gradient.Progress in Geography,2011,30(11):1431-1439.
[7]Maharjan SK,Poorter L,Holmgren M,Bongers F,Wieringa JJ,Hawthorne W D.Plant functional traits and the distribution of west African rain forest trees along the rainfall gradient.Biotropica,2011,43(5):552-561.
[8]Reich P B,Oleksyn J.Global patterns of plant leaf Nand P in relation to temperature and latitude.Proceedings of the National Academy of Sciences of the United States of America,2004,101(30):11001-11006.
[9]Xu Z Z,Zhou GS,Li H.Responses of gas exchange characteristics in leaves of Leymus Chinensis to changes in temperature and soil moisture.Acta Phytoecologica Sinica,2004,28(3):300-304.
[10]Díaz S,Cabido M,Casanoves F.Plant functional traits and environmental filters at a regional scale.Journal of Vegetation Science,1998,9(1):113-122.
[11]Xu B,Cheng Y X,Gan H J,Zhou W J,He J S.Correlations between leaf and fine root traits among and within species of typical temperate grassland in Xilin River Basin,Inner Mongolia,China.Chinese Journal of Plant Ecology,2010,34(1):29-38.
[12]Zhu B R,Xu B,Zhang D Y.Extent and sources of variation in plant functional traits in grassland.Journal of Beijing Normal University:Natural Science,2011,47(5):485-489.
[13]Givnish T J.Comparative studies of leaf form:Assessing the relative roles of selective pressures and phylogenetic constraints.New Phytologist,1987,106(Suppl 1):131-160.
[14]Sun S C,Jin D M,Li R J.Leaf emergence in relation to leaf traits in temperate woody species in East-Chinese Quercus fabri forests.Acta Oecologica,2006,30(2):212-222.
[15]Zhang SB,Ferry SJW,Zhang JL,Cao K F.Spatial patterns of wood traits in China are controlled by phylogeny and the environment.Global Ecology and Biogeography,2011,20(2):241-250.
[16]Peng Z H,Dong L S,Zhang X D,Zhou JX.Anylysis of vegetation restoration strategies in severe soil erosion area of the Loess Plateau in China.Forest Research,2005,18(4):471-478.
[17]Han L Y,Jia Y F,Wang N,Jiao JY.Soil anti-erodibility and soil erosion evolution of during process of vegetation recovering in Loess Hilly-Gully Region.Soil,2009,41(3):483-489.
[18]Zhang H H,Huang Z B.Bio-climate division and restoration of the degraded ecosystem on the Loess Plateau.Journal of Arid Land Resources and Environment,2001,15(1):64-71.
[19]Wang Z Q,Liu B Y,Wang X L.Effects of natural shrub of Caragana opulens Kom on soil moisture in a semiarid area on the Loess Plateau.Geographical Research,2005,24(1):113-120.
[20]Wei L Y,Shangguan Z P.Relationship between vertical distribution of fine root in different successional stages of herbaceous vegetation and soil environment in Loess Plateau.Acta Ecologica Sinica,2006,26(11):3740-3748.
[21]Wu Y Z,Huang M B,Zhao SW.Plant coefficient variation and adaptability evaluation of different succession communities on the Loess Plateau.Journal of Natural Resources,2008,23(5):849-857.
[22]Shi Y,Wen Z M,Gong SH,Song G,Zheng Y,Ding M.Trait variations along a climate gradient in hilly area of Loess Plateau.Research of Soil and Water Conservation,2012,19(1):107-116.
[23]Gong SH,Wen Z M,Shi Y.The response of community-weighted mean plant functional traits to environmental gradients in Yanhe river catchment.Acta Ecologica Sinica,2011,31(20):6088-6097.
[24]Zou H Y.Study on correlation between vegetation division and construction of forestand grasslands in Loess Plateau of Northern Shannxi.Research of Soil and Water Conservation,2000,7(2):96-101.
[25]Cornelissen JH C,Lavorel S,Garnier E,Diaz S,Buchmann N,Gurvich D E,Reich P B,Steege H,Morgan H D,Heijden M GA,Pausas JG,Poorter H.A handbook of protocols for standardised and easy measurement of plant functional traits worldwide.Australian Journal of Botany,2003,51(4):335-380.
[26]Eissenstat D M.On the relationship between specific root length and the rate of root proliferation:a field study using citrus rootstocks.New Phytologist,1991,118(1):63-68.
[27]Wen Z M,He X H,Jiao F,Jiao J Y.The predictive distribution of Stipa bungeana in Yanhe River catchment:GAM model and its application.Acta Ecologica Sinica,2008,28(1):193-202.
[28]Yao T T,Meng T T,Ni J,Yan S,Feng X H,Wang GH.Leaf functional trait variation and its relationship with plant phylogenic background and the climate in Xinjiang Junggar Basin,NW China.Biodiversity Science,2010,18(2):201-211.
[29]Pilar CD,Pedro V S,Carmen P R,Melchor M M,Gabriel M M.Leaf morphology and leaf chemical composition in three Quercus(Fagaceae)species along a rainfall gradient in NE Spain.Trees,1997,11(3):127-134.
[30]Scheepens J F,Frei E S,Stocklin J.Genotypic and environmental variation in specific leaf area in a widespread Alpine plant after transplantation to different altitudes.Oecologia,2010,164(1):141-150.
[31]Reich P B,Wright I J,Cavender-Bares J,Craine J M,Oleksyn J,Westoby M,Walters M B.The evolution of plant functional variation:traits,spectra,and strategies.International Journal of Plant Sciences,2003,164(Suppl.3):S143-S164.
[32]Hoiss B,Krauss J,Potts S G,Roberts S,Steffan-Dewenter I.Altitude acts as an environmental filter on phylogenetic composition,traits and diversity in bee communities.Proceedings of Biological Science,2012,279(1746):4447-4456.
[33]Tanaka Y.Trait response in communities to environmental change:effect of interspecific competition and trait covariance structure.Theoretical Ecology,2010,5(1):83-98.
[34]Hu M Y,Zhang L,Luo T X,Shen W.Variations in leaf functional traits of Stipa purpurea along a rainfall gradient in Xizang,China.Chinese Journal of Plant Ecology,2012,36(2):136-143.
参考文献:
[1]孟婷婷,倪健,王国宏.植物功能性状与环境和生态系统功能.植物生态学报,2007,31(1):150-165.
[2]冯秋红,史作民,董莉莉.植物功能性状对环境的响应及其应用.林业科学,2008,44(4):125-131.
[3]龚春梅,白娟,梁宗锁.植物功能性状对全球气候变化的指示作用研究进展.西北植物学报,2011,31(11):2355-2363.
[6]宋璐璐,樊江文,吴绍洪.植物叶片性状沿海拔梯度变化研究进展.地理科学进展,2011,30(11):1431-1439.
[9]徐振柱,周广胜,李晖.羊草叶片气体交换参数对温度和土壤水分的响应.植物生态学报,2004,28(3):300-304.
[11]徐冰,程雨曦,甘慧洁,周文嘉,贺金生.内蒙古锡林河流域典型草原植物叶片与细根性状在种间及种内水平上的关联.植物生态学报,2010,34(1):29-38.
[12]朱璧如,徐冰,张大勇.草地植物功能性状变异的程度和来源.北京师范大学学报:自然科学版,2011,47(5):485-489.
[16]彭镇华,董林水,张旭东,周金星.黄土高原水土流失严重地区植被恢复策略分析.林业科学研究,2005,18(4):471-478.
[17]韩鲁艳,贾燕锋,王宁,焦菊英.黄土丘陵沟壑区植被恢复过程中的土壤抗蚀与细沟侵蚀演变.土壤,2009,41(3):483-489.
[18]张厚华,黄占斌.黄土高原生物气候分区与该区生态系统的恢复.干旱区资源与环境,2001,15(1):64-71.
[19]王志强,刘宝元,王晓兰.黄土高原半干旱区天然锦鸡儿灌丛对土壤水分的影响.地理研究,2005,24(1):113-120.
[20]韦兰英,上官周平.黄土高原不同演替阶段草地植被细根垂直分布特征与土壤环境的关系.生态学报,2006,26(11):3740-3748.
[21]吴元芝,黄明斌,赵世伟.黄土高原植被演替不同阶段植物系数的变化与适应性评价.自然资源学报,2008,23(5):849-857.
[22]施宇,温仲明,龚时慧,宋光,郑颖,丁曼.黄土丘陵区植物功能性状沿气候梯度的变化规律.水土保持研究,2012,19(1):107-116.
[23]龚时慧,温仲明,施宇.延河流域植物群落功能性状对环境梯度的响应.生态学报,2011,31(20):6088-6097.
[24]邹厚远.陕北黄土高原植被区划及与林草建设的关系.水土保持研究,2000,7(2):96-101.
[27]温仲明,赫晓慧,焦峰,焦菊英.延河流域本氏针茅(Stipabungeana)分布预测——广义相加模型及其应用.生态学报,2008,28(1):193-202.
[28]尧婷婷,孟婷婷,倪健,阎顺,冯晓华,王国宏.新疆准噶尔荒漠植物叶片功能性状的进化和环境驱动机制初探.生物多样性,2010,18(2):201-211.
[34]胡梦瑶,张林,罗天祥,沈维.西藏紫花针茅叶功能性状沿降水梯度的变化.植物生态学报,2012,36(2):136-143.
