夜香树花甾体皂苷抑制K562细胞增殖及对PI3K/AKt信号通路的调控
2013-12-20罗发军赵世元钟振国
罗发军 赵世元 钟振国
夜香树,又名夜来香,茄科夜香树属植物(Cestrum nocturnum,Linn)。原产热带美洲,现广植于热带、亚热带地区,我国广东、广西、福建、云南均有栽培,每年开花约6次,资源非常丰富。我们曾报道夜香树提取物体内外有较强地抗肿瘤作用[1-4]。本实验从夜香树花中提取得到夜香树花皂苷(以下简称SSFCN),体外培养人白血病K562细胞,用不同浓度的SSFCN处理K562细胞,MTT法检测SSFCN对K562细胞的增殖抑制作用,应用流式细胞仪检测SSFCN对K562细胞周期的阻滞作用,现将结果报告如下。
1 材料与方法
1.1 细胞
人慢性髓源白血病细胞系K562细胞株购自中国科学院上海细胞生物学研究所细胞库,常规培养于10%新生牛血清的RPMI 1640培养基中,置于37℃、5%CO2、饱和湿度培养箱中悬浮培养。
1.2 夜香树花甾体皂苷(SSFCN)的提取
取干燥的夜香树花2.3 kg,用乙醇浸泡24 h,加热回流提取,过滤,减压浓缩得浸膏,乙醇浸膏用硅胶拌匀后,依次用石油醚、乙酸乙酯和正丁醇回流提取,回收溶剂,获得石油醚部位、乙酸乙酯部位和正丁醇部位。取正丁醇部位浸膏100 g,用硅胶拌匀后,采用硅胶柱色谱法分离,先用氯仿-甲醇梯度洗脱,经簿层检识后将相同的溶液合并,直至氯仿-甲醇比例为20∶1时,发现有结晶析出,经反复硅胶柱层析,氯仿甲醇混合物液洗脱,甲醇重结晶。得到1种不定型的结晶物,该化合物的曲线下面积为99.56%。经不同系统进行薄层层析检识、高效液相色谱法、酸性水解测定其糖苷基团的结构、光谱分析,结合氢谱和碳谱(600 MHz)元素分析表明,该化合物单体含C、H、O 3种元素等;含量达99.1%,经鉴定为甾体皂苷类化合物。
1.3 主要试剂与仪器
新生牛血清购自美国Hyclone公司;RPMI Medium 1640购自美国GIBCO公司;MTT 、Hoechst33342染色Annexin V/PI细胞凋亡检测试剂盒、TUNEL细胞凋亡检测试剂盒caspase-3、cytochtome c等购自碧云天生物技术研究所。CO2培养箱(Thermo Forma,型号38) ;流式细胞仪(美国库尔特公司);倒置荧光显微镜(Nikon,型号TE20002U) ;倒置显微镜(Olym2pus,型号CK40) ;酶标仪(B iocell,型号Sunris);凝胶成像系统(Bio-RAD)。
1.4 MTT法测定药物对细胞增殖抑制作用[5]
RPMI 1640完全培养基(GIB-CO)、3%谷胺酰胺、卡那霉素750 mg/L,用缓冲液调pH至6.8~7.2,滤菌后4℃冰箱内保存备用。选对数生长期的白血病细胞K562细胞,用10%胎牛血清的RPMI 1640培养基配成5000个/mL的细胞悬液,在96孔培养板中每孔加入200 μl上述细胞悬液,置37℃、5% CO2培养箱中培养24 h后,离心去上清液,实验组分别加入终浓度为60 μg/mL、30 mg/L、15 mg/L 、7.5 mg/L、3.8 mg/L的SSFCN(含10% FBS的RPMI 1640培养液);阳性对照组加入终浓度为60 mg/L的As2O3(含10% FBS的RPMI 1640培养液),对照组则加入200 μl的10%胎牛血清的RPMI 1640培养基细胞悬液,每组4孔(实验重复3次)。置37℃、5% CO2培养箱中培养4天后离心弃上清,每孔加入200 μl新鲜配制的含0.2 mg/ mL MTT的无血清培养液,37℃继续培养4 h,离心弃上清,加入200 μl /孔 DMSO,振荡混匀后,用波长为550 nm、参比波长为450 nm的酶标仪测定OD值,测定时减去空白对照。按下列公式计算药物对肿瘤细胞生长的抑制率。
肿瘤细胞生长抑制率(%)=(1-实验组平均OD值/对照组平均OD值) ×100%
1.5 流式细胞仪分析(PI染色法)[6]
取对数生长期K562细胞,用含10%小牛血清的RPMI 1640培养基配成1×106个/ml细胞悬液,分装在培养瓶中,实验组加入SSFCN终浓度为30 μg/ml,对照组加等体积培养基,置于含5% CO2、37℃温箱中分别培养24 h、48 h、72 h,离心收集细胞,然后用PBS液洗1次,加入70%乙醇4℃过夜;弃去70%乙醇,用PBS液清洗2次,加0.5ml PBS充分混匀细胞,加入终浓度为100 μg/ml RNAase A,37℃消化1 h,加入2 mmol/L,Hoechst 33258 2 μl和PI(propidium iodide)4℃染色1 h,然后在Epicsxl流式细胞仪上进行检测,氩离子激光器488 nm或514 nm波长激发;阻断滤片为620 nm长波通滤片。
1.6 K562细胞DNA的提取与琼脂糖凝胶电泳分析[7]
取对数生长期K562细胞,分别接种于3个培养皿中,常规培养24 h,更换含0.5%小牛血清的 RPMI-1640培养液,24 h后加入0.5 mg/L SSFCN,阴性对照组平皿中加等量的DMSO(终浓度为培养总体积的1%)。加药15 h后,用0.6 mL细胞裂解液(0.5% TritonX -100,5 mmol/L EDTA 、10 mmol/L Tri,pH 7.4)裂解细胞,然后用等体积的酚-氯仿提取3次,乙醇沉淀后,将DNA沉淀溶于20 l TE(pH 7.8)中,用1.5%琼脂糖凝胶进行DNA电泳分析。紫外光下观察“DNA条带”并摄影。
1.7 Western blot 法检测SSFCN处理K562细胞后AKt磷酸化水平
处于对数生长期的K562细胞,用含10%小牛血清的RPMI 1640培养基配成1×106个/ml细胞悬液,分装在培养瓶中,分别加入终浓度为30 μg/ml、15 μg/ml、7.5 μg/ml的SSFCN,对照组加等体积培养基,置于含5% CO2、37℃ 温箱中培养72 h,离心收集细胞,分别加入200 μl预冷的蛋白裂解液,放置于4℃裂解60 min,冰浴下超声裂解15 min,冷冻离心15 min,采用Bradford法检测蛋白浓度,分装后置-70℃保存。取等量蛋白(20 μg)进行SDS-PAGE电泳分离,先恒压100V电泳20 min随后150V电泳60 min,然后在250 mA的条件下电转膜90 min,将蛋白转移至PVDF膜上,5%脱脂奶粉室温封闭1 h,分别加入相应的Ⅰ抗过夜;加入相应的生物素化Ⅱ抗(均为1∶2000稀释)室温2 h。再加入ABC复合物室温30 min,加入DAB显色液,实验在相同条件下重复3次。
1.8 统计学处理
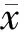
2 结果
2.1 SSFCN对K562细胞的增殖抑制作用
分别用浓度为60 μg/ml、30 μg/ml、15 μg/ml、7.5 μg/ml、3.75 μg/ml的SSFCN,处理处于对数生长期的K562细胞72 h后,采用MTT法检测SSFCN对 K562细胞的增殖抑制作用,结果表明,SSFCN对K562细胞生长呈明显抑制作用,呈浓度依赖性,浓度越高,作用时间越长,SSFCN对细胞生长抑制作用越强,见表1。
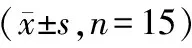
表1 MTT法检测不同浓度SSFCN对K562细胞的抑制作用
2.2 SSFCN对 K562 细胞的细胞周期和凋亡的影响
流式细胞仪分析,与对照组相比,30 mg/L SSFCN处理 K562 细胞24 h、48 h、72 h后,G0/G1期细胞周期无明显变化,S期细胞比例逐渐增大,从45.8%→49.3%→51.5%;G2+M期细胞比例逐渐减小,从19.1%→17.2%→14.5%;与对照组比较,细胞周期中细胞比例的改变以72 h最为明显(G1期46.8%→34.1%,S期38.5%→51.5%,G2+M期没有明显的变化)。随着药物作用K562细胞时间的延长,细胞凋亡数量逐渐增加,作用72 h,其凋亡率达31.2%,而对照组仅为4%~6%,两组相比差异显著,见表2,30 mg/L SSFCN处理K562 细胞,流式细胞仪检测发现有明显的亚倍体峰。
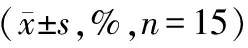
表2 30 mg/L SSFCN 作用不同时间对 K562 细胞周期及凋亡的影响
2.3 DNA凝胶电泳分析
以30 μg/ml SSFCN作用K562细胞24 h、48 h、72 h 药物诱导的DNA断裂。结果表明,SSFCN 作用K562细胞24 h后,DNA没有裂解成小分子DNA片段,作用48 h后,才观察到“DNA ladder”,表明经SSFCN处理后K562细胞发生细胞凋亡(图1)。
2.4 不同浓度SSFCN处理K562细胞72 h P-AKt表达水平变化
不同浓度SSFCN作用K562细胞后,AKt水平无明显变化(P>0.05),P-AKt308和P-AKt473的磷酸化水平明显下调,随着SSFCN浓度的增高,其水平下调更加明显(F=63.5,P<0.01)(图2)。

图1 SSFCN作用K562细胞不同时间的DNA凝胶电泳图像

图2 不同浓度SSFCN处理K562细胞72 h后P-AKt表达水平的变化
3 讨论
细胞凋亡是受基因调控的主动的细胞死亡过程,有其特征性的形态和生化特征,而细胞周期的阻滞与细胞凋亡、分化关系密切[8]。细胞通过2个限制点(G1/S和G2/M)保证细胞的忠实复制。当细胞受损时,通过激活限制点,分别导致细胞的G1期和G2期延迟,使细胞有时间完成复制前和有丝分裂的修复,以保证细胞高质量的存活,当损伤超过细胞的修复能力时,则促使细胞凋亡。本研究从细胞增殖、流式细胞仪、细胞DNA琼脂糖凝胶电泳分析等来确认SSFCN诱导K562细胞凋亡发生。从MTT法抑制作用实验结果来看,SSFCN各剂量组均能使K562细胞数量明显下降,IC50<20 μg/ml,进一步证实SSFCN体外抑瘤作用;本组流式细胞仪检测结果证实随着SSFCN作用时间延长肿瘤细胞发生凋亡增强;通过琼脂糖凝胶电泳检测出现有DNA Ladder,再一次证实我们的假设。
PI3K是1种细胞内蛋白激酶,是细胞内重要的信号转导分子,AKt是细胞内的信号分子,是PI3K信号转导途径中一个重要的下游靶激酶,具有丝/苏氨酸激酶活性,PI3K/AKt信号通路与细胞的生长、增殖、维持细胞生存等具有重要作用[9]。PI3K受到生长因子刺激后被激活,对磷脂酰肌醇环上3位羟基进行磷酸化生成PIP3,在磷脂酰肌醇依赖蛋白激酶(PDK)的协助下,AKt从细胞质转位到细胞膜,促使其结构发生变化,在Ser308和Thr308位点磷酸化激活,AKt活化后,其下游因子也被进一步激活,对细胞周期、凋亡产生调节作用。已经证实,多种肿瘤组织如肝癌、胃癌、乳腺癌、胰腺癌等组织中AKt异常激活[10-11],通过负调节PI3K/AKt信号通路,才能抑制肿瘤细胞的增殖,促进其凋亡,加速死亡[12]。本组结果提示SSFCN作用于K562细胞后,可能负性调节PI3K/AKt信号通路,从而诱导K562细胞凋亡,但其机制仍需进一步研究。
如上所述,SSFCN具有抑制K562细胞的增殖和促进凋亡的能力,机制可能抑制K562细胞PI3K/AKt信号通路,从而抑制K562细胞增殖。本研究为开发SSFCN治疗慢性白血病提供理论依据。
[1] 赵世元,钟振国,廖 文,等.夜香树提取物体外抗肿瘤作用的实验研究〔J〕.天然产物研究与开发,2008,20(1):125.
[2] 钟振国,赵世元,吕金燕,等.夜香树提取物体内抗肿瘤作用的实验研究〔J〕.中药材,2008,31(11):1709.
[3] 赵世元,钟振国,廖 文,等.夜香树提取物体外抗肿瘤作用的实验研究〔J〕.天然产物研究与开发,2008,20(1):12.
[4] 赵世元,农智新,叶海洪,等.夜香树叶甾体皂苷对人肝癌细胞株BEL-7404增殖抑制作用机制研究〔J〕.中国实验方剂学杂志,2013,(7):212.
[5] 徐淑云,卞如濂,陈 修.药理实验方法学〔M〕.北京:第3版,人民卫生出版社,2002:175.
[6] 胡 野,凌志强,单小方.细胞凋亡的分子医学〔M〕.北京军事医学科学出版社,2002:482.
[7] AOKIS,KONG D,MATSUIK,et al.Smenospongine.a spongean sesquiterpene am inoquinone,induces erythroid differentiation in K562 cells〔J〕.Anticancer Drugs,2009,15(4):363.
[8] 彭 安,申东兰,徐颂周.紫金龙诱导Bel-7402人肝癌细胞分化的实验研究〔J〕.实用癌症杂志,2012,27(2):111.
[9] KEKRE N,GRIFFIN C,MCNULTY J,et al.Pancratistatin causes early activatiom of caspase-3 and the flipping of phosphatidyl serine followed by rapid apoptosis specifically in human lymphoma cells〔J〕.Cancer Chemother Pharmacol,2009,56:29.
[10] ROBERT V,MOUILLE B,MAYEUR C,et al.Effects of the garlic compound diallyl disulfide on the metabolism,adherence and cell cycle of HT-29 colon carcinoma cells;Evidence of ensitive and resistant sub-populations〔J〕.Carcinogenesis,2001,22(8):1155.
[11] Anindita chakrabarty,Violeta sanchez,Maria G,et al.Feedback upregulation of HER3(Erbb3)expression and activity attenuates antitumor effect of PI3K inhibitors〔J〕.PNAS,2012,109(8):2718.
[12] Jang Bae Moon,Jung Ha Kim,Kabsun Kim,et al.AKt induces osteoclast differentiation through regulating the GSK3/NFATcl signaling cascade〔J〕.The Journal of Immunology,2011,27:163.
