谷氨酸对脱氧雪腐镰刀菌烯醇刺激下的断奶仔猪生长性能、血常规及血清生化指标变化的干预作用
2013-12-20吴苗苗印遇龙李丽立李铁军
吴苗苗 肖 昊 印遇龙 李丽立* 李铁军*
(1.中国科学院亚热带农业生态研究所,中国科学院亚热带农业生态过程重点实验室,湖南省畜禽健康养殖工程技术中心,农业部中南动物营养与饲料科学观测实验站,长沙 410125;2.中国科学院大学,北京 100049)
脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON)又称呕吐毒素,是一种单端孢霉烯族毒素,广泛存在于自然界受霉菌污染的小麦、大麦、玉米等谷类作物中[1]。1μg/kg的DON便能影响肠黏膜的生理屏障功能,干扰机体蛋白质的合成,造成免疫系统抑制等。当饲粮中DON含量在1 mg/kg以上时,试验动物普遍产生厌食行为,且DON严重影响体重增加。近年来研究发现,DON可能与人类食管癌、免疫球蛋白A(IgA)肾病有关,对人类及动物的健康构成威胁。在我国饲料中DON检出率可达 100%,检测超标率可达 17.7%[2]。被污染的谷物营养成分含量均大幅度降低,畜禽在误食被DON污染的饲料后,会引起食欲减退或废绝、呕吐、腹泻、发烧、站立不稳、反应迟钝、体重下降、流产、死胎和弱仔,抑制免疫机能和降低机体抵抗力,严重时损害造血系统,造成死亡[3-5]。不同动物对DON的敏感度也不同,猪是最敏感的,且雄性比雌性敏感度高[6-7]。谷氨酸作为一种功能性氨基酸,是肠道能量来源的主要物质。谷氨酸、谷氨酰胺和天冬氨酸的代谢为肠道保持完整性和维持功能提供了大量的ATP[8]。仔猪摄入饲粮中谷氨酸50%以上在肠道中完全氧化成CO2,其产生的CO2量高于消化道葡萄糖(GLU)产生的 CO2量[9-10];肠道偏向于利用肠道内的谷氨酸合成谷胱甘肽(与肠上皮细胞保持还原状态有关,并参与解毒过程),且谷氨酸也是体内合成肠道修复及其他快速增殖的细胞所需的谷氨酰胺的必需前体,即谷氨酸实际上也具有谷氨酰胺所具有的作用[11],如谷氨酰胺在疾病的预防、控制感染及集体损伤后的修复过程中具有营养和免疫调节双重作用[12]。且谷氨酸的钠盐谷氨酸钠在改善饲粮适口性上也具有一定的作用。近年来,随着对疾病和应激状态下营养生理的深入研究,依据DON的毒性特点和生物学特征及谷氨酸可能有助于提高采食量、保持肠道完整性及促进蛋白质合成等功能,本研究利用DON刺激断奶仔猪,探讨在饲粮中添加谷氨酸对DON诱导产生的应激损伤的干预作用,为寻求理想的营养学支持提供试验依据。
1 材料与方法
1.1 试验动物与设计
选择28头28日龄的“杜×长×大”三元杂交断奶仔猪,按照随机区组设计分为4组,分别饲喂基础饲粮(NC组)、基础饲粮 +4 mg/kg DON(DON组)、基础饲粮+4 mg/kg DON+2%谷氨酸(DG组)、基础饲粮+2%谷氨酸(Glu组),每组7个重复,每个重复1头猪。试验期为37 d,试验结束时测定仔猪的生长性能、脏器指数、血常规和血清生化指标。
1.2 禾谷镰刀菌(F.graminearum R6576)培养及DON污染饲粮制备
禾谷镰刀菌菌种由华中农业大学提供。选用马铃薯葡萄糖琼脂(PDA)培养基,121℃高压蒸汽灭菌20 min,冷却后在超净工作台接种禾谷镰刀菌菌种,然后置于28℃培养箱中培养5~6 d,待菌丝长好后,接种于羧甲基纤维素酯(CMC)液体培养基中,用接种针将菌丝打碎,1 L三角瓶中加入CMC液体培养基220 mL,于摇床上振荡培养(28 ℃,200 r/min)5 d。
基础饲粮配制参照NRC(1998)猪的营养需要,基础饲粮组成及营养水平见表1。将基础饲粮平铺于室内,厚度适中,然后将处理好的每1 L CMC液体培养基溶液喷洒于25 kg基础饲粮上,搅拌,混匀。处理过程中保持底物含水量均匀且在20%左右,温度28℃左右,处理7 d。将处理好的饲粮与未处理的基础饲粮按1∶1混合均匀。每一次配的饲粮都会在每组饲粮中随机取5个饲粮样品进行毒素含量的测定,调整至饲粮DON含量为4 mg/kg,同时分别按试验设计要求加入谷氨酸。
1.3 饲养管理
仔猪在同一猪舍内饲养,自由采食和饮水,日清圈2次。分组后预试7 d,转入正试期,正试期为37 d。每日观察仔猪采食和健康状况。
1.4 测定指标与方法
1.4.1 生长性能测定
分别在试验开始(第1天)和试验结束(第37天)清晨将仔猪空腹个体称重,并结算各组饲粮消耗,计算仔猪的平均日增重、平均日采食量和料重比。
1.4.2 血清生化指标测定
试验第37天,清晨对空腹仔猪用无菌注射器前腔静脉采血10 mL/头。将血液静置15 min,离心(3 000 r/min,20 min)分离血清,分装于Eppendorf管中,4℃保存,待测。用Beckman公司CX4型全自动血液生化分析仪进行血清中白蛋白(ALB)、GLU、免疫球蛋白 G(IgG)、免疫球蛋白M(IgM)、总蛋白(TP)含量及乳酸脱氢酶(LDH)、碱性磷酸酶(ALP)、谷丙转氨酶(ALT)、谷草转氨酶(AST)和肌酸激酶(CK)活性的测定。
1.4.3 脏器指数测定
试验第37天,将仔猪屠宰后立即打开腹腔,分离肝脏、肾脏、脾脏、心脏、胸腺和胰腺,称重记录数据。
脏器指数(g/kg)=脏器绝对重量/体重。
1.4.4 血常规测定
用血液分析仪(南昌百特HL-2400)进行白细胞数量、淋巴细胞百分比、中间值细胞百分比、中性粒细胞百分比、淋巴细胞绝对值、中间值细胞绝对值、中性粒细胞绝对值、红细胞数量、血红蛋白含量、红细胞比积、平均红细胞体积、平均红细胞血红蛋白含量、平均红细胞血红蛋白浓度、红细胞体积分布宽度、血小板数量、平均血小板体积、血小板压积和血小板分布宽度的测定。
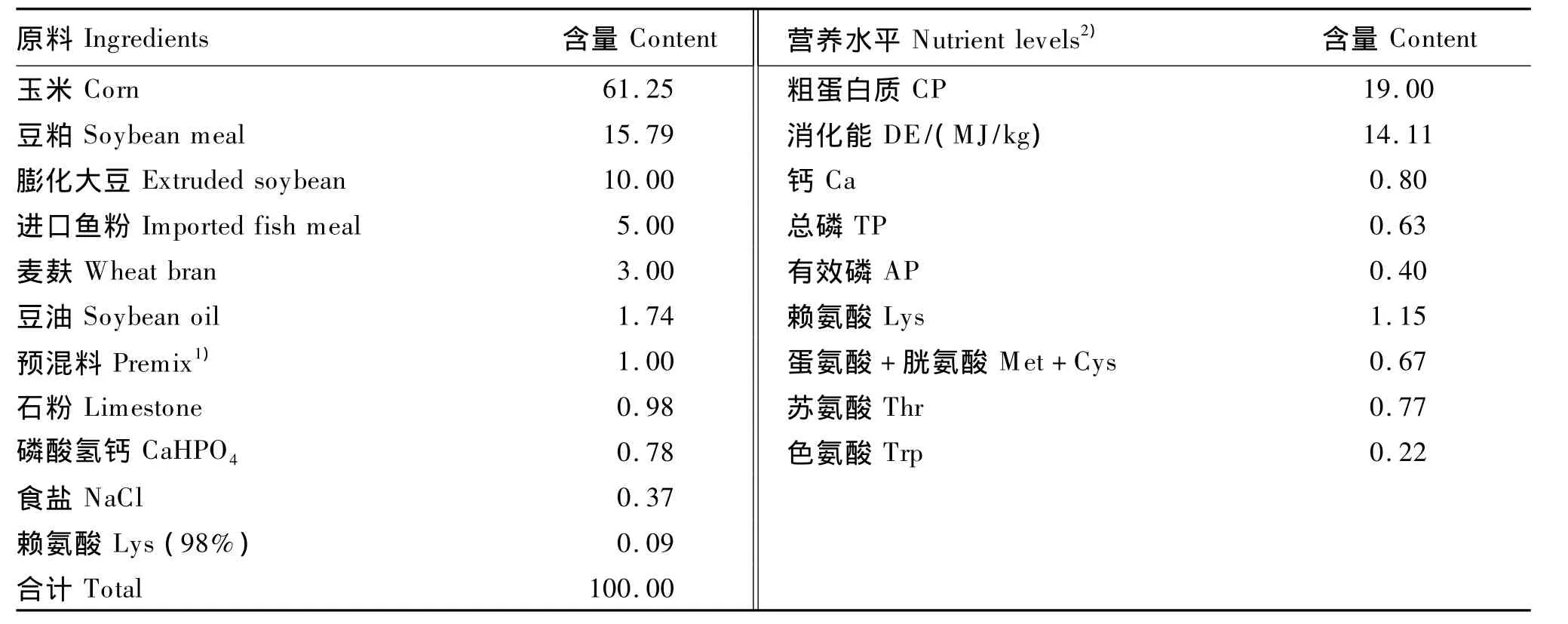
表1 基础饲粮组成及营养水平(干物质基础)Table 1 Composition and nutrient levels of the basal diet(DM basis) %
1.5 统计分析
试验数据采用SPSS 17.0统计软件进行单因素方差分析和Duncan氏多重比较,以P<0.05为差异显著性标准。试验数据以平均值±标准误表示。
2 结果
2.1 谷氨酸对 DON刺激下的断奶仔猪生长性能的影响
由表2可知,与NC组相比较,DON组仔猪料重比显著升高了8.74%(P<0.05),平均日采食量和平均日增重则分别显著下降了6.25%和14.89%(P<0.05);Glu组仔猪料重比显著下降了9.71%(P <0.05),平均日增重显著上升了12.77%(P <0.05)。与 DON 组相比较,DG 组仔猪料重比显著下降了8.93%(P<0.05),平均日增重虽有升高趋势,但差异不显著(P>0.05)。
2.2 谷氨酸对DON刺激下的断奶仔猪血清生化指标的影响
由表3可知,与NC组相比较,DON组仔猪血清中GLU含量及ALT、CK和AST活性显著升高(P <0.05),TP含量显著降低(P <0.05)。与DON组相比较,DG组仔猪血清中GLU含量及CK和AST活性显著降低(P<0.05),TP含量显著升高(P<0.05),ALT活性有降低趋势,但差异不显著(P >0.05)。
2.3 谷氨酸对DON刺激下的断奶仔猪脏器指数的影响
由表4可知,与NC组相比较,DON组仔猪肝脏指数、肾脏指数和胰腺指数分别显著升高了9.43% 、22.68%和 11.56%(P <0.05),脾脏指数则显著降低了19.49%(P<0.05),心脏指数和胸腺指数差异不显著(P>0.05);而Glu组上述6项脏器指数无显著变化(P>0.05)。与DON组相比较,DG组仔猪肝脏指数、肾脏指数和胰腺指数分别显著降低了 10.66%、12.68% 和 11.71%(P <0.05),脾脏指数显著升高了 28.03%(P <0.05)。
2.4 谷氨酸对DON刺激下的断奶仔猪血常规的影响
由表5可知,与NC组相比较,DON组仔猪血液中中性粒细胞百分比、红细胞数量、红细胞比积、血小板数量和平均血小板体积显著降低(P<0.05),白细胞数量、中性粒细胞绝对值和血小板压积有降低趋势,但差异不显著(P>0.05);而Glu组血小板分布宽度显著升高(P<0.05)。与DON组相比较,DG组仔猪血液中红细胞和血小板数量显著升高(P<0.05),白细胞数量、中性粒细胞百分比、中性粒细胞绝对值、红细胞比积和平均血小板体积有升高趋势,但差异不显著(P>0.05)。
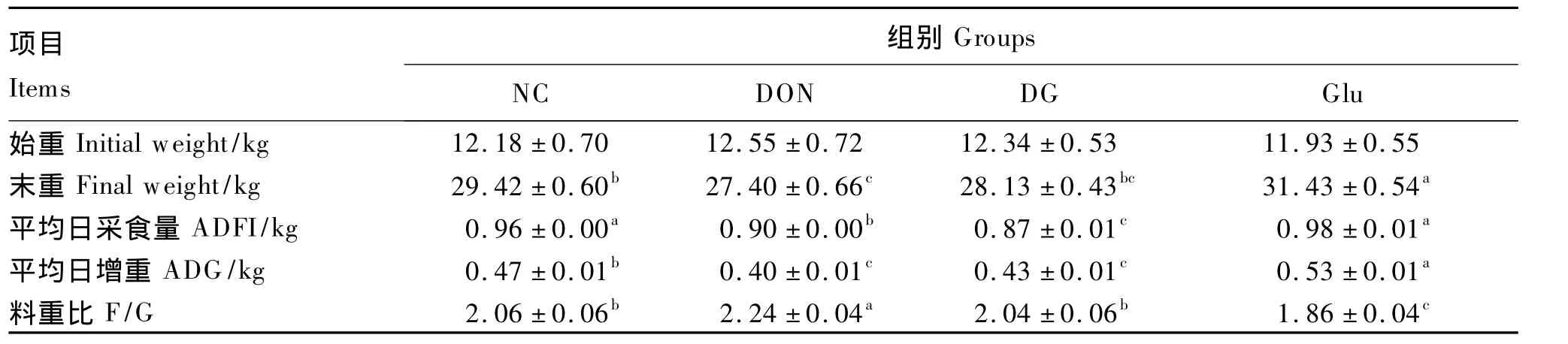
表2 谷氨酸对DON刺激下的断奶仔猪生长性能的影响Table 2 Effects of Glu on growth performance of DON stressed weaner piglets
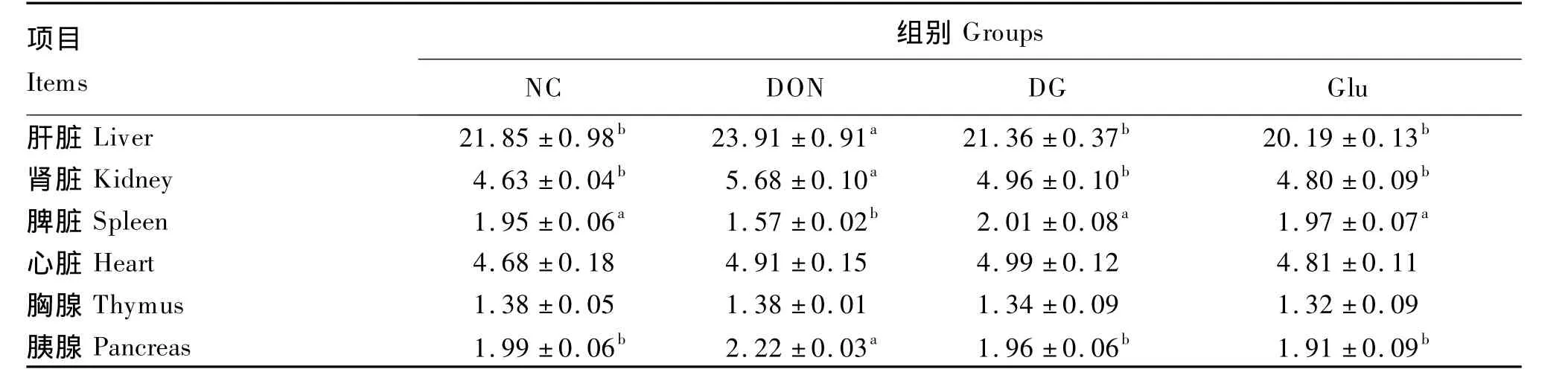
表4 谷氨酸对DON刺激下的断奶仔猪脏器指数的影响Table 4 Effects of Glu on visceral indexes in DON stressed weaner piglets
3 讨论
生理功能完整的肠黏膜对病菌和毒素构成屏障作用,但是在动物肠道屏障受到DON刺激的情况下,小肠绒毛的生长受到抑制,肠壁细胞被溶解发生水肿,消化道黏膜受到强烈刺激反射作用于呕吐中枢导致呕吐,会直接引起营养成分吸收利用和机体免疫力的下降[13]。DON具有很强的细胞毒性,对生长较快的细胞(如胃肠道黏膜细胞、胸腺细胞、骨髓造血细胞、脾细胞等)的生长和凋亡有重要影响。含量为250~500 ng/mL的DON可在脾脏细胞、骨髓细胞和胸腺细胞中潜伏18 h,之后会诱导它们的凋亡[14-15]。谷氨酸作为动物黏膜主要的能源物质之一,可以氧化供能,仔猪摄入的饲粮中谷氨酸50%以上在肠道完全氧化产生的CO2量高于消化道氧化GLU产生的量[9],表明谷氨酸是肠道能量产生的最大贡献者[16],是与肠道黏膜生长和代谢相关的重要氨基酸之一[17],对于仔猪的生长尤为重要。谷氨酸可以作为氨基酸合成的前体物质及其他氨基酸分解或蛋白质从头合成所需要的α-氨基和氨氮的碳前体,对机体维持氮平衡也尤为重要[18]。谷氨酸、半胱氨酸及甘氨酸均为合成谷胱甘肽的底物[19],为动物肠道生长发育提供抗氧化剂。
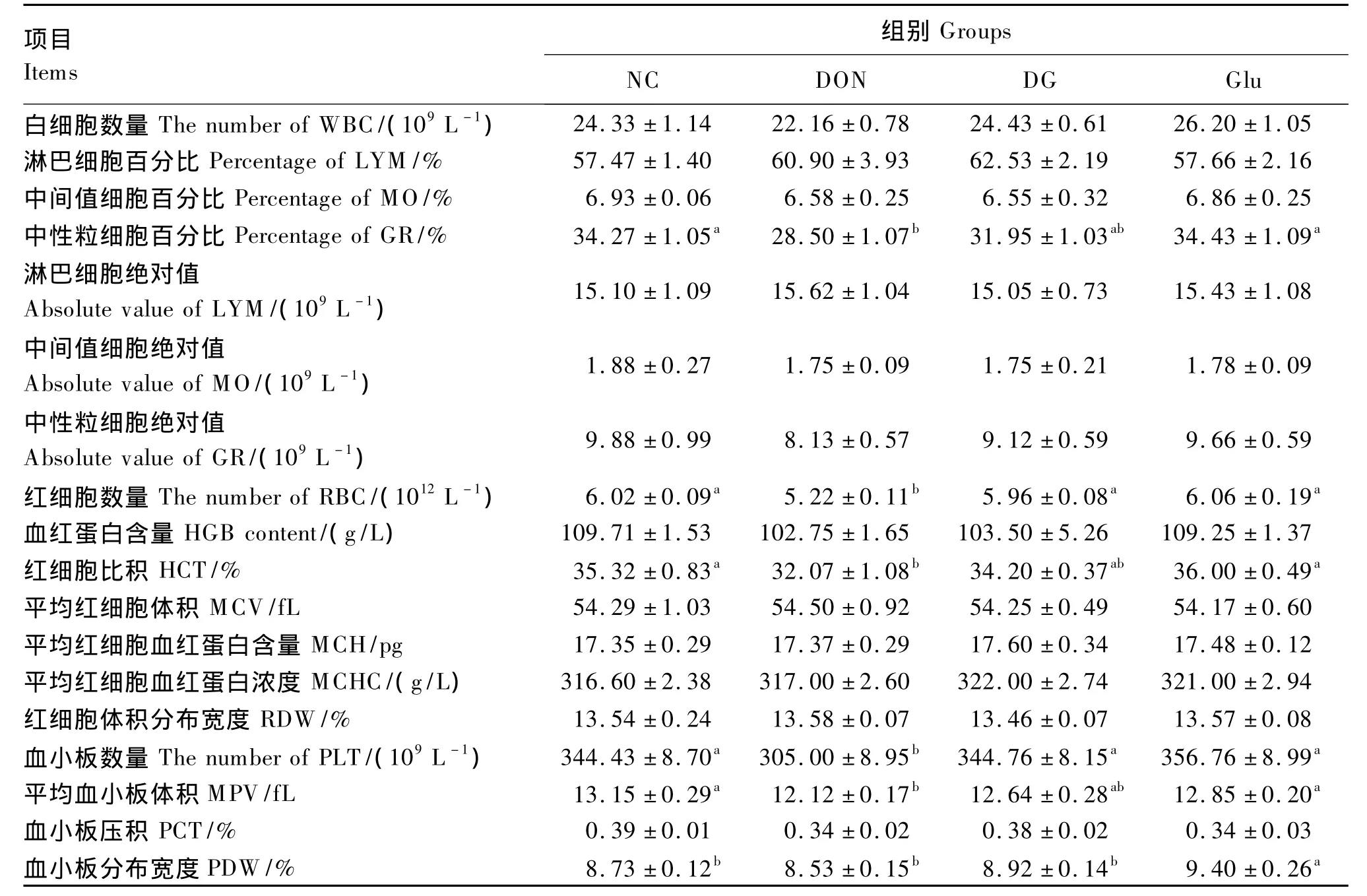
表5 谷氨酸对DON刺激下的断奶仔猪血常规的影响Table 5 Effects of Glu on blood routine in DON stressed weaner piglets
DON通过扰乱大脑血清素的分泌影响食欲,并损伤胃肠道黏膜和绒毛使吸收受阻[20]。在仔猪摄入添加DON饲粮后出现磨牙、嘴角有白色泡沫、采食量降低,且饲料转化率降低,说明仔猪生长缓慢不仅与饲粮摄入减少有关,还应与应激造成营养素的吸收抑制有关。本试验结果表明,添加2%谷氨酸对DON导致的仔猪平均日采食量和平均日增重下降有一定缓解作用,且可显著提高仔猪平均日增重并降低料重比。其可能原因是谷氨酸氧化代谢为肠上皮细胞更新和营养吸收提供了足够的能量[16],有助于缓解仔猪肠道应激从而促进仔猪生长。
脏器指数广泛应用于药物治疗及受试物毒性大小的判断,反映毒物对器官毒性的综合情况。DON可造成机体各器官广泛性损伤。本试验中,脾脏发生萎缩,与李月红等[21]研究结果一致。肝脏、肾脏和胰腺发生代偿性增大,可能是DON激活炎性细胞释放大量细胞因子和炎性介质,使肝脏应激蛋白合成增加。而谷氨酸对肝脏、肾脏、胰腺和脾脏都具有一定保护修复作用。
血清生化指标是反映动物机体生理功能的重要指标,可以作为临床医疗和科学研究的重要依据[22]。血清TP由肝脏合成,是机体蛋白质来源之一,可用于提供能量和修补组织,血清TP含量是反映肝脏合成功能情况的重要指标,在一定程度上代表了饲粮中蛋白质的营养水平及家畜对蛋白质的消化吸收程度。该指标降低通常是动物发生应激反应的指标之一,如鸡在发生热应激时,血清该指标显著下降[23]。本试验结果表明,添加2%谷氨酸对DON导致的血清TP含量的降低有一定的缓解作用,其可能原因是谷氨酸促进了机体蛋白质的合成。正常情况下,细胞内酶(如AST、ALT)的活性由于细胞膜屏障作用的存在而不易逸出,仅因细胞的不断更新和破坏而少量释放入血液。只有当细胞由于各种因素而受到损伤时,细胞膜通透性的升高使其释放入血的速度加快,血清中酶活性显著升高[24]。因此,血液ALT和AST等活性的升高通常是应激反应的一个指标,同时血清ALT和AST活性还可反映肝脏的功能情况。如鸡在发生热应激时,血清中上述酶的活性均显著升高[25]。CK是一种组织特异性酶,动物体发生应激时,该酶活性升高,如猪发生运输应激时,血清中CK活性升高。血清GLU含量与动物的生长性能密切相关,多数动物应激时,血清GLU含量升高。本试验结果表明,添加2%谷氨酸对DON导致的ALT、AST和CK活性及血清GLU含量的升高有一定的缓解作用。这可能是因为谷氨酸作为合成谷胱甘肽的底物之一,为动物体提供抗氧化剂[19],同时能增强肝脏细胞的合成,从而改善肝脏功能。
血常规检测包括对血液中有形成分红细胞、白细胞和血小板这3个系统的质和量进行检测和分析,它是临床上最常见的基础化验检测项目之一。血液对保证机体正常的功能调节、新陈代谢及体内外环境平衡起重要作用,因此血常规检测和分析对了解各种早期病变、疾病性质发生发展及治疗具有一定意义[26]。DON引起的血细胞数量的减少,如对猪进行灌胃DON后24 h内,红细胞、白细胞和血小板数量均低于给药前[27]。本试验结果表明,DON可导致红细胞、血小板数量、红细胞比积和平均血小板体积显著降低,与霍星华等[28]研究结果一致,添加2%谷氨酸对DON导致的骨髓造血功能具有一定的缓解作用。其可能原因是,谷氨酸作为肠黏膜主要能量来源之一,氧化防御底物之一,促进蛋白质合成和细胞的高效更新和增殖[29]。
4 结论
DON刺激可以导致仔猪生长性能下降,脏器指数、血常规及血清生化指标发生变化,而饲粮中添加谷氨酸在提高仔猪生长性能的同时对这一现象有一定的缓解作用。
[1] TUTELYAN C A.Deoxynivalenol in cereals in Russia[J].Toxicology Letters,2004,153(1):173 - 179.
[2] 甄阳光,柏凡,张克英,等.我国主要饲料原料及产品中呕吐毒素污染分布规律研究[J].中国畜牧杂志,2009,45(8):21 -24.
[3] WIJNANDS L M,LEUSDEN VAN F M.An overview of adverse health effects caused by mycotoxins and bioassays for their detection[R].Bilthoven:National Institute of Public Health and Environment,2000.
[4] FRANKIE T,PAJK T,REZAR V,et al.The role of dietary nucleotides in reduction of DNA damage induced by T-2 toxin and deoxynivalenol in chicken leukocytes[J]Food and Chemical Toxicology,2006,44(11):1838-1844.
[5] SWAMY H,SMITH T K,MACDONALD E J,et al.Effects of feeding a blend of grains naturally contaminated with Fusarium mycotoxins on swine performance,brain regional neurochemistry,and serum chemistry and the efficacy of a polymeric glucomannan mycotoxin adsorbent[J].Journal of Animal Science,2002,80:3257 -3267.
[6] 尹杰,伍力,彭智兴,等.脱氧雪腐镰刀菌烯醇的毒性作用及其机理[J].动物营养学报,2012,24(1):48-54.
[7] ROTTER B A,PRELUSKY D B,PESTKA J J.Toxicology of deoxynivalenol(vomitoxin)[J].Journal of Toxicology and Environmental Health,1996,48:1 -34.
[8] WATFORD M.Glutamine metabolism and function in relation to proline synthesis and the safety of glutmine and proline supplementation[J].The Journal of Nutrition,2008,138:2003 -2007.
[9] STROLL B,HENRY J,REEDS P J,et al.Catabolism dominates the first-pass intestinal metabolism of dietary essential amino acids in milk protein-fed piglets[J].The Journal of Nutrition,1998,128:606 - 614
[10] VAN DER SCHOOR S R,VAN GOUDOEVER J B,STOLL B,et al.The pattern of intestinal substrate oxidation is altered by protein restriction in pigs[J].Gastroenterology,2001,121:1167 -1175.
[11] REEDS P J,BURRIN D G,STOLL B,et al.Enteral glutamate is the preferential source for mucosal glutathione synthesis in fed piglets[J].American Journal of Physiology,1997,273:E408 - E415.
[12] YIN F G,JIANG W M,GUAN S,et al.Glutamine and animal immune function[J].Journal of Food Agriculture and Environment,2010,8(3):135 -141.
[13] ACCENSI F,PINTON P,CALLU P,et al.Ingestion of low doses of deoxynivalenol does not affect hematological,biochemical,or immune responses of piglets[J].Journal of Animal Science,2006,84(7):1935 -1942.
[14] UZARSKI R L,ISLAM Z,PESTKA J J.Potentiation of trichothecene-induced leukocyte cytotoxicity and apoptosis by TNF-alpha and Fas activation[J].Chemico-Biological Interactions,2003,146(2):105-119.
[15] LE DREAN G,AUFFRET M,BATINA P,et al.Myelotoxicity of trichothecenes and apoptosis:an in vitro study on human cord blood CD34+hematopoietic progenitor[J].Toxicology in Vitro,2005,19(8):1015 -1024.
[16] REEDS J P,BURRIN G D,STOLL B,et al.Intestinal glutamate metabolism[J].The Journal of Nutrition,2000,130:978 -982.
[17] FAN M Z,MATTHEWS C J,ETIENNE M P N,et al.Expression of apical membrane L-glutmate transporters in neonatal porcine epithelial cells along the small intestinal crypt-villus axis[J].American Journal of Physiology Gastrointestinal Liver Physiology,2004,287:G385 - G398.
[18] GILL S,PULIDO O.Glutamate receptors in peripheral tissue:excitatory transmission outside the CNS[M].London:Kluwer Academic/Plenum Publishers,2005:47-48.
[19] AOYAMA K,WATABE M,NAKAKI T.Rugulation of neuronal glutathione synthesis[J].Journal of Pharmacology Science,2008,108:227 -238.
[20] PRELUSKY D B.The effect of deoxynivalenol on serotoninergic neurotransmitter levels in pig blood[J].Journal of Environmental Science and Health,1994,29(6):1203-1218.
[21] 李月红,张祥宏,王俊灵,等.脱氧雪腐镰刀菌烯醇对小鼠胸腺细胞凋亡和增殖的影响[J].中国病理生理杂志,2002,18(7):778 -781.
[22] 伍力,耿梅梅,王文策,等.哺乳藏仔猪发育期血液生化指标动态变化规律研究[J].西南农业学报,2010,23(2):570 -575.
[23] STANG I R,SZIJARTO A,ONODY P,et al.Reduction of liver ischemia/reperfusion injury via glutamine pretreatment[J].Journal of Surgical Research,2011,166(1):95-103.
[24] 赵聘,赵云焕.复合抗热应激添加剂对蛋鸡血液生化指标的影响[J].河南农业科学,2005,2:70 -73.
[25] 何世山,金小军.高温对肉鸡血液生化指标的影响[J].浙江大学学报:农业与生命科学版,2003,29(3):311-314.
[26] 张宇.血常规检测的临床意义[J].中国医药指南,2012,17:390 -391.
[27] 赵青,何敏,剡海阔,等.呕吐毒素不同给药方式对猪血常规指标的影响[J].中国畜牧兽医,2010,37(4):47-50.
[28] 霍星华,赵宝万,万学攀,等.脱氧雪腐镰刀菌烯醇的毒性研究进展[J].毒理学杂志,2008,22(2):151-154.
[29] WU G,KNABE D A,FLYNN N E.Biology of metabolism in growing animals[M].Oxford:Elsevier Science Ltd,2005.
