凋落物和增温联合作用对峨眉冷杉幼苗抗氧化特征的影响
2013-12-19王根绪郭剑英羊留冬
杨 阳,杨 燕 ,王根绪,郭剑英,3,羊留冬
(1.中国科学院水利部成都山地灾害与环境研究所山地环境演变与调控重点实验室,成都 610041;2.中国科学院研究生院,北京 100049;3.乐山师范学院旅游与经济管理学院,乐山 614004)
以全球变暖为主要特征的全球气候变化已经改变并正在继续改变着陆地生态系统的结构和功能,并间接威胁着人类的生存与健康,因而备受世界各国政府和科学家的普遍关注[1]。大量的监测和模拟研究结果表明,20世纪开始的全球温室效应正在不断的扩大,地球表面平均温度在过去的100a中已上升了0.6℃。政府间气候变化专门委员会(IPCC)第4次评估报告预测到21世纪末,全球平均气温将升高1.8—4.0℃[2]。气候变暖导致气温和土壤温度升高,从而直接或间接地影响了植物的生长、生物量分配格局、气孔密度甚至光合和蒸腾作用[3-6],进而引起群落结构的强烈变化[4]。与此同时,植物体内部生理特征也会对增温产生响应。对云杉幼苗的研究发现,增温能引起丙二醛含量、过氧化氢浓度和超氧阴离子自由基产生速率降低,增加超氧化物歧化酶和过氧化物酶活性[7]。也有研究发现随着温度的升高,植物叶片中的可溶性糖含量和超氧化物歧化酶活性先增加后降低,而淀粉含量和谷胱甘肽酶活性先降低后增加[8]。这些研究大多是实验室或温室控制条件下开展的模拟增温试验,而在野外自然条件下构建增温对亚高山典型针叶林优势物种幼苗早期生长和生理影响的研究则较少[9]。
幼苗作为森林更新的重要物质基础,是森林更新成功与否的关键。凋落物对森林更新早期阶段具有重要意义,它通过各种直接或间接的作用影响着幼苗生长。直接的物理障碍增加幼苗的损伤和死亡[10],间接地通过降解产生的营养物质增加土壤肥力、减少凋落物覆盖缓解非生物条件产生的胁迫,从而促进幼苗生长,增加幼苗存活率[11-12]。这些研究大多集中在凋落物单独效应下植物的形态和理化特征的响应,而忽略了气候变暖背景下不同物种组成森林凋落物对幼苗早期生长的影响[13-14]。
峨眉冷杉林是青藏高原亚高山暗针叶林的重要组成部分,其森林更新的早期阶段是关系到这一地区针叶林群落成功演替与否的关键环节,并对气候变化十分敏感。近年来,有研究表明小于20a的峨眉冷杉林更新幼苗数量少,呈现中幼林比例下降等更新能力明显衰退现象[15],而该针叶林林下生长的密集灌丛,使林下凋落物盖度大而厚,给森林更新带来极大的困难,是限制森林早期更新的主要因素之一[16]。随着近年来青藏高原气候变暖趋势的持续增强[17],不仅凋落物的量和类型及其时空分布将受到显著影响,而且凋落物的质量和化学特性将发生明显变化[18-19]。在这种情况下,一个亟需解决的关键科学问题是:气温升高及其驱动的凋落物的上述变化对森林更新早期阶段的幼苗建成产生何种影响?针对这一问题,本研究通过模拟气候变暖和不同类型凋落物的联合作用,阐明亚高山典型针叶林峨眉冷杉早期更新对气候变暖与凋落物变化联合作用的响应模式,并探索其内在机制,以丰富山地生态系统应对未来气候变暖的全面认识,并且为当地森林管理和保育提供科学依据。
1 材料和方法
1.1 研究区域概括
贡嘎山位于青藏高原东缘,横断山系中段,属青藏高原与四川盆地过渡带,地理位置介于101°30'—102°15'E和29°20'—30°20'N,主峰海拔7556 m。试验地设置在中国科学院贡嘎山高山生态系统观测试验站附近(3000 m),研究区域的年平均温度3.8℃,平均降水量1940.0 mm,主要集中在6—8月。年均蒸散量1578.6 mm,相对空气湿度90.2%。
1.2 实验材料与设计
选择贡嘎山高山生态系统观测站附近峨眉冷杉林下微环境较一致的100 m×100 m样地,利用开顶式气室(OTCs)和加热电缆联合方法模拟气候变暖,该OTCs为六边形,8 mm厚的有机玻璃纤维制成的增温小室,基面积为2.6 m2,顶部面积为1.27 m2,高度为0.52 m。功率为18 W/m,长为16 m,总功率为288 W的加热电缆缠绕在直径约为3.5 m、长度2.5 m的PVC管上,然后将其固定于OTC内,固定位置离地面约15—20 cm,离OTC内壁约10—20 cm。利用空气和土壤温湿度传感器分别对框内外的空气温度和湿度、土壤湿度进行自动连续的检测。与对照相比,空气温度平均增加约为2.9℃,土壤温度平均增加1.8℃。取地表新鲜凋落物人工添加于各试验样方内,其厚度约为223 g/m2[20]。
本实验供试的材料来自于峨眉山苗圃(29°36'N,103°29'E,海拔3099 m)3年生峨眉冷杉幼苗,2009年5月上旬选择健康一致的幼苗移栽于样地内。为了避免框边边缘效应,OTCs增温小室只选取中心1 m2样方内,且对照和处理样方内幼苗数保持一致以尽可能保证相同的移栽密度,株距均为25 cm,每个样方内共25株冷杉幼苗。对照和处理均设置3个重复,每个重复之间间隔3—5 m。
1.3 样品处理与化学分析方法
2010年7月在每个试验小区里随机取多株冷杉幼苗,用剪刀剪取当年新生叶5—6 g左右,锡箔纸包裹并标记处理编号,冷藏于-80℃液氮罐带回实验室分析。每个生理指标重复3次,一个星期内完成测试工作。
1.3.1 超氧阴离子自由基产生速率的测定(O-2)和过氧化氢(H2O2)的含量
超氧阴离子自由基产生速率参考Ke等[21]的方法,取叶片0.2000 g,加入1.5 mL的50 mmol/L pH值7.8磷酸缓冲液(含有0.1 mmol/LEDTA;0.3%(g/mL)TritonX-10;4%(g/mL)聚乙烯比个(PVP)),研磨后以10500×g离心20 min。取1 mL上清液为提取液,依次加入0.5 mL 50 mmol/L磷酸缓冲液(pH值7.8),1 mL 1 mmol/L盐酸羟胺,摇匀,于25℃中保温1 h,然后再加入1 mL 17 mmol/L对氨基苯磺酸和1 mL 7 mmol/La-萘胺混合,于25℃中保温20 min,然后在可见光分光度计测定OD530。根据测得的OD530,查NO-2标准曲线,可求得产生速率。
参考Prochazkova等[22]的方法。准确称取0.2000 g冷杉新生叶于6 mL 5%三氯乙酸中研磨成匀浆。在10000×g室温下离心10 min。取上清液1 mL加入0.1 mL 20%TiCl4的浓盐酸液,再加入0.2 mL浓氨水,摇匀。在10000×g室温下离心10 min。沉淀用3 mL 1 mmol/L硫酸充分溶解后,置紫外可见光分光光度计上测定415 nm吸光值。
1.3.2 丙二醛(malondialdehyde(MDA))含量和膜透性的测定(电导率的测定)
参考 Dhinsa 和 Matowe[23]的方法。
利用公式CMDA(nmol/L)={(A532-A600)-0.0571×(A450-A600)}/0.155计算MDA量(排除多糖干扰),用每克干(鲜)重中MDA的量表示MDA的含量,单位μmol/L干(鲜)重或nmol/L干(鲜)重。
膜的稳定性可以间接由电子的渗透量来计算[24]。准确称取0.2000 g冷杉新生叶,加入10 mL无离子水,在10℃下振荡2—4 h。测电导率C1,然后将材料煮沸,冷却到室温在测电导率C2。计算膜相对透性的公式:电导率(%)=C1/C2×100。
1.3.3 碳水化合物和游离脯氨酸的测定
参考可溶性糖类用蒽酮法测定[25],用蔗糖作为标准曲线。在可见光光度计读取630 nm波长下的吸光值。同时提取可溶性糖后的残渣,用可溶性糖测定的方法来测定淀粉含量[25]。
游离脯氨酸含量的测定参考Bates等[26]的方法。准确称取0.2000 g冷杉新生叶,用5 mL 3%磺基水杨酸溶液研磨提取,匀浆以1000×g离心10 min。取上清液2 mL加入2 mL 3%磺基水杨酸,2 mL冰乙酸和4 mL 2.5%茚三酮,置于沸水浴中显色分钟。冷却,加入3 mL甲苯。520 nm波长处的吸光值,以甲苯为空白。
1.3.4 抗氧化酶活性
准确称取0.2000 g冷杉新生叶放入预先冷却的研钵里,加入6 mL的50 mmol/L磷酸缓冲液(内含0.1 mmol/LEDTA,体积分数0.3%TritonX-100,4%(g/mL)不溶性聚乙烯吡咯烷酮(PVP))中研磨成匀浆。以1000×g离心10 min。收集上清液用于SOD、APX、CAT、GR活性测定。
(1)超氧歧化酶(superoxide dismutase(SOD))活性的测定依照Becana等[27]等的方法,取上清液加入100 μL 加入3 mL 反应液(内含 50 mmol/L 甲硫氨酸(Met)、750 μmol/LNBT、0.1 mmol/LEDTA、20 μmol/L 核黄素),放在光照条件下30 min。最后在可见光光度计读取560 nm波长下的吸光值。SOD活性以每mg蛋白抑制NBT光化还原的50%为一个酶活性单位U[28]。
(2)抗坏血酸过氧化物氢酶(ascorbate peroxidase(APX))参照Nakano和Asada[29]的方法。取上清液1 mL加入3 mL酶反应液(50 mmol/L磷酸缓冲液、1 mmol/L抗坏血酸、2.5 mmol/LH2O2)。最后在290 nm处OD值在0.5 min或1 min内的变化,逐渐变小(消光系数为2.8 mmol·L-1·cm-1)。
(3)过氧化氢酶(catalase(CAT))利用CAT的促进H2O2分解,使反应体系在240 nm(40 L mmol-1cm-1)处吸光光度值减小的原理测定该酶的活性[30]。酶活性测定的反应体系为含有10 mmol/LH2O2的50 mmol/L磷酸缓冲液(pH值7.0)。紫外可见分光光度计读取240 nm处吸光光度值在3 min内每15 s的变化。酶活性以每秒每毫克蛋白分解H2O2的微摩尔数表示,单位μmol H2O2/minmg蛋白。
(4)过氧化物酶(peroxidase(POD))依照Ekmekci和Terzioglu[31]的方法,反应体系包括20 mmol/L醋酸钠缓冲液(pH值5.0)、1%邻联茴香胺(o-2dianisidine,先溶于甲醇中)、30 mmol/LH2O2和适当酶液,测定在460 nm吸光度增加值(消光系数为11.3 mmol·L-1·cm-1)。
(5)谷胱甘肽(glutathione(GR))参考Sgherri等[32]的方法,反应混合物为50 mmol/L磷酸盐缓冲液(pH值7.0)、1 mmol/LGSH、0.15 mmol/LNADPH、0.24 单位谷胱甘肽还原酶(GR EC1.6.4.2)、0.1 mmol/LH2O2和酶提取液,加入H2O2启动反应,测定在340 nm下NADPH氧化量(消光系数为6.22 mmol·L-1·cm-1)。
1.4 数据分析
所有试验数据采用SPPSS软件(SPSS16.0 for windows)进行ANOVA分析,Duncan'test法检验相应不同处理间各参数在置信区间(P<0.05)水平上的差异显著性。
2 研究结果
2.1 电导率、丙二醛和脯氨酸
在B型凋落物情景下,增温处理显著降低了冷杉幼苗丙二醛和自由脯氨酸含量(表1,P<0.05)。在A型凋落物情景下,增温处理显著增加了冷杉幼苗叶片的自由脯氨酸含量。可见,与A型凋落物相比,B型凋落物处理下的冷杉幼苗受增温引起的膜质伤害更低,渗透调节影响小。在环境温度情景下,B型凋落物处理下冷杉幼苗的脯氨酸含量显著高于A型凋落物。而当凋落物与增温联合情景下,B-T处理使冷杉幼苗的脯氨酸含量显著低于A-T处理,说明在温度增加的情景下,B型凋落物能及时使用其高的渗透调节物质改善冷杉幼苗受到的膜伤害。
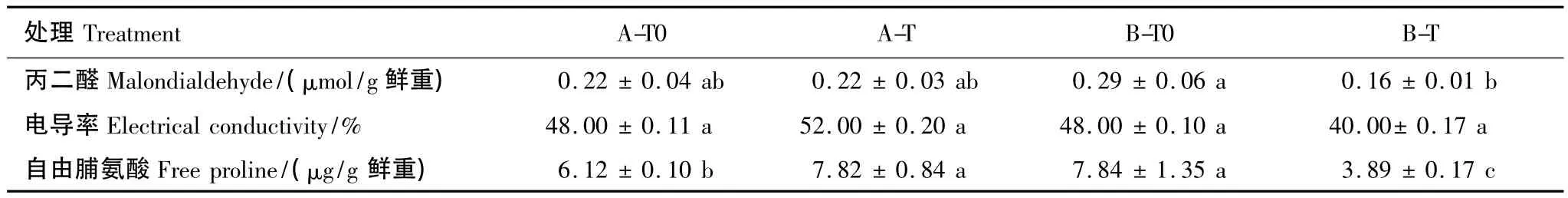
表1 不同类型凋落物和增温处理下峨眉冷杉幼苗的电导率、丙二醛和自由脯氨酸含量Table 1 The contents of malondialdehyde,electrolyte leakage and free proline in A.fabri needles under two types of litter additional and temperature enhancement
2.2 过氧化氢浓度和超氧阴离子自由基产生速率
在A型凋落物情景下,增温显著增加了过氧化氢浓度(图1,P<0.05);在B型凋落物情景下,增温显著增加了超氧阴离子自由基产生速率(图2,P<0.05)。在环境温度情景下,凋落物的类型对过氧化氢和超氧阴离子自由基的产生速率均没有影响。而当增温与凋落物联合下,B-T处理使峨眉冷杉幼苗的过氧化氢含量显著低于A-T处理。可见,在温度增加的情景下,B型凋落物处理使冷杉幼苗遭受的氧化伤害显著低于A型凋落物的氧化伤害。
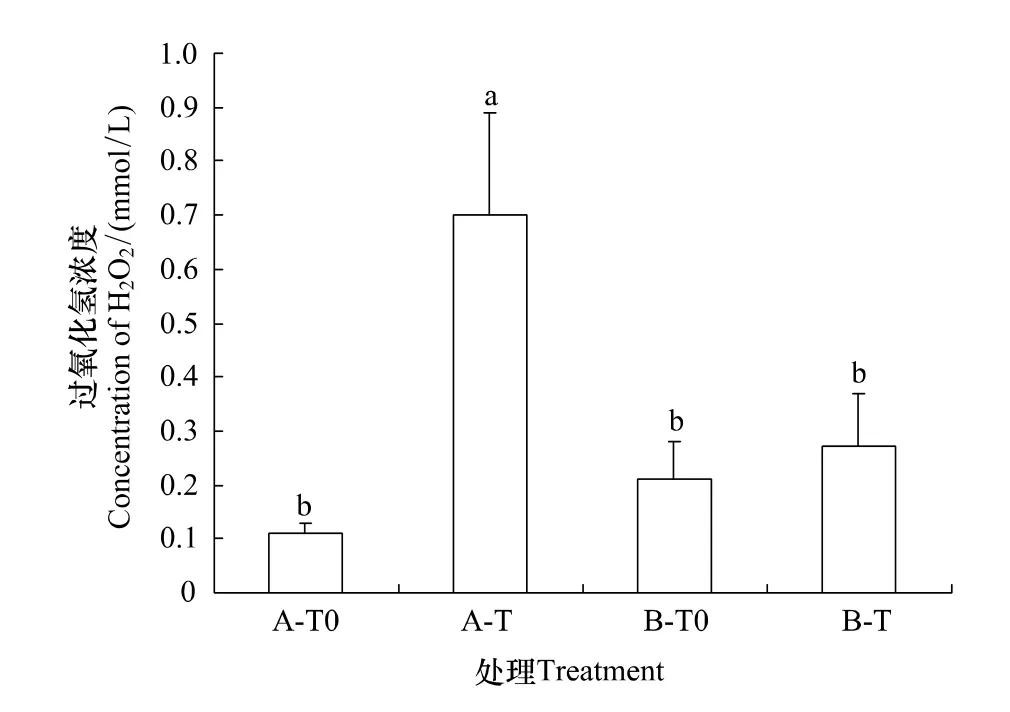
图1 不同类型凋落物和增温处理下峨眉冷杉幼苗的过氧化氢的浓度Fig.1 The concentration of H2O2in of A.fabri needles under two types of litters and temperature enhancement
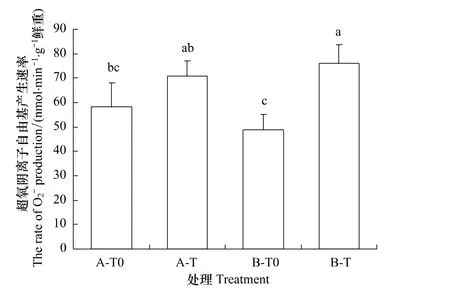
图2 不同类型凋落物和增温处理下峨眉冷杉幼苗的超氧阴离子自由基(O-2)产生速率Fig.2 The rate of O-2production in A.fabri needles under two types of litters and temperature enhancement
2.3 非结构性碳水化合物
在A型凋落物情景下,增温没有引起峨眉冷杉幼苗可溶性糖和淀粉含量的变化;然而,在B型凋落物情景下,增温却显著降低了幼苗中可溶性糖和淀粉含量(图3和图4,P<0.05)。
2.4 抗氧化酶活性
在凋落物存在情景下,增温均显著降低了超氧化物歧化酶(SOD)活性,然而增温却增加了过氧化物酶(POD)活性,抗坏血酸过氧化物氢酶(APX)和过氧化氢酶(CAT)活性未受到影响。其中,A型凋落物情景下,与环境温度相比,增温导致峨眉冷杉叶片SOD活性降低了40.24%,POD活性增加了257.89%;B型凋落物情景下,增温导致SOD活性降低了69.73%,POD活性增加了87.5%。可见,增温引起A型凋落物处理下冷杉叶片的SOD和POD活性改变而造成不利伤害,其伤害远远大于B型凋落物。此外,在A型凋落物情景下,增温导致谷胱甘肽酶活性降低了68.35%,在B型凋落物情景下,却增加了GR活性179.09%,差异显著(表2,P<0.05)。本研究结果显示增温对B型凋落物处理下幼苗的酶活性影响更大。
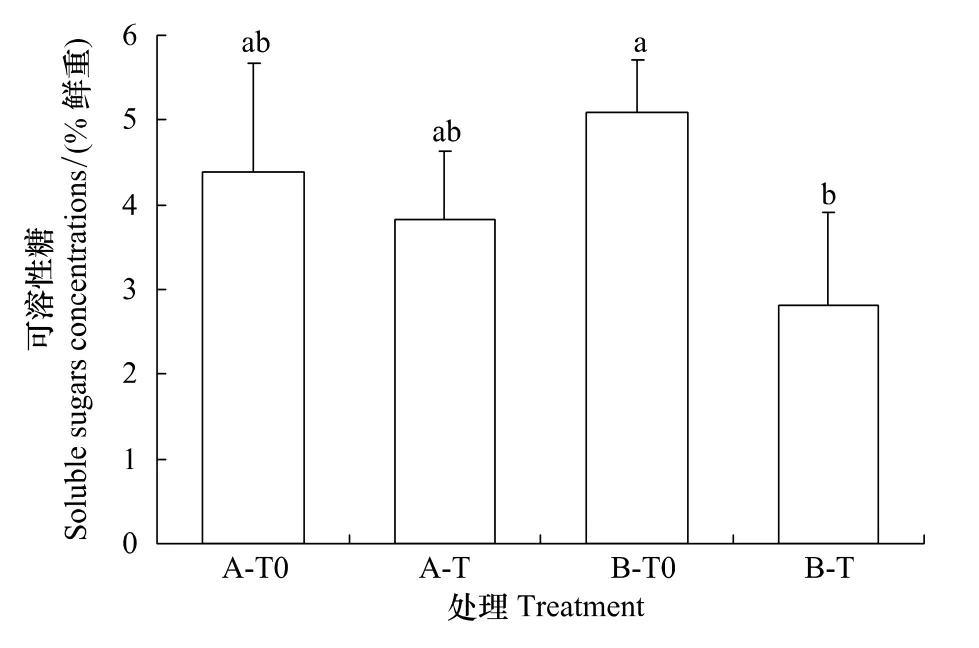
图3 不同类型凋落物和增温处理下峨眉冷杉幼苗的可溶性糖的含量Fig.3 Soluble sugars concentrations of A.fabri seedlings subjected to two types oflittersaddition and temperature enhancement
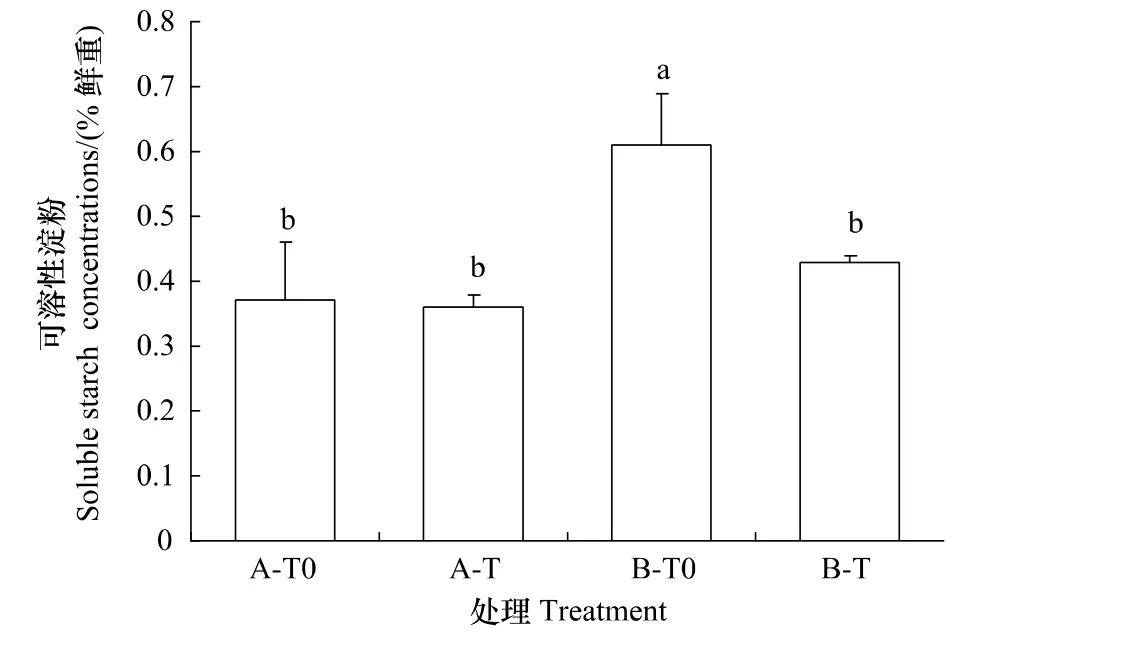
图4 不同类型凋落物和增温处理下峨眉冷杉幼苗的淀粉的含量Fig.4 Soluble starch concentrations of A.fabri seedlings subjected to two types oflittersaddition and temperature enhancement

表2 不同类型凋落物和增温处理下峨眉冷杉幼苗的抗氧化酶活性Table 2 The effects of two types of litter additional and temperature enhancement on the activities of antioxidant enzymes in A.fabri seedlings
3 讨论
植物器官在逆境下易遭受伤害,丙二醛能抑制细胞保护酶活性和降低抗氧化物的含量,从而加剧膜脂过氧化,其含量可以反映植物遭受逆境伤害的程度[33]。而相对电导率的变化可以反映植物细胞膜的伤害程度,是衡量树木抗逆性大小的重要指标之一。增温导致B型凋落物处理下冷杉叶片的丙二醛含量降低,显示出这一处理下植物受到相对低的氧化伤害。这可能是由于B-T处理下冷杉叶片中的抗坏血酸(APX)、谷胱甘肽(GR)、过氧化氢酶(CAT)活性相对较高,植物保护酶产生的一种防御反应,清除活性氧和自由基的能力增强,植物体内的丙二醛含量下降,降低细胞膜脂氧化,电解质渗透也减少。此外,B-T处理下的脯氨酸含量显著低于A-T处理,也说明其受到的氧化伤害低于A型凋落物处理。另一方面,环境温度下,B型凋落物处理下冷杉叶片比A型凋落物处理下具有更高的脯氨酸含量,而当赋予增温联合作用时,B-T处理却显示出显著低于A-T处理的脯氨酸含量,这一结果说明增温与B型凋落物发生了协同作用,其氧化伤害降低,有利于对冷杉幼苗的生长。
在正常情况下,细胞内的活性氧处于一个较低的水平,当植物受到外界胁迫时,细胞内会产生大量的活性氧,并引起膜脂氧化伤害,而植物体会对此伤害自动产生抗氧化酶以降低活性氧活性,以抵御氧化伤害。目前的研究结果显示,与环境温度相比,增温显著增加了A型凋落物处理下冷杉叶片的过氧化氢浓度和B型凋落物处理下叶片的超氧阴离子自由基产生速率,说明增温造成了峨眉冷杉叶片的活性氧含量升高。与此同时,增温引起的POD和GR活性显著增加可能抵御增温导致的氧化伤害。而在环境温度下,A和B两种类型凋落物处理下的过氧化氢浓度和超氧阴离子自由基产生速率没有差异。很明显,在环境温度情景下,A和B两种类型凋落物对冷杉并未造成氧化伤害,而当赋予其环境温度增加时,B-T处理显示出低于A-T处理的氧化伤害。这一结果与抗氧化酶活性结果一致。在环境温度情景下,SOD、POD、APX和CAT活性在A、B型两种类型的凋落物处理下没有差异,而当赋予这两种凋落物处理下的幼苗环境温度增加时,B型比A型处理下幼苗具有更高的APX、GR、和CAT抗氧化酶活性,这一结果,也显示出B型凋落物更有利于冷杉幼苗应对气温升高引起的氧化伤害。
可溶性糖和淀粉的积累是植物对胁迫的一种适应机制,它对细胞膜和原生质胶体有稳定作用,在细胞内无机离子浓度过高时起到保护酶类的作用[34]。本研究结果显示,在环境温度时,B型凋落物处理下冷杉幼苗的淀粉含量高于A型凋落物处理(图4)。更高的淀粉含量说明植物体产生了更多的光合产物[35],有利于生长。在凋落物情景下,增温均显著降低了冷杉幼苗可溶性糖和淀粉的含量。这可能是由于淀粉能参与渗透调节,转化为植物自身的结构,从而引起含量降低[8];当升高的温度会增加植物叶片蒸腾速率,植物为了防止干旱胁迫,降低其可溶性糖含量以降低植物水势[36]。
综上所述,本研究结果显示在气候变暖的情景下,B型凋落物比A型凋落物覆盖下的峨眉冷杉幼苗具有更高的适应温度增高引起的生理生态特征改变的能力。Cornelissen[37]等将不同功能型植被凋落物混合后,研究发现落叶植物叶片的分解速率高于常绿植物叶片。A型凋落物含有75%的常绿冷杉针叶和25%落叶灌木叶,而B型凋落物含有55%常绿冷杉针叶和45%落叶灌木叶,二者物种组成差异导致了不同的分解速率,同时增温也可能加快了凋落物的分解[38]。可见,增温环境下的B型凋落物具有更高的分解速率,更有利于养分的释放和微生物的活动[18],因而更有利于植物应对未来气候变暖的环境。本研究结果对丰富高海拔地区森林更新动态和揭示全球变暖下陆地生态系统的反馈机制具有至关重要的作用。
[1] Oreskes N.The scientific consensus on climate change.Science,2004,306(5702):1686-1686.
[2] IPCC(Intergovernmental Panel on Climate Change).Climate Change 2007:Mitigation of Climate Change∥Metz B,Davidson O R,Bosch P R,Dave R,Meyer L A,eds.Contribution of Working Group III to the Fourth Assessment Report of the Intergovernmental Panel on Climate Change.Cambridge,Cambridge University Press,2007:416-416.
[3] Aerts R,Cornelissen J H C,Dorrepaal E.Plant performance in a warmer world:general responses of plants from cold,northern biomes and the importance of winter and spring events.Plant Ecology,2006,182(1/2):65-77.
[4] Li N,Wang G X,Yang Y,Gao Y H,Liu L A,Liu G S.Short-term effects of temperature enhancement on community structure and biomass of alpine meadow in the Qinghai-Tibet Plateau.Acta Ecologica Sinica,2011,31(4):895-905.
[5] Xu Z F,Hu T X,Zhang L,Zhang Y B,Xian J R,Wang K Y.Short-term gas exchange responses of Betula utilis to simulated global warming in a timberline ecotone,eastern Tibetan Plateau,China.Chinese Journal of Plant Ecology,2010,34(3):263-270.
[6] Zhang L R,Niu H S,Wang S P,Li Y N,Zhao X Q.Effects of temperature increase and grazing on stomatal density and length of four alpineKobresia meadow species,Qinghai Tibetan Plateau.Acta Ecologica Sinica,2010,30(24):6961-6969.
[7] Han C,Liu Q,Yang Y.Short-term effects of experimental warming and enhanced ultraviolet-B radiation on photosynthesis and antioxidant defense of Picea asperata seedlings.Plant Growth Regulation,2009,58(2):153-162.
[8] Ren F,Zhou H K,Zhao X Q,Han F,Shi L N,Duan J C,Zhao J Z.Influence of simulated warming using OTC on physiological-biochemical characteristics of Elymus nutans in alpine meadow on Qinghai-Tibetan plateau.Acta Ecologica Sinica,2010,30(3):166-171.
[9] Lloret F,Peñuelas J,Estiarte M.Experimental evidence of reduced diversity of seedlings due to climate modification in a Mediterranean-type community.Global Change Biology,2004,10(2):248-258.
[10] Facelli J M,Pickett S T A.Plant litter:its dynamics and effects on plant community structure.Botanical Review,1991,57(1):1-32.
[11] Brearley F Q,Press M C,Scholes J D.Nutrients obtained from leaf litter can improve the growth of dipterocarp seedlings.New Phytologist,2003,160(1):101-110.
[12] Sayer E J.Using experimental manipulation to assess the roles of leaf litter in the functioning of forest ecosystems.Biological Reviews,2006,81(1):1-31.
[13] Rinnana R,Michelsenb A,Jonasson S.Effects of litter addition and warming on soil carbon,nutrient pools and microbial communities in a subarctic heath ecosystem.Applied Soil Ecology,2008,39(3):271-281.
[14] Linares J C,Camarero J J,Carreira J A.Interacting effects of changes in climate and forest cover on mortality and growth of the southernmost European fir forests.Global Ecology and Biogeography,2009,18(4):485-497.
[15] Gao J R,Zhang D S,Niu J Z,Yu X X,Zhang W J.Structural characteristics of Abies fabri forests at the upper reach of Yangtze River.Chinese Journal of Applied Ecology,2003,14(1):20-24.
[16] Liu Z G,Yin K P,Yang Q X,Chen Q H.The Vegetation of Gongga mountain.Chengdu:Sichuan Science and Technology-University Press,1985:36-38.
[17] Giorgi F,Christensen J,Hulme M,von Storchm H,Whetton P,Jones R,Mearns L,Fu C,Arritt R,Bates B,Benestad R,Boer G,Buishand A,Castro M,Chen D,Cramer W,Crane R,Crossly J,Dehn M,Dethloff Klaus,Dippner J,Emori S,Francisco R,Fyfe J,Gerstengarbe F,Gutowski W,Gyalistras D,Hanssen-Bauer I,Hantel M,Hassell D,Heimann D,Jack C,Jacobeit J,Kato H,Katz R,Kauker Frank,Knutson T,Lal M,Landsea C,Laprise R,Leung L,Lynch A,May W,McGregor J,Miller N,Murphy J,Ribalaygua J,Rinke Annette,Rummukainen M,Semazzi,F,Walsh K,Werner P,Widmann M,Wilby R,Wild M,Xue Y.Regional climate information:evaluation and projections//Climate Change 2001:The Scientific Basis-Contribution of Working Group I to the Third IPCC Assessment Report.Cambridge:Cambridge University Press,2001:583-638.
[18] Aerts R.The freezer defrosting:global warming and litter decomposition rates in cold biomes.Journal of Ecology,2006,94(4):713-724.
[19] Cornelissen J H C,van Bodegom P M,Aerts R,Callaghan T V,van Logtestijn R S P,Alatalo J,Chapin F S,Gerdol R,Gudmundsson J,Gwynn-Jones D,Hartley A E,Hik D S,Hofgaard A,Jónsdóttir I S,Karlsson S,Klein J A,Laundre J,Magnusson B,Michelsen A,Molau U,Onipchenko V G,Quested H M,Sandvik S M,Schmidt I K,Shaver G R,Solheim B,Soudzilovskaia N A,Stenström A,Tolvanen A,Totland Ø,Wada N,Welker J M,Zhao X,Team M O L.Global negative vegetation feedback to climate warming responses of leaf litter decomposition rates in cold biomes.Ecology Letter,2007,10(7):19-627.
[20] Yang L D,Wang G X,Yang Y,Cao Y,Li W,Guo J Y.Dynamics of litter fall in Abies fabric mature forest at Gongga Mountain.Acta Agiculturae Uiversitatis Jiangxiensis,2010,32(6):1163-1167.
[21] de Ke S,Wang A G,Sun G C,Dong L F.The effect of active oxygen on the activity of ACC synthase induced by exogenous IAA.Acta Botanica Sinica,2002,44(5):551-556.
[22] Prochazkova D,Sairam R K,Srivastava G C,Singh D V.Oxidative stress and antioxidant activity as the basis of senescence in maize leaves.Plant Science,2001,161(4):765-771.
[23] Dhinsa R,Matowe W.Drought tolerance in two mosses:correlated with enzymatic defence against lipid peroxidation.Journal of Experimental Botany,1981,32(1):79-91.
[24] Shanahan J F,Edwards I B,Quick J S,Fenwick J R.Membrane thermostability and heat tolerance of spring wheat.Crop Science,1990,30(2):247-251.
[25] Li H S.Principles and Techniques of Plant Physiology and Biochemistry Experiments.Beijing:Higher Education Press,2000.
[26] Bates L S,Waldren R P,Teare I D.Rapid determination of free proline for water stress studies.Plant and Soil,1973,39(1):205-207.
[27] Becana M,Aparicio-Tejo P,Irigoyen J J,Sanchez-Diaz M.Some enzymes of hydrogen peroxide metabolism in leaves and root nodules of Medicago sativa.Plant Physiology,1986,82(4):1169-1171.
[28] Costa H,Gallego S M,Tomaro M L.Effect of UV-B radiation on antioxidant defense system in sunflower cotyledons.Plant Science,2002,162(6):939-945.
[29] Nakano Y,Asada K.Hydrogen peroxide is scavenged by ascorbate-specific peroxidase in spinach chloroplast.Plant and Cell Physiology,1981,22(5):867-880.
[30] Kato M,Shimizu S.Chlorophyll metabolism in higher plants.VII.Chlorophyll degradation in senescing tobacco leaves:phenolic-dependent peroxidative degradation.Canadian Journal of Botany,1987,65(4):729-735.
[31] Ekmekci Y,Terzioglu S.Effects of oxidative stress induced by paraquat on wild and cultivated wheats.Pesticide Biochemistry Physiology,2005,83(2/3):69-81.
[32] Sgherri C L M,Loggini B,Puliga S,Navari-Izzo F.Antioxidant system in Sporobolus stapfianus:changes in response to desiccation and rehydration.Phytochemistry,1994,35(3):561-565.
[33] Ozkur O,Ozdemir F,Bor M,Turkan I.Physiochemical and antioxidant responses of the perennial xerophyte Capparis ovata Desf.to drought.Environmental and Experimental Botany,2009,66(3):487-492.
[34] Sofo A,Dichio B,Xiloyannis C,Masia A.Lipoxygenase activity and proline accumulation in leaves and roots of olive tree in response to drought stress.Physiology Plant,2004,121(1):58-65.
[35] Guo J Y,Yang Y,Wang G X,Yang L D,Sun X.Ecophysiological responses of Abies fabri seedlings to drought stress and nitrogen supply.Physiologia Plantarum,2010,139(4):335-347.
[36] Xue G X,Gao H Y,Li P M,Zou Q.Effects of chitosan treatment on physiological and biochemical characteristics in cucumber seedlings under low temperature.Journal of Plant Physiology and Molecular Biology,2004,30(4):441-448.
[37] Cornelissen J H C,Van Bodegom P M,Aerts R,Callaghan T V,Van Logtestijn R S P,Alatalo J,Chapin F S,Gerdol R,Gudmundsson J,Gwynn-Jones D,Hartley A E,Hik D S,Hofgaard A,Jónsdóttir J S,Karlsson S,Klein J A,Laundra J,Magnusson B,Michelsen A,Molau U,Onipchenko V G,Quested H M,Sandvik S M,Schmidt I K,Shaver G R,Solheim B,Soudzilovskaia N A,Stenström A,Tolvanen A,Totland Ø,Wada N,Welker J M,Zhao X Q,Team M O L.Global negative vegetation feedback to climate warming responses of leaf litter decomposition rates in cold biomes.Ecology Letters,2007,10(7):619-627.
[38] Xu Z F,Yin H J,Zhao C Z,Cao G,Wan M L,Liu Q.A review of responses of litter decomposition in terrestrial ecosystems to global warming.Chinese Journal of Plant Ecology,2009,33(6):1208-1219.
参考文献:
[4] 李娜,王根绪,杨燕,高永恒,柳林安,刘光生.短期增温对青藏高原高寒草甸植物群落结构和生物量的影响.生态学报,2011,31(4):895-905.
[5] 徐振锋,胡庭兴,张力,张远彬,鲜骏仁,王开运.青藏高原东缘林线交错带糙皮桦幼苗光合特性对模拟增温的短期响应.植物生态学报,2010,34(3):263-270.
[6] 张立荣,牛海山,汪诗平,李英年,赵新全.增温与放牧对矮嵩草草甸4种植物气孔密度和气孔长度的影响.生态学报,2010,30(24):6961-6969.
[15] 高甲荣,张东升,牛健植,余新晓,张文敬.长江上游峨眉冷杉林结构特征的研究.应用生态学报,2003,14(1):20-24.
[16] 刘照光,印开蒲,陈庆恒,杨启修,邱发英.贡嘎山植被.成都:四川科学技术出版社,1985:36-38.
[20] 羊留冬,王根绪,杨燕,曹洋,李伟,郭剑英.贡嘎山峨眉冷杉成熟林凋落物量动态研究.江西农业大学学报,2010,32(6):1163-1167.
[38] 徐振锋,尹华军,赵春章,曹刚,万名利,刘庆.陆地生态系统凋落物分解对全球气候变暖的响应.植物生态学报,2009,33(6):1208-1219.
