农田开垦对三江平原湿地土壤种子库影响及湿地恢复潜力
2013-12-25王国栋BethMiddleton吕宪国赵魁义娄彦景
王国栋, Beth A Middleton,吕宪国,姜 明,*, 王 铭, 赵魁义,娄彦景
(1. 中国科学院东北地理与农业生态研究所湿地生态与环境重点实验室, 长春 130012; 2. 中国科学院研究生院, 北京 100039;3. U.S. Geological Survey, National Wetland Research Center, Lafayette, Louisiana, 70506, USA)
湿地是地球上最重要的生态系统之一,同时也是自然界最富生物多样性的生态景观和人类最重要的生存环境之一。近年来由于人类活动的加剧,湿地生态系统也成为最受威胁的生境类型之一[1]。恢复和重建受损湿地生态系统的重要性越来越被人们所认识,并逐渐成为研究的热点[2]。作为湿地生态研究的重要组成部分,湿地种子库在植被演替更新和受损湿地恢复中起着十分重要的作用。受损湿地土壤种子库在植被恢复过程中的作用日益受到重视[3]。对于受到严重干扰和退化的湿地,湿地土壤种子库可能提供进行植被重建和湿地恢复所需物种的种子和繁殖体。
农田开垦破坏了湿地原有植被,同时农田沟渠建设阻碍了种子的传播,从而影响湿地种子库的来源。耕作过程往往破坏土壤的结构,改变土壤原始状况,从而改变土壤中种子库的分布格局,影响种子的分布密度以及数量。目前,关于开垦湿地种子库的研究表明,不同类型湿地开垦后种子库中物种类型以及恢复潜力有所不同。湿地类型以及干扰的时间和强度严重影响湿地恢复的潜力[4]。美国中西部Prairie湿地开垦70 a后土壤种子库中仍然保存有重要的优势物种[5]。然而,森林湿地在开垦1—3 a后其优势木本和草本物种就可能在种子库中消失[4],美国东南部森林湿地在受到人为干扰破坏后,经过5 a的天然恢复,群落结构发生变化,草本植物取代木本植物成为湿地中的优势种[6]。农田湿地种子库物种与天然湿地植被呈现显著差异[4],长江中下游湖泊湿地开垦为稻田后,种子库结构呈现单一化的发展趋势,且这种变化随开垦的时间而强化,开垦50 a后,湿地物种丧失,土壤种子库优势类群演变为单一的禾本科植物[7]。
三江平原是我国最大的沼泽分布区,也是重要的商品粮基地[8]。为保障国家粮食安全,在过去的50多年里,国家先后对三江平原进行了多次大规模的开垦。兴建农田水利工程,将大片沼泽地开垦为耕地,导致三江平原沼泽湿地面积急剧减少,目前大约有80%的湿地已经丧失,洪涝灾害严重,沼泽生物资源大量减少,沼泽湿地退化严重[9]。然而,迄今未见三江平原垦后湿地土壤种子库特征及湿地植被恢复潜力的相关研究。在这种背景下,加强对三江平原湿地恢复潜力的研究显得非常重要。本文采用温室萌发法在两种水分条件下对三江平原天然湿地、不同开垦年限湿地种子库特征进行研究,进而分析通过种子库进行湿地植被恢复的潜力。
1 研究地区与研究方法
1.1 研究地区概况
三江平原沼泽区位于中国东北部,由黑龙江、松花江、乌苏里江汇流冲积而成,地理坐标为45°—48°N,130°—135°E。属于北温带大陆性季风气候,年平均降雨量为550—600 mm,年平均气温大约为1.9 ℃。最冷月(1月)平均气温在-18 ℃以下。最热月(7月)平均气温在21—22 ℃左右。北东走向的完达山脉将本区分为两部分。完达山以北的三江平原在大地构造上属同江内陆断陷,是一个中、新生代大面积沉陷地区。完达山以南的平原称为穆棱-兴凯平原,也属于三江平原一部分,在大地构造上属新生代内陆断陷,为第三纪初断陷形成的平原。第四纪以来,大部分地区处于间歇性缓慢下沉阶段,因而地势低平,河道蜿蜒曲折,河漫滩宽广,径流滞缓,加之地面组成物质粘重,下渗困难,有利于沼泽的发育。植被类型以典型沼泽湿地植被为主,植物群落以小叶章(Calamagrostisangustifolia)群落和毛苔草 (Carexlasiocarpa)群落为主,植被的覆盖度一般在70%—90%。主要土壤类型有泥炭沼泽土、腐殖质沼泽土、草甸沼泽土、淤泥沼泽土、草甸土、泥炭土等[10-11]。
1.2 研究方法
1.2.1 种子库取样与萌发
种子库是指土壤基质中有活力种子的总和,本文中研究的种子是广义的,既包括植物形态解剖学上严格意义的种子,也包括植物繁殖体,如根茎、鳞茎等。种子库取样工作于 2010年5月10日进行,土样采集区域位于黑龙江支流鸭绿河流域,该地位于三江平原东北部,黑龙江省佳木斯市抚远县浓桥镇(48.0026 N, 134.0729 E)。分别选取天然湿地、开垦1、3、10、20a的大豆地进行取样。其中开垦1a的大豆地为2009年秋季经过翻耕还没有进行作物种植的湿地。天然湿地与开垦湿地相距较远,避免天然湿地植被对开垦湿地的种源补给。每个样地随机选取两个面积为25 cm×25 cm的样点作为平行处理,同时在每个样点按0—5 cm和5—10 cm两个层次取土壤样品。湿地开垦年限通过向当地农民调查得知。其中,分别用以下简称代表天然湿地和不同开垦年限湿地,NW:天然湿地;F1:开垦1a湿地;F3:开垦3a湿地;F10:开垦10a湿地;F20:开垦20a湿地。
萌发 2010年5月18日,在中国科学院东北地理与农业生态研究所玻璃温室内进行种子库萌发实验。温室保持通风,与外界温度、湿度条件保持一致。将相同层次的土样进行去除碎石、均匀混合,同时过筛将土样中根茎取出单独进行培养。将每个样地的0—5 cm、5—10 cm土层和取出的根茎分别平铺于12个装有经过清水冲洗的蛭石的圆柱形培养盆中。培养盆高度为11 cm,直径为13.4 cm,蛭石厚度为8 cm,土层厚度约2 cm。培养盆底部具有圆形的小孔,保证水分交换。将装有土样的12个培养盆两个一组分成6组,随机选取3组分别置于3个培养槽中,培养槽中加水保持土壤湿润,另外3组分别置于3个培养槽中,保持淹水10 cm处理。这样,每个处理6个重复。6个培养槽中一共装有180个培养盆。
幼苗计数 实验期间每周统计每个培养盆内每种植物萌发的个体数。对于经过鉴定的幼苗及时地进行计数,并从培养盆中移出。对于无法鉴定的物种,移栽至另外的培养盆培养至可鉴定为止。萌发实验持续到没有新的幼苗萌发为止,萌发实验持续大约6个月。
1.2.2 数据分析
不同开垦年限种子库的萌发种相似性采用群落系数R=[c/(a+b-c)]×100%。
式中,a代表类型A的物种数;b代表类型B的物种数;c代表类型A和B中的共有种数。
每个培养盆中萌发的幼苗数扩展到1m2的面积上,两种水分条件下土壤种子库萌发物种数与萌发密度是各层萌发物种数与种子数的总和,不同土层种子库萌发物种数与萌发密度是两种水分条件下萌发物种数与种子数的总和。使用单因素方差分析(one-way ANOVA)以及最小显著性检验(LSD法)对不同类型湿地平均幼苗萌发密度进行分析,显著水平α=0.05。幼苗萌发密度数据通过(log(x+1))转换以满足方差同质性要求。数据分析使用SPSS16.0软件辅以Excel实现。
2 结果
2.1 种子库萌发情况
本次试验共萌发物种50种,其中1、2年生草本12种,多年生草本34种,灌木2种,藓类2种。天然湿地与开垦1年、3年、10年、20年湿地萌发的物种数依次是34、31、21、21、8种,见表1。
2.2 开垦年限对种子库的影响
农田开垦对湿地土壤种子库产生明显的影响,见图1。随着开垦年限的增加,种子库萌发物种数呈现极显著差异,天然湿地与开垦1、3、10、20a湿地平均物种数分别为12种、20种、10种、6种、3种。秋翻湿地(开垦1年)平均萌发物种数最多,明显多于其他类型(P<0.01),其次为天然湿地与开垦3年湿地,显著多于开垦20年湿地(P<0.05),而开垦10年湿地与开垦3年、20年湿地没有显著性差异(P>0.05)。随着开垦年限的增加,种子库萌发密度呈现极显著差异,天然湿地与开垦1、3、10和20a湿地的种子萌发密度分别为7624、9836、4336、4872和432粒/m2。秋翻湿地萌发种子密度最大,显著多于开垦3a、10a湿地(P<0.01),开垦20a湿地最少,显著低于其他类型(P<0.01),而天然湿地与开垦1、3、10a湿地,开垦3a、10a湿地之间无显著差异(P>0.05)。

表1 三江平原天然湿地及不同开垦年限湿地种子库组成及密度
天然湿地与开垦年限小于10a的湿地物种数和种子密度没有显著差异,但是当湿地开垦年限达到20a后,物种数与种子密度显著降低,这与Wienhold等[12]的研究结果相一致。天然湿地与小于10a开垦湿地相似性维持在0.54—0.58之间,而与开垦20a湿地相似性却显著降到0.42,见表2。
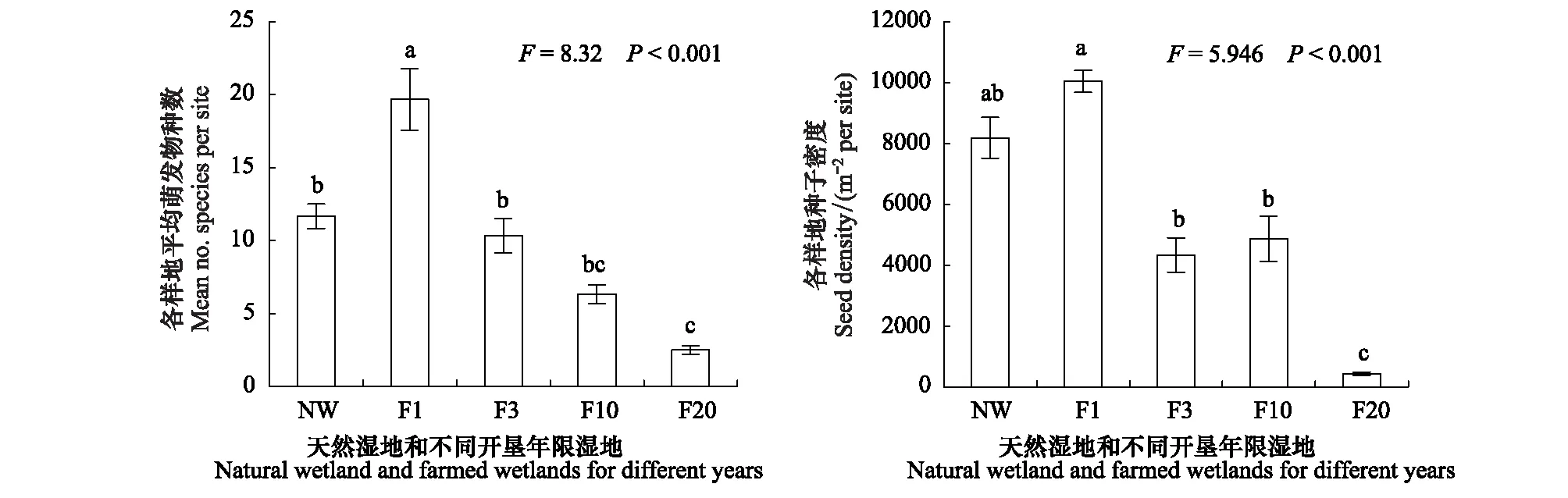
图1 三江平原天然湿地与开垦湿地种子库萌发平均物种丰富度与种子密度(均值±标准误)
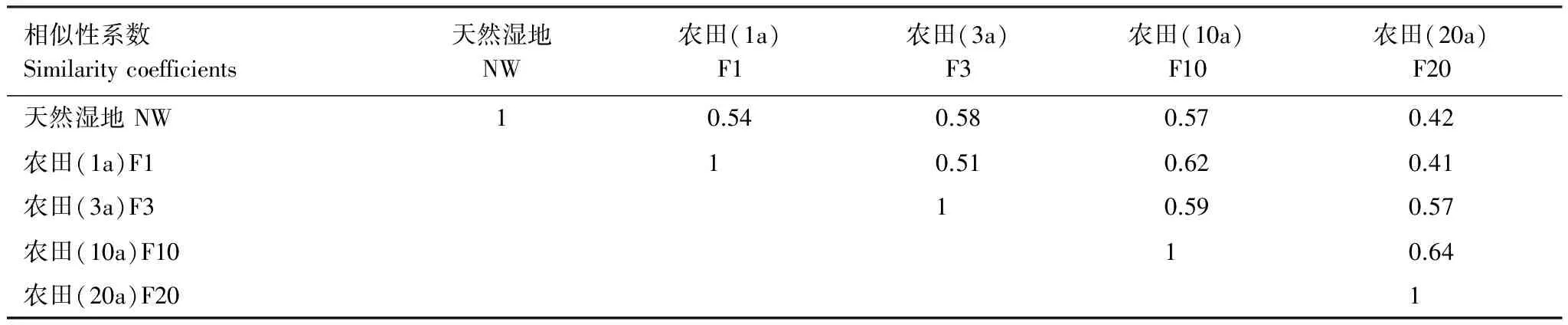
表2 三江平原天然湿地与开垦湿地相似性系数
2.3 水分处理及种子库分层
本次试验共进行了两种水分处理:湿润和淹水10 cm。湿润处理共萌发物种47种,而淹水处理共萌发物种6种,分别是菹草(Potamogetoncrispus)、竹叶眼子菜(Potamogetonmalaianus)、三裂慈菇(Sagittariatrifolia)、苦草(Vallisneriaspiralis)、泽泻(Alismaorientale)、宽叶香蒲(Typhalatifolia),其中两种水分条件下共有物种3种:三裂慈菇(Sagittariatrifolia)、苦草(Vallisneriaspiralis)、宽叶香蒲(Typhalatifolia)。
图2表明湿润条件下萌发物种数显著高于淹水处理。湿润条件下,天然湿地与秋翻湿地萌发物种数集中在28—32种,开垦3a、10a萌发物种集中在15—20种,开垦20a萌发物种则只有5—10种。淹水条件下,萌发物种数比较稳定,集中在4—7种左右,开垦20a萌发物种则只有2—3种。同时,湿润条件下种子萌发密度也显著高于淹水处理。湿润处理条件下,随着开垦年限增加,种子萌发密度逐渐减少,到开垦20a,迅速减少到304粒/m2。淹水处理条件下,一经开垦,萌发种子密度迅速减小,到开垦20a时,密度只有128粒/m2。
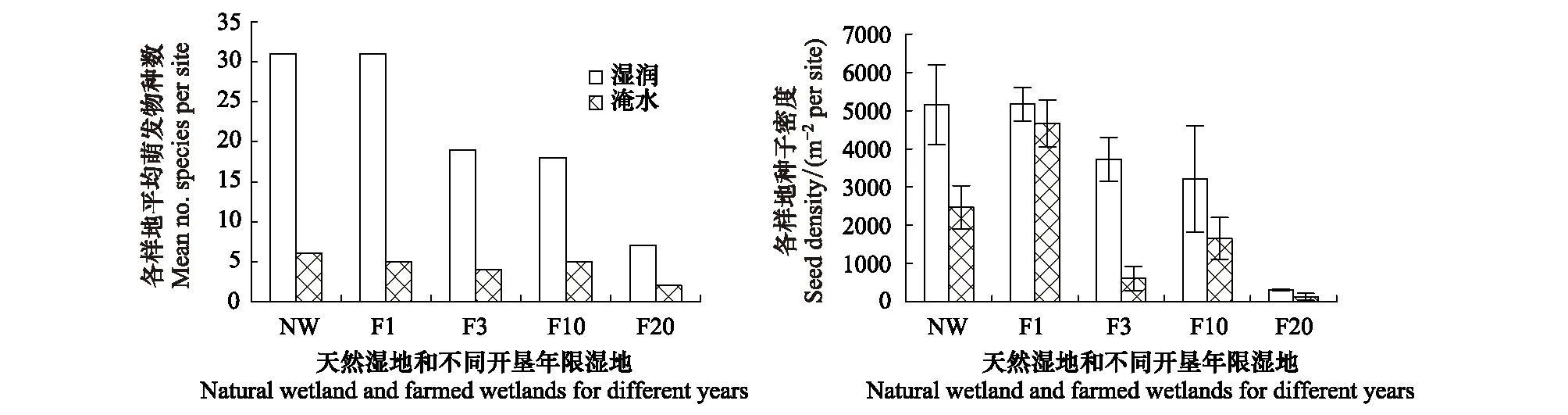
图2 两种水分条件下(湿润/淹水)天然湿地与开垦湿地土壤种子库萌发物种数与萌发密度
对0—5 cm、5—10 cm土层以及湿地中残留的根茎进行萌发培养表明不同深度土层种子萌发物种数和种子密度具有显著差异(P<0.01,LSD)。不同开垦年限湿地,上层土壤萌发物种数及种子萌发密度均显著高于下层。同时,随着开垦年限的增加,上下两层土壤萌发物种数和种子密度呈现逐渐减小的趋势,但到开垦20a湿地时,上下层土壤物种数和种子萌发密度都急剧减少,见图3。天然湿地与秋翻湿地培养根茎仍有大量物种萌发,随着开垦年限增加,萌发物种数显著减少,到开垦20a时,无物种萌发。
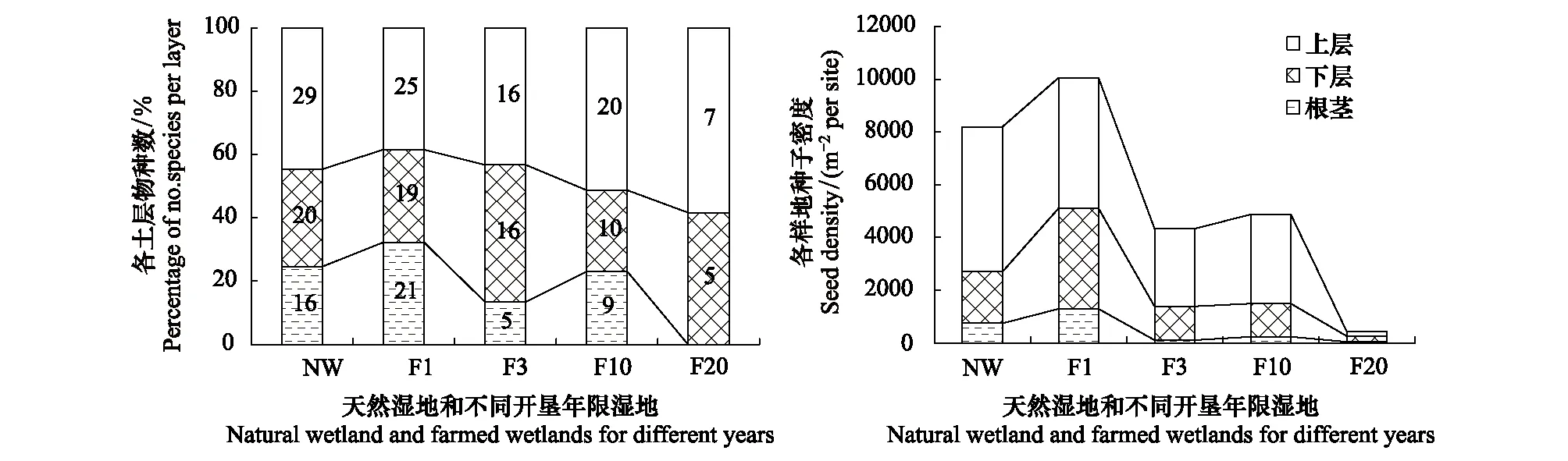
图3 不同土层(0—5cm/5—10cm/根茎)天然湿地与开垦湿地种子库萌发物种数与种子萌发密度
2.4 典型优势物种萌发特征
小叶章(Calamagrostisangustifoli)和毛苔草(Carexlasiocarpa)为三江平原沼泽湿地的典型优势植物。随着开垦年限的增加,小叶章(Calamagrostisangustifoli)和苔草(Carexspp.)都呈现显著差异(P<0.05,LSD)。在天然湿地,小叶章和苔草种子密度都达到最大值,分别是1200粒/m2,440粒/m2左右。湿地开垦为农田后,两者种子密度显著下降,翻耕湿地、开垦3a、开垦10a湿地两者密度分别是350—600粒/m2,60—130粒/m2,而开垦20a后,两者的密度均为0(表3)。

表3 天然湿地与不同开垦年限湿地小叶章和苔草种子萌发密度
3 讨论
3.1 三江平原湿地种子库特征
三江平原不同开垦年限湿地种子库变化较大,其中以天然湿地和秋翻湿地最大,分别达到7624粒/m2,9836粒/m2,而湿地一经开垦,则显著降低到4000—5000粒/m2,开垦20a后,种子密度仅为432粒/m2,可见开垦年限显著影响湿地种子库的规模。张志权[13]归纳,各种类型种子库密度在102—106粒/m2之间,其中耕作地种子库含量在103—105粒/m2之间,湿地种子库的密度在0—104粒/ m2之间。Leck 和Graveline[14]对美国新泽西州淡水沼泽研究表明种子库规模在6405—32000粒/m2之间,刘贵华等[15]对长江中下游湖滨和丘陵沼泽研究表明种子库规模在4689—35832粒/m2之间。本研究中湿地和农田中种子库规模都与已有结果相符合。而邢福等[16]采用温室萌发法通过经常浇水保持土壤湿润对三江平原沼泽湿地各演替序列的种子库规模研究为433—2066粒/m2,本研究结果要远远高于先前该地区的研究。
秋翻湿地萌发物种数与种子密度都是最高,明显高于其他开垦年限的湿地。同时高于天然湿地,但两者种子萌发密度没有显著差异。由图4可以看出翻耕地导致下层5—10 cm萌发数量显著高于其他类型,这是导致萌发密度增大的主要原因。秋翻湿地不仅促使贮藏的湿地物种尤其是沉水物种菹草(Potamogetoncrispus)的大量萌发,同时翻耕也导致湿地中或附近农田传播的某些喜旱物种的萌发,比如苣荬菜(Sonchusbrachyotus)、灰绿藜 (Chenopodiumglaucum)、荠菜(Capsellabursa-pastoris)、野稗(Echinochloacrusgalli)等。
对分层土壤的研究表明,0—5 cm萌发的物种数与种子密度都显著大于5—10 cm土层。这与以往的研究结果相一致[17]。虽然5—10 cm土壤种子库规模小于上层,由于农田翻耕导致下层依然具有相当规模的种子密度,在进行开垦湿地种子库规模研究时,该层种子库依然不能忽视,因此取样深度应适当加大。这与以前的研究中,在没有或长期不受干扰的生境中的种子库大部分集中在地下0—5 cm深度内,5 cm以下的种子库往往被忽略不计有所不同[18]。
地表积水是湿地的重要水文特征,在进行种子萌发时,许多研究工作会专门进行不同的湿润处理研究,将土壤置于不同的水位条件下,研究积水状况对种子萌发的影响。vander Valk 和Davis[18]研究表明,湿润处理和沉水处理仅有25% 的种类是相同的,即使仅2 cm 深的水也会对种子库的萌发产生重要影响。本研究中将土样置入湿润和10 cm淹水条件下,最大限度保证不同水分类型物种萌发。萌发结果表明,两种水分条件下萌发物种类型显著不同,湿润处理条件下萌发物种主要是湿生物种,同时萌发物种较丰富。而淹水条件下萌发物种只有3—5种,以菹草等沉水草本植物为主。
3.2 湿地目标优势物种的消失
湿地植物是湿地生态系统的基本组分和主要生产者,是湿地结构和功能的核心部分。植被的恢复是湿地恢复成败的基本标准之一[19]。而目标优势物种的建立,对于湿地植被群落的建立、动态与稳定起着决定性作用[5]。而对于开垦湿地优势物种的恢复潜力分析,不同类型湿地研究结果有很大差异。美国中西部Prairie湿地开垦70 a后土壤种子库中仍然保存有重要的优势物种[5]。然而,森林湿地在开垦1—3a后其优势木本和草本物种就可能在种子库中消失[4]。对Prairie湿地研究表明,苔草在湿地恢复中受到种子的限制,因此需要播种来克服种子传播的限制[20]。本研究中,小叶章作为三江平原优势物种,随着开垦年限的增加,种子密度逐渐减小,到开垦20多年后,小叶章种子消失,这大大增加了湿地优势物种恢复的难度。虽然小叶章作为多年生草本物种,可以经过根茎进行无性繁殖,但是湿地一旦经过开垦,植被根茎等繁殖体必将受到损坏,如果种子库中种子消失,同时缺乏外来的种子输入,则植被恢复的难度大大加大。而王雪宏等[21]的研究表明,开垦大约20 a的小叶章湿地经过10 a左右的自然恢复,能够形成一个以小叶章为优势物种的湿地植物群落。这主要有两个方面的条件:第一,弃耕地与周围大片的天然湿地相邻,温度、降水差异不大。该开垦湿地进行弃耕后,与周围的天然湿地具有连续的水力联系,保证了湿地恢复所需要的水文及气候条件[22,23]。第二,周围大片的天然小叶章湿地为该弃耕地提供了充足的种子来源。湿地中小叶章和其他湿地物种种子成熟后,经过风的传播作用,可以将种子带入弃耕地中。同时连通的水力联系使得小叶章种子可以通过水播作用散播到弃耕地中[22,24,25],这是小叶章群落得以重新建立的基础。然而,三江平原大规模的农田开垦使得农田连片分布,周围缺乏天然湿地种子的供给,同时农田道路、排水沟渠的建立将农田分割开来,缺乏必要的水力联系[8,26],这对于种子传播极为不利。因此,对于农田景观中残存的少量孤立天然湿地,由于其具有很高的生物多样性,对其利用与保护需要引起足够的重视。
3.3 种子库研究与湿地恢复
湿地种子库在植被演替更新和受损湿地恢复中起着十分重要的作用,但是恢复生态学家有时对种子库在恢复中的作用表示怀疑,而湿地类型以及先前受到的干扰的时间和强度不同,种子库在恢复中的作用也有很大的差异。种子库可能是很短寿命的,这时农田开垦可能破坏掉几乎全部的植被[3]。相反,经过20 a的开垦后,Prairie湿地种子库中仍保存有至少60%的物种[12],仍保存有重要的优势物种和稀有物种[3,5]。Winton等[27]对植被退化湖泊的研究也表明,淹水湖泊种子库具有长寿命特征,对于保持种子密度和物种丰富度都有作用,湖泊种子库为退化湖泊植被资源的恢复提供了可能。
三江平原沼泽湿地经历了长期的农田开垦后,土壤种子库密度下降,湿地物种逐渐消失。湿地开垦10 a左右,萌发物种与种子密度依然保持在一定的水平,作为三江平原优势物种的小叶章和苔草依然存在,但密度显著下降,开垦20 a后,两者彻底消失,生物多样性显著下降到很低的水平。因此我们认为三江平原开垦农田湿地保存有大量的湿地物种,依然具有很大的恢复潜力。但是利用土壤种子库进行湿地恢复存在一个开垦阈值,大约在10—20 a之间,当开垦超过20 a后,仅依靠湿地土壤种子库难以达到湿地植被恢复的效果。
水文恢复是湿地恢复的必要条件,合适的水文条件为湿地植物生长提供了足够的水分以及适宜的群落水文生境,同时水流及洪水波动也是种子传播的重要途径。种子库恢复湿地植被取决于开垦年限、种子寿命、种子扩散和洪水发生的频率等许多因素[28]。要成功进行农田湿地恢复需要景观尺度上恢复洪水波动来重新连接种子传播的途径[4]。多年生物种在三江平原湿地中占有很大的比例,小叶章、毛苔草等多年生湿地物种,可以同时进行无性繁殖和有性繁殖,在湿地恢复过程中需要考虑两种繁殖方式的结合。种子库为湿地植被恢复提供了大量的物种,对于种子库中消失的物种以及小叶章、苔草等优势物种,播种法为我们提供一种新的途径,此时需要注意种子的储藏、萌发条件与发芽率的关系[29],寻找保持种子最高活性的储藏技术,同时注意播种方式、土层厚度、水深、播种密度等对种子发芽率和成活率影响。对于可以进行无性繁殖的植物而言,营养体移植法是成功率较高的方法。尤其在三江平原,无性繁殖是天然湿地中优势物种繁殖的一种主要策略,加强这方面的研究对三江平原湿地恢复具有重要意义。
[1] Chen Y Y, Lu X G. The wetland function and research tendency of wetland science. Wetland Science, 2003, 1(1): 1-8.
[2] Zhou J, Li W, Liu G H, Tachibana H. An overview of studies on the restoration and reconstruction of disturbed wetland vegetation communities. Acta Phytoecologica Sinica, 2001, 25(5): 561-572.
[3] Middleton B A. Wetland Restoration, Flood Pulsing and Disturbance Dynamics. New York: John Wiley and Sons, 1999.
[4] Middleton B A. Soil seed banks and the potential restoration of forested wetlands after farming. Journal of Applied Ecology, 2003, 40(6): 1025-1034.
[5] Galatowitsch S M, van der Valk A G. The vegetation of restored and natural prairie wetlands. Ecological Applications,1996, 6(1): 102-112.
[6] Martin K L, Kirkman L K. Management of ecological thresholds to re-establish disturbance-maintained herbaceous wetlands of the south-eastern USA. Journal of Applied Ecology, 2009, 46(4): 906-914.
[7] Feng W, Wu X M, Pan G X, Xu X W, Qiang S. Comparison of soil seed bank structure in natural wetlands and their corresponding reclaimed paddy fields at lower reaches of Yangtze River in Anhui, China. Chinese Journal of Ecology, 2008, 27(6): 874-879.
[8] Liu X T, Ma X H. Natural Environmental Changes and Ecological Protection in the Sanjiang Plain. Beijing: Science Press, 2002: 59-170.
[9] Liu X T, Ma X H. Influence of large-scale reclamation on natural environment and regional environmental protection in the Sanjiang Plain. Scientia Geographica Sinica, 2000, 20(1): 14-19.
[10] Chen G Q, Niu H G, Lü X G, Yang Q. Mire-wetlands and Its Agricultural Reclamation in the Sanjiang Plain // Chen G Q ed. Study on the Marsh in the Sanjing Plain. Beijing: Science Press, 1996: 152-158.
[11] Mire Department Changchun Institute of Geography, CAS. Mire of Sanjiang Plain. Beijing: Science Press, 1983: 1-28.
[12] Wienhold C E, van der Valk A G. The impact of duration of drainage on the seed banks of northernprairie wetlands. Canadian Journal of Botany, 1989, 67(6): 1878-1884.
[13] Zhang Z Q. Soil seed bank. Chinese Journal of Ecology, 1996, 15(6): 36-42.
[14] Leck M A, Graveline K J. The seed bank of a freshwater tidal marsh. American Journal of Botany, 1979, 66(9): 1006-1015.
[15] Liu G H, Xiao Z, Chen S F, Zhang Q F. The role of soil seed bank in wetland restoration and biodiversity conservation in the middle and lower reaches of Yangtze River. Progress in Natural Science, 2007, 17(6): 741-747.
[16] Xing F, Wang Y, Xu K, Yu L L, Lü X G. Characteristics of soil seed banks of community successional series in marshes in the Sanjiang Plain. Wetland Science, 2008, 6(3): 351-358.
[17] Wang X L, Zhou J, Li W, Liu G H, Zhang X J. Seasonal dynamics of soil seed bank in Honghu wetland withdrawn from long-term rice culture. Acta Phytoecologica Sinica, 2003, 27(3): 352-359.
[18] van der Valk A G, Davis C B. The role of seed banks in the vegetation dynamics of prairie glacial marshes. Ecology, 1978, 59(2): 322-325.
[19] Peng S L. Restoration ecology and vegetation reconstruction. Ecologic Science, 1996, 15(2): 26-31.
[20] Kettenring K M, Galatowitsch S M.Carexseedling emergence in restored and natural prairie wetlands. Wetlands, 2011, 31(2): 273-281.
[21] Wang X H, Lü X G, Bao X, Wu H T, Guo Y. Natural restoration of plant species diversity on reclaimedCalamagrostisangustifoliawetland. Chinese Journal of Ecology, 2009, 28(9): 1808-1812.
[22] Bakker J P, Dijkstra M, Russchen P T. Dispersal, germination and early establishment of halophytes and glycophytes on a grazed and abandoned salt-marsh gradient. New Phytologist, 1985, 101(2): 291-308.
[23] Mitsch W J, Wilson R F. Improving the success of wetland creation and restoration with know-how, time, and self-design. Ecological Applications, 1996, 6(1): 77-83.
[24] Middleton B. Hydrochory, seed banks, and regeneration dynamics along the landscape boundaries of a forested wetland. Plant Ecology, 2000, 146(2): 169-181.
[25] Neff K P, Baldwin A H. Seed dispersal into wetlands: techniques and results for a restored tidal freshwater marsh. Wetlands, 2005, 25(2): 392-404.
[26] Xi M, Lü X G. Distribution characteristics of dissolved organic carbon in the sediment of multistage canal and ditch systems in wetlands of the Sanjiang Plain. Acta Ecologica Sinica, 2007, 27(4): 1434-1441.
[27] Winton M D, Clayton J S, Champion P D. Seedling emergence from seed banks of 15 New Zealand lakes with contrasting vegetation histories. Aquatic Botany, 2000, 66(3): 181-194.
[28] Middleton B, Wu X B. Landscape pattern of seed banks and anthropogenic impacts in forested wetlands of the northern Mississippi River Alluvial Valley. Ecoscience, 2008, 15(2): 231-240.
[29] Budelsky R A, Galatowitsch S M. Effects of moisture, temperature, and time on seed germination of five wetlandCarices: implications for restoration. Restoration Ecology, 1999, 7(1): 86-97.
参考文献:
[1] 陈宜瑜, 吕宪国. 湿地功能与湿地科学的研究方向. 湿地科学, 2003, 1(1): 1-8.
[2] 周进, 李伟, 刘贵华, Tachibana H. 受损湿地植被的恢复与重建研究进展. 植物生态学报, 2001, 25(5): 561-572.
[7] 冯伟, 吴新民, 潘根兴, 许信旺, 强胜. 皖江湿地及其开垦为稻田后土壤种子库结构比较. 生态学杂志, 2008, 27(6): 874-879.
[8] 刘兴土, 马学慧. 三江平原自然环境变化与生态保育. 北京: 科学出版社, 2002: 59-170.
[9] 刘兴土, 马学慧. 三江平原大面积开荒对自然环境影响及区域生态环境保护. 地理科学, 2000, 20(1): 14-19.
[10] 陈刚起, 牛焕光, 吕宪国, 杨青. 三江平原沼泽湿地与农业开发 // 陈刚起. 三江平原沼泽研究. 北京: 科学出版社, 1996: 152-158.
[11] 中国科学院长春地理研究所沼泽研究室. 三江平原沼泽. 北京: 科学出版社, 1983: 1-28.
[13] 张志权. 土壤种子库. 生态学杂志, 1996, 15(6): 36-42.
[15] 刘贵华, 肖蒇, 陈漱飞, 张全发. 土壤种子库在长江中下游湿地恢复与生物多样性保护中的作用. 自然科学进展, 2007, 17(6): 741-747.
[15] 刘贵华, 肖蒇, 陈漱飞, 张全发. 土壤种子库在长江中下游湿地恢复与生物多样性保护中的作用. 自然科学进展, 2007, 17(6): 741-747.
[16] 邢福, 王莹, 许坤, 于丽丽, 吕宪国. 三江平原沼泽湿地群落演替系列的土壤种子库特征. 湿地科学, 2008, 6(3): 351-358.
[17] 王相磊, 周进, 李伟, 刘贵华, 张学江. 洪湖湿地退耕初期种子库的季节动态. 植物生态学报, 2003, 27(3): 352-359.
[19] 彭少麟. 恢复生态学与植被重建. 生态科学, 1996, 15(2): 26-31.
[21] 王雪宏, 吕宪国, 暴晓, 武海涛, 郭岳. 开垦小叶章湿地植物物种多样性的自然恢复. 生态学杂志, 2009, 28(9): 1808-1812.
[26] 郗敏, 吕宪国. 三江平原多级沟渠系统底泥可溶性有机碳的分布特征. 生态学报, 2007, 27(4): 1434-1441.
