对虾桃拉综合征病毒实时荧光定量PCR检测方法的建立
2013-12-18方成俊陈俊玉王碧生杨奇志潘迎芬陈晖陈旭新
方成俊陈俊玉王碧生杨奇志潘迎芬陈 晖陈旭新
(1.东山出入境检验检疫局 福建东山 363401;2.美国Protein Simp1e公司中国广州办事处 广州 510000)
对虾桃拉综合征病毒(TSV)于1992年最早出现在南美最大对虾养殖国家厄瓜多尔,对虾感染病毒后死亡率高达40%~95%,曾引起美洲对虾养殖业的巨大损失,与对虾白斑综合征病毒(WSSV)、对虾传染性皮下及造血组织坏死病毒(IHHNV)一起被FAO称为“影响世界对虾养殖的三大病害”。对虾桃拉综合征病毒基因组为单链RNA病毒,暂归于小RNA病毒科,该病毒主要感染西半球的对虾品种,如南美白对虾、凡纳对虾(P.vannamei)、蓝脚细对虾(P.setiferus)等,其中以南美白对虾最为敏感,因为TSV在其体内能迅速增殖并向外释放。近几年由于我国成功引进南美白对虾,大规模养殖已开始,我国对虾产量的50%以上都来自于南美白对虾,如果该病在我国流行并蔓延,将对我国的对虾养殖业造成沉重的打击。据报道,对虾桃拉综合征已在我国台湾地区发生过大面积暴发,在广东、广西、海南、福建等省沿海海水对虾养殖密集区也有发生。以标记特异性荧光探针为特点的荧光定量PCR技术(F1uorescence Quantitative PCR,FQ-PCR),如 TaqMan探针、HybProbe杂交探针技术,集PCR和探针杂交技术为一体,直接探测PCR过程中的荧光变化,实现DNA模板的准确定量结果,整个过程实行闭管式实时测定,是目前最先进的PCR技术。目前国内还未有应用实时荧光PCR技术进行桃拉综合征病毒检测的研究报道。
1 材料与方法
1.1 试验材料 对虾桃拉综合征病毒毒株由南海水产研究所提供,其他对照毒株(皮氏杆状病毒、斑节对虾型杆状病毒、中肠腺坏死杆状病毒、传染性皮下造血坏死病毒、肝胰腺细小病毒和呼肠孤病毒)由本单位保存。试验对虾采自福建省和广东省各养殖场。Taq酶和AMV反转录酶为TaKaRa公司产品。实时荧光定量PCR仪型号为罗氏LightCyc1er1.5。
1.2 方法
1.2.1 样本RNA的提取 取患虾肝脏,放于灭过菌的研钵中,加入无菌处理和DEPC处理过的500μL PBS或生理盐水,进行快速研磨,直至无固体物存在。收集研磨产生的液体移到离心管中6 000 r/min离心20 s,取上清备用。取若干个1.5 mL经灭菌的无RNA酶污染的离心管,作好标记。首先各加入600μL Trizo1,然后分别加入相应编号的样本上清液各200μL,吸打混匀,再加入200μL氯仿,振荡混匀。静置5 min,12 000 r/min离心10 min。分别吸取各管中的上层液相(切勿吸入下层液体)转移至新的作好相应标记的1.5 mL无RNA酶污染的离心管中,加入-20℃预冷的异丙醇400μL,颠倒混匀,静置5 min,12 000 r/min离心10 min。轻轻倒去上清,倒置于吸水纸上,吸干液体;加入700μL 75%乙醇,颠倒洗涤,12 000 r/min离心5 min;轻轻倒去上清,倒置于吸水纸上,尽量吸干液体。4 000 r/min离心10 s,用微量加样器尽量将残余液体吸干,室温干燥1~5 min。加入15μL DEPC水,轻弹混匀,溶解管壁上RNA,保存于-18℃以下备用。
1.2.2 引物与探针 上游引物:5’-CTAATATTGTCATGTATCCTTGGGTG-3’, 下 游 引 物 :5’-ATACTGGAGCACGCGTTACTGA-3’,探针:FAM-5’-CCAGCAGATGTTCCTGAGGAGCCC-3’-TAMRA。根据各引物的分子量以及合成时的OD值,计算每个引物和探针的储存液浓度,然后用RNase Free水溶解稀释,分装后于-20℃贮存备用。
1.2.3 实时荧光定量PCR反应体系与循环条件实时荧光定量PCR反应体系见表1。循环条件为step1:50 ℃ 30 min,95 ℃ 2 min;step2:95 ℃ 5 s,60℃ 40 s,40个循环。
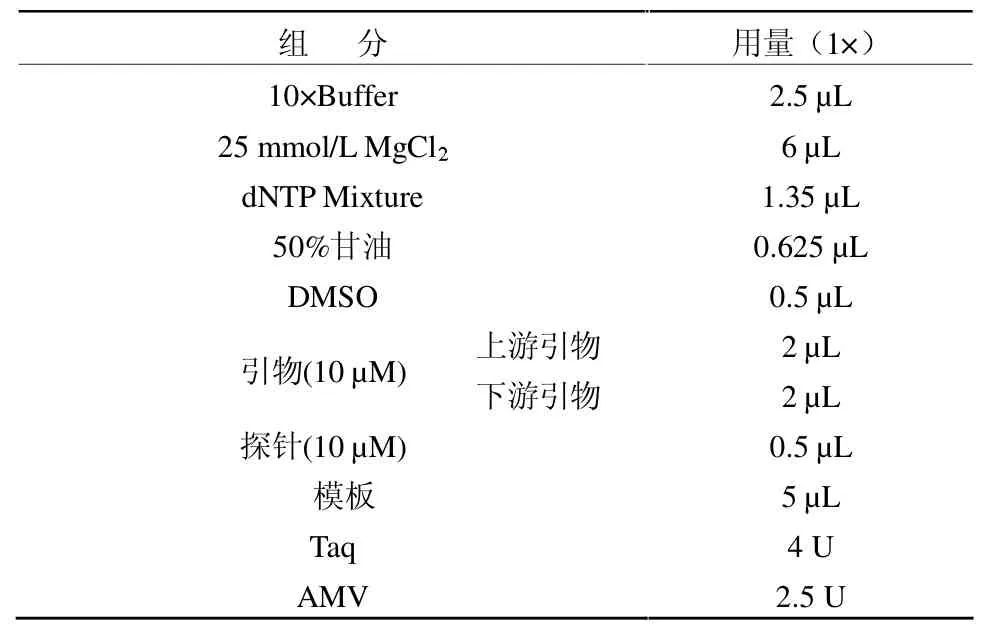
表1 Taura病毒荧光PCR反应体系的各组分情况
1.2.4 阀值设定与结果分析 阀值设定原则为超过阴性对照扩增曲线(无规则噪音线)的最高点。Cp值>45为阴性,Cp值<45为阳性,Cp值在 44~46的标本需重新测定一次,再按上述要求判定。阳性标本定量数据的测定,实时荧光定量PCR仪会根据各个标准品测得的et值绘制成标准曲线后仪器自动计算阳性样本的拷贝数据并在电脑界面上显示。
2 结果与分析
2.1 对虾桃拉综合征病毒实时荧光定量PCR的建立 为验证设计、合成的引物和探针的性能,分别利用针对Taura病毒所设计的各套引物探针,进行实时荧光PCR扩增,筛选出能够工作的引物与探针最佳组合。同时,进行反应体系以及PCR反应程序的优化。
在进行Taura病毒实时荧光PCR反应时,需对所用仪器中每个检测孔设置相应的单荧光信号收集,选择的荧光检测通道应与探针所标记的荧光报告基团的波长一致,如Taura病毒FAM检测收集。具体设置方法因仪器而异,应参照仪器使用说明书。
2.2 引物探针组合筛选 通过检索文献,确定靶基因,从GeneBank下载所有Taura病毒的序列,用生物软件进进序列比对,截取最一致的序列进行引物探针设计,将设计好的引物探针在GeneBank上进行B1ast比对,验证引物探针的保守性。随后进一步试验筛选出最佳引物和探针组合,以确定为本方法中所使用的引物和探针的兼容性和效率,并进行相关的优化最佳PCR反应浓度组、反应条件、特异性、灵敏度和适用性测试。选择的引物探针序列位置分别见图1,核酸序列见表2。
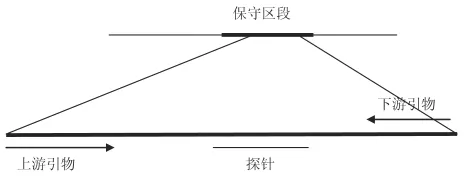
图1 对虾桃拉综合征病毒引物和探针的设计
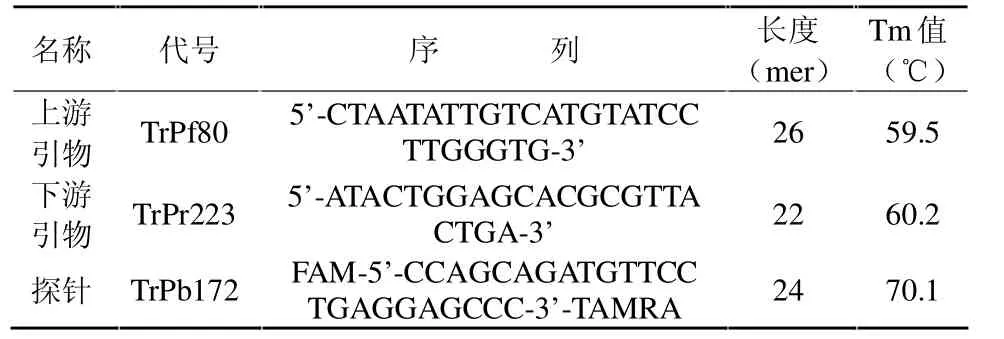
表2 对虾桃拉综合征病毒引物探针序列
2.3 体系优化结果
2.3.1 Taq酶的优化 Taq酶用量(以单位U计)从1~5以1单位为梯度递增。从试验结果中可知,不同酶用量对Cp值的影响很小,Taq酶用量分别为1 U、2 U、3 U、4 U和5 U时,阳性模板的Cp值在23.16~23.94的较狭窄范围内波动。但选定4 U Taq酶进行反应时,反应体系的荧光增量最高。故选择4 U Taq酶作为本荧光PCR反应中使用的Taq酶用量。
2.3.2 Mg2+用量优化 将25 mM MgC12加样量从3~6μL,以1μL为梯度递增。从多次重复试验结果可知,25 mM MgC12加样量在3μL以上时对Cp值的影响很小,但在6μL时反应体系的荧光增量最高,所以选定25 mM MgC12加样量为6μL作为本荧光PCR反应中单个反应的用量。
2.3.3 引物探针用量优化 将10 mM的引物加样量从 0.25~1μL递增,10 mM的探针加样量从0.125~0.5μL递增。将不同浓度的引物和探针配比,用所提取的核酸进行扩增。从多次重复的试验结果中发现:不同浓度的引物、探针对于该阳性模板Cp值基本稳定在22.18~23.86,但引物浓度为10μM、加样量为2μL,Taura病毒探针浓度为10μM、加样量为0.5μL的荧光扩增效率较高,效率在90%~100%。所以,选定2条引物加样量均为2μL,Taura病毒探针加样量0.5μL作为荧光PCR反应的引物和探针浓度。
2.3.4 循环条件优化结果 试验结果显示,采用循环条件一的体系无论是Cp值还是曲线的扩增效率都较循环条件二的结果好,故选择循环条件一作为荧光PCR扩增时的循环条件。
循环条件一为step1:50℃ 30 min,95℃ 2 min;step2:95 ℃ 5 s,60 ℃ 40 s,40 cyc1es。循环条件二为step1:50 ℃ 30 min,95 ℃ 2 min;step2:95 ℃ 5 s,55 ℃ 10 s,72 ℃ 20 s,40 cyc1es。
2.4 实时荧光PCR扩增结果
2.4.1 实时荧光PCR扩增结果 为检测Taura病毒设计的一套引物和探针,其扩增效果很好,出现了特异且典型的检测曲线,Cp值约为23,扩增效果见图2。
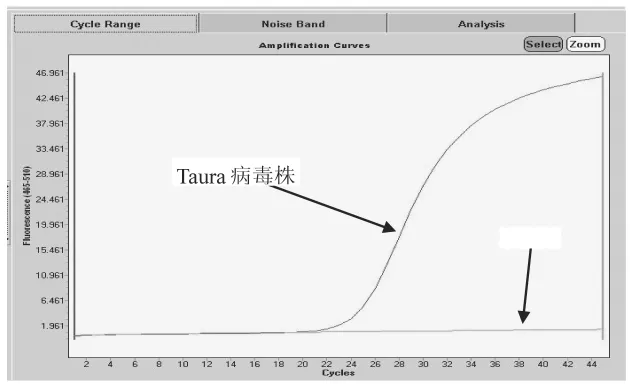
图2 Taura病毒样品模板扩增曲线
2.4.2 灵敏度试验结果 取Taura病毒标准毒株,按 10-1、10-2、10-3、10-4、10-5、10-6、10-7的倍数梯度稀释,取最后5个梯度的毒株样品进行荧光PCR检测,以确定该方法最低检出浓度,具体结果见表3和图3。本研究建立的荧光PCR方法到10-6稀释度时还可以检出,检出限在450个病毒拷贝左右,比普通PCR方法的10-4检测限高100倍。

表3 荧光PCR检测法结果
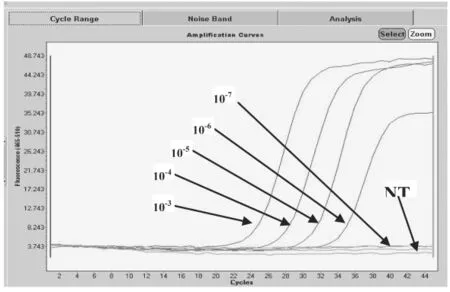
图3 Taura病毒实时荧光PCR检测结果
2.4.3 特异性试验结果 用Taura病毒的实时荧光PCR体系检测收集到的所有Taura病毒毒株,以及常见的其他对虾病毒毒株。特异性试验结果如表4和图4。所有的Taura病毒毒株检测结果均为阳性,而非Taura病毒毒株检测结果为阴性,荧光PCR检测结果的特异性为100%。
2.4.4 检测时间优化结果 普通PCR检测试验共需8个步骤:样本DNA提取、DNA扩增、琼脂糖配制、制电泳板、加样、电泳、结果报告、扩增片段,约需240 min。实时荧光定量PCR仅需前面2步,通过优化循环条件,检测时间约45~60 min,约为普通PCR检测方法的1/4。
3 讨论
3.1 引物探针设计原理 实时荧光PCR的引物与探针设计应该遵循以下原则:(1)选择病原体RNA不形成高级结构的区域进行设计,保持GC含量在30%~80%,引物Tm值为58~60℃,引物对间不能形成二聚体或二聚体的自由能应大于-3.5 kc/m,单个引物自身形成发夹结构的自由能也必须大于-3.5 kc/m。在引物序列中,不能出现连续的G,而且3’端尽量避免G或C的出现,在引物的最后5个碱基内,不应有两个以上的G或C,以便提高引物的特异性。(2)选择没有RNA自身二聚体的区域进行探针设计,保持GC含量在30%~80%,探针的Tm值为68~70℃,5’端不能是G,探针自身不形成二聚体。另外,上游引物与探针之间距离不能相距太远。扩增的目的核酸片断大小应在70~150 bp。

表4 Taura病毒荧光PCR检测特异性试验
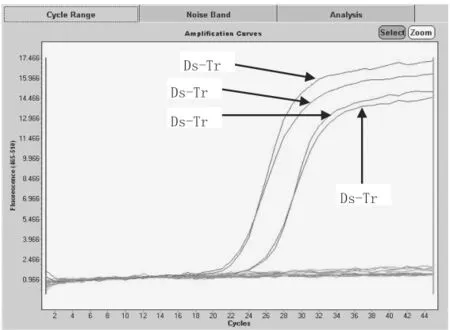
图4 Taura病毒特异性试验
Taura病毒的探针引物的设计,通过下载Gen-Bank中所有Taura病毒的基因组序列,进行比对,找到该病毒的高度保守区,将该保守区放入Gen-Bank中进行B1ast比对,找出其与其他物种的同源区,在设计引物和探针时避开这些同源区。这样设计出来的引物探针对,再进行B1ast对比,以分析其与其他物种的同源性,以评价其可以造成的错检可能。最终的生物信息学分析显示,所设计的引物和探针相对Taura病毒的序列而言高度保守,相对其他非Taura病毒的所有其他物种而言非常特异。因而,通过严格的探针设计原则,荧光PCR检测方法在理论上切实可行。
3.2 Taura病毒实时荧光PCR的特异性 用Taura病毒实时荧光PCR试剂分别检测多种对虾病毒,试验结果显示,Taura病毒毒株检测结果为阳性,而非Taura病毒毒株检测结果为阴性,说明荧光PCR引物TrPf80、TrPr223和引物TrPb172对Taura病毒毒株的检测特异性为100%。Taura病毒荧光PCR检测方法的高度特异性很好地避免了许多方法在检测过程中出现的错检和漏检现象,因此,具有显著的优越性。
3.3 Taura病毒实时荧光PCR的灵敏度 通过一系列的灵敏度试验及统计学数据表明,Taura病毒实时荧光PCR检测方法的灵敏度均达到了10-6(450个病毒拷贝)的水平,每个反应管的检测灵敏度则达到了百位数。由于整个反应的灵敏度受很多因素影响,如RNA的提取方法、反应体系中各成分的浓度、反应条件的设置以及仪器本身的检测性能等都能显著影响系统灵敏度。
[1] 世界动物卫生组织(OIE).水生动物疾病诊断手册[M].3版.国家质量监督检验检疫总局,译.北京:中国农业出版社,2000:165-171.
[2] 江育林,高隆英,史秀杰,等.用RT-PCR快速检测Taura综合征病毒[J].检验检疫科学,2004,14(2):8-9.
[3] 熊炜,邱璐,李健,等.RT-PCR检测Taura综合征病毒方法改进及应用[J].中国动物检疫,2005,22(12):29-31.
[4] 谢芝勋,庞耀珊,邓显文,等.多重RT-PCR同时检测鉴别三种对虾病毒的研究与应用[J].病毒学报,2005,21(5):393-396.
[5] 黄新新,莫胜兰,陆承平.RT-PCR法检测我国东南沿海凡纳滨对虾的桃拉综合征病毒[J].中国病毒学,2005,20(5):546-548.
[6] 庞耀珊,谢芝勋,何竞铭,等.二温式RT-PCR检测对虾Taura综合征病毒的研究[J]. 海洋科学,2004,28(2):54-57.
[7] 陈信忠,龚艳清,孔繁德,等.应用RT-PCR方法从进境南美白对虾亲虾中检出桃拉综合征病毒(Taura syndrome virus)[J].中国动物检疫,2003,20(12):21-22.
