两种不同方法对猪瘟免疫效果评估对比试验
2013-12-18黄剑锋福建省南平市延平区畜牧水产局动物疫控中心353000
黄剑锋 福建省南平市延平区畜牧水产局动物疫控中心 353000
猪瘟是威胁我国养猪业的头号疾病,目前,我国对于猪瘟的控制主要依靠猪瘟疫苗的免疫预防,猪场猪瘟疫苗免疫效果的好坏直接关系到本场猪瘟感染压力的大小,也关系到猪场的经济效益,猪场定期对猪瘟疫苗效果检测评估是十分重要的。目前,用于猪瘟疫苗免疫效果评估的方法很多,选择科学合理的检测方法是科学评估的首要问题。作者采用生产实际中2种常用的评估方法(正向间接血凝试验和酶联免疫吸附试验)对3个规模化猪场66份血清样品进行了猪瘟免疫效果平行对比检测试验。现报告如下。
1 试验材料与方法
1.1 试剂 猪瘟抗体检测试剂盒(阻断ELISA)购自北京爱德士元亨生物科技有限公司,法国LSI猪瘟抗体检测试剂盒,试剂盒批号:2-VETPRA-017。猪瘟正向间接血凝试验器材包括猪瘟正向间接血凝抗原、猪瘟阴(阳)性血清、正向稀释液,购自中国农业科学院兰州兽医研究所,试剂盒批号:20120406。
1.2 仪器 3 000×g(g为相对离心力)台式离心机、精密移液器(50~1 000 μL)、单道微量移液器(0.5~10 μL)、多道微量移液器(25~50 μL)、酶标仪(普朗)、96孔110°V型微量血凝反应板、微型振荡器、隔水式培养箱。
1.3 检测室温湿度 检测室温度为22℃、湿度为57%。
1.4 待检样品 延平区A、B、C 3个规模化猪场提供的66份血清(其中A猪场 20份、B猪场23份、C猪场23份)。3个规模化猪场提供的66份血清均为180~220日龄二次免疫后 15~18 d所采的后备母猪血清。
1.5 试验操作与结果判定 2种试验操作步骤分别按各试剂盒附带的使用说明书严格操作。
猪瘟抗体检测试验(阻断ELISA)成立条件:阳性对照的平均OD值阻断率大于60%,阴性对照平均OD值/阳性对照平均OD值大于4。用INH%来说明检测结果,其计算方式为:IHN%=[(阴性对照OD值-样品OD值)/阴性对照平均OD值]×100。结果说明:被检样品的阻断率大于40,该样品为猪瘟抗体阳性;样品阻断率小于或等于30,该样品为阴性(无猪瘟抗体存在);样品阻断率在30~40,该样品为可疑。
猪瘟正向间接血凝试验成立条件:阳性对照的血凝效价≥1:512,阴性对照的血凝效价为0,试验成立、有效。以能引起50%红细胞出现凝集的最大稀释度为被检样品的血凝效价,抗体效价≥1:32为免疫合格,小于1:32为免疫不合格。
2 结果与分析
2.1 A猪场猪瘟免疫检测结果 A场ELSA检测结果在IHN%51~60的有1份、IHN%61~70有3份、IHN%71~80有 9份、IHN%81~90有 7份;猪瘟正向间接血凝试验抗体效价为1:128的有1份、1:512的有19份。见表1。
2.2 B猪场猪瘟免疫检测结果 B场ELSA检测结果在IHN%41~50的有1份、IHN%51~60为0份、IHN%61~70有 3份、IHN%71~80有 10份、IHN%81~90有9份;猪瘟正向间接血凝试验抗体效价为1:16的有 1份、1:32有 2份、1:64有 2份、1:128有3份、1:256有 2份、1:512有 13份。见表 2。
2.3 C猪场猪瘟免疫检测结果 C场ELSA检测结果在 IHN%41~50的 0份、IHN%51~60的 0份、IHN%61~70有 1份、IHN%71~80有 7份、IHN%81~90有15份;猪瘟正向间接血凝试验抗体效价为1:16 的 0 份、1:32 的 0 份、1:64 的 0 份、1:128有1份、1:256有 1份、1:512有 21份。见表 3。
从表1-表3可以看出,通过ELISA方法检验,66份血清猪瘟抗体均为阳性;通过IHA方法检验,66份血清中有1份为猪瘟抗体阴性、65份阳性,IHA检测方法的阳性率较低。经过统计学x2检验,两种检测方法差异不显著(P>0.05)。
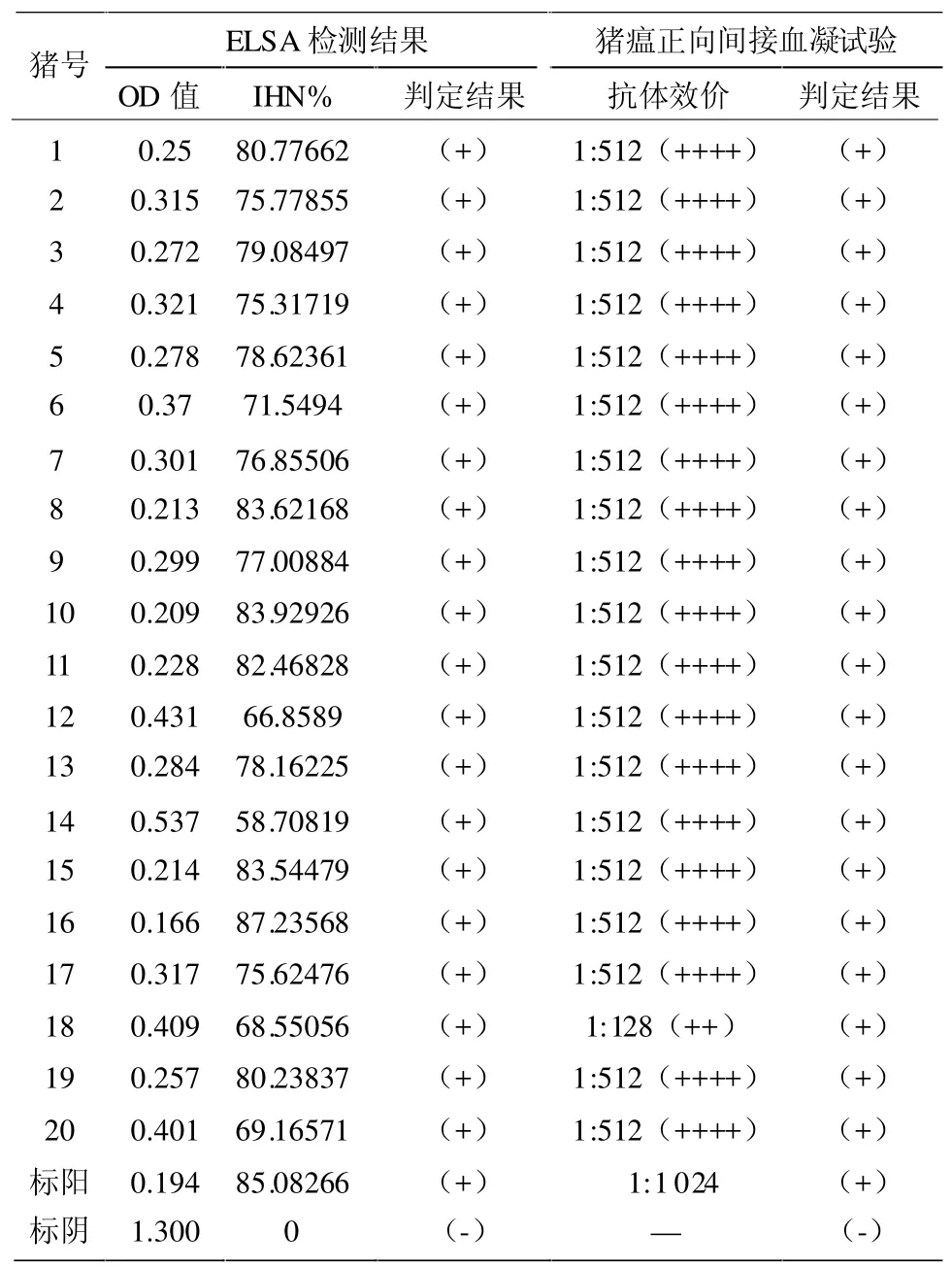
表1 A猪场猪瘟免疫检测结果
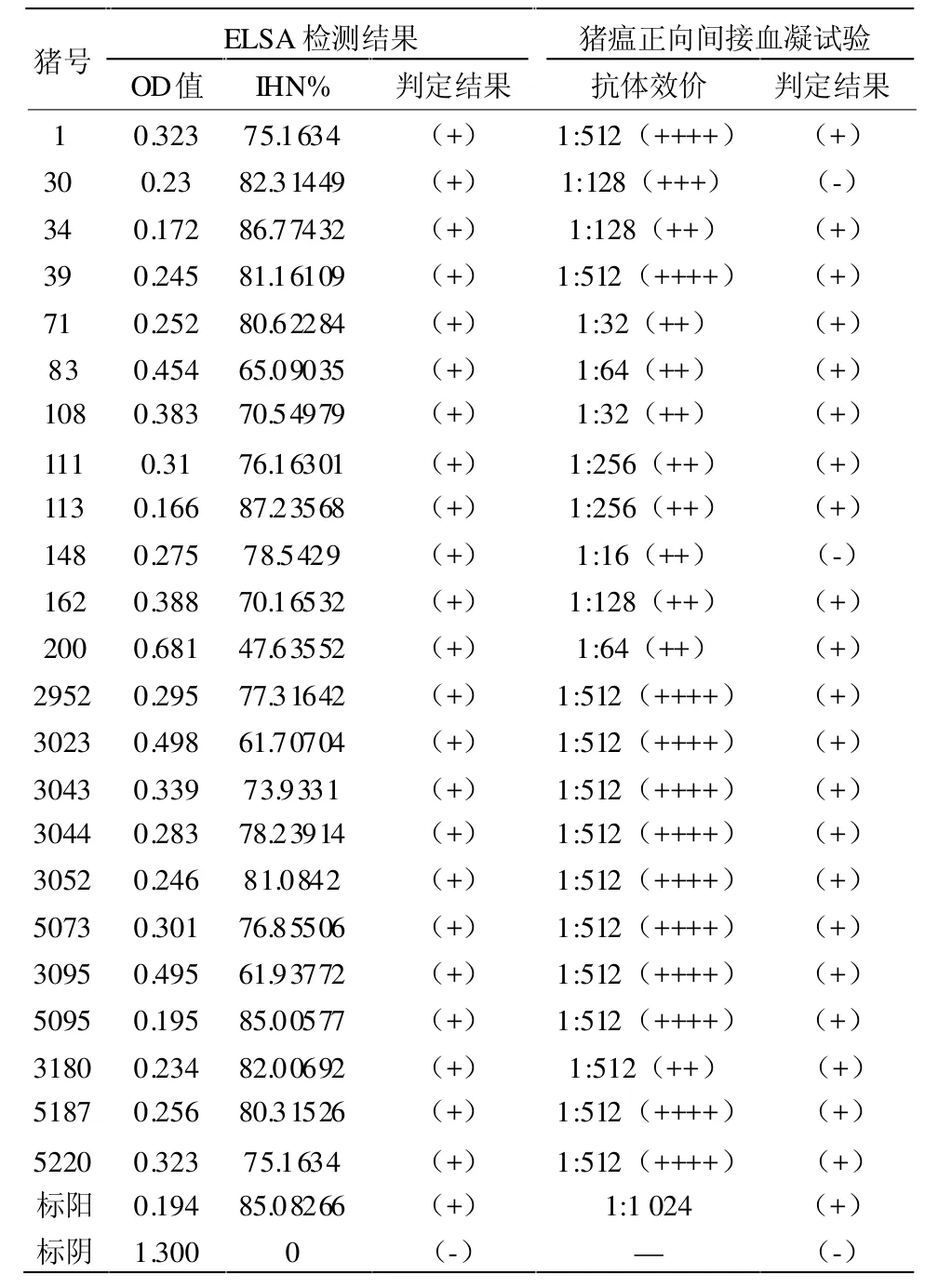
表2 B猪场猪瘟免疫检测结果
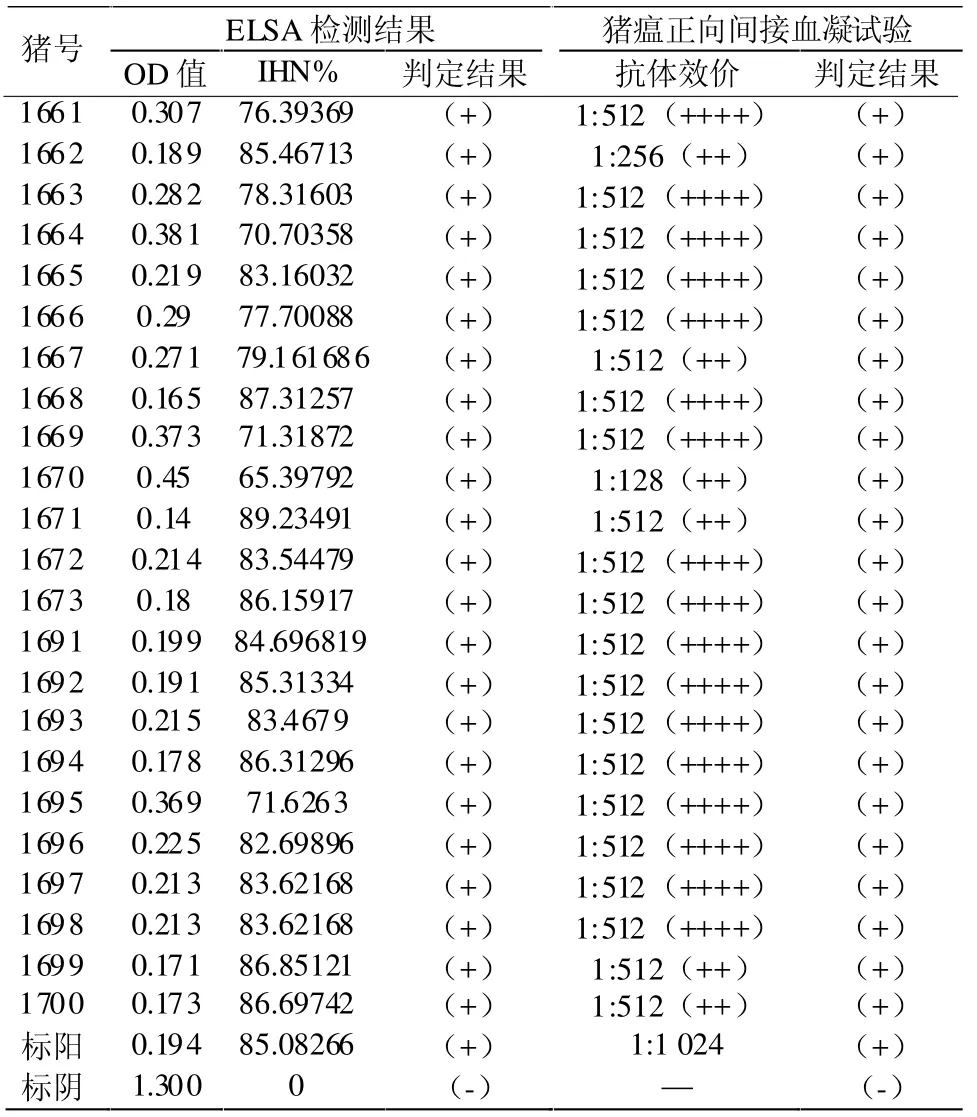
表3 C猪场猪瘟免疫检测结果
3 小结与讨论
1)ELISA 检测的抗体阻断率在 71~80、81~90 两个区域较多,血清数为57份;IHA检测的抗体在1:512区域较多,血清数53份,ELISA检测法的血清数分布更倾向正态分布,IHA检测法的血清数分布呈负偏态分布。两种方法检测的抗体值也存在较大差异,如B场中71号猪血清ELISA检测IHN%值为 80.62284,IHA 检测为 1:32;108 号猪血清ELISA检测IHN值为 70.54979,IHA检测为1:32;148号猪血清ELISA检测IHN%值为78.5429,IHA检测为 1:16;200号 猪 血清 检 测 IHN%值为47.63552,IHA检测为1:64等。造成这些差异的原因可能是:(1)手工操作的误差。如加样、稀释过程中出现的误差;(2)工作温度。如在ELISA试验过程中反应板需要在37℃温箱中分别培育2次,每次各2 h,而在IHA试验过程中只需保持室温在20~25℃即可;(3)在ELISA试验中洗板次数的多少和显色时间的长短也是决定样品OD值大小的关键步骤。
2)通过试验比较,两种检测方法在确定母源抗体消长规律、掌握疫苗免疫效果、猪场净化等方面均可提供较为准确的理论依据。从费效比来看,ELISA试验具有快速、敏感、重复性好、样品用量少、结果容易判断等优点,但它对实验操作人员、试验仪器设备、工作温度等均有很高的要求,并且成本较高,而IHA试验也具有快速、敏感、特异性强等特点,且不需要特殊设备,检测成本低,有利于推广使用。
