嗜酸氧化亚铁硫杆菌中金属转运基因的克隆与差异表达
2013-12-18吴学玲张云静刘代刚范宏伟刘学端
吴学玲,张云静,刘代刚,段 红,范宏伟,刘学端
(中南大学 资源加工与生物工程学院 教育部生物冶金重点实验室,长沙 410083)
At.ferrooxidans是一种以亚铁、硫粉或者金属硫化物作为能源物质的革兰氏阴性、化能自养和嗜酸的中温浸矿菌[1],工业上广泛应用于铜、锌、镍、镉和其他金属离子的生物浸出[2]。在生物浸出过程中,At.ferrooxidans经常遇到许多不利的环境变化,如生长环境温度升高、营养物质缺乏、pH值改变和有毒重金属的出现[3]。然而At.ferrooxidans对某些金属离子具有较强的抗性,研究发现向培养基中加入 600 mmol/L的 Zn2+或者 200 mmol/L的 Cu2+之后,At.ferrooxidans仍然能够生长[4],这使At.ferrooxidans在回收铜或者锌等金属的生物浸出过程中具有广泛应用价值[5]。因此,研究这些微生物耐受高浓度金属离子的分子机制意义重大。At.ferrooxidans DC菌株从中国广西大厂矿区的酸性矿坑水中分离出来,利用电感耦合等离子体原子发射光谱测定来自大厂矿区的矿坑水样品的元素组成,结果表明样品中含有多种元素,例如锰、锌、镉、铜、铁和硫等,其中锰、锌和镉含量分别是 815.9、1655.71 和 56.13 mg/L[6−7]。
虽然锌和锰对于生物体来说是必需的微量元素,许多重要的功能蛋白和酶都需要锌作为其结构或者辅助因子[8−9]。但是,一旦体内锌离子的浓度过高,将会对呼吸链产生抑制从而对细胞造成毒害作用[10−11]。锰以几种不同的价态存在,作为蛋白辅因子时它在电子传递反应中起催化剂的作用。同时,锰是必需的金属酶的组分,包括依赖于Mn2+的超氧物歧化酶。另外,锰是许多酶的激活剂,这些酶主要参与不同的代谢途径如 DNA合成、糖代谢或者蛋白修饰等。与其他必需的过渡态金属一样,过量的锰对生物体也会产生毒害作用。因为锰和铁竞争共同的转运体和配体,锰毒性的经典效应是引起缺铁[12]。镉对于生物体来说是一种非必需的重金属元素,少量存在就对生物体造成很大的毒害作用。大厂矿区的浸矿液中金属离子的含量远远超出At.ferrooxidans生长需要的微量元素,但是At.Ferrooxidans依然能很好地生长,说明它能够耐受很高浓度的金属离子。然而,至于是何种机制使 At.ferrooxidans具有如此高的抗锰、锌和镉的能力至今仍不清楚。关于At.ferrooxidans对金属的抗性研究集中在Cu2+、As3+及Ag+的抗性机制,而关于其对Mn2+、Zn2+和 Cd2+的抗性机制较少被报道。本文作者旨在通过研究金属转运基因在金属离子胁迫下的相对表达,说明金属离子转运基因编码的蛋白参与金属离子的转运,从金属离子转运方面研究At.ferrooxidans耐受高浓度金属离子的分子机制。已发现的保护细胞免受高浓度Zn2+的毒害的外排系统有3类:耐药结节分化家族RND (Resistance, nodulation and division),多药物外排转运体、P型ATP酶和阳离子扩散推动子[13]。几个转运体基因家族参与 Mn2+的转运,包括阳离子/H+反向转运体,与抗性相关的巨噬细胞蛋白转运体,阳离子促进扩散转运体家族和P型ATP酶[14]。CadA P型ATP酶和RND CzcCBA 复合物参与Cd2+的外排[15]。
本文作者以 4个金属转运基因(afe_0671、afe_0674、afe_1143和afe_1144)作为目标基因,利用实时荧光定量 PCR 技术[16−17]验证它们在不同浓度Zn2+、Mn2+和Cd2+的胁迫下的相对表达,并采用生物信息学手段对这4个基因及其编码的蛋白进行结构和功能的预测,为研究At.ferrooxidans对金属离子的抗性机制奠定理论基础。
1 实验
1.1 实验材料
1.1.1 菌种与培养基
At.ferrooxidans DC菌株由中南大学生物冶金教育部重点实验室从取自广西大厂铜矿的酸性矿坑废水中分离得到。
At.ferrooxidans DC菌株生长于 9K基础培养基[18],30 ℃,170 r/min 摇床无菌培养。能源物质为单质硫 10 g/L。
1.1.2 其他试剂
DNA提取试剂盒为TIANamp Bacteria DNA Kit(TIANGEN Inc.),DNA凝胶回收试剂盒为TIAgel midi purification Kit (TIANGEN),PGM-T平末端连接试剂盒(TIANGEN Inc.),RNA 提 取试 剂 为 Trizol(Invitrogen),RNA纯化试剂盒为 Rneasy mini kit(Qiagen),RNA反转录试剂盒为Rever Tra Ace®qPCR RT Kit (TOYOBO)。
1.2 实验方法
1.2.1 DNA的提取及4个基因的克隆测序
细菌基因组提取使用 TIANamp Bacteria DNA Kit,以提取后的基因组为模板扩增目标基因。PCR扩增条件为:预变性94 ℃,3 min;变性94 ℃,40 s;退火60 ℃,45 s;延伸72 ℃,90 s,共32个循环;最后72 ℃延伸10 min。PCR产物经琼脂糖凝胶电泳检测后切胶纯化目的片段,将纯化后的PCR产物平末端加A之后连接到PGM-T载体转化到Escherichia coli DH5α感受态细胞中,重组菌在LB平板上过夜培养之后挑取阳性克隆子做穿刺管培养12 h后送去上海生物工程公司测序。实验中所用到的引物均在表1中。
1.2.2 At.ferrooxidans DC菌株对Mn2+、Zn2+及Cd2+最大耐受浓度的测定
根据预实验的结果,本研究中选用 0.32、0.34、0.36和0.38 mol/L的Mn2+,0.06、0.1、0.14和0.18 mol/L的Zn2+及0.04、0.06和0.08 mol/L的Cd2+作为胁迫环境。将At.ferrooxidans DC菌株接种至加入不同浓度的Mn2+、Zn2+和Cd2+的9K培养基中,起始菌浓度均为5×106cell/mL,30 ℃,170 r/min 摇床无菌培养。其中空白(Blank)是不接种不加入金属离子的生长条件,0 mol/L是接种但不加入金属离子的生长条件。每24 h测定培养液的pH值,测定10 d。
1.2.3 At.ferrooxidans DC菌株的生长条件
根据最大耐受浓度的测定,本研究中选用 0.1、0.2、0.3和0.4 mol/L 的 Mn2+,0.04、0.08、0.12和0.16 mol/L的Zn2+以及0.04和0.08 mol/L的Cd2+作为刺激环境。首先将At.ferrooxidans DC菌株接种至9 K培养基,培养至对数期时离心收集菌种(4 ℃,10 min,12 000 r/min),然后将所收集的菌接种于含有0、0.1、0.2、0.3 和 0.4 mol/L Mn2+和 0、0.04、0.08、0.12和0.16 mol/L Zn2+及0.04、0.08 mol/L Cd2+的9 K 培养基中,使菌的起始浓度均为5×107cell/mL,短暂培养之后,离心收集菌种,马上进行RNA提取。
1.2.4 RNA的提取与cDNA的合成
采用Trizol一步法提取总RNA,用RNeasy mini kit (Qiagen)纯化总RNA,用NanoDrop微量分光光度计(NanoDrop Technologies)检测RNA的浓度和纯度。取等量的 RNA进行反转录,反转录采用 Rever Tra Ace®qPCR RT Kit (TOYOBO),以总RNA中mRNA为模板反转录合成cDNA,反转录后用 NanoDrop微量分光光度计测定每一个cDNA的浓度,然后将cDNA样品浓度均稀释至200 mg/L,于−20 ℃保藏备用。
1.3 RT-qPCR
1.3.1 标准样品的制备
分别以目标基因及内参基因为样品, 以cDNA为模板进行普通PCR扩增,琼脂糖凝胶电泳,切下目的条带采用凝胶回收试剂盒进行纯化。然后将纯化后的PCR产物进行10倍梯度稀释, 取103~109做标准品用于制备标准曲线, 做7个点。普通PCR程序如下:预变性94 ℃,3 min;变性94 ℃,30 s;退火55 ℃,30 s;延伸72 ℃,30 s,共30个循环;最后72 ℃延伸5 min。
1.3.2 实时荧光定量PCR
RT-qPCR的反应程序如下:预变性95 ℃,3 min;变性 95 ℃,30 s;退火 58 ℃,30 s;延伸 72 ℃,30 s,共40个循环;退火55~95 ℃,10 s, 每循环一次温度增加0.5 ℃共80个循环。每组实验设置3个平行,选用16S rRNA为内参基因[19],阴性对照不加任何模板。实时荧光定量 PCR的引物如表2所列,数据采用Expression Macro™ Version 1.1 (http∶//www.gene-quantification.info/ )软件进行处理。
1.3.3 生物信息学分析
用 BLAST (http∶//www.ncbi.nih.gov/blast/Blast.cgi)进行相似性搜索。ORF Finder(http∶//www.ncbi.nlm.nih.gov/gorf/gorf.html)寻找基因的开放阅读框。ExPASy Proteomics Server (http∶//expasy.org/cgi-bin/ pi_tool)进行蛋白质等电点及相对分子量的计算。PSORTb v.3.0(http∶//www.psort.org/psortb)做蛋白亚细胞结构定位。TMHMM Server v.2.0 (http∶//www.cbs.dtu.dk// servive-s/TMHMM-2.0/)做蛋白质的跨膜分析。NCBI conserved domains(http∶//www.ncbi.nlm.nih.gov/Structure/cdd/wrp sb.cgi)[20]寻找蛋白的保守区域。

表1 常规PCR引物Table 1 Primers used in regular PCR
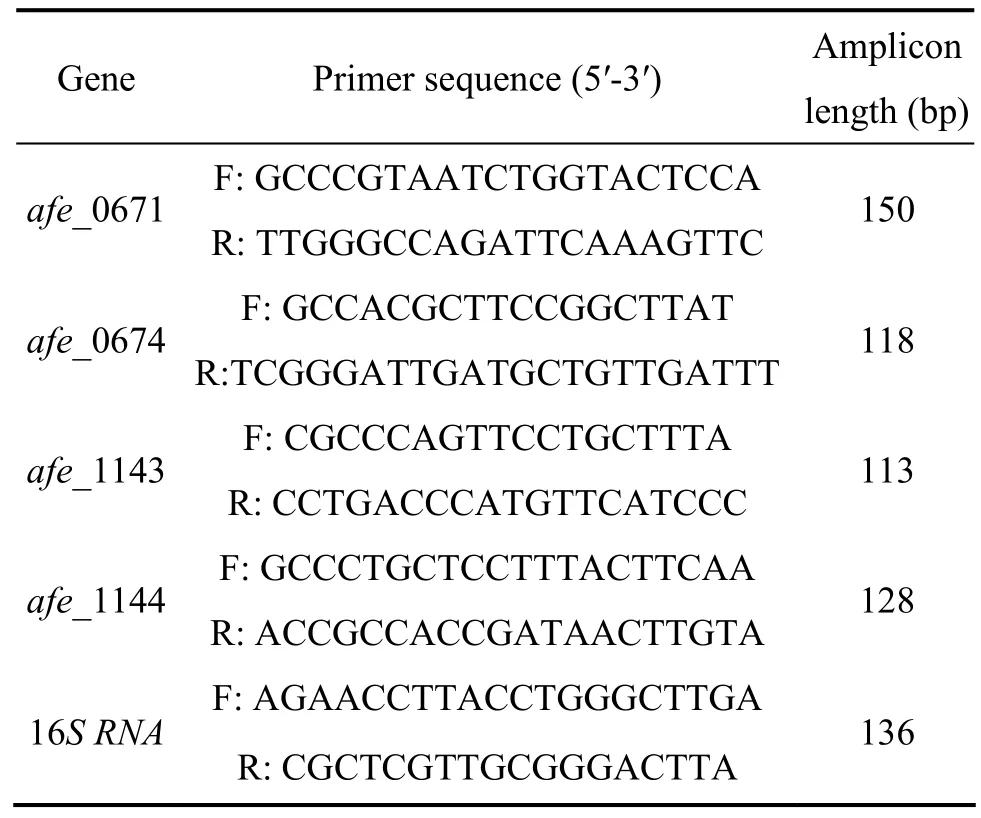
表2 用于RT-qPCR的目标基因的引物Table 2 Primers used for RT-qPCR of targeted genes
2 结果与讨论
2.1 4个基因的克隆测序
以At.ferrooxidans DC基因组为模板通过扩增和克隆得到 afe_0671、afe_0674、afe_1143和 afe_1144基因片段,说明At.ferrooxidans DC菌株中含有这4个基因。各基因的测序结果经 BLAST序列比对,结果显示与At.ferrooxidans ATCC 23270中对应的基因的序列相同,说明这4个基因编码的蛋白的功能与At.ferrooxidans ATCC 23270菌株中对应的基因编码的蛋白的功能可能相同。
2.2 At.ferrooxidans DC菌株对Mn2+、Zn2+及Cd2+最大耐受浓度的测定
实验结果表明不加入金属离子时,培养10 d后,培养液的pH值从2.0降为1.18。加入不同浓度的金属离子之后培养液的pH值变化受到不同程度的抑制,且随着金属离子浓度的增加,pH值变化越小。本研究中At.ferrooxidans DC菌株是以硫粉作为能源物质,培养液pH值变化越小,说明DC菌株的生长被抑制作用越强。图1所示为不同金属离子浓度下pH值的变化曲线。从图1(a)可以看出,当Mn2+的浓度为0.32 mol/L,培养10 d后,培养液的pH值从2.0降为1.41,说明DC菌株的生长明显的被抑制;当Mn2+的浓度为0.38 mol/L,培养10 d后,培养液的pH值降为1.85,培养液的pH值变化很小,DC菌株的生长几乎完全被抑制,所以At.ferrooxidans DC菌株对Mn2+的最大耐受浓度是0.38 mol/L。由图1(b)可看出,当Zn2+的浓度为0.06 mol/L时,培养10 d后,培养液的pH值从2.0降为1.25,At.ferrooxidans DC菌株的生长较小的被抑制;当Zn2+的浓度为0.18 mol/L时,培养10 d后,培养液的pH值没有变化,At.ferrooxidans DC菌株的生长完全被抑制,所以At.ferrooxidans DC菌株对Zn2+的最大耐受浓度是0.18 mol/L。由图1(c)可看出,当Cd2+的浓度是0.04 mol/L时,培养10 d后,培养液的pH值降为1.28,DC菌株的生长较小的被抑制;当Cd2+的浓度是0.08 mol/L时,培养10 d后,培养液的pH值降为 1.93,DC菌株的生长几乎完全被抑制,所以At.ferrooxidans DC菌株对 Cd2+的最大耐受浓度是0.08 mol/L。

图1 不同金属离子浓度下pH值变化曲线Fig.1 pH change curves at different metal ions concentrations∶ (a)Mn2+; (b)Zn2+; (c)Cd2+
以硫粉作为能源物质时,At.ferrooxidans DC菌株对Mn2+、Zn2+及Cd2+的最大耐受浓度分别是0.38、0.18和0.08 mol/L。实验结果表明,Mn2+、Zn2+和Cd2+对DC菌株毒害作用由大到小顺序依次为 Cd2+、Zn2+、Mn2+。3种离子对DC菌株毒害作用大小不同包含两方面的原因,一方面是3种金属离子本身的毒性大小不同;另一方面是DC菌株对这3种金属离子的解毒机制不同。锌和锰对于生物体来说是一种必需的微量元素,低浓度时有利于细菌的生长,其浓度超过正常生理浓度时就会产生毒害作用,抑制细菌的生长。而镉对于生物体来说是一种非必需的元素,只要存在就会对细菌产生毒害作用[21],所以 Cd2+对 At.ferrooxidans DC菌株的毒害作用最大。生物体有5种基本的机制即有毒金属离子外排、酶的转变、胞内胞外的隔离、通过透性屏障的外排和降低细胞内靶部位的敏感性保护细胞免受金属离子毒害[22]。At.ferrooxidans中存在许多金属抗性基因和金属离子转运体基因,这些基因编码的蛋白可能参与金属离子的解毒过程。
2.3 不同浓度Mn2+、Zn2+和Cd2+刺激下金属转运基因的相对表达
实时荧光定量PCR后,溶解曲线峰带单一,没有杂峰出现,说明引物的特异性较好;标准曲线R2值均接近于1,说明Ct值与其起始拷贝数的对数值之间的关系性好; 内参基因16S rRNA在不同环境中的表达量均较为衡定,无显著性差异(P<0.05)。经内参基因校正,在Mn2+刺激下各基因的相对表达量如图2(a)所示,在低浓度Mn2+(0.1 mol/L)刺激下,其中的3个基因(afe_0671,afe_1143和afe_1144)的表达量分别上调1.99、3.42和2.12倍,afe_0674的表达量没有上调;在高浓度Mn2+(0.4 mol/L)刺激下,4个基因(afe_0671,afe_0674,afe_1143和 afe_1144)的表达量分别上调437.66、743.86、301.14和676.54倍。在Zn2+刺激下各基因相对表达量如图2(b)所示,在低浓度Zn2+(0.04 mol/L)刺激下,4个基因(afe_0671,afe_0674,afe_1143和afe_1144)的表达量分别上调1.3、1.32、4.13和5.7倍;在高浓度 Zn2+(0.16 mol/L)刺激下,4个基因(afe_0671,afe_0674,afe_1143和afe_1144)的表达量分别上调237.78、85.49、227.41和149.29倍。在Cd2+刺激下各基因的相对表达量如图2(c)所示,在低浓度Cd2+(0.04 mol/L)刺激下,4 个基因(afe_0671、afe_0674,afe_1143和afe_1144)的表达量分别上调3、3.29、5.02和6.06倍;在高浓度Cd2+(0.08 mol/L)刺激下,4个基因(afe_0671、afe_0674、afe_1143和afe_1144)的表达量分别上调 6.08、12.32、18.55和 32.03倍。从图2中可以看出,在不同浓度的Mn2+、Zn2+及Cd2+的刺激下,4个基因(afe_0671、afe_0674、afe_1143和afe_1144)的表达量的表达量均上调,且随着Mn2+、Zn2+及Cd2+浓度的增加,各基因上调的倍数升高。实验数据表明At.ferrooxidans DC菌株中这 4个基因(afe_0671、afe_0674、afe_1143 和 afe_1144)对于 Mn2+、Zn2+及Cd2+的胁迫非常敏感,且随着金属离子浓度的增加,其表达量上调倍数升高,说明它们可能与Mn2+、Zn2+及Cd2+的转运密切相关。

图2 不同金属离子浓度刺激下金属转运基因的差异表达Fig.2 Differential expression of metal transport genes under different metal ions concentrations∶ (a)Mn2+; (b)Zn2+; (c)Cd2+
MOORE和HELMANN[23]认为在金属离子有限的条件下金属离子和螯合复合物通过主动运输转运至体内;相反的,当金属离子积累到超过生理需求时,金属螯合或者外排系统就会被诱导。另外,NAVARRO等[19]认为随着金属离子浓度的增加基因表达量升高,编码外排系统的基因被诱导。在金属离子刺激下,4个基因(afe_0671、afe_0674、afe_1143和afe_1144)的表达量上调,且随着金属离子浓度的增加,上调倍数增加,推测这4个基因编码的蛋白的作用可能是外排金属离子或者参与金属离子的外排。虽然afe_0671和afe_1144编码的蛋白被报道特异性的转运Zn2+[24−25],但是afe_0671、afe_1143和afe_1144的表达量也被报道在Cu2+的刺激下上调[2,19],说明afe_0671、afe_1143和afe_1144所编码的蛋白也与Cu2+的转运相关。结合以前的报道推测,afe_0671、afe_1143和afe_1144所编码的蛋白可能参与Zn2+、Mn2+、Cu2+和Cd2+的外排;afe_0674编码的蛋白可能参与Zn2+、Mn2+及Cd2+的外排,至于其是否参与Cu2+的外排还没有报道过。这些基因编码的蛋白是否参与其他的金属离子的转运,还有待实验证明。
在At.ferrooxidans ATCC 23270的全基因组中,afe_0671编码重金属外排系统蛋白, afe_1143编码重金属外排转运体,MFP(Membrane fusion protein)subunit,afe_0671和afe_1144基因编码属于CzcA家族的重金属外排泵蛋白。细菌中 CzcA是复合物CzcCBA的组分,化学渗透复合物 CzcCBA 是由CzcC(小的外膜蛋白),CzcB(连接CzcA与CzcC形成一个连续的从细胞质到胞外通道的周质耦合蛋白)和CzcA(一个大的内膜蛋白)组成一个内外膜通道。另外,作为离子/质子交换载体外排 Cd2+、Zn2+和 Co2+的CzcCBA复合物是金属抗性家族RND的一个成员[26]。属于CzcA家族的外排镉、锌、钴的重金属外排泵负责金属的解毒。克隆实验结果显示,At.ferrooxidans DC中的这4个基因的序列与At.ferrooxidans ATCC 23270中对应的基因的序列相同,说明这4个基因编码的蛋白的功能与At.ferrooxidans ATCC 23270菌株中对应的基因编码的蛋白的功能可能相同。在标准菌株中,这4个基因编码的蛋白的功能被推测为参与金属离子的外排,所以,在At.ferrooxidans DC中,这4个基因编码的蛋白的功能也是参与金属离子的外排,验证了本文作者的推测。
为了进一步验证本文作者的推测,采用生物信息学的手段对这4个基因(afe_0671、afe_0674、afe_1143和afe_1144)及其编码的蛋白进行分析。基因afe_0671的开放阅读框架的长度为3114 bp,编码一个相对分子量为112324.22 Da、等电点为9.18的12次跨膜的膜蛋白,该蛋白的保守序列是COG3696,被称为假定的银外排泵,主要参与无机离子的转运与代谢;afe_0674基因的开放阅读框架的长度为 363bp,编码一个相对分子量为12701.82 Da,等电点为9.73的蛋白,它的保守区域是 cl02363,被称为 CusF(Copper binding periplasmic protein )。在大肠杆菌中CusF是参与铜和银抗性的周质蛋白,CusF形成一个由5条链组成的β桶状的 OB(Oligonucleotide/oligosaccharide binding)折叠。Cu2+结合到CusF保守的H36、M47 and M49残基上;afe_1143基因的开放阅读框架的长度为1320 bp,编码一个相对分子量为47 204.05 Da、等电点为9.64的膜蛋白,它的保守区域是 PRK09783,其功能还没有完全确定,暂时被称为 CusB(copper/silver efflux system membrane fusion protein)。CusB连接内膜外排泵CusA和外膜通道CusC介导对铜和银的抗性,晶体结构显示 CusB具有多个金属离子结合位点[27];afe_1144基因的开放阅读框架的长度为3111 bp,编码一个相对分子量为112 374.33 Da、等电点为9.34的12次跨膜的膜蛋白,它的保守区域是 COG3696,也被称为推测的银外排泵,参与无机离子的转运和代谢。
3 结论
1)在不同浓度 Zn2+、Mn2+和 Cd2+的刺激下,以硫粉作为能源物质时,At.ferrooxidans DC菌株对Mn2+、Zn2+、Cd2+的最大耐受浓度分别是 0.38、0.18和0.08 mol/L,且随着金属离子浓度的增加,DC菌株的生长受到的抑制作用越大。
2)实验结果表明:Mn2+、Zn2+和Cd2+对DC菌株毒害作用由大到小的顺序依次为Cd2+、Zn2+、Mn2+。
3)在不同浓度 Mn2+、Zn2+和 Cd2+的刺激下,At.ferrooxidans DC菌株的4个基因(afe_0671、afe_0674、afe_1143和afe_1144)的相对表达量均呈上调趋势,且随着金属离子浓度的增加,上调倍数增加,说明这 4个基因对于Mn2+、Zn2+和Cd2+的胁迫非常敏感,而且这 4个基因的相对表达量与金属离子的浓度成正相关。
4)随着金属离子浓度的增加,基因的表达量升高,编码外排系统的基因被诱导,由此推测这4个基因编码的蛋白可能参与金属离子的外排。结合以前的报道认为,afe_0671、afe_1143和afe_1144编码的蛋白可能参与Zn2+、Mn2+、Cu2+及 Cd2+的外排,afe_0674编码的蛋白可能参与Zn2+、Mn2+及Cd2+的外排,至于其是否参与Cu2+的外排还没有报道过。
5)生物信息学分析表明,这4个基因编码的蛋白转运金属离子或者参与金属离子的转运。基因afe_0671和afe_1144编码的蛋白是参与金属离子转运的多次跨膜蛋白,基因afe_1143编码的蛋白是位于细胞质膜上的金属离子转运体蛋白,基因afe_0674编码的蛋白是一种参与Cu2+及Ag2+转运的蛋白。
[1]ORELLANA L H, JEREZ C A.A genomic island provides Acidithiobacillus ferrooxidans ATCC 53993 additional copper resistance∶ A possible competitive advantage[J].Applied Microbiology and Biotechnology, 2011, 92(4)∶ 761−767.
[2]REIS F C, MADUREIRA D J, VICENTINI R, CARLOS C,FERRAZ L F C, GARCIA O, OTTOBONI L.Transporter protein genes are differentially expressed in Acidithiobacillus ferrooxidans LR maintained in contact with covellite[J].World Journal of Microbiology and Biotechnology, 2010, 26(11)∶2061−2068.
[3]QIN Wen-qing, HUANG Qiu-xia, ZHU Jian-yu, YANG Peng,YU Run-lan, LI Jiao-kun, LIU Xue-duan, QIU Guan-zhou.Expression and function of two chaperone proteins, AtGroEL and AtGroES, from Acidithiobacillus ferrooxidans ATCC 23270[J].World Journal of Microbiology and Biotechnology,2011, 27(12)∶ 2981−2988.
[4]NOVO M T M, DASILVA A C, MORETO R, CABRAL P C P,COSTACURTA A, GARCIA O, OTTOBONI L.Thiobacillus ferrooxidans response to copper and other heavy metals∶ Growth,protein synthesis and protein phosphorylation[J].Antonie van Leeuwenhoek, 2000, 77(2)∶ 187−195.
[5]WATLING H R.The bioleaching of sulphide minerals with emphasis on copper sulphides[J].Hydrometallurgy, 2006,84(1/2)∶ 81−108.
[6]ZHOU Zhi-jun, YIN Hua-qun, LIU Yi, XIE Ming, QIU Guan-zhou, LIU Xue-duan.Diversity of microbial community at acid mine drainages from Dachang metals-rich mine, China[J].Transactions of Nonferrous Metals Society of China, 2010, 20(6)∶1097−1103.
[7]管 昊.大厂铅锌矿酸性矿坑水微生物多样性以及不同培养条件对群落的影响[D].长沙∶ 中南大学,2008∶ 1−62.GUAN Hao.Analysis of microbial communities in mined rainages of Da Chang lead-zinc mine, and influence of different culture conditions on community[D].Changsha∶ Central South University, 2008∶ 1−62.
[8]VALLEE B L, AULD D S.Zinc coordination, function and structure of zinc enzymes and other proteins[J].Biochemistry,1990, 29(24)∶ 5647−5659.
[9]PATZER S I, HANTKE K.The ZnuABC high-affinity zinc uptake system and its regulator Zur in Escherichia coli[J].Molecular Microbiology, 1998, 28(6)∶ 1199−1210.
[10]KASAHARA M, ANRAKU Y.Succinate-and NADH oxidase systems of Escherichia coli membrane vesicles[J].Journal of Biochemistry, 1974, 76(6)∶ 967−976.
[11]BEARD S J, HUGHES M N, POOLE R K.Inhibition of the cytochrome bd-terminated NADH oxidase system in Escherichia coli K-12 by divalent metal cations[J].FEMS Microbiology Letters, 1995, 131(2)∶ 205−210.
[12]CAILLIATTE R, SCHIKORA A, BRIAT J F, MARI S, CURIE C.High-affinity manganese uptake by the metal transporter NRAMP1 is essential for arabidopsis growth in low manganese conditions[J].The Plant Cell Online 2010, 22(3)∶ 904−917.
[13]HANTKE K.Bacterial zinc transporters and regulators[J].Biometals, 2001, 14(3)∶ 239−249.
[14]PITTMAN J K.Managing the manganese∶ Molecular mechanisms of manganese transport and homeostasis[J].New Phytologist, 2005, 167(3)∶ 733−742.
[15]SILVER S, PHUNG L E T.A bacterial view of the periodic table∶ Genes and proteins for toxic inorganic ions[J].J Ind Microbiol Biotechnol, 2005, 32∶ 587−605.
[16]ZAMMIT C M, MUTCH L A, WATLING H R, WATKIN E L J.Evaluation of quantitative real-time polymerase chain reaction for enumeration of biomining microorganisms in culture[J].Hydrometallurgy, 2008, 94(1/4)∶ 185−189.
[17]刘小荣, 张 笠, 王勇平.实时荧光定量 PCR技术的理论研究及其医学应用[J].中国组织工程研究与临床康复, 2010,14(2)∶ 329−332.LIU Xiao-rong, ZHANG Li, WANG Yong-ping.Theory study and medical application of real-time quantitative polymerase chain reaction[J].Journal of Clinical Rehabilitative Tissue Engineering Research, 2010, 14(2)∶ 329−332.
[18]吴学玲, 袁 鹏, 胡 琪, 侯冬梅, 苗 博, 邱冠周.不同嗜酸氧化亚铁硫杆菌(DY15, DY26, DC)对黄铜矿的浸出及其基因 Afe0022 的差异表达[J].中国有色金属学报, 2011, 21(4)∶0392−0398.WU Xue-ling, YUAN Peng, HU Qi, HOU Dong-mei, MIAO Bo,QIU Guan-zhou. Bioleaching of chalcopyrite by Acidithiobacillus ferrooxidans DY15, DY26 and DC and difference expressions of gene Afe0022[J].The Chinese Journal of Nonferrous Metals, 2011, 21(4)∶ 0392−0398.
[19]NAVARRO C A, ORELLANA L H, MAURIACA C, JEREZ C A.Transcriptional and functional studies of Acidithiobacillus ferrooxidans genes related to survival in the presence of copper[J].Appl Environ Microbiol, 2009, 75(19)∶ 6102−6109.
[20]MARCHLER-BAUER A, LU Shen-nan, ANDERSON J B,CHITSAZ F, DERBYSHIRE M K, DEWEESE-SCOTT C,JESSICA H.CDD∶ A conserved domain database for the functional annotation of proteins[J].Nucleic Acids Research,2011, 39(1)∶ D225−D229.
[21]OUZIAD F, HILDEBRANDT U, SCHMELZER E, BOTHE H.Differential gene expressions in arbuscular mycorrhizalcolonized tomato grown under heavy metal stress[J].Journal of Plant Physiology, 2005, 162(6)∶ 634−649.
[22]DOPSON M.Growth in sulfidic mineral environments∶ Metal resistance mechanisms in acidophilic micro-organisms[J].Microbiology, 2003, 149(8)∶ 1959−1970.
[23]MOORE C M, HELMANN J D.Metal ion homeostasis in Bacillus subtilis[J].Current Opinion in Microbiology, 2005, 8(2)∶188−195.
[24]LEGATZKI A, GRASS G, ANTON A, RENSING C, NIES D H.Interplay of the Czc system and two P-type atpases in conferring metal resistance to ralstonia metallidurans[J].Journal of bacteriology, 2003, 185(15)∶ 4354−4361.
[25]ANTON A, GROßE C, REIßMANN J, PRIBYL T, NIES D H.CzcD is a heavy metal ion transporter involved in regulation of heavy metal resistance in ralstonia sp.strain CH34[J].Journal of Bacteriology, 1999, 181(22)∶ 6876−6881.
[26]SILVER S, PHUNG L T.A bacterial view of the periodic table∶genes and proteins for toxic inorganic ions[J].Journal of Industrial Microbiology & Biotechnology, 2005, 32(11/12)∶587−605.
[27]SU Chih-chia, YANG Feng, LONG Feng, REYON D, ROUTH M D, KUO D W.Crystal structure of the membrane fusion protein CusB from Escherichia coli[J].Journal of Molecular Biology, 2009, 393(2)∶ 342−355.
