Co-Ni-Fe-Mn配合−沉淀体系的平衡热力学
2013-12-18马立文聂祚仁席晓丽韩新罡
马立文,聂祚仁,席晓丽,韩新罡
(北京工业大学 材料科学与工程学院,北京 100124)
Co、Ni是贵重的有色金属,广泛地应用于国防、原子能、航天、化工、电子等高科技领域,是重要的战略资源。然而,由于原生资源的匮乏,钴镍二次资源的回收利用逐渐受到重视,成为研究热点[1−4]。钴镍二次资源主要为报废的机器、设备、金属构件、废旧电池、失效催化剂、废功能合金、冶炼废渣及其他化工过程产生的废料等[5],除含Co和Ni以外,一般还含有Fe、Mn、Cu、Zn、Cd等有价金属,成分比较复杂,分离较为困难。
钴镍二次资源的组成多样、含量不同,但也具有其特点。废 Ni-H电池及废镍合金含 Ni较高,可达11%~55.6%;废锂电池及废钴催化剂等含 Co较高,可达10%~50%;钴镍之外含量较高的元素主要是Fe、Mn,在某些废合金及废渣中可分别达到 70%及24%[6−9]。因此,有效分离 Co、Ni、Fe、Mn是湿法回收钴镍二次资源中一个具有普遍意义的问题。钴镍二次资源湿法回收过程中涉及的方法主要是化学沉淀法、溶剂萃取法和离子交换法[10−12]。这些方法的主要目的是对二次资源中的复杂多金属成分进行有效分离。其中沉淀法不仅可以分离金属组分,还能作为一种反应方法制备共沉淀材料,尤其在引入配合剂的情况下,溶液中金属离子的配合、沉淀行为更为复杂,但同时也为有目的地调控金属离子的分离和共沉淀提供了可能性。已有研究者对某些金属离子在溶液中的配合行为进行了研究[13−14],分析出单一金属在简单配合剂作用下的平衡规律;也有不少文献利用配合−沉淀体系制备共沉淀化合物[15−16],合成出特定比例的产物;但总体而言,配合−沉淀体系的研究还是不够深入和全面。此外,目前大部分研究二次资源回收的文献主要关注工艺过程的优化,对二次资源综合回收的理论研究较少且不系统。因此,如能查明钴镍二次资源涉及的多金属配合−沉淀体系中的各种化学反应热力学平衡规律,将有利于丰富和完善二次资源综合回收的理论框架,同时为优化二次资源回收方法提供指导。
本文作者选择钴镍二次资源中最常见的4种金属元素(Co、Ni、Mn、Fe),以 OH−、NH3为配合剂,OH−、CO32−、S2−为沉淀剂,构建多个配合−沉淀体系,应用同时平衡原理对体系中的化学平衡进行热力学计算,绘制不同条件的多种热力学平衡图,全面、系统地揭示溶液中Co、Ni、Fe、Mn金属离子的沉淀分离条件及限度,从而为钴镍二次资源的综合回收提供理论依据。
1 配合−沉淀体系中的金属离子状态
1.1 Me-OH−体系lg[Me]—pH图
在Me-H2O体系中,Me(Co、Ni、Fe、Mn)作为待分离的金属元素,OH−既可以作为弱配合剂又可以作为沉淀剂。根据表1所列化学反应及平衡常数[17]结合质量守恒定律及同时平衡原理,可以建立体系中各反应物种的平衡关系式(1)~(12)。
由水的电离平衡可得到式(1)和(2):

由金属离子生成氢氧化物的沉淀反应可以得到式(3)~(7):

在溶液中,金属离子能够与OH−发生配合作用,从而得到溶液中各金属离子总浓度的表达式(8)~(12):

联立式(1)~(12)可以得到溶液中各金属离子总浓度与pH值的关系,作lg[Me]—pH图如图1所示。从图1可以看出,随着pH值的升高,各金属离子在水中的总浓度下降,到 pH=9.5时不变,说明此时溶液中所有金属达到沉淀最大值。对于Fe3+,在pH=3时已基本沉淀完全,而其他金属离子还大量保留在溶液中。因此,理论上可以采用水解的方法在pH=3时预先沉淀Fe(OH)3分离Fe,而其他金属离子不能通过简单的水解沉淀加以分离。

表1 配合−沉淀体系涉及的化学反应及平衡常数[17]Table 1 Reactions and equilibrium constants in complex-precipitation system[17]
1.2 Me-OH−-CO32−体系 lg[Me]—pH 图

图1 Me-OH−体系lg[Me]—pH曲线Fig.1 lg[Me]—pH curves in Me-OH− system
在 Me-OH−体系中,OH−既是配合剂,又是沉淀剂,但其沉淀作用对于Ni、Co、Mn、Fe均很接近,故金属离子未能被选择性分离,而是共沉淀。为此,可以在体系中再引入沉淀剂 CO32−,考察不同金属离子的沉淀效果。在Me-OH−-CO32−体系中考虑碳酸的电离,可以得到式(13):

在Me-OH−-CO32−体系中,由于同时有氢氧化物沉淀和碳酸盐沉淀生成,故溶液中游离金属离子浓度为该两种沉淀反应所得离子浓度的最小值:
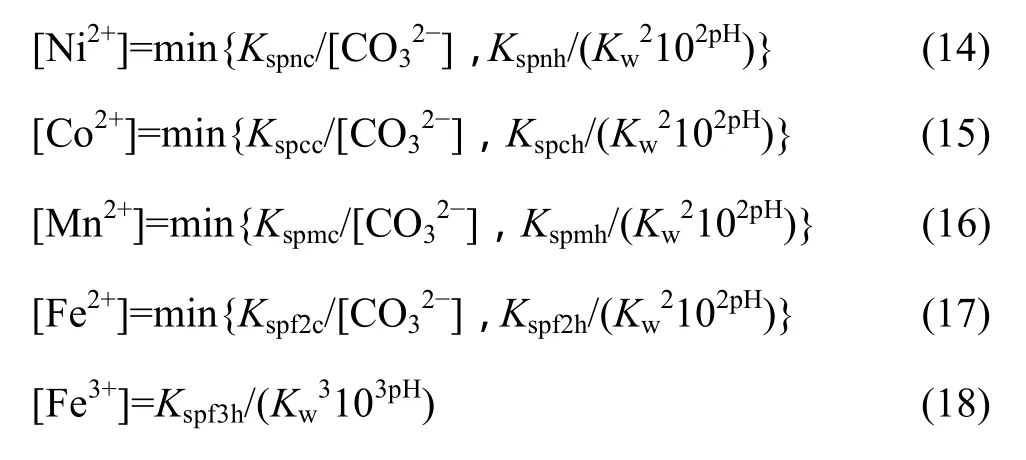
联立式(1)~(18),在碳酸根总浓度[C]=1 mol/L时可以得到溶液中各金属离子总浓度与 pH值的关系,作lg[Me]—pH图如图2所示。从图2可以看出,随着pH值的增加,溶液中的金属离子浓度先下降后升高,由于各金属离子在 Me-OH−-CO32−体系中的沉淀趋势不同,在pH值为6~13范围内,金属离子浓度曲线普遍出现一个波谷,其中沉淀趋势最大的是 Co而最难沉淀的是Ni。由于各金属离子均能较大程度的沉淀下来,故很难在该体系中直接分离这些金属。
1.3 Me-OH−-S2−体系 lg[Me]—pH 图
在 Me-OH−体系的基础上引入沉淀剂 S2−,得到Me-OH−-S2−体系,考虑体系中 HS的电离,可以得到式(19):

图2 Me-OH−-CO32−体系 lg[Me]—pH 曲线([C]=1 mol/L)Fig.2 lg[Me]—pH curves in Me-OH−-CO32− system ([C]=1 mol/L)
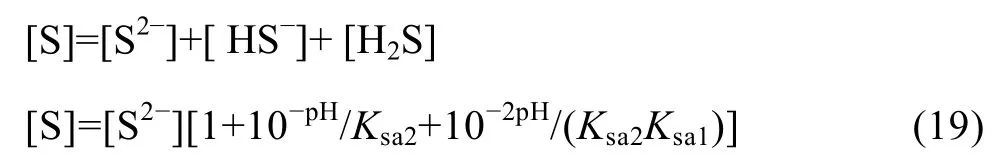
在Me-OH−-S2−体系中,由于同时存在氢氧化物和硫化物沉淀生成,故溶液中游离金属离子浓度为该两种沉淀反应所得离子浓度的最小值:

联立式(1)~(12)、(19)和(20)~(24),可以得到 S2−总浓度[S]=1 mol/L时溶液中各金属离子总浓度与pH值的关系,作lg[Me]—pH图如图3所示。从图3可以看出,随着 pH值的增加,溶液中的金属离子浓度下降。Fe3+平衡浓度最小,最低仅约为 10−26mol/L,说明其硫化物沉淀趋势最大;其次是 Ni2+和 Co2+,在pH=0时即可沉淀完全。而Fe2+在pH=4,Mn2+在pH=6时才沉淀完全。因此,在Me-OH−-S2−体系中通过控制条件,一定范围内可以将 Co、Ni和 Fe、Mn进行分离。
1.4 Me-OH−-NH3体系 lg[Me]—pH 图
在Me-OH−体系中,OH−既是沉淀剂又是配合剂,但OH−配合作用较弱,导致金属离子容易共沉淀而不易分离。为此,在该体系中引入配合作用较强的配合剂NH3,构建Me-OH−-NH3体系,考察各金属离子的分离行为的变化。在Me-OH−-NH3体系中存在氨的电离,可以得到式(25)和(26):

图3 Me-OH−-S2−体系 lg[Me]—pH 曲线([S]=1 mol/L)Fig.3 lg[Me]—pH curves in Me-OH−-S2− system ([S]=1 mol/L)

在Me-OH−-NH3体系中,金属离子能够与OH−、NH3同时发生配合作用,从而得到溶液中金属离子总浓度的表达式(27)~(31):


联 立式(1)~(7)和 (25)~(31)可以得到氨总浓度[N]=1 mol/L时溶液中各金属离子总浓度与pH值的关系,作lg[Me]—pH图如图4所示。从图4可以看出,氨能够配合大部分 Ni2+、Co2+、Mn2+,对 Ni2+的配合作用最明显,而几乎不配合Fe3+。由此可以认为,金属元素Ni、Co、Mn、Fe中的Fe,可以以Fe3+的形式在 Me-OH−体系或 Me-OH−-NH3体系中,通过预先调节pH=3初步水解分离。Ni、Co、Mn在Me-OH−-NH3体系中比在 Me-OH−体系中有更好的分离效果,然而分离程度仍然不显著。

图4 Me-OH−-NH3体系lg[Me]—pH曲线([N]=1 mol/L)Fig.4 lg[Me]—pH curves in Me-OH−-NH3 system ([N]=1 mol/L)
1.5 Me-OH−-NH3-CO32−体系中的金属离子状态
1.5.1 lg[Me]—pH图
为了进一步探讨配合−沉淀体系中 Ni、Co、Mn的分离性能,Me-OH−-CO32−体系中 Ni的沉淀趋势最小、Co的沉淀趋势最大、Mn居中,而在Me-OH−-NH3体系中,也是Ni的沉淀趋势最小。因此,将上述两个体系复合成 Me-OH−-NH3-CO32−体系,应能增加金属元素的分离程度。由于该复合体系较为复杂,作为简化手段,本文作者忽略可能出现的复杂配合物及复盐。联立式(13)、(14)~(18)、(26)~(29),得到[C]=1 mol/L、[N]=1 mol/L时金属离子总浓度lg[Me]与pH的关系,如图5所示。从图5可以看出,在pH值约为9~10时,Ni在溶液中浓度最大,Co、Mn浓度最小,Ni与Co、Mn分离趋势最大。

图5 Me-OH−-NH3-CO32−体系 lg[Me]—pH 曲线([C]=1 mol/L,[N]=1 mol/L)Fig.5 lg[Me]—pH curves in Me-OH−-NH3-CO32− system([C]=1 mol/L, [N]=1 mol/L)
1.5.2 lg[Me]—pH—C图
由于 Me-OH−-NH3-CO32−体系中沉淀剂和配合剂较多,各为两种,各沉淀剂和配合剂对溶液中的金属离子浓度都有影响,故有必要采用三维曲面图,对不同影响因素进行综合考虑。图6所示为[N]=1 mol/L时Me-OH−-NH3-CO32−体系的 lg[Me]—pH—C 曲面图。从图6可以看出,当 pH值一定时,随着[C]增大,Ni浓度基本不变,而Co、Mn浓度轻微减小;当[C]≥1 mol/L时,Co、Mn的浓度也基本不变。当[C]一定时,pH对各金属离子总浓度的影响较大,大致在pH值为8~12时Ni浓度达到最高峰值而Co、Mn浓度达到最低值,Ni与Co、Mn具有较大的分离趋势。

图6 Me-OH−-NH3-CO32−体系 lg[Me]—pH—C 曲面 ([N]=1 mol/L)Fig.6 lg[Me]—pH—C surfaces in Me-OH−-NH3-CO32−system ([N]=1 mol/L)
1.5.3 lg[Me]—pH—N图
同时考虑pH和[N]的变化对金属离子总浓度的影响,得到[C]=1 mol/L 时 Me-OH−-NH3-CO32−体系的lg[Me]—pH—N曲面图(见图7)。从图7可以看出,当pH值一定时,随着[N]增大各金属离子浓度有增大的趋势,[N]≥2 mol/L时,金属离子浓度基本不变。当[N]一定时,pH值对各金属离子总浓度的影响较大,当pH值为8~12时,Ni与Co、Mn分离趋势较大。值得一提的是,金属离子被大量配合在溶液中的 pH范围会随[N]的变化而变化:对于Ni而言,在[N]变大的情况下,其被大量配合在溶液中的pH值范围变宽,pH值由9~10变至8~12;Co和Mn与Ni的规律类似,但程度依次减小。
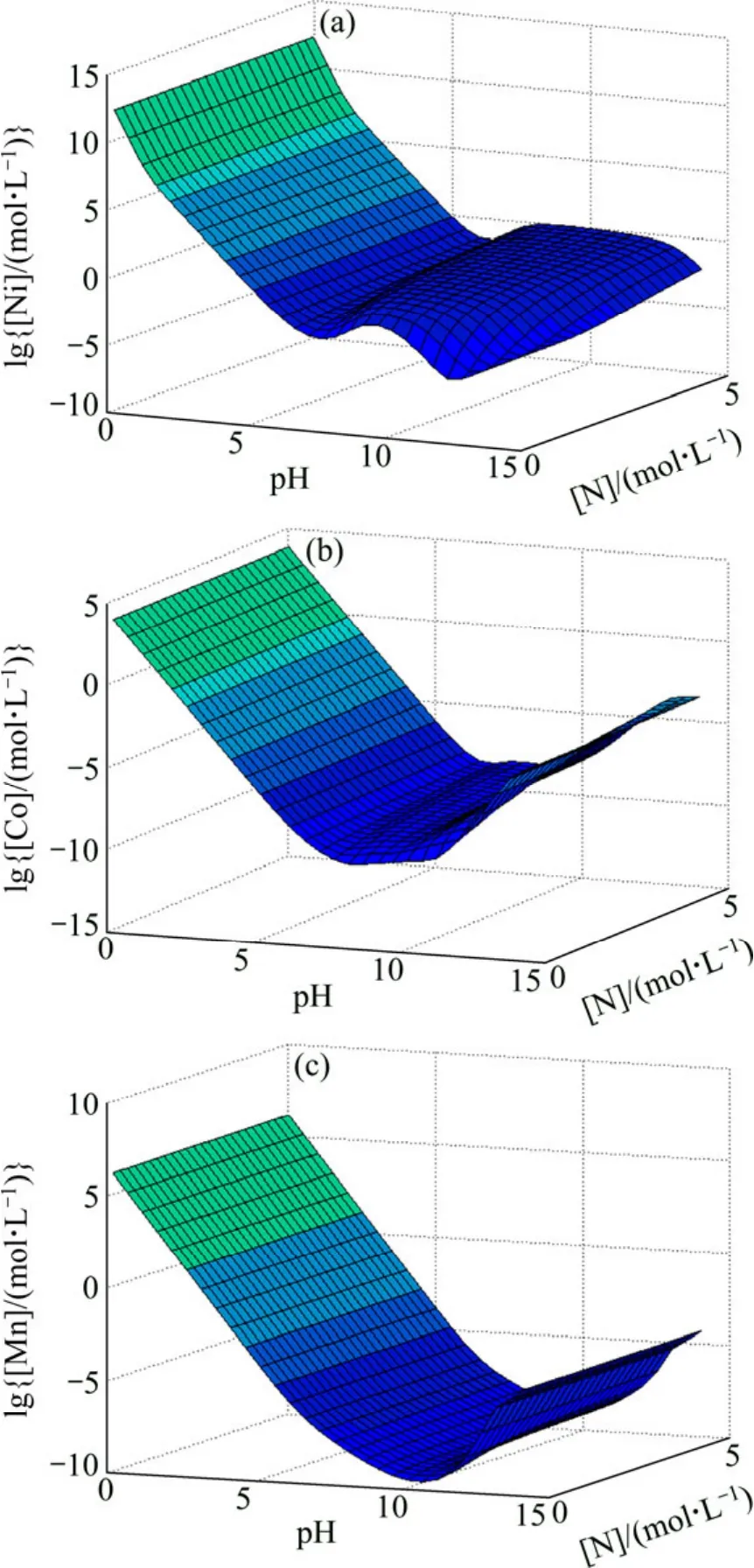
图7 Me-OH−-NH3-CO32−体系 lg[Me]—pH—N 曲面 ([C]=1 mol/L)Fig.7 lg[Me]—pH—N surfaces in Me-OH−-NH3-CO32−system ([C]=1 mol/L)
1.5.4 α—pH 图
Me-OH−-NH3-CO32−体系中 Ni、Co、Mn 在溶液中主要以游离金属离子、羟配金属离子和氨配金属离子3种状态存在。根据等式(32)~(46)即可分别计算 [C]=1 mol/L、[N]=1 mol/L时不同金属离子的离子分率α—pH图,如图8所示。从图8(a)可以看出,在不同pH 值时,Ni2+以不同形式存在,pH<6时,溶液中主要是游离 Ni2+;当 pH值为 8~12 时,溶液中无游离 Ni2+和羟合离子,主要是各级镍氨离子,且几乎全部为高级氨配离子[Ni(NH3)42+]、[Ni(NH3)52+]、[Ni(NH3)62+]。溶液中的Co2+与Ni2+具有类似的性质(图8(b)),pH<7时,溶液中主要是游离Co2+;当pH值为9~11时,溶液中无游离 Co2+和羟合离子,主要以[Co(NH3)32+]、[Co(NH3)42+]、[Co(NH3)52+]3种钴氨配合离子为主。对于溶液中的 Mn2+而言(图8(c)),氨对其配合能力没有对Ni2+和对Co2+那么强,游离Mn2+和羟合离子在整个 pH值范围内都存在,锰氨离子集中出现在 pH为9~11的范围内,且以低级锰氨配合离子[Mn(NH3)2+]、[Mn(NH3)22+]、[Mn(NH3)32+]为主。



图8 离子分率α—pH 图Fig.8 α—pH diagrams of Ni (a), Co (b)and Mn (c)
2 Me-OH−-NH3-CO32−体系金属离子沉淀行为
2.1 ΔG—pH图
在 Me-OH−-NH3-CO32−体系中,进行 Ni、Co、Mn生成氢氧化物和碳酸盐沉淀反应的热力学计算,可以更深入地了解各金属以何种形态实现分离,分离的趋势和限度如何。溶液中金属离子生成氢氧化物和碳酸盐沉淀反应的吉布斯自由能变化如式(47)~(52)所示。根据溶度积规则[18],如果反应ΔG小于零,表明该条件下沉淀生成可行;ΔG大于或等于零,则表明沉淀不生成。
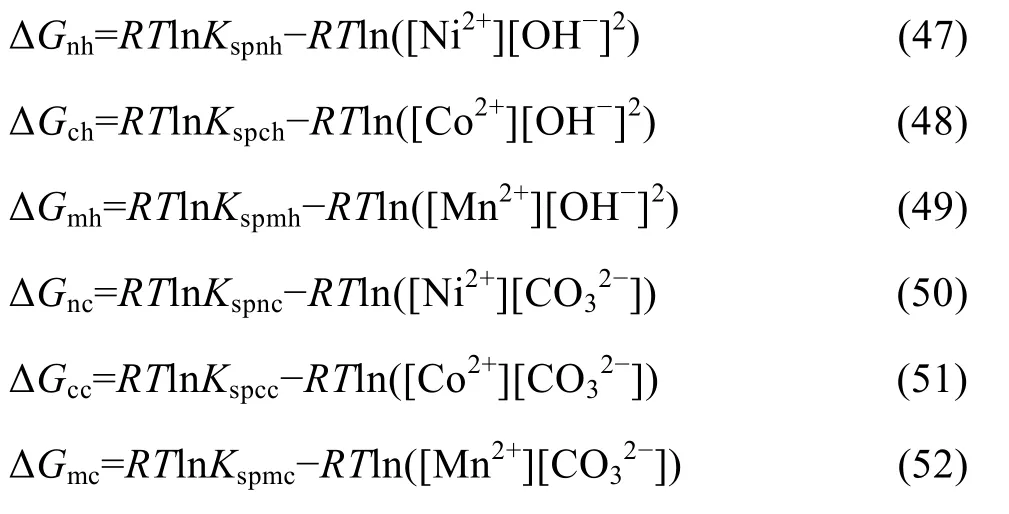
假设初始金属离子浓度均为 0.1 mol/L,[C]=1 mol/L,[N]=2 mol/L,计算 Me-OH−-NH3-CO32−体系中Ni、Co、Mn碳酸盐沉淀反应和氢氧化物沉淀反应的ΔG,得到图9。
从图9可以看出,在Me-OH−-NH3-CO32−体系中,生成NiCO3和Ni(OH)2的反应的吉布斯自由能分别在pH>9和8<pH<11时大于零,说明此条件下Ni2+被配合在溶液中不生成沉淀,且pH=10时,Ni2+最不容易沉淀。对于 Co2+而言,pH>2.5时,生成 CoCO3的反应的吉斯自由能小于零;pH>10时,生成Co(OH)2反应的吉布斯自由能小于零。说明在这两个 pH值范围内,Co2+容易生成沉淀。对于 Mn2+而言,pH>3.5时,生成 MnCO3沉淀;pH>8时,生成Mn(OH)2沉淀。图9表明,pH=10时,理论上能最大程度将Ni2+保留在溶液之中,而充分沉淀Mn2+和Co2+,且沉淀形式以MnCO3和CoCO3为主。
2.2 ΔG—pH—C图

图9 Me-OH−-NH3-CO32−体系碳酸盐沉淀反应和氢氧化物沉淀反应的ΔG—pH曲线([C]=1 mol/L,[N]=2 mol/L)Fig.9 ΔG—pH curves of carbonates and hydroxides in Me-OH−-NH3-CO32− system ([C]=1 mol/L, [N]=2 mol/L)
类似lg[Me]—pH图,综合考虑沉淀剂、配合剂对溶液中的金属碳酸盐沉淀反应和氢氧化物沉淀反应的ΔG的影响,得到[Me]=0.1 mol/L、[N]=2 mol/L、[C]为 0~2 mol/L的三维 ΔG—pH—C图(见图10)。从图10(a)可以看出,pH值对Ni沉淀反应的影响明显:在[C]相同的条件下,随着pH值的增加,Ni(OH)2生成反应的ΔG先增大后减小,NiCO3生成反应的ΔG不断增大;约pH=10时,Ni(OH)2和NiCO3生成反应的ΔG达到最大正值,沉淀反应不发生。[C]对Ni沉淀反应的影响相对不明显:在pH值相同的条件下,随着[C]的增加,Ni(OH)2生成反应的ΔG轻微增大,NiCO3生成反应的ΔG轻微减小;当[C]≥1 mol/L时,Ni(OH)2和NiCO3生成反应的ΔG基本不变,且为正值,Ni的沉淀反应不发生。

图10 Me-OH−-NH3-CO32−体系沉淀反应的 ΔG—pH—[C]曲面([N]=2 mol/L)Fig.10 ΔG—pH—[C]surfaces of precipitation reactions in Me-OH−-NH3-CO32− system ([N]=2 mol/L)∶ (a)Ni(OH)2,NiCO3; (b)Co(OH)2, CoCO3; (c)Mn(OH)2, MnCO3
从图10(b)可以看出,pH值对Co沉淀反应的影响明显:相同[C]条件下,随着pH值的增加,Co(OH)2生成反应的ΔG减小,CoCO3生成反应的ΔG增大;当pH>8时,Co(OH)2和CoCO3生成反应的ΔG均为负值,沉淀产生。[C]对Co沉淀反应的影响相对不明显:在pH值相同的条件下,随着[C]的增加,Co(OH)2生成反应的ΔG轻微增大,CoCO3生成反应的ΔG轻微减小;当[C]≥1 mol/L时,Co(OH)2和CoCO3生成反应的ΔG基本不变,且为负值,Co的沉淀反应发生。
从图10(c)可以看出,pH值对Mn沉淀反应的影响明显:在[C]相同的条件下,随着 pH值的增加,Mn(OH)2生成反应的ΔG减小,MnCO3生成反应的ΔG增大;当pH>8时,Mn(OH)2和MnCO3生成反应的ΔG均为负值,沉淀产生。[C]对 Co沉淀反应的影响相对不明显:在pH值相同的条件下,随着[C]的增加,Mn(OH)2生成反应的ΔG轻微增大,MnCO3生成反应的 ΔG 轻微减小;当[C]≥1 mol/L时,Mn(OH)2和MnCO3生成反应的ΔG基本不变,且为负值,Mn的沉淀反应发生。
2.3 ΔG—pH—N图
综合考虑pH值和[N]对各金属离子浓度的影响,得到[Me]=0.1 mol/L、[C]=1 mol/L、[N]为 0~6 mol/L的三维ΔG—pH—N图(见图11)。从图11(a)可以看出,pH值对Ni沉淀反应的影响较大:在[N]相同的条件下,随着pH值的增加,Ni(OH)2生成反应的ΔG先增大后减小,NiCO3生成反应的ΔG不断增大,当pH≈10时,Ni(OH)2和NiCO3生成反应的ΔG共同达到最大正值,沉淀反应不发生。[N]对Ni沉淀反应的影响也显著:在 pH值相同的条件下,随着[N]的增加,Ni(OH)2和NiCO3生成反应的ΔG增大,[N]越高越有利于Ni配合在溶液中不被沉淀。
从图11(b)可以看出,pH值对Co沉淀反应的影响较大:在[N]相同的条件下,随着pH值的增加,Co(OH)2生成反应的ΔG整体呈减小趋势,CoCO3生成反应的ΔG整体呈增大趋势。[N]对 Co沉淀反应的影响也显著:在pH值相同的条件下,随着[N]的减小,Co(OH)2和CoCO3生成反应的ΔG均减小;当[N]≤2 mol/L时,Co(OH)2和CoCO3生成反应的ΔG均为负值,Co能够充分沉淀。
从图11(c)可以看出,pH值对Mn沉淀反应的影响较大:在[N]相同的条件下,随着 pH值的增加,Mn(OH)2生成反应的ΔG减小,MnCO3生成反应的ΔG增大,pH>8时,二者ΔG均为负值,Mn能够充分沉淀。[N]对Mn沉淀反应的影响不显著:在pH值相同的条件下,随着[N]的减小,Mn(OH)2和 MnCO3生成反应的ΔG均轻微减小,Mn更容易沉淀。
由以上分析可知,通过同时控制[C]、[N]和pH值,可以得到分离 Ni、Co、Mn不同状态,其中当[C]=1 mol/L、[N]=2 mol/L、pH=10时能够充分保留Ni在

图11 Me-OH−-NH3-CO32−体系沉淀反应的 ΔG—pH—N 曲面([C]=1 mol/L)Fig.11 ΔG—pH—N surfaces of precipitation reactions in Me-OH−-NH3-CO32− system ([C]=1 mol/L)∶ (a)Ni(OH)2,NiCO3; (b)Co(OH)2, CoCO3; (c)Mn(OH)2, MnCO3
溶液中而沉淀Co、Mn,沉淀形式以MnCO3、CoCO3为主。Co和Mn的后续分离可采用 Me-OH−-S2−体系调节pH<6以沉淀Co。依据上述配合−沉淀分离模型,可以得到的分离Co、Ni、Fe、Mn的初步工艺流程,如图12所示。在流程中运用多个配合−沉淀体系,每个体系的分离程度和分离效果均能通过建立理论模型进行预测和调控,从而为钴镍二次资源综合回收钴镍、制备钴镍产品,提供系统性地理论指导。

图12 配合−沉淀体系分离金属流程Fig.12 Metal separation flow for complexation-precipitation system
3 结论
1)以Me为Co、Ni、Fe、Mn为金属元素,OH−、NH3为配合剂,OH−、S2−、CO32−为沉淀剂,建立Me-OH−、Me-OH−-CO32−、Me-OH−-S2−、Me-OH−-NH3、Me-OH−-NH3-CO32−等多个配合−沉淀体系的热力学平衡模型,绘制 lg[Me]—pH 曲线,发现 Fe3+可以在Me-OH−、Me-OH−-NH3体系中通过调节pH=3预先沉淀分离,Ni2+可Me-OH−-NH3-CO32−体系中与 Co、Mn分离,Mn2+可在Me-OH−-S2−体系中通过调节pH<6从溶液中与Co分离。
2)Co、Ni、Mn 在 Me-OH−-NH3-CO32−体系中的沉淀行为受 pH值、配合剂、沉淀剂浓度共同影响,在pH值为9~10时,Ni在溶液中浓度最大,存在形式几乎全部为高级氨配离子[Ni(NH3)42+]、[Ni(NH3)52+]、[Ni(NH3)62+];Co、Mn浓度最小,主要以[Co(NH3)32+]、[Co(NH3)42+]、 [Co(NH3)52+]、 [Mn(NH3)2+]、[Mn(NH3)22+]、[Mn(NH3)32+]几种氨配合离子形式存在。
3)经过热力学计算绘制 Co、Ni、Mn在Me-OH−-NH3-CO32−体系中的沉淀反应吉布斯自由能变ΔG单因素二维曲线及双因素三维曲面发现,当pH值为8~12及[CO32−]增大有利于Co、Mn沉淀,[NH3]增大不利于生成 Co、Ni、Mn沉淀,通过控制[C]=1 mol/L、[N]=2 mol/L、pH=10能够充分沉淀Co、Mn而将大部分Ni保留在溶液中,沉淀形式主要为MnCO3和 CoCO3。
[1]WANG R C, LIN Y C, WU S H.A novel recovery process of metal values from the cathode active materials of the lithium-ion secondary batteries[J].Hydrometallurgy, 2009, 99(3/4)∶194−201.
[2]FERREIRA D A, PRADOS L M Z, MAJUSTE D.Hydrometallurgical separation of aluminium, cobalt, copper and lithium from spent Li-ion batteries[J].Journal of Power Sources,2009, 187(1)∶ 238−246.
[3]VALVERDE I M J, PAULINO J F, AFONSO J C.Hydrometallurgical route to recover molybdenum, nickel, cobalt and aluminum from spent hydrotreating catalysts in sulphuric acid medium[J].Journal of Hazardous Materials, 2008, 160(2/3)∶310−317.
[4]FREITAS M B J G, CELANTE V G, PIETRE M K.Electrochemical recovery of cobalt and copper from spent Li-ion batteries as multilayer deposits[J].Journal of Power Sources 2010, 195(10)∶ 3309−3315.
[5]王永利, 赵丽霞.从含钴废料中提取钴的研究进展[J].再生资源研究, 2005(2)∶ 29−31.WANG Yong-li, ZHAO Li-xia.The research progress of drawing the cobalt[J].Recycling Research, 2005(2)∶ 29−31.
[6]LI L, GE J, CHEN R J, WUA F, CHEN S, ZHANG X X.Environmental friendly leaching reagent for cobalt and lithium recovery from spent lithium-ion batteries[J].Waste Management,2010, 30(12)∶ 2615−2621.
[7]钟燕萍, 王大辉, 康 龙.从废弃镍基电池中回收有价金属的研究进展[J].新技术新工艺, 2009(8)∶81−85.ZHONG Yan-ping, WANG Da-hui, KANG Long.Research development of valuable metals recycling from used nickel-based batteries[J].New Technology and New Process,2009(8)∶ 81−85.
[8]陈 亮, 唐新村, 张 阳, 瞿 毅, 王志敏.从废旧锂离子电池中分离回收钴镍锰[J].中国有色金属学报, 2011, 21(5)∶1192−1198.CHEN Liang, TANG Xin-cun, ZHANG Yang, QU Yi, WANG Zhi-min.Separation and recovery of Ni, Co and Mn from spent lithium-ion batteries[J].The Chinese Journal of Nonferrous Metals, 2011, 21(5)∶ 1192−1198.
[9]王成彦, 王含渊, 江培海, 尹 飞, 陈永强.高锰含钴物料中钴的回收[J].有色金属∶ 冶炼部分, 2005(5)∶ 2−5.WANG Cheng-yan, WANG Han-yuan, JIANG Pei-hai, YIN Fei,CHEN Yong-qiang.Recovery of cobalt from cobalt ores with high manganese[J].Nonferrous Metals∶ Extractive Metallurgy,2005(5)∶ 2−5.
[10]KANG J, SOHN J, CHANG H, SENANAYAKE G, SHIN S M.Preparation of cobalt oxide from concentrated cathode material of spent lithium ion batteries by hydrometallurgical method[J].Advanced Powder Technology 2010, 21(2)∶ 175−179.
[11]SNAYL A A.Extraction and separation of Co(Ⅱ)and Ni(Ⅱ)from acidic sulfate solutions using Aliquat 336[J].Journal of Hazardous Materials 2010, 173(1/3)∶ 223−230.
[12]LI L, XU S, JU Z, WU F.Recovery of Ni, Co and rare earths from spent Ni-metal hydride batteries and preparation of spherical Ni(OH)2[J].Hydrometallurgy 2009, 100(1/2)∶ 41−46.
[13] 柴立元, 常 皓, 王云燕, 舒余德, 李 敬, 袁 林, 王 璞,方 艳, 赵 堃.Cd2+-H2O系羟合配离子配位平衡[J].中国有色金属学报 2007, 17(3)∶ 487−491.CHAI Li-yuan, CHANG Hao, WANG Yun-yan, SHU Yu-de, LI Jing, YUAN Lin, WANG Pu, FANG Yan, ZHAO Kun.Equilibrium of hydroxyl complex ions in Cd2+-H2O system[J].The Chinese Journal of Nonferrous Metals, 2007, 17(3)∶487−491.
[14]TANG M T, YANG J G, YANG S H.Thermodynamic calculation of Sn(IV)-NH4+-Cl−-H2O system[J].Transactions of Nonferrous Metals Society of China, 2004, 14(4)∶ 802−806.
[15]蔡进红, 代建清, 周小兵.共沉淀法合成Zn 掺杂Co2-Y 平面六角铁氧体粉的热力学分析[J].无机化学学报, 2008, 24(12)∶1943−1948.CAI Jin-hong, DAI Jian-qing, ZHOU Xiao-bing.Thermodynamic analysis on preparation of zinc doped Co2-Y planar hexagonal ferrite powder by chemical Co-precipitation method[J].Chinese Journal of Inorganic Chemistry, 2008, 24(12)∶1943−1948.
[16]苏继桃, 苏玉长, 赖智广, 禹 萍, 何显达.共沉淀法制备镍、钴、锰复合碳酸盐的热力学分析[J].硅酸盐学报, 2006,34(6)∶ 695−698.SU Ji-tao, SU Yu-chang, LAI Zhi-guang, YU Ping, HE Xian-da.Thermodynamic analysis of preparation of multiple carbonate of Ni, Co and Mn by coprecipitation method [J].Journal of the Chinese Ceramic Society, 2006, 34(6)∶ 695−698.
[17]约翰·安迪.兰氏化学手册[M].2版.魏俊发, 杨祖培, 高子伟,杨义芳, 胡道道, 译.北京∶ 科学出版社, 2003.DEAN J A.Lange’s handbook of chemistry[M].2nd ed.WEI Jun-fa, YANG Zu-pei, GAO Zi-wei, YANG Yi-fang, HU Dao-dao, transl.Beijing∶ Science Press, 2003.
[18]张平民.工科大学化学(上册)[M].长沙∶ 湖南教育出版社,2002∶ 337−338.ZHANG Ping-min.Advanced chemistry for engineering(Volume 1)[M].Changsha∶ Hunan Educational Press, 2002∶337−338.
