不同林龄短枝木麻黄小枝单宁含量及养分再吸收动态
2013-12-16叶功富张尚炬张立华卢昌义林益明
叶功富,张尚炬,张立华,卢昌义,林益明
(1.福建省林业科学研究院,福州 350012;2.福建省平潭国有防护林场,平潭 350400;3.中国科学院烟台海岸带研究所,烟台 264003;4.厦门大学环境与生态学院,厦门 361005)
植物体内的物质和能量代谢以及外部形态均随着植物个体生长发育而发生改变[1]。有研究表明,植物的发育会影响其体内防御物质含量的变化[2],这种变化可能具有重要的生态学意义。植物的生物量、生物多样性、碳库、土壤养分含量及其生态系统过程也会随着林龄的增长而变化[3]。养分从衰老叶片转移到其他部位的再吸收过程是植物自身一个非常重要的养分保存机制。通常被认为是与土壤养分的有效性有关[4-6]。然而土壤养分的有效性有可能随着林分发育过程而改变,而且植物的许多生理生态特性也与植物自身发育成熟过程有关[7]。因此,植物的养分再吸收可能也会随着林龄的变化而发生改变。
短枝木麻黄(Casuarina equisetifolia)是东南沿海重要的防风固沙树种,有研究表明[8-9],短枝木麻黄小枝具有较高的单宁含量和养分再吸收率,这可能是其长期适应贫瘠沙地的重要特征。而关于木麻黄单宁含量随林分发育过程的动态变化,以及养分再吸收与林龄相关性的研究尚未见报道。基于此,本研究旨在探讨不同林龄短枝木麻黄人工林的单宁含量和N、P再吸收效率动态,从而揭示木麻黄林分发育过程中的营养保存策略,为海岸带木麻黄防护林的营养管理提供科学依据。
1 材料与方法
1.1 试验地概况
试验地设在福建省惠安县的赤湖林场(23°45′N,118°55′E),位于福建东南部沿海,属亚热带海洋性气候,干、湿季节明显。年均降水量和蒸发量分别为1029 mm和2000 mm,绝对最高和最低气温分别为37℃和2.2℃,终年无霜冻。雨季为3月到10月,旱季为11月到2月。本试验地土壤为均一性风积沙土,沙土层厚度80—100 cm,土壤pH值为5.00,非根际土壤表层养分含量为:有效磷0.25 mg/kg,速效钾 13.27 mg/kg,全氮0.24 g/kg,全碳2.48 g/kg。试验样地设置在幼龄(5年生)、成熟(21年生)和衰老(38年生)短枝木麻黄人工纯林内,株行距2.0 m×2.0 m,初植密度2500株/hm2,林下灌木、草本稀少[10]。3个试验林的主要参数参见表1。

表1 短枝木麻黄试验林的主要特征Table 1 Main features of the C.equisetifolia stands at Chihu Forest Center
1.2 样品采集
2009年10月,在3个样地内分别随机选择50株树龄、高度及生长状况较为一致的短枝木麻黄,按每10株设1组,共5组作为5个重复,进行标记。在每组标记植株内林冠外侧采取成熟和衰老小枝,每个组分的小枝分别采集50 g左右,以避免个体之间的差异。
1.3 化学分析方法
总酚(TP)的测定采用普鲁士蓝法[11];可溶性缩合单宁(ECT),蛋白质结合缩合单宁(PBCT)和纤维素结合缩合单宁(Fiber-bound condensed tannins,FBCT)采用正丁醇-盐酸法[12],总缩合单宁(TCT)为 ECT、PBCT 和 FBCT 之和[12]。除 TP 以单宁酸为标准物外,ECT、PBCT和FBCT的测定均以纯化的木麻黄小枝缩合单宁为标准物。提取液中单宁与PPC的测定采用平板法[13]。各单宁指标的测定步骤详见Lin等[14],标准物的提取和纯化方法见Hagerman[15]。备用粉碎样品经H2SO4-H2O2硝化后,采用纳氏试剂比色法测定N含量[16],采用钼锑抗显色法测定P含量[17]。
1.4 计算方法
N、P再吸收率(RE)用N、P从衰老叶中所吸收的元素含量占成熟叶中元素含量的百分率来计算[18-19],其计算公式为:
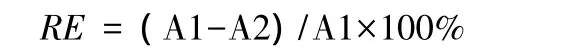
式中,A1为成熟叶中的N或P含量;A2为衰老叶中N或P含量。
1.5 统计分析
数据统计分析采用SPSS 15.0 for Windows,相关分析采用线性相关性分析;在单因素方差分析(One-Way ANOVA)的基础上,利用多重比较的方法(S-N-K)检验林分发育过程中单宁和养分含量及其再吸收之间的差异。
2 结果与分析
2.1 不同林分小枝总酚含量的变化
成熟小枝中 TP含量((180.49±7.70)—(218.52±6.06)mg/g)随林分的发育而降低。衰老小枝中TP含量表现为幼龄林>衰老林>成熟林(图1)。在所有林分中,TP含量均随着小枝衰老而下降(P<0.05)。
2.2 不同林分小枝缩合单宁含量的变化
不同发育阶段林分成熟和衰老小枝缩合单宁含量的变化如图2所示。成熟和衰老小枝中ECT含量的变化呈幼龄林>衰老林>成熟林。成熟和衰老林分中随着小枝的衰老,ECT含量升高,但在幼龄林中为下降趋势。PBCT含量在幼龄林和成熟林中随小枝的衰老而增加(P<0.05),而在衰老林中没有显著变化。FBCT含量在成熟林中随小枝衰老而升高,幼龄林和衰老林中成熟和衰老小枝之间的差异不显著。在所有林分中,成熟和衰老小枝中的ECT含量都显著高于PBCT和FBCT。TCT含量随着林分发育的变化情况与ECT相似。
2.3 不同林龄短枝木麻黄小枝蛋白质结合能力的变化
幼龄林成熟和衰老小枝PPC显著高于成熟林和衰老林(图3)。在3个林分中PPC均随着小枝的衰老而下降。
相关分析的结果表明,PPC 与 TP(TP 和 PPC:y=3.035x-11.629,r=0.983,P < 0.001)和 TCT(y=1.505x+248.403,r=0.438,P<0.05)具有显著正相关关系(图4)。
2.4 不同林龄短枝木麻黄小枝氮磷含量、氮磷比及其再吸收率的变化
随着林龄的增加,成熟和衰老小枝N含量均显著升高,而P含量则依次降低(表2)。相应地,成熟小枝N∶P比随着林分发育而显著升高,均大于20。3种林分小枝氮再吸收率均小于52%,最低值出现在衰老林中;而磷再吸收率均高于70%,最高值((78.08±1.96)%)出现在成熟林分中。衰老小枝中N含量大于0.7%,P含量低于0.03%。成熟和衰老小枝中N含量和P含量呈显著负相关(表3)。小枝N∶P比与NRE呈显著相关,而与PRE无显著相关性。
除成熟小枝中TCT含量与磷含量之间相关性不显著外,短枝木麻黄小枝TP和TCT含量与氮、磷含量均呈显著相关(表 4)。
3 讨论
树木生长过程有其阶段性,且在不同阶段其抗逆性也有差异。短枝木麻黄幼龄林生长迅速,对营养和水分的需求较多,其组织较嫩,极易受到不良条件的影响。本研究中,成熟小枝TP含量随着林分发育而降低(图1),表明林龄对短枝木麻黄小枝TP含量的影响显著。短枝木麻黄在较易遭受侵害的幼龄林时期,通过增强单宁等次生代谢物质的合成来提高自身防御能力[20]。随着林龄增加,TP含量下降,这一方面可能是由于成熟林生长旺盛,对营养和空间的需求很大,所以大部分资源分配给生长,初级代谢速度较快,用于合成次生物质的底物较少,致使缩合单宁含量不同程度的下降;另一方面,短枝木麻黄木质化程度不断提高,对害虫的物理抵抗能力增强,此时树体可以减少分配在化学防御上的投入。衰老林分个体生长缓慢,抵抗力下降,因而缩合单宁含量在衰老林分小枝中有所升高。TP的需求在林分成熟和衰老过程中下降,3种林分中成熟小枝TP含量均显著高于衰老小枝。小枝衰老过程中多酚含量下降一方面可能是由于在叶片的衰老过程中,大部分可溶性含碳化合物(包括多酚)通过降解呈小分子而被转移到其他的组织中[21],另一方面可能是小分子酚类物质和叶片表层的多酚会被雨水淋溶[22-23],从而造成衰老叶片中多酚含量的减少。
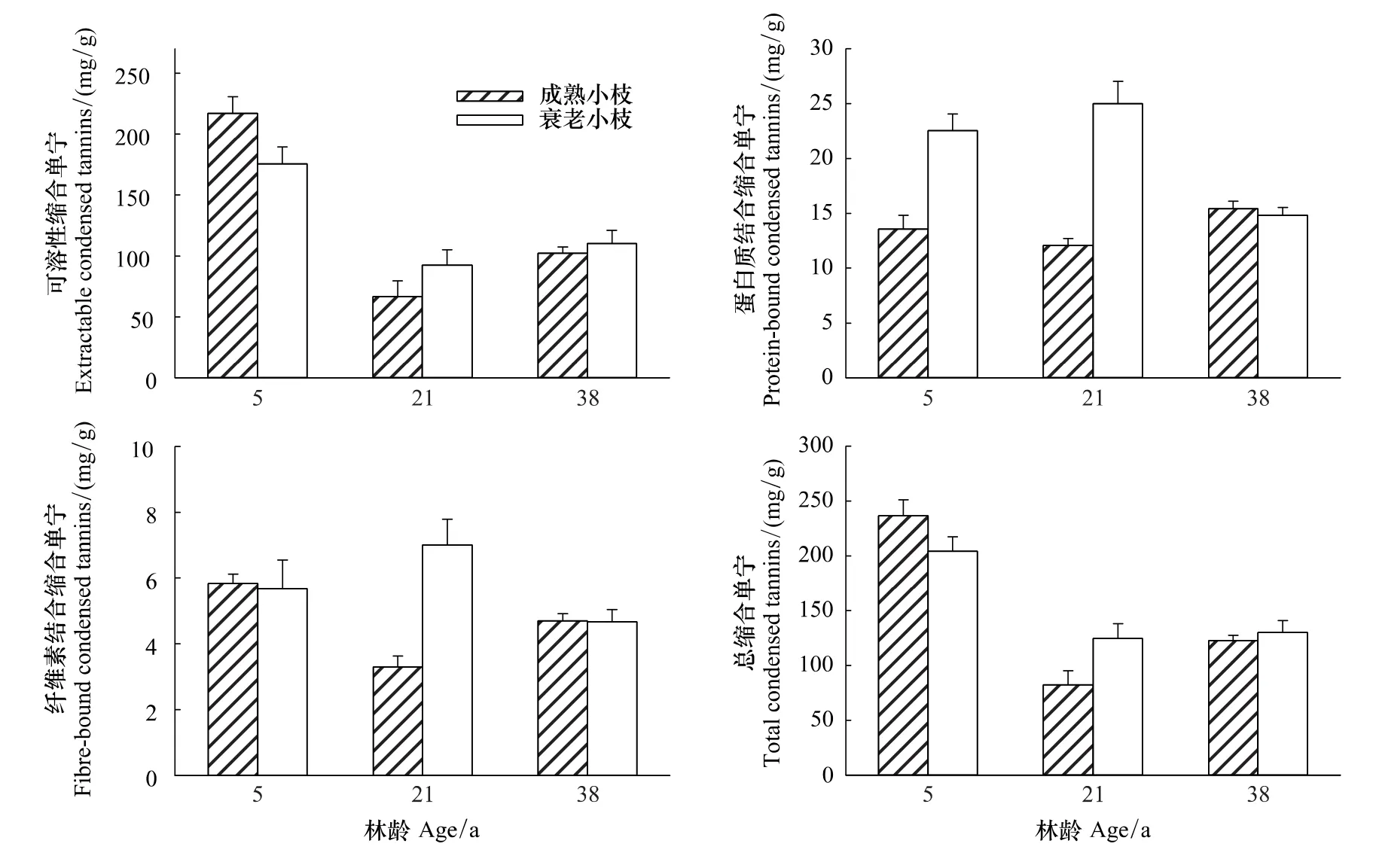
图2 不同林龄短枝木麻黄小枝缩合单宁含量的变化Fig.2 Changes in condensed tannins contents in branchlets C.equisetifolia of different forest ages
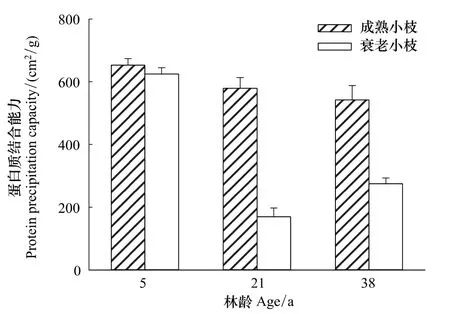
图3 不同林龄短枝木麻黄小枝蛋白质结合能力的变化Fig.3 Changes in protein precipitation capacity in branchlets of C.equisetifolia of different forest ages
单宁的蛋白质结合能力与其自身的生物学活性有关[24-25],在3种林分中,成熟小枝的PPC均比衰老小枝高。PPC与TP和TCT具有显著正相关,这与前期的研究结果一致[8]。另外,单宁结合蛋白质的能力与其分子大小有关[26]。虽然分子量小于500的多酚几乎不能与蛋白质结合,从而使蛋白质产生变性,但是,单宁分子量太大也会由于无法与蛋白质位点产生交联而降低单宁的PPC[14]。小枝在衰老过程中单宁可能发生聚合,使分子结构和分子量增大,从而逐渐降低了衰老小枝的PPC。
成熟小枝TP和TCT含量与氮含量呈负相关。大量的研究结果反映了酚类和单宁等次生代谢物质与叶片中的氮含量存在着显著的负相关[27-28]。这种模式支持了碳氮平衡假说[29]和生长分化假说[30]等理论,认为在营养限制的立地条件下,植物会增加碳向以碳为基础的次生代谢物质中的分配,导致在贫瘠立地条件下,植物组织中的养分含量较低而单宁含量较高,而在营养充足的立地条件下,组织中的养分含量较高而单宁含量较低。
本研究中,短枝木麻黄小枝中的N含量随着林分生长发育而增加(表1),这与Yuan和Chen[3]对欧洲山杨的研究结论一致。叶片N含量随着林分发育而增加可能是土壤氮补给增加的直接结果,因为叶片中的N含量在一定程度上反映了样地土壤的肥力[31]。但Yuan和Chen[3]对不同林龄欧洲山杨的研究显示,土壤N的有效性并不能随着林分年龄的增加而改变。叶片中N含量的改变可能与稀释效应有关,因为幼龄林合成叶片生物量的速率更快,所以尽管对营养的绝对吸收率很高,但叶片中的氮含量可能还是相对较低[3]。
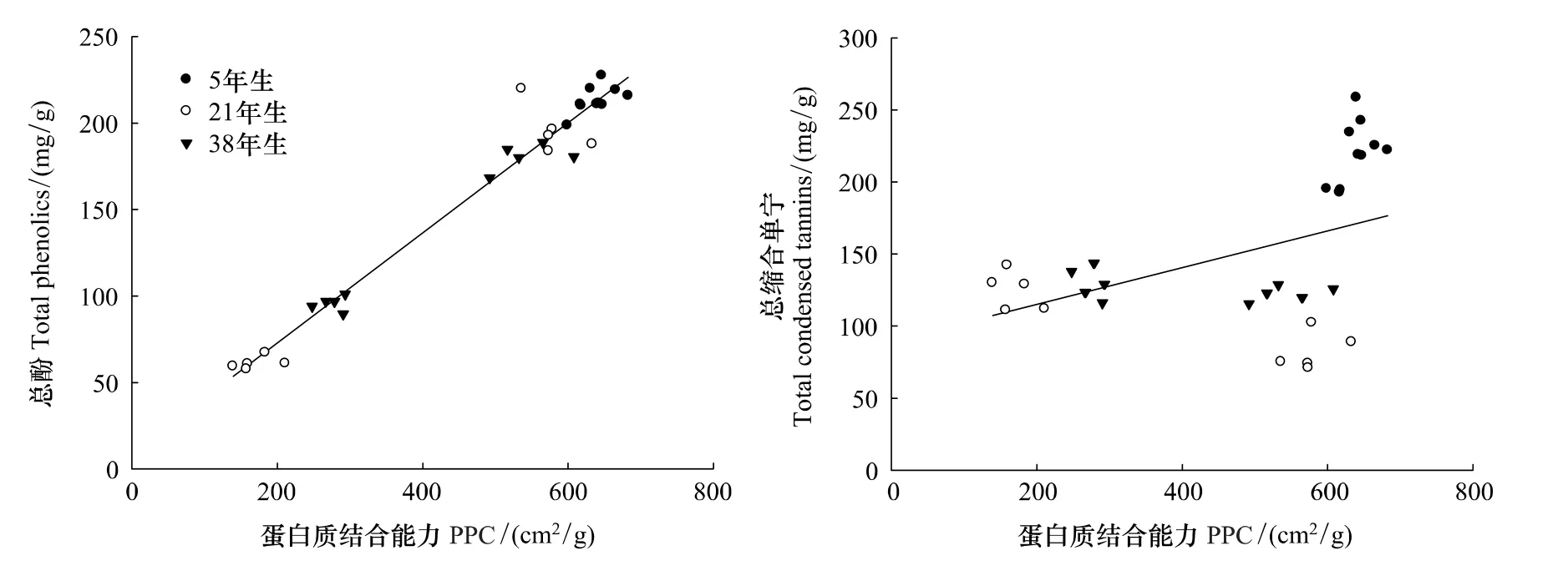
图4 短枝木麻黄小枝总酚和总缩合单宁含量与蛋白质结合能力之间的相关性Fig.4 Relationships between TP and PPC;TCT and PPC in branchlets of C.equisetifolia
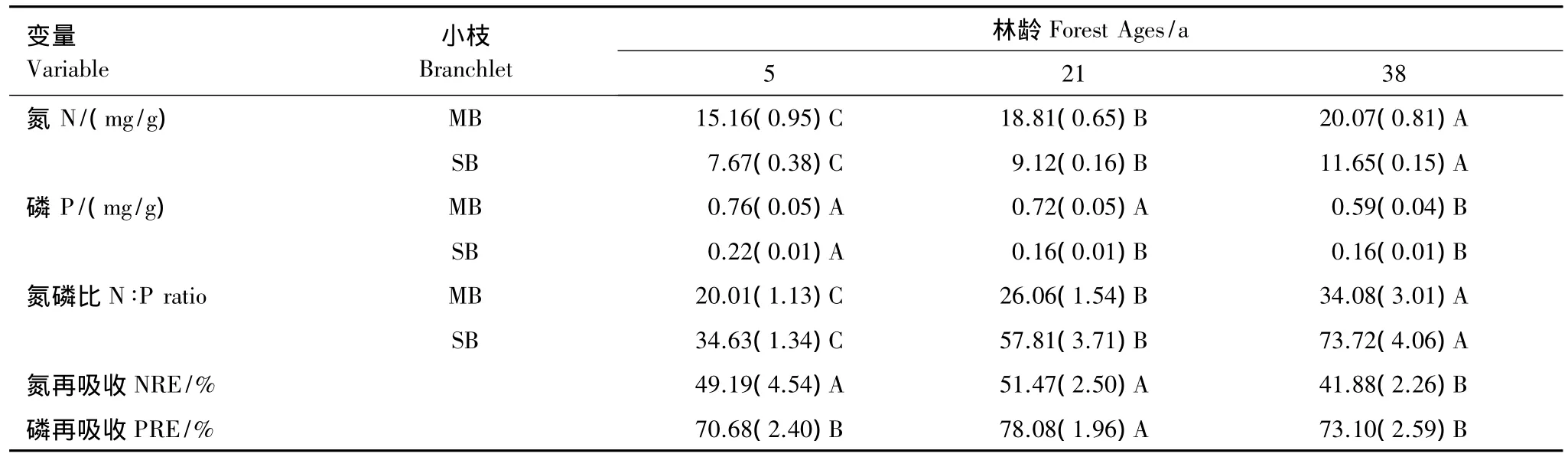
表2 不同林龄短枝木麻黄小枝中氮磷含量、再吸收率及氮磷比的变化Table 2 Changes in N,P concentrations,N ∶P ratios,NRE and PRE in branchlets of C.equisetifolia of different forest ages
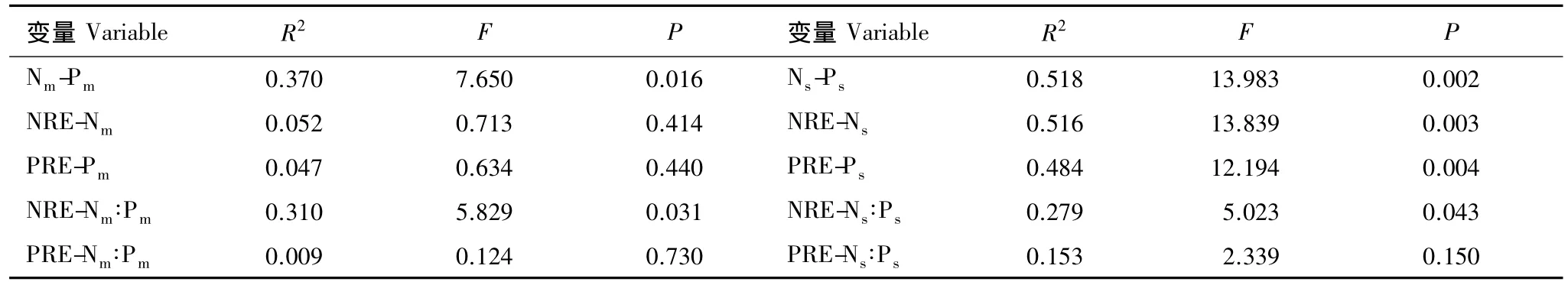
表3 短枝木麻黄小枝中氮磷含量,氮磷再吸收及氮磷比之间的相关性Table 3 Correlations among N and P concentrations,N and P resorptions and N ∶P ratios in branchlets of C.equisetifolia
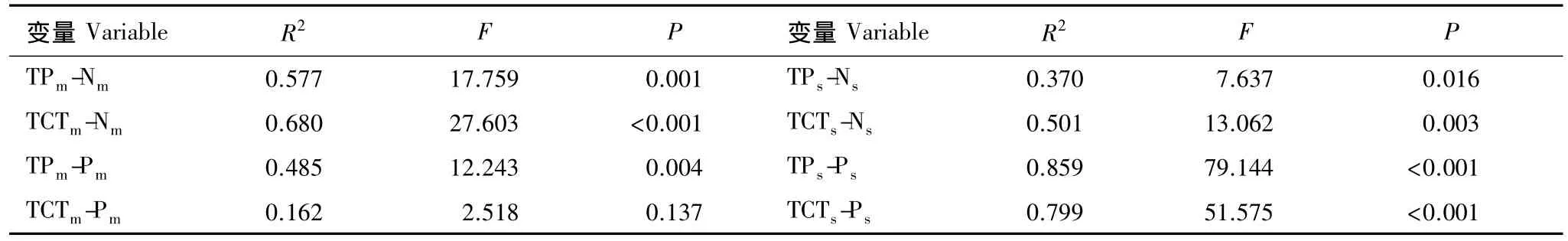
表4 短枝木麻黄小枝中单宁与养分含量之间的相关性Table 4 Correlation of tannins and nutrient contents in branchlets of C.equisetifolia
在大多数陆地生态系统中,氮磷的有效性限制了植物的生长,氮磷比(N∶P)可以用来表示群落营养限制的状况[32-33],N∶P小于14表示N限制,高于16表示P限制[34]。由成熟叶片中的N∶P指示的营养限制类型可能与有效养分的再吸收效率有重要关系。本研究中成熟小枝的N∶P均大于20,显示短枝木麻黄3种林分均属P限制,相应的,PRE(高于70%)显著高于NRE(低于52%)。成熟林中PRE较幼龄林和衰老林高,衰老林分的NRE低于幼龄林和成熟林。相对于衰老林,幼龄林和成熟林的生物量积累更快,因而会有较高的N需求[34],这可能是幼龄和成熟林NRE高于衰老林的原因。较高的营养再吸收率经常可以用较高的营养库来解释,生长较快的植物对营养的需求也更强[35]。然而本研究中,幼龄林和成熟林的NRE没有显著差异,这可能是由于短枝木麻黄本身具有固氮作用的原因。Aerts and Chapin[36]和 Güsewell[37]的研究显示相比较N而言,P更容易具有高的营养再吸收效率。在P限制立地生长的植物可能比在N限制立地生长的植物更容易具有高营养再吸收效率,这一结论与N∶P及再吸收效率的结果完全一致。
Killingbeck[19]提出了木本植物衰老叶片中N和P再吸收度的界限。在衰老叶中当N的营养浓度低于0.7%,P的营养浓度低于0.04%时则认为是植物营养的完全再吸收[19]。在本研究中,衰老小枝中N的营养浓度>0.7%,P的浓度<0.04%,这表明木麻黄的营养再吸收是N为不完全再吸收,而P则为完全再吸收。
决定多年生植物生长的因素不仅是它们对营养的需求量,还应包括可被再利用的营养储存量。养分再吸收的水平影响凋落物的性质,进而影响其分解速率和养分有效性。对养分再吸收及其影响因素的了解是揭示森林植物在生态系统营养循环中作用的关键[35]。植物叶片营养状况与养分再吸收之间存在着密切的联系[38-40]。本研究中,NRE与衰老小枝中的N浓度具有显著正相关关系(表2),这与已有的研究报道相似[8,41],但是NRE与成熟小枝中的N含量没有相关关系。这可能是由于衰老叶提供的控制养分再吸收的活性物质对养分再吸收的效应,超过了叶片本身营养含量对再吸收的影响[18]。NRE与成熟和衰老小枝中的N∶P有显著的线性相关。PRE与衰老小枝中P含量有显著线性相关,但与成熟小枝中的P含量或N∶P都没有相关性,前人研究也有类似的报道[8,42]。
综上所述,短枝木麻黄可能通过多酚物质的形成和较高的养分再吸收率两种生长策略来维持高生产力,以抵御食草动物的取食,降低凋落物的分解率,提高衰老小枝中养分的再吸收程度,减少养分损失增强竞争优势,从而适应贫瘠的立地条件。短枝木麻黄小枝单宁含量与养分再吸收受林龄影响,其养分保存机制会随着林分的生长发育而进行调节,即不同生长阶段的林分可能存在不同的营养保存策略:幼龄林和衰老林小枝多酚(尤其是缩合单宁)含量较高,而养分再吸收率较低,因此这两种林分的策略是以形成多酚物质为主;而处于成熟阶段的林分小枝多酚含量最低,但养分再吸收率最高,则可能以最大限度的利用自身衰老组织中的养分作为主要策略。
[1] Jones C S.An essay on juvenility,phase change,and heteroblasty in seed plants.International Journal of Plant Sciences,1999,160(S6):S105-S111.
[2] Donaldson J R,Stevens M T,Barnhill H R,Lindroth R L.Age-related shifts in leaf chemistry of clonal aspen(Populus tremuloides).Journal of Chemical Ecology,2006,32(7):1415-1429.
[3] Yuan Z Y,Chen H Y H.Changes in nitrogen resorption of trembling aspen(Populus tremuloides)with stand development.Plant and Soil,2009,327(1/2):121-129.
[4] Kobe R K,Lepczyk C A,Iyer M.Resorption efficiency decreases with increasing green leaf nutrients in a global data set.Ecology,2005,86(10):2780-2792.
[5] Richardson S J,Peltzer D A,Allen R B,McGlone M S.Resorption proficiency along a chronosequence:responses among communities and within species.Ecology,2005,86(1):20-25.
[6] Yuan Z Y,Chen H Y H.Global-scale patterns of nutrient resorption associated with latitude,temperature and precipitation.Global Ecology and Biogeography,2009,18(1):11-18.
[7] Groom P K,Lamont B B,Markey A S.Influence of leaf type and plant age on leaf structure and sclerophylly in Hakea(Proteaceae).Australian Journal of Botany,1997,45(5):827-838.
[8] Zhang L H,Lin Y M,Ye G F,Liu X W,Lin G H.Changes in the N and P concentrations,N:P ratios,and tannin content in Casuarina equisetifolia branchlets during development and senescence.Journal of Forest Research,2008,13(5):302-311.
[9] Zhang L H,Ye G F,Lin Y M,Zhou H C,Zeng Q.Seasonal changes in tannin and nitrogen contents of Casuarina equisetifolia branchlets.Journal of Zhejiang University Science B,2009,10(2):103-111.
[10] Ye G F,Zhang L H,Lin Y M,Hou J,Lu C Y,Zeng G Q.Dynamics of nutrient and energy for fine roots of Casuarina equisetifolia plantations on coastal sandy soil.Acta Ecologica Sinica,2007,27(9):3874-3882.
[11] Graham H D.Stabilization of the Prussian blue color in the determination of polyphenols.Journal of Agricultural and Food Chemistry,1992,40(5):801-805.
[12] Terrill T H,Rowan A M,Douglas G D,Barry T N.Determination of extractable and bound condensed tannin concentrations in forage plants,protein concentrate meals and cereal grains.Journal of the Science of Food and Agriculture,1992,58(3):321-329.
[13] Hagerman A E.Radial diffusion method for determining tannin in plant extracts.Journal of Chemical Ecology,1987,13(3):437-449.
[14] Lin Y M,Liu J W,Xiang P,Lin P,Ye G F,da Sternberg L S L.Tannin dynamics of propagules and leaves of Kandelia candel and Bruguiera gymnorrhiza in the Jiulong River Estuary,Fujian,China.Biogeochemistry,2006,78(3):343-359.
[15] Hagerman A E.The Tannin Handbook.http://www.users.muohio.edu/hagermae.2011.
[16] Mae T,Makino A,Ohira K.Changes in the amounts of ribulose-1,5-bisphosphate carboxylase synthesized and degraded during the life span of rice leaf(Oryza sativa L.).Plant and Cell Physiology,1983,24(6):1079-1086.
[17] Institute of Soil Science,Chinese Academy of Sciences.Physico-chemical Analysis of Soils.Shanghai:Shanghai Science and Technology Press,1978.
[18] Aerts R.Nutrient resorption from senescing leaves of perennials:are there general patterns?Journal of Ecology,1996,84(4):597-608.
[19] Killingbeck K T.Nutrients in senesced leaves:keys to the search for potential resorption and resorption proficiency.Ecology,1996,77(6):1716-1727.
[20] Watkinson A R.Plant population dynamics//Crawley M J,ed.Plant Ecology.Oxford:Blackwell Seientific Publications,1986:137-184.
[21] Mafongoya P L,Nair P K R,Dzowela B H.Mineralization of nitrogen from decomposing leaves of multipurpose trees as affected by their chemical composition.Biology and Fertility of Soils,1998,27(2):143-148.
[22] Harborne J B.Recent advances in chemical ecology.Natural Product Reports,1997,14(2):83-98.
[23] Hattenschwiler S,Vitousek P M.The role of polyphenols in terrestrial ecosystem nutrient cycling.Trends in Ecology& Evolution,2000,15(6):238-243.
[24] Martin J S,Martin M M.Tannin assays in ecological studies:lack of correlation between phenolics,proanthocyanidins and protein-precipitating constituents in mature foliage of six oak species.Oecologia,1982,54(2):205-211.
[25] Deshpande S S,Cheryan M,Salunkhe D K,Luh B S.Tannin analysis of food products.Critical Review in Food Science and Nutrition,1986,24(4):401-449.
[26] Makkar H P S,Dawra R K,Singh B.Protein precipitation assay for quantitation of tannins:Determination of protein in tannin-protein complex.Analytical Biochemistry,1987,166(2):435-439.
[27] Mansfield J L,Curtis P S,Zak D R,Pregitzer K S.Genotypic variation for condensed tannin production in trembling aspen(Populus tremuloides,Salicaceae)under elevated CO2and in high-and low-fertility soil.American Journal of Botany,1999,86(8):1154-1159.
[28] Horner J D,Cates R G,Gosz J R.Tannin,nitrogen,and cell wall composition of green vs.senescent Douglas-fir foliage.Oecologia,1987,72(4):515-519.
[29] Bryant J P,Chapin F S III,Klein D R.Carbon/nutrient balance of boreal plants in relation to vertebrate herbivory.Oikos,1983,40(3):357-368.
[30] Herms D A,Mattson W J.The dilemma of plants:to grow or defend.Quarterly Review of Biology,1992,67(3):283-335.
[31] Lambers H,Chapin F S,Pons T L.Plant Physiological Ecology.New York:Springer Verlag,2008.
[32] Güsewell S,Koerselman W.Variation in nitrogen and phosphorus concentrations of wetland plants.Perspectives in Plant Ecology,Evolution and Systematics,2002,5(1):37-61.
[33] Rejmánková E.Nutrient resorption in wetland macrophytes:comparison across several regions of different nutrient status.New Phytologist,2005,167(2):471-482.
[34] Miller H G.The influence of stand development on nutrient demand,growth and allocation.Plant and Soil,1995,168(1):225-232.
[35] Lambers H,Chapin F S,Pons T L.Plant Physiological Ecology.New York:Spinger,1998.
[36] Aerts R,Chapin F S.The mineral nutrition of wild plants revisited:a re-evaluation of processes and patterns.Advances in Ecological Research,2000,30:1-67.
[37] Güsewell S.Nutrient resorption of wetland graminoids is related to the type of nutrient limitation.Functional Ecology,2005,19(2):344-354.
[38] Del Arco J M,Escudero A,Garrido V M.Effects of site characteristics on nitrogen retranslocation from senescing leaves.Ecology,1991,72(2):701-708.
[39] Lal C B,Annapurna C,Raghubanshi A S,Singh J S.Effect of leaf habit and soil type on nutrient resorption and conservation in woody species of a dry tropical environment.Canadian Journal of Botany,2001,79(9):1066-1075.
[40] Côté B,Fyles J W,Djalilvand H.Increasing N and P resorption efficiency and proficiency in northern deciduous hardwoods with decreasing foliar N and P concentrations.Annals of Forest Science,2002,59(3):275-281.
[41] Yuan Z Y,Li L H,Han X G,Huang J H,Jiang G M,Wan S Q,Zhang W H,Chen Q S.Nitrogen resorption from senescing leaves in 28 plant species in a semi-arid region of northern China.Journal of Arid Environments,2005,63(1):191-202.
[42] Huang J J,Wang X H,Yan E R.Leaf nutrient concentration,nutrient resorption and litter decomposition in an evergreen broad-leaved forest in eastern China.Forest Ecology and Management,2007,239(1/3):150-158.
参考文献:
[10] 叶功富,张立华,林益明,侯杰,卢昌义,曾国强.滨海沙地木麻黄 (Casuarina equisetifolia)人工林细根养分与能量动态.生态学报,2007,27(9):3874-3882.
[17] 中国科学院南京土壤研究所.土壤理化分析.上海:上海科技出版社,1978.
