硅酸钠浓度对铝合金微弧氧化起弧过程能量消耗的影响
2013-12-14葛延峰蒋百灵时惠英
葛延峰,蒋百灵,时惠英
(西安理工大学 材料科学与工程学院,西安 710048)
微弧氧化(Micro-arc oxidation, MAO)技术[1-4]以铝、镁、钛等有色金属及其合金为阳极,不锈钢做阴极,置于脉冲电场环境的电解液中,在热化学、等离子体化学和电化学的共同作用下使金属表面产生微弧放电而生成一层与基体以冶金方式结合的陶瓷质氧化膜。铝合金经微弧氧化技术处理后极大提高了材料表面的硬度、耐磨、耐蚀、耐压绝缘及抗高温冲击等特性[5-8],同时工艺过程无限制元素加入和污染物排放被誉为清洁处理。但微弧氧化工艺处理成本很高,限制了其推广应用[9-10]。众多文献研究表明[11-15]:微弧氧化工艺既不消耗阴极又不消耗电解液溶质元素,仅依靠电源能量供给实现金属自我氧化,因此能量消耗成为铝合金微弧氧化处理的主要成本。
电解液组成和浓度是影响微弧氧化起弧过程的主要因素之一[16-17],硅酸钠因成本低廉且不污染环境在铝合金微弧氧化电解液体系中得到广泛应用。目前,国内外关于微弧氧化技术的研究主要集中在电解液及电参数对陶瓷层微观结构和性能的影响等方面[7-9,12-13],而硅酸钠浓度对铝合金微弧氧化起弧过程能量消耗的影响规律尚不明确[10]。针对工艺过程环保、涂层性能优异的铝合金微弧氧化技术主成本构成中能量消耗过高限制其推广应用这一工程学问题,本文作者在不同浓度硅酸钠溶液中研究铝合金微弧氧化起弧过程,借助电化学测试和扫描电子显微镜分析起弧瞬间膜层阻抗值并观察表面形貌,计算不同溶液中起弧过程的能量消耗,明确硅酸钠的作用机理及其对起弧过程中能量消耗的影响规律,为降低起弧过程能量消耗和实现微弧氧化技术的推广应用提供理论依据。
1 实验
1.1 试验材料和设备
试验采用的试样材料是1050工业铝合金,其化学成分(质量分数)为Si 0.25%,Fe 0.4%,Mn 0.05%,Zn 0.05%,Cu 0.05%,Mg 0.05%,余量为Al。试样尺寸为d25 mm×3 mm的圆片。微弧氧化电解槽容量为50 L,将硅酸钠(分析纯,西安三浦精细化工)和去离子水按硅酸钠浓度为0、0.25、1、4和10 g/L分别配置电解液。采用西安理工大学研制的MAO-Ⅲ型直流脉冲电源进行微弧氧化处理,电源控制参数示意图如图1所示,横坐标t代表时间,纵坐标I代表峰值电流,其中峰值电流强度Ip、电流脉冲宽度 Δt和单位时间(1 s)的电流脉冲个数N3个电参量可独立调整。铝合金在不同浓度硅酸钠溶液中设置Ip为200 A/dm2、Δt为15 μs、N为500分别进行微弧氧化处理,试样表面发生明显微弧放电现象或电压达到设备极限值(1 500 V)即切断电源。定义通电至铝合金试样表面均匀布满微弧放电斑点所消耗的时间为起弧时间ta,此时阴、阳两极间电压值即为起弧电压。铝合金试样微弧氧化工艺流程为:表面打磨清洗→微弧氧化→去离子水清洗→干燥。
1.2 试验方法
采用JSM-6700F型扫描电子显微镜(SEM)观察试样的微观形貌,并借助X射线能谱仪(EDS)分析各元素相对含量。CHI660D型电化学工作站用于交流阻抗测试,分析试样的表面阻抗值。电化学测试采用三电极体系,其中试样为工作电极,饱和甘汞电极(SCE)为参比电极,铂电极(Pt)为辅助电极。电化学测试前,试样采用环氧树脂封装,暴露面积约 1 cm2,腐蚀介质为 3.5%(质量分数)的 NaCl水溶液,测量参数:交流信号振幅5 mV,扫描速度0.1 mV/s,频率0.01~105Hz,以恒电位方式扫描。利用软件依据Randles等效电路模型(图2,其中Rc代表膜层电阻,Cc代表膜层电容,Re代表溶液电阻)对交流阻抗结果进行模拟和解析得到相应等效电路组件参数和交流阻抗拟合结果。
微弧氧化起弧过程能量消耗(起弧能量)指从通电到试样表面出现微弧放电现象过程中直流脉冲电源输出的总能量,从图1可知,起弧能量Q为通电时间内作用于两极间单脉冲能量的集合,如式(1):
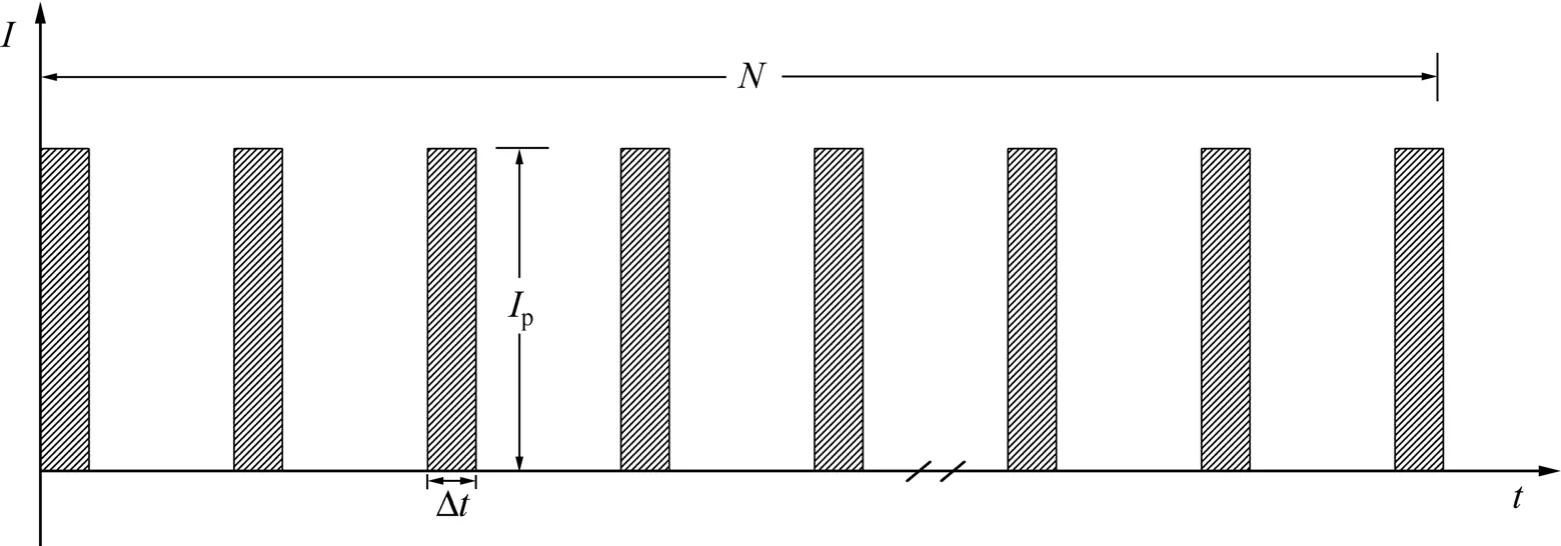
图1 电源控制参数示意图Fig.1 Schematic drawing of control parameters on power source
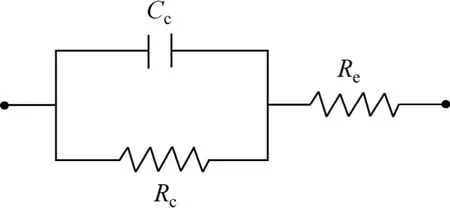
图2 Randles等效电路Fig.2 Equivalent model circuit of Randles

式中:N代表每秒内脉冲个数,ta为起弧时间,Wsi是单个脉冲所蕴含能量,为峰值电流Ip、峰值电压Ut及导通时间也就是脉宽Δt的乘积,单位为J,计算式如式(2):

根据电流等通量变换原理,可知峰值电流Ip与平均电流Ia的关系如式(3):

由于Ip保持不变,将式(3)进行转变可以得到式(4):

通过式(2)和(4)对式(1)进行转化,最终可得到起弧能量的计算公式如式(5):

式中:ta为起弧时间;V(t)为电压随时间变化函数;Ia为平均电流;Q即微弧氧化起弧过程的能量消耗。
2 结果与讨论
2.1 硅酸钠浓度对起弧时间及电压的影响
铝合金试样分别在不同浓度硅酸钠水溶液中按既定电参数进行微弧氧化处理,记录不同时刻两极间电压值、起弧时间以及起弧电压。图3所示为试样在不同浓度硅酸钠溶液中的电压—时间变化曲线。从图3电压曲线变化可以看出,通电初期试样两端电压增速较高,后期增速降低。铝合金试样在硅酸钠浓度为 0的溶液中没有微弧放电现象出现,仅在其表面有少量气泡产生,通电240 s后,电压达到1 500 V时停止通电。0.25 g/L硅酸钠溶液中处理的试样,试验初期其表面出现少量气泡且局部区域出现暗光点,随着极间电压升高,气泡逐渐增多直至覆盖整个试样表面,暗光点逐渐变多且亮度增强,电压至1 217 V时白色微弧放电斑点覆盖试样表面,且在亮度最强处观察到细小火花。铝合金试样在浓度为0.25、1、4和10 g/L的硅酸钠溶液中均出现微弧放电现象,起弧电压分别为1 217、866、552和351 V,起弧时间ta分别为270、126、115和40 s。随着溶液中硅酸钠浓度增大,铝合金试样表面发生微弧放电现象所需电压降低,从通电到均匀布满微弧放电斑点的等待时间缩短。
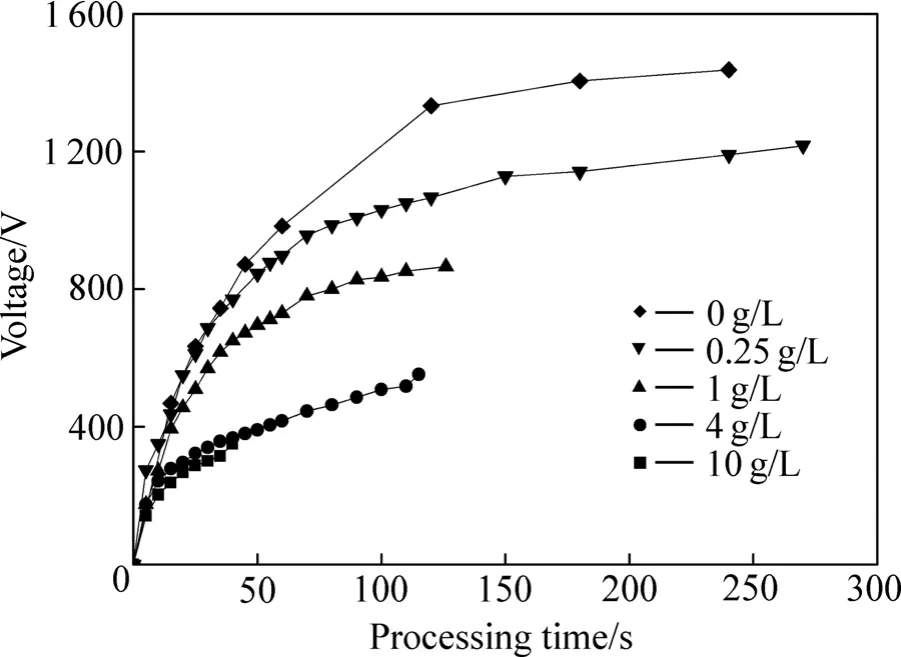
图3 不同浓度硅酸钠溶液中电压—时间曲线Fig.3 Voltage—time curves under different contents of Na2SiO3 solution
2.2 硅酸钠浓度对微观结构的影响
采用 SEM 对铝合金试样在不同浓度硅酸钠溶液中微弧氧化起弧瞬间的表面形貌进行观察,结果如图4所示。从图4(a)中可以看到,试样在硅酸钠浓度为0的溶液中通电处理240 s后表面可以看到许多腐蚀坑,分析是由于溶液电导率较差,溶液中主要导电离子为电解产生的少量 OH-与 H+,少量 OH-在阳极与基体Al发生氧化反应,但没有足够的OH-供应,其阳极上金属离子脱离试样表面速度远超过 Al(OH)3形成速度,故形成许多腐蚀坑,属典型电解腐蚀。从图4对比还可以看出,随着硅酸钠溶液浓度升高,起弧瞬间铝合金试样表面放电微孔数量逐渐增加,孔径逐渐增大。在0.25 g/L的硅酸钠溶液中,微弧氧化处理后试样表面仅有一层沉积物生成(见图4(b)),呈片状堆积,膜层均匀几乎没有孔洞,层片状的膜层分布跟基体表面特性关系密切。随着溶液中硅酸钠浓度的继续增大,沉积物增加并迅速覆盖整个基体,更多沉积物将在薄弱或缺陷处生成,从而形成放电通道,如图4(c)所示起弧瞬间的膜层表面微孔数量少,孔径较小,有些区域甚至无孔洞,仅为层片状阻挡层。当溶液浓度达到10 g/L时(见图4(e)),试样表面放电通道数量明显增多,孔径也明显增大,表面局部开始出现较大的喷射状孔洞及熔融颗粒,呈现典型“火山堆”状结构。

图4 不同浓度硅酸钠溶液中试样起弧瞬间表面形貌Fig.4 Surface morphologies of samples at arcing moment under different Na2SiO3 solution contents: (a)0 g/L; (b)0.25 g/L;(c)1 g/L; (d)4 g/L; (e)10 g/L
借助 SEM 的能谱附件对图4(a)和(e)的表面元素进行分析,其结果如图5所示。试样在硅酸钠浓度为0的溶液中通电处理240 s后,EDS分析结果(见图5(a))显示表面元素主要以 Al以及基体金属中杂质元素(Mn,Fe,Cu)等形式存在,无O元素存在,结合表面形貌(见图4(a))说明试样表面无氧化膜生成且出现明显电解腐蚀现象。试样在硅酸钠浓度为10 g/L的溶液中通电处理40 s后,EDS分析结果(见图5(b))显示表面元素主要为 Al和 O,其摩尔分数分别为 58%和42%,结合相关文献[6]可知,电解液中溶质元素Si有利于电化学沉积反应的发生,因此,硅酸钠浓度增大有利于缩短微弧氧化起弧时间,促进铝合金微弧氧化初期成膜过程。
2.3 硅酸钠浓度对表面阻抗的影响
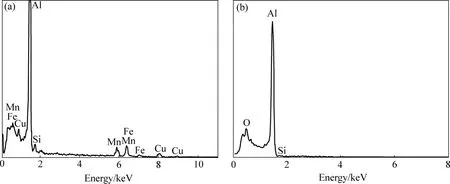
图5 不同浓度硅酸钠溶液中试样起弧瞬间表面元素分析Fig.5 Surface elementary analysis of samples at arcing moment under different Na2SiO3 solution contents: (a)0 g/L;(b)10 g/L
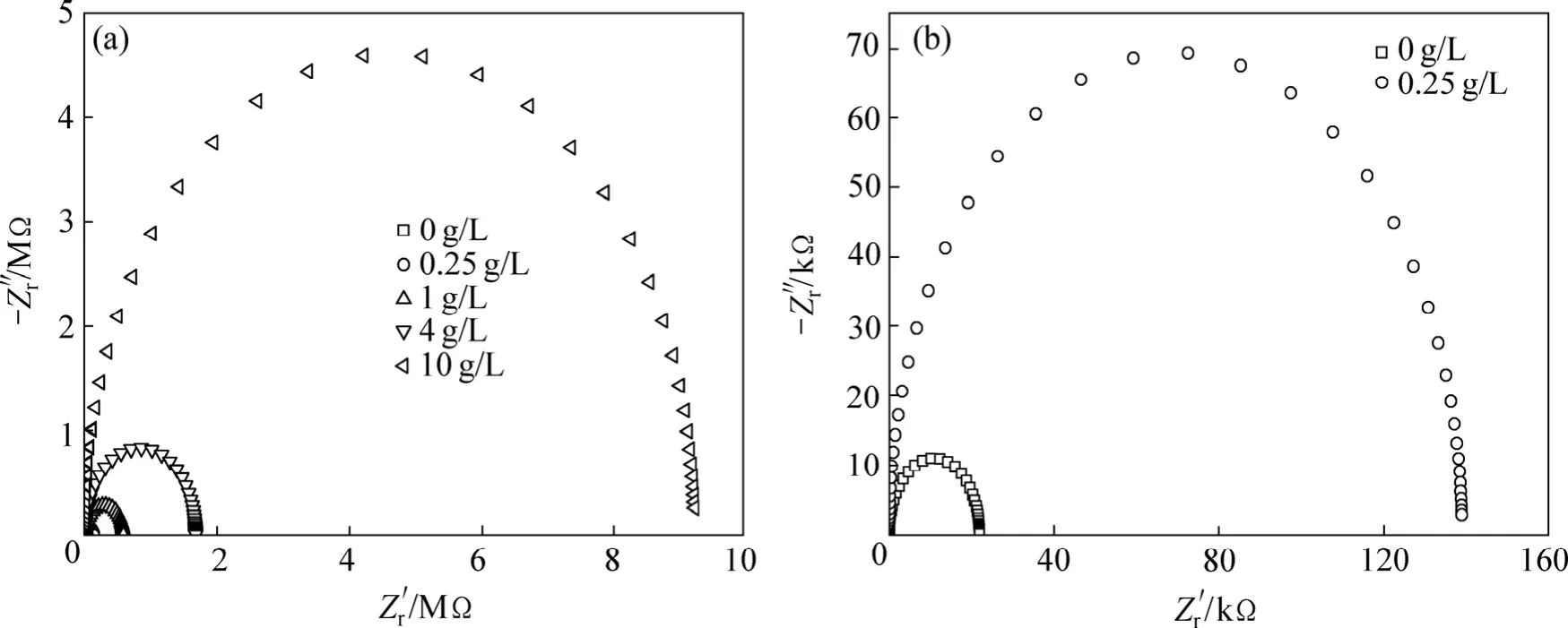
图6 不同浓度硅酸钠溶液中起弧瞬间膜层的阻抗图谱Fig.6 Impedance spectra of samples at arcing moment under different Na2SiO3 solution contents: (a)Complex spectra; (b)Partial enlarged drawing

表1 不同浓度硅酸钠溶液中起弧瞬间膜层的电阻值Table 1 Coating resistance of samples at arcing moment under different Na2SiO3 concentrations
采用电化学工作站对铝合金试样在不同浓度硅酸钠溶液中起弧瞬间所得膜层的表面阻抗值进行测定,依据 Randles等效电路模型(见图2),利用软件ZView2.0进行模拟和解析得到试样的交流阻抗图谱(图6)和膜层表面阻值结果如表1所示。从表1看到,试样在硅酸钠浓度为0的溶液中持续通电后电压达到设备极限值,其试样表面电阻值为4.4 kΩ,与基体相比 (800 Ω)虽略有增大,但从表面形貌(图4(a))和能谱结果(图5(a))分析可知,试样表面发生电解腐蚀现象,膜层表面阻值增加不明显。试样在浓度为0.25、1、4和10 g/L的硅酸钠溶液中起弧瞬间表面阻值都在105数量级以上,且随着硅酸钠浓度增大起弧瞬间膜层阻值明显增加。通过电化学知识分析可知,随着硅酸钠溶液浓度增大,溶液电导率增加且电阻值减小,在每一个放电周期内,膜层局部的失稳过程(速溶和激冷)转换较快,冷凝过程中的电化学反应较迅速,电解液中SiO32-水解形成的OH-率先在样品表面缺陷处失电子而产生活化氧原子,与铝原子结合形成氧化铝。因此,随着硅酸钠浓度的增大,在电场环境下,样品表面缺陷被击穿的概率也增加,反应产物氧化铝的增多最终表现为膜层阻抗值增加。交流阻抗分析结果表明,铝合金试样表面形成阻值达 105数量级的高阻抗膜是微弧放电现象发生的前提,同时溶液中硅酸钠浓度增大更有利于在铝合金表面形成高阻抗膜。
2.4 硅酸钠浓度对起弧能量的影响
为了研究通电时间对铝合金微弧氧化通电过程能量消耗的影响,按照式(5)对图3中电压变化曲线进行分段积分,得到不同时刻试样在硅酸钠浓度为 0和0.25 g/L两种溶液中能量消耗的计算结果表2。从表2看到,相同时刻试样在硅酸钠浓度为0溶液中消耗能量均高于0.25 g/L溶液中消耗能量,主要是由于试样在浓度为 0的溶液中电压更高。在浓度为 0的溶液中,导电离子仅有少量H+与OH-,溶液中缺少Si元素,不能形成高阻抗阻挡层,因此消耗的能量更多用于建立电场使设定电流下的电子通过;而0.25 g/L溶液中,其电导率相对较高,溶质离子数量明显多于前者,因此溶液中更容易迁移吸附在样品表面并参与微弧氧化初期成膜过程,能量能够用于发生电化学沉积反应,促进试样表面微弧氧化初期高阻抗膜层的形成。
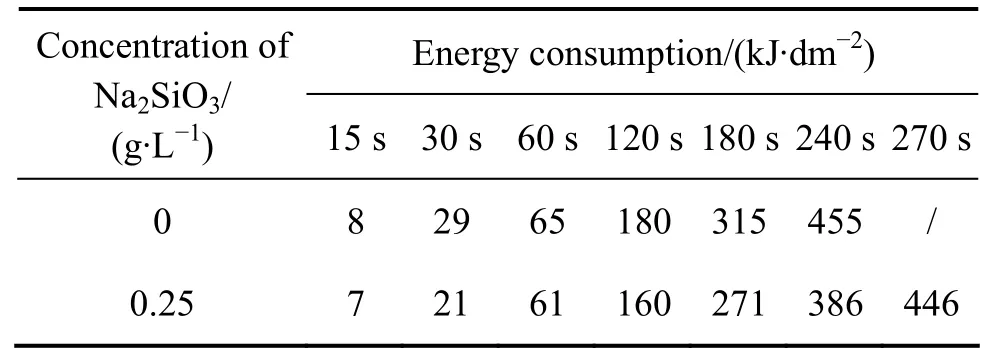
表2 不同浓度硅酸钠溶液中通电过程能量消耗Table 2 Energy consumption of samples during MAO processing under different Na2SiO3 concentrations
同样按照式(5)对图3中电压变化曲线进行积分计算,可得铝合金试样在不同浓度硅酸钠溶液中微弧氧化起弧过程的能量消耗结果如图7所示。从图7中可以看出,随着硅酸钠溶液浓度增大,铝合金试样起弧能量大幅度降低。铝合金试样在硅酸钠浓度为0的溶液中,能量消耗最大,测量溶液电导率可知其电导率仅为0.01 S/m;而浓度为0.25、1、4和10 g/L的硅酸钠溶液中,电导率分别为0.09、0.23、0.76和1.6 S/m。由微弧氧化的击穿电压模型[11]可知,只有当施加在样品表面的电压高于某一特定值时,电子才可能注入到高阻抗膜的导电带中,即发生微弧放电。在试样表面电阻、溶液电阻、膜层阻抗、双电层极化电阻构成的负载体系中,只有当试样表面某一薄弱区域电阻分压高于某一特定值时,微弧氧化过程才会进行,宏观上表现为出现弧光放电现象。当硅酸钠浓度为0时,溶液本身导电性很差,导致在设定电流下电子难以通过,只能依靠提高溶液两端电压值来驱使电子快速通过,溶液电压降很高,由焦耳定律可知能量主要消耗在加热溶液上,最终导致作用在样品表面的电压降低有效能减少,因此,通电过程中样品表面无微弧放电现象出现。随着Na2SiO3溶液的浓度由0.25 g/L增加至10 g/L,其电阻值减小,溶液电压降降低,样品电压降升高,通电过程中作用在试样的有效能增加,最终实现微弧氧化起弧过程能量消耗的降低。铝合金微弧氧化起弧过程的能量消耗随着硅酸钠浓度的增大而减小,并在浓度为10 g/L时达到最小值,仅为16 kJ/dm2。
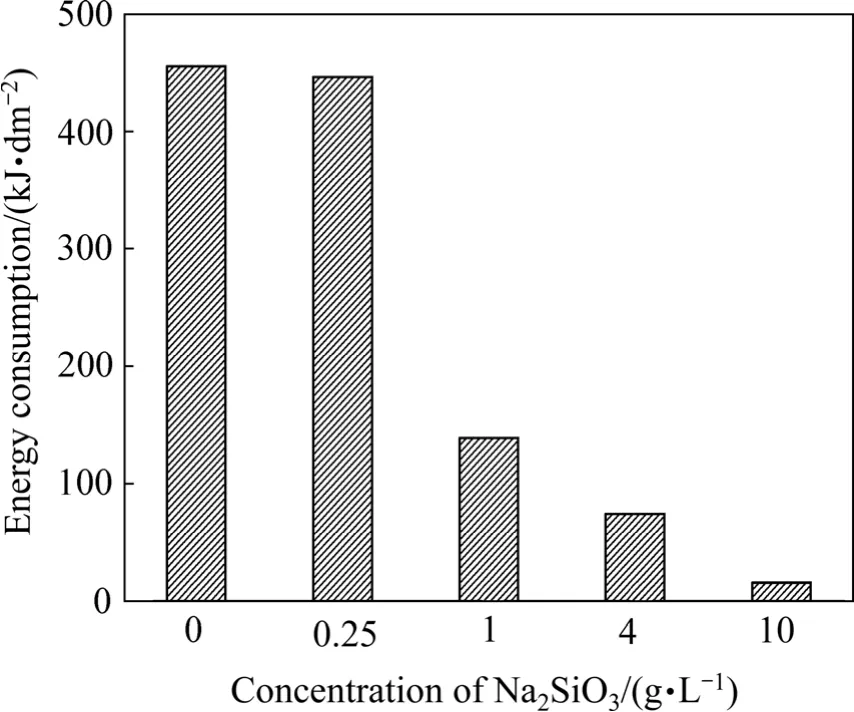
图7 硅酸钠溶液浓度对起弧过程能量消耗的影响Fig.7 Effect of Na2SiO3 solution contents on arcing energy consumption
3 结论
1)当溶液中硅酸钠浓度为0时,即使极间电压升至1 500 V,铝合金表面仍无微弧放电现象出现,仅发生电解腐蚀。
2)随着硅酸钠浓度由0.25 g/L增加至10 g/L,铝合金表面发生微弧放电现象所需的电压由1 217 V降低至351 V,通电至起弧的等待时间由270 s缩短至40 s,起弧瞬间膜层表面放电微孔数量增多。
3)铝合金表面形成阻值达105数量级的高阻抗膜是发生微弧放电现象的前提,电解液中添加硅酸钠有利于其表面生成高阻抗膜。
4)硅酸钠浓度的增大能够促进铝合金样品表面发生弧光放电现象,降低微弧氧化起弧过程的能量消耗;当浓度达到10 g/L时,能量消耗值达到最小,仅为16 kJ/dm2。
[1]GUPTA P, TENHUNDFELD G, DAIGLE E O.Electrolytic plasma technology: Science and engineering—An overview[J].Surface and Coatings Technology, 2007, 201(21): 8746-8760.
[2]LIA H X, RUDNEV V S, ZHENG X H, YAROVAYA T P,SONG R G.Characterization of Al2O3ceramic coatings on 6063 aluminum alloy prepared in borate electrolytes by micro-arc oxidation[J].Journal of Alloys and Compounds, 2008, 462(1/2):99-102.
[3]NIE X, LEYLAND A, SONG H W, YEROKHINC A L,DOWEYD S J, MATTHEWS A.Thickness effects on the mechanical properties of micro-arc discharge oxide coatings on aluminium alloys[J].Surface and Coatings Technology, 1999,116/119(9): 1055-1060.
[4]蒋百灵, 白力静, 蒋永锋, 张淑芬.铝合金微弧氧化技术[J].西安理工大学学报, 2000, 16(2): 8-11.JIANG Bai-ling, BAI Li-jing, JIANG Yong-feng, ZHANG Shu-fen.The technique of microarc oxidation on aluminum alloy[J].Journal of Xi’an University of Technology, 2000, 16(2):8-11.
[5]JASPARD-MÉCUSON, CZERWIEC T, HENRION G,BELMONTE T, DUJARDIN L, VIOLA A, BEAUVIR A.Tailored aluminium oxide layers by bipolar current adjustment in the plasma electrolytic oxidation (PEO)process[J].Surface and Coatings Technology, 2007, 201: 8677-8682.
[6]杨 巍, 蒋百灵, 时惠英.LY12铝合金微弧氧化膜层的形成与生长机制[J].中国有色金属学报, 2010, 20(10): 1949-1954.YANG Wei, JIANG Bai-ling, SHI Hui-ying.Formation and growth mechanism of microarc oxidation coating on LY12 aluminium alloy[J].The Chinese Journal of Nonferrous Metals,2010, 20(10): 1949-1954.
[7]XIN Shi-gang, SONG Li-xin, ZHAO Rong-gen.Properties of aluminum oxide coating on aluminum alloy produced by micro-arc oxidation[J].Surface and Coatings Technology, 2005,199(2): 184-188.
[8]熊仁章, 盛 磊, 郭洪光.铝合金微弧氧化陶瓷层的耐磨性能[J].兵器材料科学与工程, 2000, 33(3): 13-14.XIONG Ren-zhang, SHENG Lei, GUO Hong-guang.Wear resistant properties of ceramic layer on Al based alloy by micro arc oxidation[J].Ordnance Material Science and Engineering,2000, 33(3): 13-14.
[9]NYKYFORCHYN H M, KLAPKIV M D, POSUVAILO V M.Properties of synthesised oxide-ceramic coatings in electrolyte plasma on aluminium alloys[J].Surface and Coatings Technology, 1998, 100/101: 219-221.
[10]蒋百灵, 刘东杰.制约微弧氧化技术应用开发的几个科学问题[J].中国有色金属学报, 2011, 21(10): 2402-2407.JIANG Bai-ling, LIU Dong-jie.Scientific aspects of restricting development and application of micro-arc oxidation technology[J].The Chinese Journal of Nonferrous Metals, 2011,21(10): 2402-2407.
[11]YEROKHIN A L, SHATROV T A, SAMSONOV V,SHASHKOV P, PILKINGTON A, LEYLAND A, MATTHEWS A.Oxide ceramic coatings on aluminium alloys produced by a pulsed bipolar plasma electrolytic oxidation process[J].Surface and Coatings Technology, 2005, 199: 150-157.
[12]YEROKHIN A L, SNIZHKO L O, GUREVINA L, LEYLAND A, PILKINGTON A, MATTHEWS A. Discharge characterization in plasma electrolytic oxidation of aluminium[J].Journal of Applied Physics, 2003, 36: 2110-2120.
[13]XUE W B, WANG C, LI Y L, DENG Z W, CHEN R Y, ZHANG T H.Effect of microarc discharge surface treatment on the tensile properties of Al-Cu-Mg alloy[J].Materials Letters, 2002,56: 737-743.
[14]MÉCUSON F, CZERWIEC T, BELMONTE T, DUJARDIN L,VIOLA A, HENRION G.Diagnostics of an electrolytic microarc process for aluminium alloy oxidation[J].Surface and Coatings Technology, 2005, 200: 804-808.
[15]LÜ G H, GU W C, CHEN H, FENG W R, KHOSA M L, LI L,NIU E W, ZHANG G L, YANG S Z.Characteristics of ceramic coatings on aluminum formed by plasma electrolytic oxidation in silicate and phosphate electrolyte[J].Applied Surface Science,2006, 253: 2947-952.
[16]骆海贺, 蔡启舟, 魏伯康, 余 博, 何 剑, 李定骏.添加剂浓度对微弧氧化陶瓷层结构及耐蚀性的影响[J].中国有色金属学报, 2008, 18(6): 1082-1087.LUO Hai-he, CAI Qi-zhou, WEI Bo-kang, YU Bo, HE Jian, LI Ding-jun.Effects of additive concentration on microstructure and corrosion resistance of ceramic coatings formed by micro-arc oxidation on AZ91D Mg alloy[J].The Chinese Journal of Nonferrous Metals, 2008, 18(6): 1082-1087.
[17]SNIZHKO L O, YEROKHIN A L, PILKINGTON A,GUREVINA N L, MISNYANKIN D O, LEYLAND A,MATTHEWS A.Anodic processes in plasma electrolytic oxidation of aluminium in alkaline solutions[J].Electrochimica Acta, 2004, 49: 2085-2095.
