不同低氧浓度暴露对慢性疲劳综合征建模小鼠肠上皮内γδT细胞的影响
2013-12-10罗贝贝张亚军王红霞MaboundaKounga陈佩杰
王 茹, 罗贝贝, 张亚军, 王红霞, P.R.Mabounda Kounga, 陈佩杰
(上海体育学院运动健身科技省部共建教育部重点实验室,上海200438)
慢性疲劳综合征(chronic fatigue syndrome,CFS)是现代医学中发现的一种疾病。目前,CFS的发病机制尚不清楚,临床也缺乏特异的诊断标准和有效的治疗方法[1]。近年有研究发现:CFS患者肠道菌群异常改变,胃肠道功能紊乱,黏膜免疫失衡,促炎因子水平升高[2],提示肠道菌群异常相关的肠黏膜免疫屏障功能紊乱可能参与了CFS的发生[3]。肠上皮间淋巴细胞(intestinal intraepithelial lymphocytes,iIEL)在消化道中的数量极其庞大且由多个T细胞亚群组成,其中以γδT细胞所占的比例最大。已知γδT细胞是一类重要的固有免疫细胞,主要分布在黏膜和上皮组织,在维持和调节正常黏膜免疫功能中发挥重要作用[4]。本研究通过流式细胞术分析γδT细胞在慢性疲劳综合征建模小鼠肠上皮间淋巴细胞中所占的比例,试图从肠道黏膜免疫的角度探讨CFS的发病机制。此外,鉴于适宜低氧引发的良性生物学效应,本研究进一步观察不同程度低氧暴露对CFS小鼠肠上皮内γδT细胞的影响,为治疗CFS患者提供新思路。
1 研究方法
1.1 动物与分组选取72只30~40 g的SPF级雄性ICR小鼠作为实验对象,分笼饲养,每笼6只,自由饮食,保持饲养环境温度为(23±2)℃,湿度为55% ±15%,实验动物由上海西普尔-必凯实验动物有限公司提供[SCXK(沪)2008-0016]。所有小鼠被随机分为6组,每组12只,即正常对照组(C0组)、慢性疲劳综合征建模组(CFS0组)、低氧干预正常对照组(C组)、慢性疲劳综合征低氧干预对照组(CFS组)、慢性疲劳综合征+15%氧浓度低氧暴露组(15%H组)和慢性疲劳综合征+18%氧浓度低氧暴露组(18%H组)。其中,CFS0组、CFS组、15%H组和18%H组采用束缚和强迫游泳方式建立慢性疲劳综合征小鼠模型(建模方案如表1所示),C0组和C组在同等条件下正常饲养。建模完成后C0组和CFS0组立即处死,用于检验建模效果。C组继续饲养7 d,CFS组自然恢复7 d,15%H组和18%H组分别在15%和18%氧浓度环境暴露7 d(1 h/d,低氧干预方案见表2),低氧设备为美国 HYPOXIC SYSTEMS公司 HYP-123型低氧发生器。
1.2 行为学测试 CFS建模第5周进行水迷宫测试。水迷宫测试相关实验设备均由安徽淮北正华生物仪器设备有限公司生产,视频处理借助美国ANY-maze动物行为学视频分析系统完成。
Morris水迷宫测试用于测定小鼠的空间学习记忆能力。Morris水迷宫测试分为隐藏平台获得实验和移开平台空间搜索实验2个部分,水面背景采用黑色食用色素着染,测试顺序参照 C.V.Vorhees等[5]建议的方案。1)隐藏平台获得实验:平台置于任一象限水面下1.5 cm处,每天训练4次,持续5 d,小鼠入水时面向池壁,找到隐藏平台后立即停止试验,仪器自动记录小鼠从入水到发现隐藏平台的时间即逃避潜伏期。如果小鼠在120 s内未能找到平台,由实验者将其引导至平台停留15 s,逃避潜伏期记为120 s。2)移开平台空间搜索实验:在Morris水迷宫测试的第6天移去隐藏平台,任意选取一个入水点将小鼠面向池壁放入水中,仪器自动记录60 s内小鼠在各个象限停留的时间,记录在平台所在象限停留时间。

表1 CFS建模方案Table 1 CFS Mice Model Induced by Chronic Restraint and Forced Swimming

表2 低氧干预方案Table 2 Hypoxia Intervention Scheme
1.3 肠道iIEL分离方法
1.3.1 实验器材 RPMI 1640培养液购自美国Gibco公司,Percoll分离液购自美国Sigma公司,流式抗体以及相关试剂购自美国Beckman Coulter公司。磷酸盐缓冲溶液(10×PBS溶液)、Hank’s溶液、乙二胺四乙酸(EDTA)、二硫苏糖醇(DTT)、5%胎牛血清(FCS)、多聚赖氨酸、多聚甲醛、生理盐水等常规试剂药品均购自上海国药集团化学试剂有限公司。
眼科剪、培养皿、50 mL离心管、15 mL离心管、200目筛网购自上海国药集团化学试剂有限公司。仪器设备:移液器(德国eppendorf),振荡水浴箱(上海比郎仪器有限公司生产),低温离心机(上海飞鸽 DL-4000B),病理诊断系统(德国Leica公司提供),Epics XL流式细胞仪(美国Beckman Coulter公司生产),倒置相差显微镜(美国Olympus公司生产),GDS-8000图像采集分析系统(美国UVP公司提供)。
1.3.2 iIEL分离方案 啮齿类实验动物iIEL的分离方法最早建立于1981年[6]。国内外许多学者对分离方法进行了改进:梯度密度离心、筛网或尼龙毛过滤[7];分离过程中大部分使用了DTT与EDTA等螯合剂作为消化液以及用冷生理盐水(4℃)冲洗管腔[8];低温下静置的时间、摇床振荡的力度和2层Percoll界面间的细胞层是否吸取完全是影响小鼠iIEL分离收获率的主要因素,此外分离过程中的人为因素(熟练程度)也影响iIEL的获得量[9]。本实验采用2009年Binda等改良的分离小鼠iIEL方法[10],并由专人操作以减少误差。具体步骤如下。
第一,Percoll工作液的配制:Percoll原液与10×PBS溶液按体积比9∶1混合,制成100%等渗Percoll。100%等渗Percoll与1×PBS溶液按体积比7∶3和4∶6混合,制成70%等渗Percoll溶液和40%等渗Percoll溶液。
第二,iIEL的制备:颈椎脱臼法处死小鼠,剖开腹腔,小心取出小肠置于预先制冷的含5%FCS的RPMI 1640培养液中。在冷生理盐水中冲洗,去除肠系膜和集合淋巴小结。纵向剪开小肠,再用冷生理盐水冲洗至肠内外壁均无残留物。将小肠剪成5 mm大小的碎片,移入50 mL离心管中静置沉淀,吸去上清液。加入30 mL消化液(在无Ca2+、Mg2+的Hank’s溶液中加入2 mmol/L DTT与5 mmol/L EDTA),置入恒温振荡水浴箱中,37 ℃,150 r/min,振荡30 min,收集上清,重复2次。上清液通过200目尼龙网筛过滤后,4℃离心(400 g)10 min收集细胞,将细胞沉淀用预先配置的40%Percoll溶液3 mL重悬。
第三,iIEL的纯化:取70%Percoll 4 mL铺于15 mL离心管底部,再将上述3 mL的细胞悬液轻轻加于4 mL 70%Percoll溶液上,2层液体间可见形成清晰的分界面。4℃ 400 g离心30 min,小心吸取在2层分离液之间的细胞,用5倍以上体积的RPMI 1640培养液洗2遍、重悬,将所获得的细胞用倒置显微镜计数。
1.3.3 流式检测肠上皮内γδT细胞 100万个细胞加入1μL的FITC标记的抗小鼠γδTCR和PE标记的抗小鼠CD3抗体,避光室温下孵育30 min,用流式细胞仪检测iIEL中的CD3+iγδT细胞的百分比。收集1万个细胞用于数据分析,采用同型抗体作为阴性对照。荧光激发光波长为488 nm,PE及FITC荧光滤光片波长分别为575 nm和525 nm,分析系统软件为SystemⅡ。
1.4 数据分析 所有数据以“均值±标准误”表示,逃避潜伏期采用重复测量方差分析,其他指标采用单因素方差分析处理。所有数据处理由SPSS 17.0统计学软件完成,其中P<0.05表示具有显著性差异。
2 研究结果
2.1 CFS建模及低氧干预过程中各组小鼠体重变化
表3显示,CFS建模第1周C0组和CFS0组小鼠体重不存在显著性差异,CFS 建模第2、3、4、5 周,CFS0组小鼠体重明显低于C0组(P<0.05)。

表3 CFS建模过程中小鼠体重的变化Table 3 CFSMice Weight Change during Chronic Restraint and Forced Swimming
2.2 CFS建模过程中行为学指标变化
2.2.1 CFS建模过程中小鼠潜伏期的变化 图1显示,CFS建模第5周C0组和CFS0组小鼠逃避潜伏期的变化,重复测量方差分析显示,C0组与CFS0组小鼠逃避潜伏期存在显著性差异(P<0.05),单因素方差分析显示,在水迷宫测试第4天C0组潜伏期明显比CFS0组短(P <0.05)。
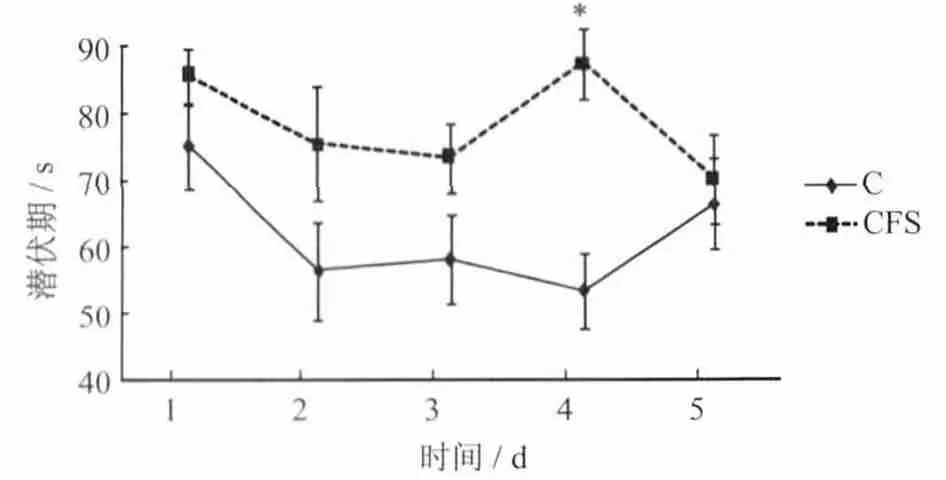
图1 CFS建模小鼠逃避潜伏期的变化Figure 1.The Escape Latency of CFSMice in Morris Water Maze
2.2.2 CFS建模过程中小鼠空间搜索能力的差异图2显示,CFS建模第5周末CFS0组小鼠停留在平台所在象限时间明显低于C0组(P<0.05)。

图2 CFS建模小鼠停留在平台所在象限的时间差异Figure 2.The Time Spending in the Target Quadrant of CFSMice
2.3 流式细胞仪检测γδT细胞在CD3+iIEL细胞中的百分比 图3显示,CFS建模第5周末CFS0组小鼠γδT细胞在 CD3+iIEL细胞中的百分比明显低于C0组。
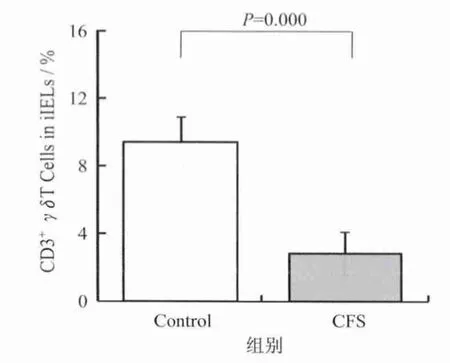
图3 CFS建模时各组小鼠CD3+γδT细胞在iIEL细胞中所占的百分比Figure 3. Percentage of CD3+γδT Cells in Intestinal Intraepithelial Lymphocytes of CFSMice
CFS建模成功并进行为期1周的低氧干预后发现:与 C组相比,CFS组和18%H组的 γδT细胞在CD3+iIEL细胞中所占的百分比显著下降;15%H组的γδT细胞在CD3+iIEL细胞中所占的百分比与对照组无差异;15%H组γδT细胞在CD3+iIEL细胞中所占的百分比显著高于CFS组和18%H组(图4)。
3 讨论
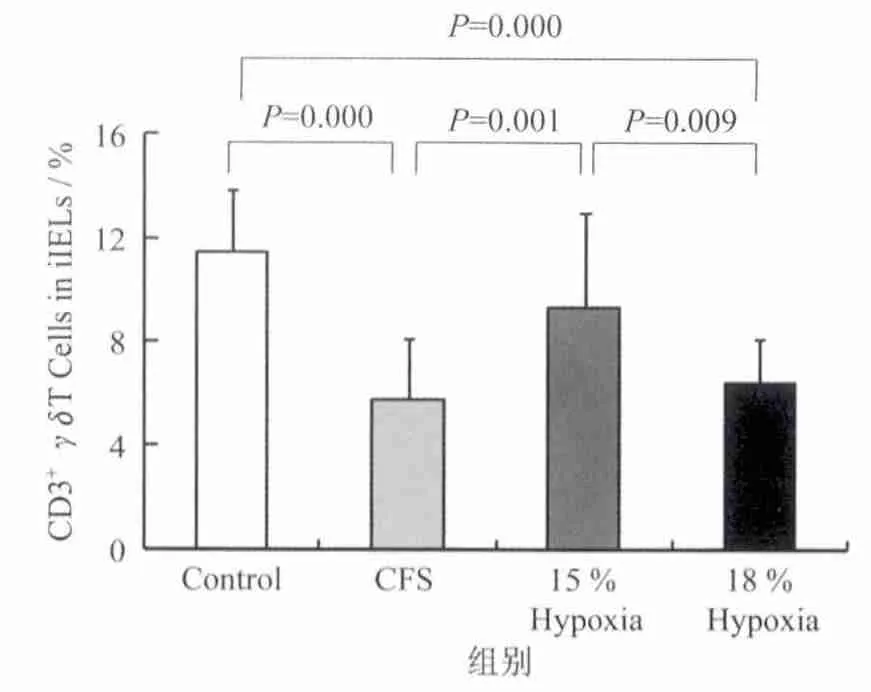
图4 干预后各组小鼠CD3+γδT细胞在iIEL细胞中所占的百分比Figure 4. Percentage of CD3+γδT Cells in Intestinal Intraepithelial Lymphocytes of CFSMice after Hypoxia Intervention
Michael Maes提出CFS的发生是生理和心理因素综合作用的结果,他认为:持续性的心理和生理(如剧烈运动等)应激易造成机体免疫及氧化-抗氧化平衡紊乱;当反复遭受外界病毒和细菌感染时,进一步恶化机体免疫,导致氧化抗氧化失衡状态,诱发CFS,出现疲劳、肌肉疼痛及行为认知功能恶化等症状[11]。
鉴于CFS患者主要病症,以生理、心理为切入点可能更加符合CFS的发病机制。目前关于CFS动物模型建立尚无统一标准:多数研究[12-15]采用注射脂多糖(lipopolysaccharide,LPS)、布鲁氏杆菌 (Brucella abortus,BA)及多聚肌胞甘酸(poly I:C)等造成动物机体免疫紊乱进而诱发慢性疲劳综合征;也有部分研究[16-20]采用强迫游泳或跑步等运动形式建立慢性疲劳综合征动物模型,但建模时间各不相同。此类CFS动物模型往往偏重于CFS患者病症的复制,忽略了生理、心理应激在CFS发生中的作用。基于此,本研究根据CFS发病的生理、心理学理论模式,采用束缚及强迫游泳方式建立CFS小鼠模型。
3.1 CFS建模效果 临床对于CFS尚无特异性的诊断标准,相关研究多采用动物行为学相关指标判断CFS建模效果,目前最为常用的是水迷宫测试。Morris水迷宫测试是英国心理学家Morris于20世纪80年代初设计并应用于大脑学习记忆机制研究的一种实验手段,此方法已得到广泛认可,并被大多数学者运用于从事动物空间学习记忆能力的相关研究。水迷宫测试主要包括隐藏平台获得实验和移开平台空间搜索实验,其中前者主要通过逃避潜伏期的变化反映小鼠的学习能力,而后者主要通过穿越平台所在象限的次数和停留在平台所在象限的时间反映小鼠的记忆力水平。
研究证实,CFS建模动物学习记忆能力下降[21],与CFS患者注意力和记忆力减退症状相符,提示可通过学习记忆能力评定、判断CFS建模效果。本研究结果显示:采用束缚和强迫游泳的方式成功建立以空间学习记忆能力减退为主要特征的CFS小鼠模型。
3.2 肠道γδT细胞免疫机能肠上皮间淋巴细胞(intestinal intraepithelial lymphocytes,iIEL)是肠道黏膜免疫屏障的主要组成部分,其数量极其庞大,每只鼠可达5×106~7×106个,主要位于肠道基底膜的肠腔面且在肠道的不同部位iIEL数量不相同(空肠最多,回肠次之,结肠较少)。iIEL受刺激后可分泌多种细胞因子,进而参与维持正常的肠道黏膜免疫功能,其作为一种特殊的淋巴细胞群体,长期与肠道菌群、病原体等接触,在调节肠道黏膜抗感染免疫、维持肠道上皮细胞完整性和对食物等外来抗原的免疫耐受中发挥重要作用[22]。
iIEL由多个T细胞亚群组成,其中以γδT细胞所占的比例最大,可达30%~50%[22]。γδT细胞是适应性免疫系统的重要成员T细胞的一大亚类,由于其表面的TCR是由γ和δ链组成而命名。相对于αβT细胞而言,γδT细胞有许多特殊的天然免疫系统特性:γδTCR具有高度多样性,不具MHC限制性和不依赖抗原的处理和呈递过程,表明γδT细胞在抗感染中起第一线的防御作用[23]。早在1999年,Matrumoto等用转基因鼠研究证明,TCRγδIEL通过合成分泌IFN-γ促进肠上皮细胞的分化、增殖和MHCⅡ类分子的表达[24]。此外,γδT细胞作为一种特殊的淋巴细胞群体,通过其活化后合成分泌的细胞因子及细胞毒活性在黏膜局部的抗感染免疫,维护上皮细胞的完整性及调节对外来抗原的免疫应答等方面起重要作用[24],被称作固有免疫与适应性免疫的桥梁细胞[25]。近年来,对γδT细胞的深入研究进一步表明了其能调控免疫反应具有毒杀多种癌细胞与被病毒感染的细胞的能力,但其对抗原的识别与αβT细胞并不相似。在历经长期进化后,相比αβT细胞,γδT细胞以更广泛、快速和直接的方式对体内应激事件做出应答[26]。
3.3 CFS建模小鼠肠上皮内γδT细胞的变化 大量研究表明,CFS可能存在免疫功能异常,包括慢性免疫激活、免疫细胞对多克隆刺激的反应性降低、慢性炎症和细胞因子网络紊乱等[27]。此外,还有研究认为,CFS患者免疫功能的异常可能由肠道菌群紊乱引起,肠道菌群改变可能与CFS患者的认知及情绪状态、特别是焦虑有一定关系[28]。有研究报道,补充含有益生菌的制剂能减轻CFS患者的压力和疲惫[29],甚至能改善神经认知功能[30]。同样,一项随机选取39名CFS患者双盲的研究通过粪便样本检测和贝克焦虑量表发现:服用干酪乳杆菌促进患者的肠道菌群和黏膜免疫功能平衡,并缓减CFS焦虑症状[31]。肠道菌群改变、黏膜屏障失调和小肠免疫异常可能是CFS的发病机制之一。本研究发现,CFS建模小鼠肠上皮间γδT细胞数量所占iIEL的百分比下降,提示CFS小鼠可能对体内应激事件做出应答的速度有所减弱,机体动员、发挥免疫监视的作用有所下降。当反复遭受外界病毒和细菌感染时,进一步恶化机体免疫机能,导致 CFS的发生。
3.4 不同低氧浓度对CFS建模小鼠的影响 采取措施改善CFS小鼠肠上皮间γδT细胞的表达量,无疑有利于调节肠道菌群平衡从而维持正常的肠道黏膜免疫功能。近年来,“低氧与健康”的议题引起了国际生物医学界的研究兴趣[32-34]。低氧暴露作为一种生理性刺激,其对机体产生的生物学效应主要取决低氧刺激的强度和持续时间,急性低氧暴露或持续性的低氧暴露易于引起机体损伤,中等浓度且时间相对较短的低氧暴露往往对机体具有保护作用。适宜的低氧暴露可能对CFS患者肠道免疫的改善具有一定的积极意义,但至今尚无相关报道。此外,如何把控适宜的低氧暴露时间和浓度,尤其是对CFS患者,这可能更是解决相关问题的关键。基于此,本研究在观察CFS小鼠肠道γδT细胞表达量下降的基础上,进一步探讨不同浓度低氧暴露对CFS小鼠肠道上皮内γδT细胞的影响,为进一步研究低氧应用于治疗CFS患者提供一定的实验支撑。
如何选择适宜的低氧暴露时间及低氧刺激强度是本研究的重点。当机体处于海拔5 100 m以上高度时,空气氧浓度约为12%,机体动脉血氧饱和度约为75%左右,而正常动脉血氧饱和度为93%~98%,低于94%可认为机体处于缺氧状态,低于70%可危及生命。对于CFS患者的治疗,低氧浓度可能高于12%更为合适。本研究选择15%和18%氧浓度为干预措施,探讨不同浓度低氧暴露1 h对CFS建模小鼠肠道上皮内γδT细胞的影响。研究发现,15%H组γδT细胞在CD3+iIEL细胞中所占的百分比显著高于CFS组和18%H组,15%H组γδT细胞在CD3+iIEL细胞中所占的百分比和C组无明显差异,18%H组与CFS组γδT细胞在CD3+iIEL细胞中所占的百分比无差异。
该研究结果表明:采用18%低氧干预不能缓减CFS小鼠肠道黏膜免疫细胞的改变,15%低氧干预有利于改善CFS小鼠肠道黏膜γδT细胞的抑制状况。其机制可能是:在适宜的间歇性低氧暴露刺激下,低氧诱导因子-1α(HIF-1α)合成增加,HIF-1α 不仅参与了机体的低氧耐受,而且它是维持细胞氧平衡和低氧反应基因表达的一个中心调节因子。HIF-1α蛋白活性适度地增加,调节许多靶基因及产物的表达以适应低氧,如血管内皮生长因子等表达增加,可能有助于改善肠黏膜微循环,提高肠道免疫功能。HIF-1α蛋白亦可通过多种途径导致机体代谢降低、组织耐低氧能力提高等[35]。这些微环境的改变有利于机体的内源性保护。
4 小结
CFS建模小鼠肠上皮内γδT细胞数量占iIEL的百分比下降可能导致机体对应激事件做出应答的速度有所减弱,机体动员、发挥免疫监视的作用有所下降;而每天1 h 15%低氧干预可有效提高CFS小鼠肠上皮内γδT细胞的表达,有利于改善CFS小鼠肠道黏膜免疫机能。这为今后CFS患者的治疗提供新思路。
[1] 张拥波,胡松,刘占东,等.慢性疲劳综合征的发病机制[J].国际神经病学神经外科学杂志,2010,37(1):84-87
[2] Logan A C,Rao A V,Irani D.Chronic Fatigue Syndrome:Lactic Acid Bacteria May be of Therapeutic Value[J].Medical Hypotheses,2003,60(6):915 -923
[3] Lakhan SE,Kirchgessner A.Gut Inflammation in Chronic Fatigue Syndrome[J].Nutrition and Metabolism,2010,7:79-88
[4] Groh V,Steinle A,Bauer S,et al.Recognition of Stress-Induced MHC Molecules by Intestinal Epithelial Gamma Delta T Cells[J].Science,1998,279(5357):1737 -1740
[5] Vorhees C V,Williams M T.Morris Water Maze:Procedures for Assessing Spatial and Related Forms of Learning and Memory[J].Nat Protoc,2006,1(2):848 -858
[6] Davies M D J,Parrott D M V.Preparation and Purification of Lymphocytes from the Epithelium and Lamina Propria of Murine Small Intestines[J].Gut,1981,22:481 - 488
[7] Pascual D W,Kiyono H,McGhee J R.The Enteric Nervous and Immunity Systems:Interaction for Mucosal Immunity and Inflammation[J].Immnomethods,1994,5:56 -72
[8] VagnerováK,Kverka M,Klusonová P,et al.Intestinal Inflammation Modulates Expression of 11b-Hydroxysteroid Dehydrogenase in Murine Gut[J]. Journal of Endocrinology,2006,191:497 -503
[9] 曲林林,李秋荣,黎介寿.一种小鼠肠上皮内淋巴细胞改良分离技术[J].肠外与肠内营养,2010,17(2):106-108
[10] Binda E,Erhart D,Schenk M,et al.Quantitative Isolation of Mouse and Human Intestinal Intraepithelial Lymphocytes by Elutriation Centrifugation[J].Journal of Immunological Methods,2009,344:26 -34
[11] Maes M,Twisk F N.Chronic Fatigue Syndrome:Harvey and Wessely’s(Bio)Psychosocial Model Versus a Bio(Psychosocial)Model Based on Inflammatory and Oxidative and Nitrosative Stress Pathways[J].BMC Med,2010,15(8):35
[12] Gupta A,Vij G,Chopra K.Possible Role of Oxidative Stress and Immunological Activation in Mouse Model of Chronic Fatigue Syndrome and Its Attenuation by Olive Extract[J].J Neuroimmunol,2010,226(1 -2):3 -7
[13] Sachdeva A K,Kuhad A,Tiwari V,et al.Epigallocatechin Gallate Ameliorates Chronic Fatigue Syndrome in Mice:Behavioral and Biochemical Evidence[J].Behav Brain Res,2009,205(2):414 -20
[14] Vij G,Gupta A,Chopra K.Modulation of Antigen-Induced Chronic Fatigue in Mouse Model of Water Immersion Stress by Naringin,a Polyphenolic Antioxidant[J].Fundam Clin Pharmacol,2009,23(3):331 -337
[15] Sheng R,Xu X,Tang Q,et al.Polysaccharide of Radix Pseudostellariae Improves Chronic Fatigue Syndrome Induced by Poly I:C in Mice[J].Evid Based Complement Alternat Med,2011,2011:840516
[16] Cao Y,Hu Y,Liu P,et al.Effects of a Chinese Traditional Formula Kai Xin San(KXS)on Chronic Fatigue Syndrome Mice Induced by Forced Wheel Running[J].J Ethnopharmacol,2012,139(1):19 - 25
[17] Sachdeva A K,Kuhad A,Tiwari V,et al.Protective Effect of Epigallocatechin Gallate in Murine Water-Immersion Stress Model of Chronic Fatigue Syndrome[J].Basic Clin Pharmacol Toxicol,2010,106(6):490 -496
[18] Sachdeva A K,Kuhad A,Chopra K.Epigallocatechin Gallate Ameliorates Behavioral and Biochemical Deficits in Rat Model of Load-Induced Chronic Fatigue Syndrome[J].Brain Res Bull,2011,86(3 -4):165 -72
[19] Zou J,Yuan J,Lv S,Tu J.Effects of Exercise on Behavior and Peripheral Blood Lymphocyte Apoptosis in a Rat Model of Chronic Fatigue Syndrome[J].J Huazhong Univ Sci Technolog Med Sci,2010,30(2):258 -264
[20] Lyle N,Gomes A,Sur T,et al.The Role of Antioxidant Properties of Nardostachys Jatamansi in Alleviation of the Symptoms of the Chronic Fatigue Syndrome[J].Behav Brain Res,2009,202(2):285 -290
[21] 曲长江,刘白露,解坤,等.多因素诱导建立慢性疲劳综合征动物模型的实验研究[J].中华中医药学刊,2010,28(12):2554-2557
[22] Born W,Yin Z,Hahn Y,et al.Analysis of γδ T Cell Functions in the Mouse[J].J Immunol,2010,184:4055-4061
[23] Toka F,Kenney M,Golde W.Rapid and Transient Activation ofγδ T Cells to IFN-g Production,NK Cell-Like Killing,and Antigen Processingduring Acute Virus Infection[J].The Journal of Immunology,2011,186:4853 -4861
[24] Matsumoto S,Nanno M,Watanabe N,et al.Physiological Roles of Gamma Delta T Cell Receptor Intraepithelial Lymphocytes in Cytoproliferation and Differentiation of Mouse Intestinal Epithelial Cells[J].Immunology,1999,97(1):18-25
[25] Ismail A S,Severson K M,Vaishnava S,et al.Gammadelta Intraepithelial Lymphocytes are Essential Mediators of Host-Microbial Homeostasis at the Intestinal Mucosal Surface[J].PNAS,2011,108(21):8743 -8748
[26] Witherden D,Havran W.Molecular Aspects of Epithelialγδ T Cell Regulation[J].Trends in Immunology,2011,32(6):265-271
[27] Lorusso L,Mikhaylova S V,Capelli E,et al.Immunological Aspects of Chronic Fatigue Syndrome[J].Autoimmun Rev,2009,8(4):287 -291
[28] 梁姗,王涛,胡旭,等.微生物与行为和精神疾病[J].心理科学进展,2012,20(1):75 -97
[29] Gruenwald J,Graubaum H J,Harde A.Effect of a Probiotic Multivitamin Compound on Stress and Exhaustion[J].Adv Ther,2002,19(3):141 -150
[30] Sullivan A,Nord C E,Evengard B.Effect of Supplement with Lactic-Acid Producing Bacteria on Fatigue and Physical Activity in Patients with Chronic Fatigue Syndrome[J].Nutrition Journal,2009,8(1):4
[31] Rao A V,Bested A C,Beaulne T M,et al.A Randomized,Double-Blind,Placebo-Controlled Pilot Study of a Probiotic in Emotional Symptoms of Chronic Fatigue Syndrome[J].Gut Pathogens,2009,1(1):6
[32] 周兆年.低氧与健康研究[J].中国基础科学,2005(5):20-25
[33] 张翼,杨黄恬,周兆年.间歇性低氧适应的心脏保护[J].生理学报,2007,59(5):601 -613
[34] Sica A,Melillo G,Varesio L.Hypoxia:a Couble-Edged Sword of Immunity[J].J Mol Med(Berl),2011,89(7):657-665
[35] Taie S,Ono J,Iwanaga Y,et al.Hypoxia-Inducible Factor-1a has a Key Role in Hypoxic Preconditioning[J].J Clin Neuroscie,2009,16(3):1056 -1060
