塔里木河上游灰胡杨种群生活史特征与空间分布格局
2013-12-09席琳乔王家强王海珍宇振荣
韩 路,席琳乔,王家强,王海珍,宇振荣
(1. 塔里木大学植物科学学院,新疆阿拉尔 843300; 2. 塔里木大学动物科学学院,新疆阿拉尔 843300;3. 中国农业大学资源与环境学院,北京 100193)
塔里木河上游灰胡杨种群生活史特征与空间分布格局
韩 路1,3,*,席琳乔2,王家强1,王海珍1,宇振荣3
(1. 塔里木大学植物科学学院,新疆阿拉尔 843300; 2. 塔里木大学动物科学学院,新疆阿拉尔 843300;3. 中国农业大学资源与环境学院,北京 100193)
灰胡杨是荒漠地区特有的珍稀渐危植物,主要分布在塔里木河流域,是塔里木荒漠生态系统的关键种之一。在塔里木河上游选择具有代表性群落设立5 hm2研究样地,应用相邻格子法进行每木调查,从年龄结构、生命表特征、存活曲线、生存分析以及种群不同发育阶段个体空间分布格局等方面研究了灰胡杨种群生活史动态特征与空间分布规律。结果表明:塔里木河上游灰胡杨种群结构整体上呈钟型,幼树个体较少,成年个体较多,属暂时稳定型种群;不同生境种群结构不同,随河流走向种群结构由稳定型转为衰退型。种群存活曲线趋于DeeveyⅡ,生存率呈单调下降趋势,中期(Ⅵ—Ⅸ)降幅较高;危险率呈上升趋势,于Ⅸ龄级出现危险率与死亡率、消失率高峰,生命期望单调下降,反映种群生存力下降的趋势。灰胡杨种群空间分布格局总体上为聚集分布,因生境不同空间格局发生变化,这是种群适应环境压力及与环境协同进化的结果;种群空间格局随发育进程而变化,从幼龄到中、大龄,种群分布格局的聚集强度减弱并逐渐转变为随机分布,这是种内竞争强度变化的结果。环境因子与种群分布多度的相关与逐步回归分析表明地下水位是影响种群分布的主要因素。可见,塔里木河上游灰胡杨种群结构与空间分布格局随生境和时间发生变化,环境因素和生物因素是影响灰胡杨种群生态特征的两个主要原因。
塔里木河上游;灰胡杨;种群结构;生活史;空间分布格局
种群结构是植物种群的重要属性,它能反映种群空间上的变动规律,并能客观体现种群动态及其群落的发展、演变趋势[1]。种群分布格局是种群研究的重要内容,是种群的重要结构特征之一。研究种群分布格局的目的不仅是对种群的水平结构进行定量描述,更重要的是用以揭示格局的成因,阐述种群及群落的动态变化[2]。在某种意义上来说种群结构与动态是对环境适应与选择的结果[3]。因此,研究荒漠河岸林优势种群结构与空间格局,分析种群种内和种间竞争是揭示种群生活史对策和动态机制的重要手段[4]。
灰胡杨(PopuluspruinosaSchrenk)属杨柳科杨属中最古老、最原始的多年生落叶阔叶乔木,是古地中海植物区系的孑遗种。灰胡杨于1987年被列入《中国珍稀濒危保护植物名录》中,为渐危、三级保护植物和珍贵的抗逆种质资源。近年来,随着全球气候变暖和区域水土资源的过度开发利用,天然灰胡杨林面积锐减、植被退化、优势种生长衰败[5]。由于灰胡杨独特的生理生化和生态学特性及在生态环境保护中的作用,越来越受到人们的关注。学者曾对塔里木荒漠灰胡杨的分布、群落特性与繁殖特性、光合水分生理、抗逆性与遗传差异等方面进行了研究[6- 8]。但关于塔里木河上游大面积自然分布的灰胡杨种群结构与空间分布格局及其动态方面未见系统的研究报道。灰胡杨种群在塔里木河上游的生长状况和种群动态如何?生活史特征是什么?生物因素和环境因素如何影响灰胡杨种群的空间分布? 本研究通过对塔里木河上游灰胡杨种群生活史特征、年龄结构、数量动态与空间分布格局等方面研究,掌握灰胡杨种群的生存现状,分析过去种群结构与受干扰状态,揭示灰胡杨种群的整体活力,发展特征,动态规律及其影响机制,这对种群濒危机制的探索、种群的合理保护和增殖具有重要的理论和现实意义,同时也为荒漠河岸林生态系统的恢复与重建提供理论依据。
1 研究区与研究方法
1.1 研究区概况
塔里木河上游系指从阿克苏河、叶尔羌河、和田河三河交汇的肖夹克至轮台县的英巴扎,总长495 km(图1)。该区经纬度40°25′—41°10′N,80°10′—84°36′E;平均日照时数2729.0 h,太阳总辐射能5796 MJ·m-2·a-1,年平均气温10.4 ℃,≥10℃年积温4340 ℃,平均气温≥10 ℃的持续日数为201 d,极端最高温度39.4 ℃,极端最低温度-25.0 ℃。年平均降水量50.4 mm,年平均蒸发量1880.0 mm,干燥度12—19。风沙灾害频繁,春、夏季多大风天气,是该地区风沙危害的主要季节。该区植被组成简单、稀疏,乔灌草三层结构明显。乔木主要有胡杨(PopuluseuphraticaOliv.)、灰胡杨;林下植物主要有多枝柽柳(TamarixramosissimaLedeb.)、黑果枸杞(LyciumruthenicumMurr.)、铃铛刺(Halimodendronhalodendron(Pall.)Voss)、芦苇(Phragmitesaustralis(Cav.)Trin. ex Steud.)、罗布麻(ApocynumvenetumLinn.)、胀果甘草(GlycyrrhizainflataBatal.)、骆驼刺(AlhagisparsifoliaShap.)、西北天门冬(AsparaguspersicusBaker)、小花棘豆(Oxytropisglabra(Lam.) DC.)等植物。
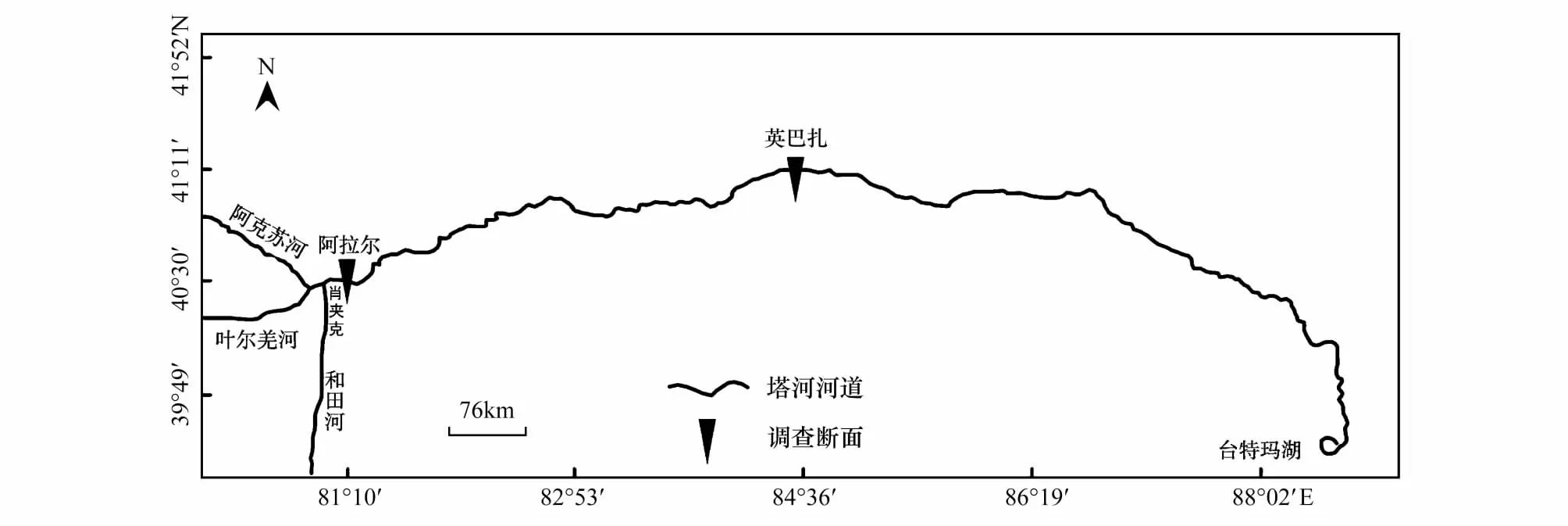
图1 塔里木河上游调查断面示意图Fig.1 Investigation sections at the upper reaches of the Tarim River
1.2 研究方法
1.2.1 样地设置与外业调查方法
野外充分踏查的基础上在塔里木河上游(UR)—上段(A)阿拉尔、下段(C)英巴扎断面选择面积较大、人为干扰较小、林分具有代表性的天然灰胡杨林,在林地内选取4个调查地点(A1丰收三场、A2托海乡、A3水工三连、C轮南镇—塔河以北),共5块100 m×100 m的样地,面积5.0 hm2,样地环境特征见表1。在每块样地内采用相邻格子法进行每木调查,以5 m×5 m为基本单元,记录胸径(DBH)≥2.5 cm的全部乔木树种的种名、胸径、树高、冠幅等指标。灌木层(4 m×4 m)、草本层(1 m×1 m)采用对角线法进行植物种类、高度、盖度、多度等详细调查,对乔木植物的幼苗、幼树逐一记录其高度、地径。统计时以灰胡杨基株为单位进行统计,若一个树桩上有多个无性系分株,则仅对其中径级最大的一株进行记录。同时,各样方用全球定位系统(GPS)定位,记录其经度、纬度和海拔高度、郁闭度等生态因子。地下水位采用土钻法结合人工打井确定,土壤含水量采用烘干法测定。

表1 塔里木河上游调查样地的环境特征
1.2.2 种群年龄结构的建立
灰胡杨生长周期长,不可能追踪所有个体的生长周期,而利用树木年轮精确测定灰胡杨个体的年龄较为困难,也缺乏其它可靠的外部特征及解析资料可以确定其树龄。因此,采用空间推时间的方法,应用生态学中大小结构分析法来研究种群年龄结构特征。虽然种群龄级和径级有所不同,但在同一环境下,同一树种的龄级和径级对环境的反应规律具有一致性[9]。按照2003年森林资源规划设计调查主要技术规定并结合灰胡杨生活史特点,级距设为4 cm,将种群划分为12个径级,第1径级胸径为0—4 cm,之后以4 cm为步长增加一级,即4.0 cm≤DBHlt;8.0 cm,作为Ⅱ级,把直径大于44 cm都归为第12级。第1径级对应Ⅰ龄级,第2径级对应第Ⅱ龄级,依此类推。按以上标准分别统计各龄级株数,以龄级为纵轴,株数/hm2为横轴,绘制灰胡杨种群年龄结构图。
1.2.3 种群生命表、存活曲线的编绘与生存分析
根据灰胡杨各龄级的统计株数,按照特定时间生命表的编制方法[10],计算生命表中各参数,完成灰胡杨种群特定时间生命表的编绘。存活曲线是借助存活个体数量来描述特定年龄死亡率,它是通过把特定年龄组的相对个体数量作图而得到。本文以生命表中的龄级为横坐标,以lnlx为纵坐标绘制灰胡杨种群的存活曲线,以死亡率,消失率为纵坐标,以龄级为横坐标绘制死亡率曲线和消失率曲线[10],分析种群动态变化。
为了更好地分析灰胡杨种群动态,阐明其生存规律,引入生存分析中的4个函数,即种群生存率函数S(t)、累积死亡率函数F(t)、死亡密度函数f(t)、危险率函数λ(t)[11- 12]。根据上述4个生存函数的估算值,绘制生存率曲线、累积死亡率曲线、死亡密度曲线和危险率曲线。
1.2.4 种群空间分布格局与动态分析
根据各样地5 m×5 m的小样方调查的个体数资料,采用方差/均值比的t检验方法;聚集强度指标采用负二项指数、Lloyd平均拥挤度和聚块性指数、Morisita指数进行种群空间格局分析[3,13]。同时,本文借用在研究种群动态时所用的以空间差异代替时间变化的理论[13],用不同龄级种群的分布格局变化来揭示灰胡杨种群发育过程中分布格局的动态变化。参照国内惯用的分级标准,按其生活史周期分为4个阶段:幼树(DBHlt;2.5 cm)、小树(2.5 cm≤DBHlt;7.5 cm)、中树(7.5 cm≤DBHlt;22.5 cm)、大树(DBH≥22.5 cm)。在5块样地内统计每个样方中各龄级灰胡杨株数,按照上述方法进行不同发育阶段种群分布格局分析。
1.2.5 种群分布与环境的相关分析
为分析灰胡杨种群分布与环境因子之间的关系,将地下水位、土壤总盐、有机质、氮、磷、钾等因子作为因变量,分别与每个样方内的灰胡杨个体数量进行相关分析[3],并对相关系数r的可信度进行t检验[14]。采用逐步回归分析得出最优回归方程,确定显著影响因素。
2 结果与分析
2.1 塔里木河上游灰胡杨种群年龄结构特征
塔里木河上游不同生境灰胡杨种群年龄结构差异明显,反映了不同生境对灰胡杨种群年龄结构的影响不同(图2)。上段(A)丰收三场(A11)生境灰胡杨种群结构呈基部宽顶部窄的金字塔型,但种群结构存在明显的凹陷。根据调查数据,幼苗(Ⅰ)较多,平均256株/hm2,占总数33.96%;幼树(Ⅱ)数量急聚减少,仅6株/hm2;中树(Ⅲ—Ⅵ)最多,平均407株/hm2,占总数53.91%;大树(Ⅶ—Ⅹ)较少,平均85株/hm2,占总数10.86%;老树(Ⅺ—Ⅻ)最少, 平均4株/hm2,占总数0.53%。丰收三场(A12)生境灰胡杨种群结构完整,幼苗、幼树、中树、大树、老树数量分别占总数15.88%、5.19%、62.56%、15.56%、0.81%,表现为中间大两头小(图2)。由于2种生境下灰胡杨种群Ⅱ龄级数量急聚下降,分别较Ⅰ龄级数量减少了97.66%、67.35%,表明严酷的环境筛导致Ⅰ向Ⅱ龄级发育中死亡率较高,导致幼树个体不足将难以补充、维持种群增长,这将直接影响种群的未来发展。

图2 塔里木河上游不同生境灰胡杨种群结构(A11—UR:样地编号)Fig.2 Population structures of Populus pruinosa under different habitats at the upper reaches of Tarim River
上段托海乡(A2)天然林灰胡杨种群结构不完整,幼苗缺失,幼树极少,仅为1 株/hm2,中树与大树占95.26%,老树仅占4.35%,年龄结构呈偏正态分布(图2),为衰退种群。灰胡杨种群因幼苗、幼树缺失且龄级集中在Ⅳ—Ⅷ级,林分中龄偏大,未来种群衰退演替速度较快。
上段水工三连(A3)天然林灰胡杨种群结构特征是幼苗少占1.02%,幼树、中树、大树与老树分别占总数15.91%、70.05%、12.86%、0.17%,年龄结构呈正态分布,龄级集中在Ⅱ—Ⅴ级(图2),林龄偏小,属衰退种群。
下段(C)轮南镇天然林灰胡杨种群幼苗、幼树、中树、大树、老树分别占总数4.67%、0.39%、3.06%、87.53%和4.38%,种群结构呈基窄顶宽的倒金字塔型(图2),属衰退型种群。由于种群龄级集中在大老龄级(Ⅵ—Ⅸ)、林分偏老,且幼苗、幼树与中树数量偏少,未来种群衰退速率最快。
综上所述,塔里木河上游(UR)灰胡杨种群年龄结构呈钟型(图2 ),属暂时稳定型种群。但Ⅰ级向Ⅱ龄级发育过程中死亡率较高(64.65%),致使种群结构出现明显凹陷。表明天然灰胡杨林立地条件较差,种群更新能力与幼树成长能力明显受抑制,未来种群增长潜力不足。分析原因与塔里木河上游近20a大面积垦荒,耕地面积增长较快,地表水与地下水过量使用而导致的地下水位迅速下降及土壤次生盐渍化有关(表1)。
2.2 塔里木河上游灰胡杨种群生命表特征分析
特定时间生命表是反映种群多个世代重叠的年龄动态历程中的一个特定时间。由于采用以空间推时间、横向导纵向法,故生命表中会出现死亡率为负的现象,这虽与生命表的数学假设相违背,但仍能作为重要的生态学依据反应种群的发展和衰落过程[12]。据此,采用匀滑技术对数据进行处理,经匀滑修正得ax,再据此编制出灰胡杨的特定时间生命表[3,12](表2)。
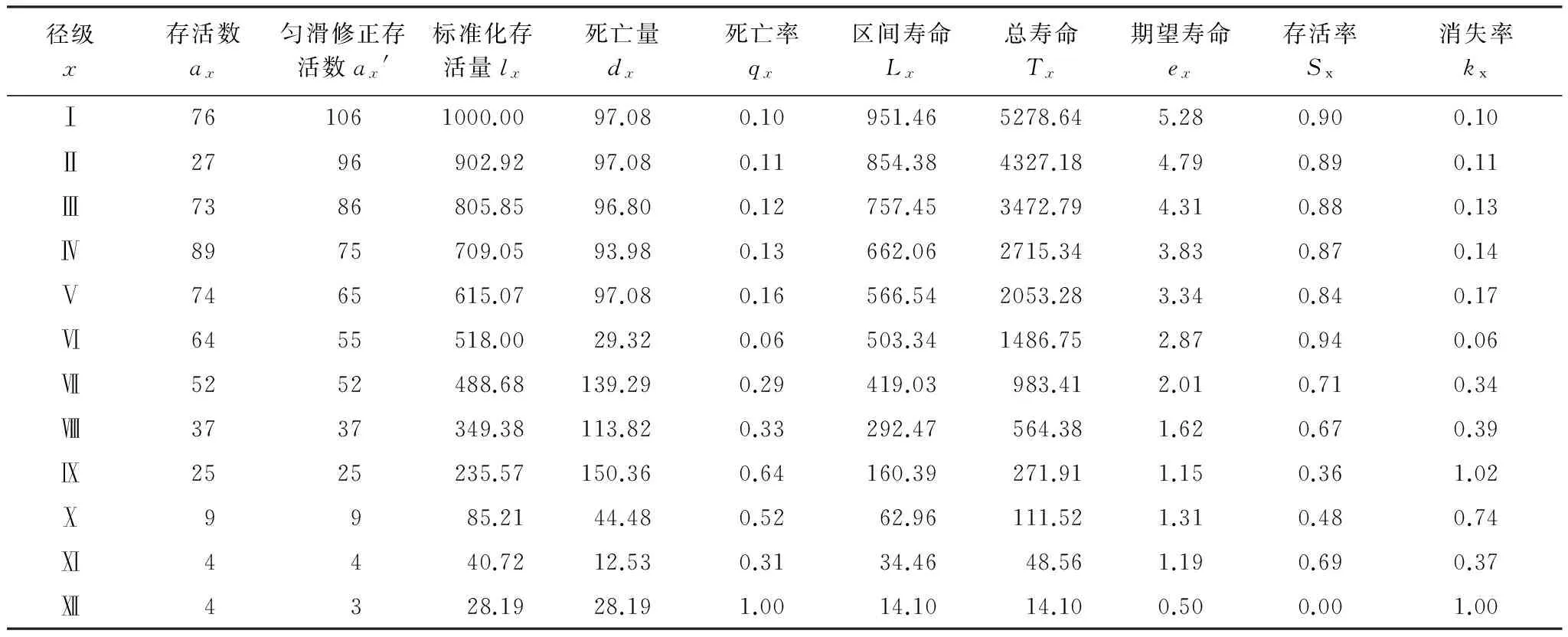
表2 塔里木河上游灰胡杨种群特定时间生命表(1 hm2)
x:Size class;ax:Survival numhers;ax′: survival numbers after smoothed;lx:Standard survival numbers;dx:Number of dying during interval;qx:Average mortality rate per age stage;Lx:Life between the interval;Tx:Total life;ex:Mean expectative life;Kx:Age-specific mortality;Sx:Age-specific survival
塔里木河上游灰胡杨种群存活数随着龄级增加而降低(表2),死亡率(qx)与消失率(kx)随龄级增加大致呈上升趋势,尤其Ⅵ龄级后上升较快,于Ⅸ龄级出现高峰期(表2,图3)。原因是随着群落演替的进行,个体逐渐长大,对空间资源需求不断增加与生态位发生重叠,林内光照、水分、养分和空间等因子不能满足其要求,造成种群内个体间的竞争加大,自疏和它疏作用加强,个体间分化严重,导致qx、kx不断上升。随龄级增长与树冠扩大,相继进入主林层,种内对生存资源竞争更加激烈,加上生长后期环境日益恶化导致其死亡量与qx、kx出现峰值;其后个体数量减少、竞争减弱,qx与kx下降。这表明灰胡杨种群年轻阶段,个体小,生长力旺盛,能有效地利用群落内的空间和土壤条件,qx与kx较低;相继进入主林层后,种内竞争激增,qx与kx较高。
灰胡杨种群平均期望寿命(ex)随龄级增加而逐渐下降(表2),是由于龄级越低个体间竞争较弱,能有效地利用群落资源,从而种群进入生长旺盛期,ex较大,即年轻个体生命力与平均生存能力强。随后ex在Ⅹ龄级略有回升,然后又下降(表2),主要是灰胡杨种群达到一定年龄后生理机能开始退化,这种趋势符合种群的生物学特征,反映了灰胡杨种群整个生命过程中个体生命力与平均生存能力的衰退。此外,灰胡杨种群死亡量、死亡率与ex变化基本保持一致(表2),这充分反映了灰胡杨生命期望值的变化规律与其死亡率之间的变化规律是有着密切地相互关系,并且客观存在。
2.3 塔里木河上游灰胡杨种群存活曲线特征分析
存活曲线是对生命表的重要反映,其能反映种群存活率或死亡率随年龄的变化情况,从而能作为种群动态的重要特征之一,这是物种经长期自然选择形成的[3,15]。灰胡杨种群的存活曲线表现为幼、中龄个体存活率较高,大龄期(Ⅷ—Ⅹ)存活率降低而死亡率显著升高(图3)。根据Hett和loucks检验估算存活状况是符合DeeveyⅡ型还是符合DeeveyⅢ曲线时,采用两种数学模型进行检验,即指数方程式Nx=N0e-bx用以描述DeeveyⅡ型存活曲线;幂函数式Nx=N0x-b描述DeeveyⅢ型存活曲线[12]。采用上述两种模型对灰胡杨种群存活曲线类型的检验,经拟合建立其相应模型如下:Nx=154.62e-0.255x(F=18.93**;r=0.8087**);Nx=143.18x-0.948(F=6.62*;r=0.6309*)。由于指数模型的F检验值及相关指数r值均大于幂函数模型的F值和r值,因此,判定塔里木河上游灰胡杨种群存活曲线更趋于DeeveyⅡ型。
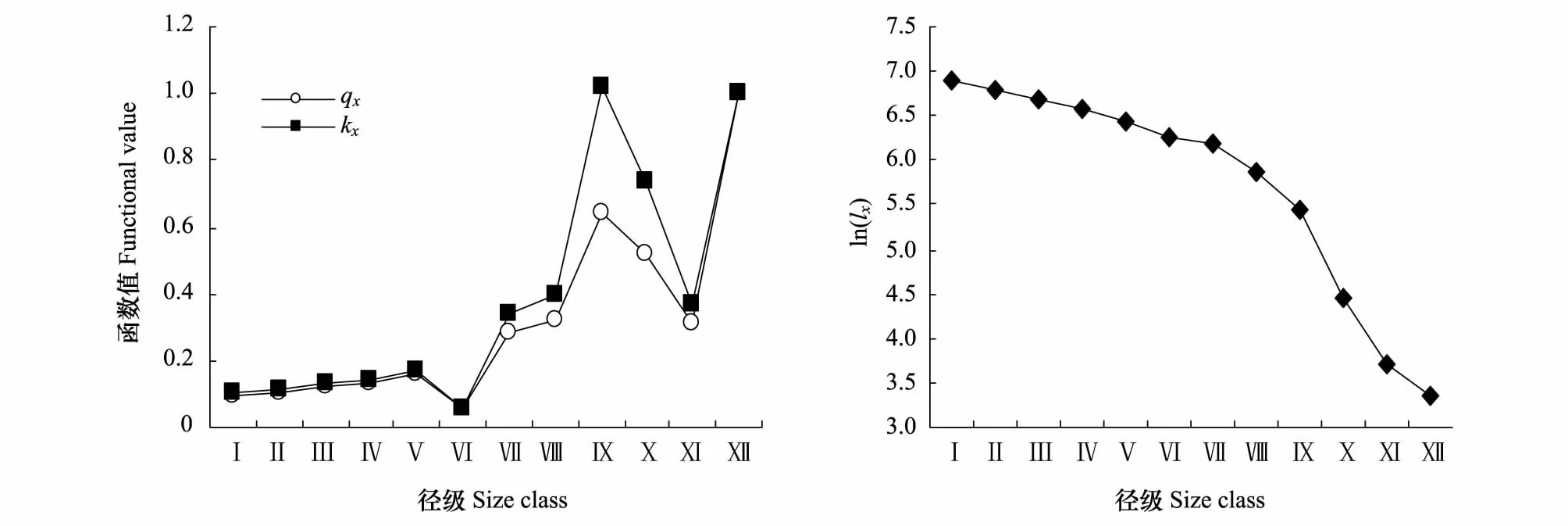
图3 灰胡杨种群存活曲线、死亡率与消失率曲线Fig.3 Survival curve, mortality rate(qx) and Age-specific mortality (kx)of P.pruinosa population qx: Average mortality rate per age stage; kx: Age-specific mortality
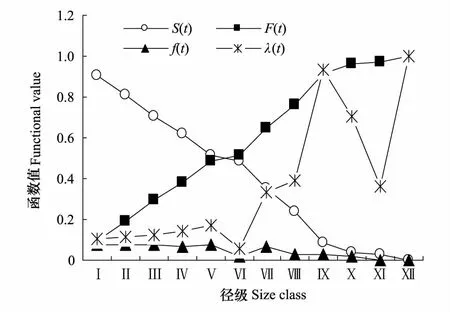
图4 灰胡杨种群4个生存函数估算值 Fig.4 Estimated value of four functions of P.pruinosa population S(t):种群生存率函数Survival rate function; F(t):累积死亡率函数Accumulative mortality rate function; f(t): 死亡密度函数Mortality density function; λ(t):危险率函数Hazard rate function
2.4 塔里木河上游灰胡杨种群生存分析
从图4可见,累积死亡率随龄级增长而呈单调上升,中期上升较快,至Ⅸ龄级已达91.48%,Ⅸ龄级后累积死亡率不足10%,表明大量个体死亡主要发生在中期(Ⅵ—Ⅸ)。死亡密度函数随龄级增长而呈单调下降,前期下降较慢,后期下降较快,这与生存率曲线变化趋势基本一致。危险率曲线总体随龄级增长而呈上升趋势。危险率在Ⅰ—Ⅴ龄级上升较慢,为17.14%,但其后突然下降至Ⅵ时仅为5.82%,表明这一阶段个体生长健壮,存活率较高;之后危险率则快速上升,至Ⅸ龄级达最高,为93.75%,表明这一阶段个体生存危险率最高,即产生高的死亡率,这与生命表分析结果一致。高危险率产生的原因可能是随个体长大,相继进入主林层,种内竞争加剧,加上生境逐年恶化,致使危险率与累积死亡率较高。
灰胡杨种群生存率随龄级增长而呈单调下降,Ⅷ龄级以前下降较慢,其中Ⅴ—Ⅵ龄级较稳定,Ⅷ—Ⅸ龄级下降最快(63.83%),其后下降速率减慢(图4)。生存率函数也表明灰胡杨个体能够存活到Ⅵ龄级的概率为0.489,而能存活到Ⅸ龄级的概率为0.085,说明这一阶段个体间竞争激烈、生存机会大幅降低。因此,这一期间对灰胡杨林进行抚育管理有其合理性,不仅具有一定的经济效益,也能减少竞争,为林木更新与生长创造更为良好的环境。
2.5 塔里木河上游灰胡杨种群空间分布格局分析
2.5.1 空间分布格局及动态分析
从表3可见,塔里木河上游不同生境下灰胡杨种群空间分布格局不同。灰胡杨种群成年树(DBHgt;2.5cm)在A11、A3、C生境呈集群分布,而在A12、A2生境呈随机分布。表明A11、A3、C 3个生境的灰胡杨种群聚集程度比A12、A2生境的种群大,因为A11、A3生境地下水位较浅,几乎为灰胡杨纯林,合适的生境下聚集程度较高,C生境林下土壤明显沙化,个体为生存而共同抵御逐渐恶化的环境呈集群分布;而A12生境地下水位较深,土壤水分匮乏;A2生境尽管地下水位较浅,但其土壤盐分含量高,这种低水或高盐的生境限制灰胡杨个体的生长与分布,导致灰胡杨种群聚集程度不高,呈随机分布(表3,表1)。
塔里木河上游5个不同生境灰胡杨种群不同发育阶段的个体群呈集群分布或随机分布。灰胡杨幼树、小树、中树在A11、A12、A33个生境中表现为集群分布,而由于灰胡杨在A2、C生境缺乏幼树与小树个体,中树则均呈随机分布。灰胡杨大树除在C生境为集群分布外,其它4个生境均为随机分布(表3)。从发育阶段的时间序列上看,灰胡杨种群空间分布格局随发育进程其聚集强度逐渐降低,至大树阶段空间格局转变为随机分布,显示出扩散的趋势。

表3 塔里木河上游灰胡杨种群空间分布格局及其动态
*Plt;0.05; C: 集群分布 Clumped pattern; R: 随机分布 Random pattern; 幼树: Sapling; 小树;Small trees; 中树: Medium trees; 大树: Large trees; 成年树: Adult trees(DBHgt;2.5cm)
塔里木河上游A11、A12、A33个生境灰胡杨幼树、小树、中树个体群都属于集群分布,而大树个体群呈现随机分布(表3)。其原因在于:3个生境灰胡杨群落林下少灌木,种间竞争较弱,幼树、小树个体群在林窗中占据各自的生存空间,故呈集群分布;随龄级增长,中树阶段个体对空间资源需求增长使种内竞争开始加强,聚集强度减弱;至大树阶段种内竞争激烈,自疏现象使得生长较弱的个体死亡,从而使得大树个体群呈现出随机分布。这充分说明在种内、种间竞争较小时,灰胡杨种群的空间格局随龄级的变化,受其生物学因素的影响,龄级越大,呈现集群分布向随机分布的过渡。灰胡杨种群在A2、C生境缺乏幼树与小树,中树均呈随机分布,而随龄级增长,A2生境大树仍呈随机分布,但C生境大树转变为聚集分布。这与A2立地条件有关,A2生境周围农田排水洗盐的废水进入灰胡杨林内,造成土壤盐分表聚,致使大量种子难以萌发与小树生长困难、死亡;通过严酷环境筛与生存斗争而存活下来的个体发育成中树而呈随机分布。随个体不断长大、生存竞争能力增强,大树仍表现为随机分布。C生境位于塔里木河上游的末端,林下土壤沙化明显,加上经常大风干扰使土壤蒸发加快,稀林区个体死亡,形成大面积裸地与间距较大的林斑[16]。由此,林斑内个体为共同抵御逐渐恶化的环境而呈集群分布,这种斑块聚集有利于个体生存,发挥群体效应来维持种群的稳定和续存,这是种群抵抗不良环境的生态适应对策。以上可知,处于不同发育阶段的灰胡杨个体群,其空间分布格局是随时间变化的,呈现出集群分布或随机分布。这说明在不同生境下,环境条件直接影响灰胡杨种群及各发育阶段的分布格局。
2.5.2 环境与种群分布的相关分析
灰胡杨种群的分布多度与地下水埋深成显著负相关,与土壤有机质成显著正相关(Plt;0.05)(表4),这说明灰胡杨适宜生长于一定地下水埋深、有机质丰富的的生境。在塔里木河流域灰胡杨主要分布在塔里木河上游区域,上游末端英巴扎(轮台)以下失去其踪影,灰胡杨对生境的选择说明其具有喜湿的生活特性,对水分条件有较强的选择性,进一步证实灰胡杨属潜水中生性树种[6],对水分需求较高。土壤有机质是表征土壤质量的重要因子,亦是土壤肥力的重要指标,其影响土壤水盐运动状况和肥力特性[17]。有机质与地下水位呈显著负相关(r=-0.879*,Plt;0.05),表明地下水位直接影响土壤有机质含量。即地下水位越深,土壤有机质越低,灰胡杨种群密度越低、长势差。因此,灰胡杨种群分布格局主要受地下水位和土壤有机质及其它化学性质的综合影响,地下水位浅且有机质丰富区域是灰胡杨种群生存的适宜环境。
利用逐步回归分析环境因子与灰胡杨种群分布多度的关系,得最优回归方程:y=0.068-0.007x(x为地下水位)。F检验表明,此回归模型可信度达到94.7%(R2=0.896),说明灰胡杨种群密度变异平方和有94.7% 是由地下水位变化造成的。变量与自变量的相关性达到显著水平,说明其与种群密度的回归关系真实可靠, 是影响塔里木灰胡杨种群分布格局的主要因子。综上所述,塔里木河上游灰胡杨种群结构与空间分布格局随生境和时间发生变化,环境因素与生物因素的综合作用导致灰胡杨种群表现出的分布特征。

表4 塔里木河上游灰胡杨个体数量与环境因子之间的相关性
*Plt;0.05
3 结论与讨论
灰胡杨主要分布在塔里木河上游,其沿河两岸呈阶梯式分布,是新疆南部荒漠河岸林的主要优势树种之一。但由于塔里木河上游于20世纪60年代开始大规模水土资源开发,致使河流断流、地下水位逐年下降,灰胡杨种群结构失调、更新困难、面积锐减,制约着荒漠河岸林的持续发展与稳定。本文从生命表特征、年龄结构、生存分析以及不同龄级个体群空间分布格局4个方面,对塔里木河上游灰胡杨种群的生活史动态特征与空间分布格局进行研究,得出以下结论:
(1)塔里木河上游不同生境的灰胡杨种群年龄结构明显不同,有金字塔型和壶型,但金字塔型种群在幼龄发育过程中死亡率较高,年龄结构中呈现明显凹陷,如果没有幼龄个体对中龄株数的补充,灰胡杨种群整体长期稳定性将难于维持。随河流走向,灰胡杨种群结构由暂时稳定型过渡到衰退型,在群落演替过程中,随着时间的推移,将会被其它更新能力、抗逆能力较强的物种所取代。这一结果与野外实际调查结果相一致,灰胡杨在塔里木河上游末端(英巴扎)以下失去了踪影,取而代之的是以胡杨—柽柳或柽柳为优势种的荒漠群落。灰胡杨自身的生物学特性及环境因素变化是形成这种现象的主要原因。在塔里木河流域,灰胡杨主要分布在上游区域,随径流量与地下水位逐年下降,其分布区域缩小,种子生产与更新困难;繁殖方式转为无性繁殖为主而聚集在母树周围,受光照等环境因子以及生境恶化的影响,根蘖苗长势差,生存能力低,使种群趋向老龄化。灰胡杨种子体积较小,所含营养物质少,种子寿命短。当种子成熟自然落下与洪水时间不一致或无法飘落于洪水漫溢的湿润土壤上时无法吸水萌发,造成灰胡杨种子发芽困难,种子成苗率低。林间开荒与农田压碱洗盐退水的排放,使林间地表盐分表聚,抑制种子萌发与幼苗生长。因此,灰胡杨种群的衰退与其自身适应能力差及人为干扰、生境恶化有关。
(2)塔里木河上游灰胡杨种群存活数随龄级增加而降低,存活曲线接近于DeeveyⅡ型,死亡率与消失率均呈现一种增长趋势,于Ⅴ龄级出现1个小高峰,随后死亡率又下降,种群进入一个平稳发展期。Ⅵ龄级后死亡率又逐渐增加,至Ⅸ出现最高峰。生存危险率与累积死亡率高峰主要发生在中后期(Ⅵ—Ⅸ),且生命期望单调下降,至Ⅸ龄级最小。可见,灰胡杨个体为争夺空间资源而导致激烈的种内竞争产生自疏作用,是导致中后期个体数量减少的原因之一。总之,灰胡杨种群生存动态与其种内对空间资源的激烈竞争及生理功能下降有关。这是前期薄弱,后期衰退的濒危植物种群的一种现象[3]。因此,改善生存环境、提高种子向幼苗的转化率与成活率是灰胡杨种群恢复的关键。
(3)种群空间分布是指组成种群的个体在其生活空间中的位置状态或布局。不同生境灰胡杨种群空间格局不同,这是立地条件差异对其的影响,也是其为生存而采取的不同适应对策。灰胡杨种群分布格局总体为聚集分布,由于种子成熟受重力影响掉落及根蘖繁殖在母树周围,幼龄期表现为聚集分布;幼龄期个体向中龄期个体的发展过程中,由于空间、营养竞争出现自疏作用,导致种群聚集程度下降;大龄期个体由于所需空间资源增多,竞争更加激烈,再加上生境逐年恶化与生理功能下降,个体较少,呈随机分布。种群在幼年阶段聚集强度高有利于高效利用群落内的空间资源而存活;种群趋于随机分布,则主要是种内竞争与生境恶化引起密度下降的结果。因此,塔里木河上游灰胡杨种群的空间分布格局是因生境的不同和发育阶段的不同变化的,环境因素和生物因素是影响其空间分布格局的两个主要原因。
(4)植被与其生存环境之间是一种相互依赖和制约的关系。土壤水分决定植物地上部生长,而地上部植物的影响一直被认为是决定有机质和可利用养分的最重要因子[18]。植物个体在适应和生存竞争过程中不得不对由非生物和生物资源所导致的异质性作出响应,因而土壤异质性是影响植物群落稳定与种群发展的重要因素[19]。相关与逐步回归分析表明,地下水位直接调整塔里木河上游灰胡杨种群的分布格局,是影响灰胡杨种群分布格局的主要因子。此外,灰胡杨对不同生境空间异质性的响应反映出其具有喜湿特性,生存对水分需求较高,表明其属于典型的潜水中生性树种,而不是旱生植物。地下水位浅与有机质丰富的区域是灰胡杨种群生存的适宜生境。
[1] Wu X P, Zheng Y, Ma K P. Population distribution and dynamics ofQuercusliaotungensis,FraxinusrhynchophyllaandAcermonoinDongling Mountain, Beijing. Acta Botanica Sinica, 2002, 44(2): 212- 223.
[2] Greig-Smith P. The use of random and contiguous quadrats in the study of the structure of plant communities. Annals of Botany, 1952, 16(2): 293- 316.
[3] Chen Z Y, Yang N, Yao X M, Tian X M, Yang M Y. Life history and spatial distribution of aTaiwaniaflousianapopulation in Leigong Mountain, Guizhou Province, China. Acta Ecologica Sinica, 2012, 32(7): 2158- 2165.
[4] Borchsenius F, Nielsen P K, Lawesson J E. Vegetation structure and diversity of an ancient temperate deciduous forest in SW Denmark. Plant Ecology, 2004, 175(1): 121- 135.
[5] Wang S J. The status, conservation and recovery of global resources ofPopuluseuphratica. World Forestry Research, 1996, (6): 37- 44.
[6] Thevs N, Zerbe S, Schnittle M, Abdusalih N, Succow M. Structure, reproduction and flood-induced dynamics of riparian Tugai forests at the Tarim River in Xinjiang, NW China. Forestry, 2008, 81(1): 45- 57.
[7] Zhang Z G, Li H, Walteher D, Yang C C, Guo G H. Comparative study on gas exchange characteristics ofPopuluseuphraticaandP.pruinosain the middle reaches of Tarim River. Acta Botanica Boreali-Occidentalia Sinica, 2012, 32(12): 2506- 2511.
[8] Wang J, Wu Y X, Ren G P, Guo Q H, Liu J Q, Lascoux M. Genetic differentiation and delimitation between ecologically divergedPopuluseuphraticaandP.pruinosa. PLoS One, 2011, 6(10): 2011, 6(10):1- 10.
[9] Frost I, Rydin H. Spatial pattern and size distribution of the animal-dispersed treeQuercusroburin two spruce-dominated forests. Écoscience, 2000, 7(1): 38- 44.
[10] Cheng W, Wu N, Luo P. Survival analysis ofAbiesFaxonianapopulations near Timberline on the upper Minjiang river. Acta Phytoecologica Sinica, 2005, 29(3): 349- 353.
[11] Yang F X, Wang S Q, Xu H G, Li B Q. The theory of survival analysis and its application to life table. Acta Ecologica Sinica, 1991, 11(2): 153- 158.
[12] Wu C Z, Hong W, Xie J S, Wu J L. Life table analysis ofTsugalongibracteatapopulation. Chinese Journal of Applied Ecology, 2000, 11(3): 333- 336.
[13] Lai J S, Zhang M, Xie Z Q. Structure and distribution pattern of dominant populations in the evergreen broad-leaved forest in Three Gorges Reservoir Area. Acta Ecologica Sinica, 2006, 26(4): 1073- 1079.
[14] Rosner B. Fundamentals of Biostatistics. 5th ed. Sun S G, Translated. Beijing: Science Press, 2004: 412- 437.
[15] Yu D P, Zhou L, Dong B L, Dai L M, Wang Q L. Structure and dynamics ofBetulaermaniipopulation on the northern slope of Changbai Mountain. Chinese Journal of Ecology, 2004, 23(5): 30- 34.
[16] Han L, Wang H Z, Chen J L, Yu J. Disturbance regimes and gaps characteristics of the desert riparian forest at the middle reaches of Tarim River. Acta Ecologica Sinica, 2011, 31(16): 4699- 4708.
[17] Shan X Z, Wei Y Q, Yan H J, Liu J F, Zhang R. Influence of organic matter content on soil hydrodynamic parameters. Acta Pedologica Sinica, 1998, 35(1): 1- 9.
[18] Vinton M A, Burke I C. Interactions between individual plant species and soil nutrient status in shortgrass steppe. Ecology, 1995, 76(4): 1116- 1133.
[19] Jackson R B, Caldwell M M. The scale of nutrient heterogeneity around individual plants and its quantification with geostatistics. Ecology, 1993, 74(2): 612- 614.
参考文献:
[3] 陈志阳, 杨宁, 姚先铭, 田小梅, 杨满元. 贵州雷公山秃杉种群生活史特征与空间分布格局. 生态学报, 2012, 32(7): 2158- 2165.
[5] 王世绩. 全球胡杨林的现状及保护和恢复对策. 世界林业研究, 1996, (6): 37- 44.
[7] 张志刚, 李宏, Walteher D, 杨婵婵, 郭光华. 塔里木河中游胡杨与灰叶胡杨气体交换特性对比研究. 西北植物学报, 2012, 32(12): 2506- 2511.
[10] 程伟, 吴宁, 罗鹏. 岷江上游林线附近岷江冷杉种群的生存分析. 植物生态学报, 2005, 29(3): 349- 353.
[11] 杨凤翔, 王顺庆, 徐海根, 李邦庆. 生存分析理论及其在研究生命表中的应用. 生态学报, 1991, 11(2): 153- 158.
[12] 吴承祯, 洪伟, 谢金寿, 吴继林. 珍稀濒危植物长苞铁杉种群生命表分析. 应用生态学报, 2000, 11(3): 333- 336.
[13] 赖江山, 张谧, 谢宗强. 三峡库区常绿阔叶林优势种群的结构和格局动态. 生态学报, 2006, 26(4): 1073- 1079.
[15] 于大炮, 周莉, 董百丽, 代力民, 王庆礼. 长白山北坡岳桦种群结构及动态分析. 生态学杂志, 2004, 23(5): 30- 34.
[16] 韩路, 王海珍, 陈加利, 于军. 塔里木荒漠河岸林干扰状况与林隙特征. 生态学报, 2011, 31(16): 4699- 4708.
[17] 单秀枝, 魏由庆, 严慧峻, 刘继芳, 张锐. 土壤有机质含量对土壤水动力学参数的影响. 土壤学报, 1998, 35(1): 1- 9.
LifehistorycharacteristicsandspatialdistributionofPopuluspruinosapopulationattheupperreachesofTarimRiver
HAN Lu1,3,*, XI Linqiao2, WANG Jiaqiang1, WANG Haizhen1, YU Zhenrong3
1CollegeofPlantScience,TarimUniversity,Alar843300,China2CollegeofAnimalScience,TarimUniversity,Alar843300,China3CollegeofResourcesandEnvironmentalSciences,ChinaAgriculturalUniversity,Beijing100193,China
PopuluspruinosaSchrenk, a rare and vulnerable plant in arid deserts occurring mainly in the Tarim River Basin, is a key species of the Tarim desert ecosystem. The existence and development of desert riparian forest has controlled the structure and function of the desert ecosystem and eased sustainable development in the region. Since the 1950s, people used soil and water resources in the upper reaches of the Tarim River in an unsustainable manner, resulting in poor forest growth and death of many areas of forest. This directly endangered the sustainable development of the oasis′ agricultural system and disturbed the ecological balance in this area. We studied the life history characteristics and spatial distribution patterns ofP.pruinosapopulations in the upper reaches of the Tarim River, Xinjiang, China, to determine the ecological characteristics ofP.pruinosapopulations and to learn how biological and environmental factors affect population the distribution and dynamics. The current trends in development of theP.pruinosaforest was studied, with the goal of ensuring the wise use (conservation) and protection (preservation) of this precious tree species in the Tarim River Basin.
The survey area was located in the upper reaches of Tarim River (40°25′—41°10′N, 80°10′—84°36′E). Five 1.0 hm2plots were established and divided into 100 subplots. Diameter at breast height (DBH) of all treesDBHgt; 2.5 cm, regeneration-sized trees ofP.pruinosaand shrubs as well as herbs were identified and measured using a contiguous grid quadrate method. We determined the life table, age structure and survivorship curve ofP.pruinosapopulations to analyze population structure and dynamics. We divided trees into four groups based on twelveDBHsize classes to analyze spatial pattern dynamics for different age classes using field data. The results showed that the age structure ofP.pruinosapopulations had a bell shape with a low percentage of younger and healthy adult trees, which indicated the population is temporarily stable. The age structures ofP.pruinosapopulations were different in different habitats and the population structure transitioned from stationary to declining shape as one proceeded down river. The survivorship curve ofP.pruinosapopulations conformed to Deevey type Ⅱ shape. The survival rate decreased over time as trees aged and survival rate of the medium aged trees (Ⅵ—Ⅸ) decreased more quickly. The hazard rate forP.pruinosapopulations increased with developing age and the mortality rate surpassed the survival rate after trees reached the Ⅷ age class. Moreover, the mortality rate, hazard rate and age-specific mortality rate peaked in the Ⅸ age class and life expectancy decreased monotonically during a given tree′s life span, which was caused by intraspecific competition for resources and physiological aging. This species generally has a clumped distribution pattern, but spatial distribution patterns differed among plots and growth periods, which implies that the spatial distribution of this species at any one site is the result of adaptation to environmental stress and interaction with the local environment. The spatial distribution patterns of different growth stages ofP.pruinosapopulations varied as age increased; aggregation intensity gradually decreased and changed over time from a clumped to a random pattern as trees matured from young to middle-age to old trees, which was a result of changes in the intensity of intraspecific competition. Correlation and stepwise regression analysis between environmental factors and population density showed that groundwater level was the main factor affecting the population distribution. As a result of variations in the availability of groundwater, the population structure and spatial pattern varied with different growth periods and different habitats, which revealed that biological and environmental factors were the two main types of factors affecting the population′s ecological characteristics. We conclude conservation strategies designed to protectP.pruinosapopulations should focus on improving habitat conditions and seedling establishment, while reducing human disturbance and enhancing genetic diversity.
the upper reaches of Tarim River;Populuspruinosaschrenk; population structure; life history; spatial distribution
国家自然科学基金资助项目(31060066);973前期研究专项资助(2012CB426507, 2011CB411909)
2013- 05- 21;
2013- 07- 25
*通讯作者Corresponding author.E-mail: hlzky@163.com
10.5846/stxb201305211136
韩路,席琳乔,王家强,王海珍,宇振荣.塔里木河上游灰胡杨种群生活史特征与空间分布格局.生态学报,2013,33(19):6181- 6190.
Han L, Xi L Q, Wang J Q, Wang H Z, Yu Z R.Life history characteristics and spatial distribution ofPopuluspruinosapopulation at the upper reaches of Tarim River.Acta Ecologica Sinica,2013,33(19):6181- 6190.
