几种生态因子对拟目乌贼胚胎发育的影响
2013-12-09彭瑞冰蒋霞敏于曙光王春琳
彭瑞冰,蒋霞敏, 于曙光, 罗 江,唐 锋,王春琳
(宁波大学海洋学院,宁波 315211)
几种生态因子对拟目乌贼胚胎发育的影响
彭瑞冰,蒋霞敏*, 于曙光, 罗 江,唐 锋,王春琳
(宁波大学海洋学院,宁波 315211)
研究盐度、光照周期、孵化密度、溶解氧对拟目乌贼(Sepialycidas)胚胎发育的影响,以确定其胚胎发育最佳生态条件。在室内控制条件下,采用单因子试验研究了不同盐度(18、21、24、27、30、33、36),光照周期L∶D(0 h∶24 h、6 h∶18 h、12 h∶12 h),孵化密度(3、6、9、12、15 个/L)等对其胚胎孵化率、培育周期、孵化周期、卵黄囊完全吸收率和初孵幼体大小的影响。结果表明:不同盐度对胚胎发育影响显著(Plt;0.05),适宜盐度为27—33,最适盐度为30,最适盐度下孵化率达(93.33±2.89)%、培育周期为(25.67±0.58)d、孵化周期为(5.33±0.58)d、卵黄囊完全吸收率达(89.27±0.33)%、初孵幼体体重达(0.247±0.006)g;光照周期对孵化周期影响不显著(Pgt;0.05),对其它指标影响显著(Plt;0.05),适宜光照周期为L∶D(6 h∶18 h),最适光照周期下孵化率达(80.33±2.89)%,培育周期为 (35.67±0.57) d、孵化周期为(4.67±0.57)d、卵黄囊完全吸收率达(82.18±7.72)%、初孵幼体体重达(0.243±0.012)g;在各孵化密度下充气与否,对胚胎发育有显著影响(Plt;0.01),水中含氧量≤5.55 mg/L时,胚胎发育受阻。在充气情况下不同孵化密度对胚胎发育影响显著(Plt;0.05),适宜孵化密度3—9 个/L,最适宜孵化密度6 个/L,最适孵化密度下孵化率达(96.67±2.89)%、培育周期为(29.67±0.58)d、孵化周期为(5.67±1.15)d、卵黄囊完全吸收率达(89.65±0.31)%、初孵幼体体重达(0.244±0.005)g。由此确定,其适宜的孵化盐度为27—33,光照周期为L∶D(6 h∶18 h),孵化密度为3—9 个/L。
拟目乌贼;胚胎发育;盐度;光照周期;孵化密度;孵化率
拟目乌贼(Sepialycidas)属于头足纲乌贼目乌贼科乌贼属,主要分布在印度洋—西太平洋大陆架附近海域,为暖水性种,个体大,肉质鲜美、营养价值高等特点,是一种极具养殖前景的种类[1]。国内外关于其的研究报道不多,主要由Nagai等[2]研究了其体内胶原蛋白的分离与鉴定,Wada等[3]和Lucky等[4]对其繁殖行为学、形态学进行了研究,Kikkawa等[5]开展了其CO2耐受程度的研究;国内学者文菁等[6]对其繁殖行为学研究,蒋霞敏等[7]对其营养成分分析与评价。关于其在繁殖生物学、生态习性等方面的研究资料还十分匮乏,生态因子对其胚胎发育和生长研究未见报道。为此,本文采用单因子试验方法,研究了盐度、光照周期、孵化密度、溶解氧对拟目乌贼胚胎发育的影响,旨在确定其胚胎发育的最佳生态条件,以期为人工育苗提供理论依据和科学指导。
1 材料与方法
1.1 实验材料
实验在福建省诏安县梅岭镇耀荣水产有限公司水产种苗场进行,亲体捕自福建南部海域(19°—20°N和111°—112°E),共324尾,雄体体重 2.20—4.10 kg((2.84±0.44) kg),雌体重 0.50—2.50 kg((1.20±0.36) kg),暂养在水泥池中(水温15—20 ℃、盐度28—31),吊挂网片与绳子作为附卵器,让其自然产卵。本实验取自同一时间段所产、发育正常、大小均匀的拟目乌贼胚胎(平均卵径长 (3.76±0.35) cm、平均卵径宽(1.73±0.16) cm、平均卵重(4.28±0.38) g,处于卵裂的多细胞期)。实验用自然海区,经过暗沉淀与沙滤的海水,水温 18.3—25.5 ℃,盐度 28.0—31.0(ATAGO盐度折光仪),pH值 7.80—8.10(pH计),COD 6.05—7.89 mg/L(YSI溶氧测定仪);淡水取自诏安县梅岭镇的地下水,水温19.3—21.3 ℃,pH值 6.80—6.90,COD 4.05—5.80 mg/L。
1.2 实验方法
1.2.1 盐度试验
设盐度18、21、24、27、30、33和36共7 个梯度,每梯度各设3个平行组,每个平行组各放20个胚胎,孵化密度为1个/L,置于49 cm×49 cm×26 cm白色泡沫箱内进行。高盐度海水采用砂滤自然海水添加人工海水素配制而成;低盐度海水以砂滤海水加经曝气的淡水调配,胚胎放入泡沫箱后,盐度按每小时升降2的速率调节到各试验组盐度要求,试验保持盐度稳定后,每隔一天100%等盐度换水,实验过程采取微充气。每天定时取卵在解剖镜下观察记录胚胎发育情况,定时测量水温、盐度、pH值、COD,及时取出死的胚胎,以免影响水质,待仔乌贼孵化出后,记录培育周期、孵化周期、孵化率、卵黄囊完全吸收率和初孵幼体体重(精确到0.001g的电子天枰),以各实验组最后一枚胚胎孵化后一周内不再有胚胎孵化为实验结束时间,整个实验过程为期51 d,每天16:30左右还测量各盐度胚胎的重量。实验期间pH值为8.03—8.15,水温为18.5—26.5 ℃,COD 10.80—11.27 mg/L,光照周期L∶D(12 h∶12 h)。
1.2.2 光照周期试验
设L∶D(0 h∶24 h)、L∶D(6 h∶18 h)和L∶D(12 h∶12 h)共3个梯度,每梯度各设3个平行组,每个平行组各放20个胚胎,孵化密度为1 个/L,置于49 cm×49 cm×26 cm白色泡沫箱内进行。暗采用双层遮阳网处理(不遮光光照强度2000—7500 lx、遮光后为40—120 lx),实验过程微冲气。其他的日常管理与测量指标同1.2.1。实验期间pH值为8.00—8.10,水温为18.5—26.5 ℃,COD 10.75—11.04 mg/L,盐度为29—32。
1.2.3 孵化密度与充气试验
孵化密度设置为3、6、9、12和15 个/L 5个梯度,设充气和不充气两个组,各设3个平行组,每个平行组各放20个胚胎,置于塑料桶(高22.5 cm、内径19.5 cm)孵化。其他的日常管理与测量指标同1.2.1,实验期间pH值为7.80—8.12,水温为20.5—26.5 ℃,盐度为29—32,光照周期L∶D(12 h∶12 h)。
1.3 测量方法与数据处理
根据拟目乌贼胚胎发育特征可分为13个阶段:胚胎期、卵裂期、囊胚期、原肠胚期、初具形态期、腕分化期、心跳出现期、色素出现期、内骨骼形成期、尾腺出现期、缘膜形成期、出膜前期,出膜期。
测量指标包括:培育周期、孵化周期、孵化率、卵黄囊完全吸收率、初孵幼体体重、胚胎的重量。
其中,培育周期指实验组中正常胚胎中有50%孵化出膜时所用的时间;孵化周期指实验组中胚胎从第1尾仔乌贼孵化出膜至最后1尾仔乌贼孵化出膜的时间间隔。
孵化率:
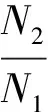
卵黄囊完全吸收率:

式中,N1、N2分别表示总卵个数、孵化出膜个数,M1、M2分别表示孵化出幼体数、孵化出膜时卵黄囊完全吸收幼体数。
1.4 数据处理
运用SPSS 17.0统计分析软件对各生态因子与其下各分析指标的数据进行相关分析、ANOVAD单因素分析和Duncan氏多重比较分析。R为相关系数。当r的绝对值为0—0.33为弱相关,0.33—0.67为中等相关,0.67—1为强相关[8]。
2 结果
2.1 盐度对盐度对拟目乌贼胚胎发育的影响
由图1、图2可知,盐度对胚胎培育周期、孵化周期、孵化率、卵黄囊完全吸收率、初孵幼体体重影响显著(Plt;0.05),相关系数为0.734—0.935,显示存在较强的正相关,其中与孵化率的相关系数最高、孵化周期最低。盐度27.0—33.0条件下胚胎均能孵化出膜,最适孵化盐度为30;当盐度≤21或者≥36时,会导致胚胎发白、变软、胚胎变大、颜色暗沉、卵内模糊、表皮褶皱、坏死等现象。盐度18.0条件下(36.67±2.78)%胚胎发育滞于囊胚期,(63.33±4.05)%发育滞于原肠胚期;盐度21条件下(81.67±3.64)%发育滞于原肠胚期的胚胎下包阶段,(18.33±2.85)%发育滞于初具形态期的器官芽形成期;盐度36条件下(26.67±2.06)%发育滞于囊胚期,(73.33±3.55)%发育滞于原肠胚期。
2.1.1 盐度对孵化率的影响
盐度24.0—33.0时,孵化率达48.33%—93.33%,盐度小于30时,孵化率随着盐度升高而增加,盐度30组孵化率最高,为93.33%,与依次降低33、27、24组之间存在显著性差异(Plt;0.05);当大于盐度30时,孵化率随着盐度升高而减少。
2.1.2 盐度对培育周期及孵化周期的影响
盐度24.0—33.0时,培育周期为25.67—29.67 d,其培育周期随盐度的升高而降低,盐度30时培育周期最短,为25.67 d,与依次增加盐度33、27组之间差异不显著(Pgt;0.05),与盐度24组之间存在显著性差异(Plt;0.05);孵化周期为5.33—6.77 d,盐度30时孵化周期最短,33、27组之间没有显著性差异(Pgt;0.05),盐度24组与其他各组有显著性差异(Plt;0.05)。
2.1.3 盐度对卵黄囊完全吸收率及初孵幼体体重的影响
盐度24.0—33.0时,卵黄囊完全吸收率为69.55%—89.28%,盐度30组最高,为96.69%,与依次降低33、27、24组之间差异显著(Plt;0.05),盐度小于30时,卵黄囊完全吸收率随着盐度降低而降低;初孵幼体体重为0.223—0.247 g,盐度30组初孵幼体最重,为0.247 g,与依次降低33、27、24组之间差异显著(Plt;0.05),盐度33与27组之间差异不显著(Pgt;0.05),当盐度小于30时,初孵幼体体重随着盐度降低而降低。
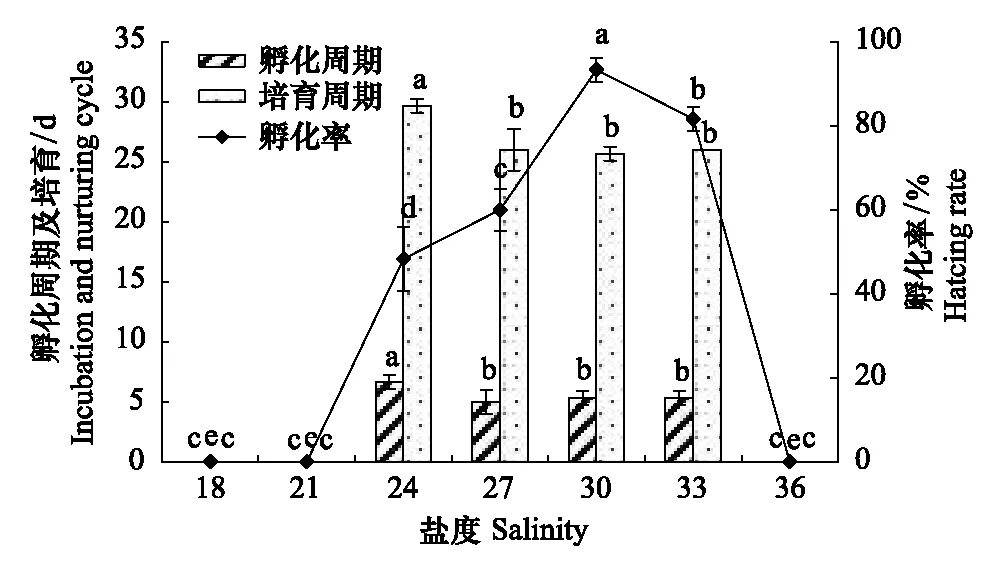
图1 盐度对培育周期、孵化周期、孵化率影响Fig.1 Eiffects of salinity on hatching rate, incubation and nurtuning cycle

图2 盐度对卵黄囊完全吸收率、初孵幼体幼体体重影响Fig. 2 Eiffects of salinity on completely absorked rate of yolk sac and the weight of newly hatched larvae

图3 不同盐度下胚胎重量随时间的变化趋势Fig.3 Curve fitted to weight of zygote in different salinity
2.1.4 盐度对胚胎重量的影响
由图3可以看出,在培育周期过程中,正常发育的胚胎呈现出先减轻后增重的趋势。试验开始的胚胎约3 g,从第1天(卵裂期)到第13天(腕分化期)渐减轻,至第13 天(腕分化期)约1.8 g,从第14 天(心跳出现期)开始又增重,出膜前平均重量达到5 g左右,约是最轻时的3倍。出膜时,胚胎的重量以盐度33组最高,为5.07 g,24组最低,为4.76 g。盐度33组与30组相差不大(Pgt;0.05),但显著大于依次降低的27、24组,胚胎的重量随着盐度升高而增加。
2.2 光照周期对胚胎发育的影响
由图4、图5可知,光照周期对拟目乌贼胚胎培育周期、孵化率、卵黄囊完全吸收率、初孵幼体体重影响显著(Plt;0.05);相关系数为0.877—0.913,显示存在强的正相关,其中与培育周期的相关系数最大、初孵幼体体重最小,但相差不大;而对孵化周期影响显著不显著(Pgt;0.05)。
2.2.1 光照周期对孵化率的影响
在不同的光照周期条件下,L∶D(12 h∶12 h)组的孵化率最高,L∶D(0 h∶24 h)组最低,L∶D(12 h∶12 h)组与L∶D(6 h∶18 h)组差异性不显著(Pgt;0.05),但与L∶D(0 h∶24 h)组显著差异(Plt;0.05)。孵化率随着光照时间增加而增加。
2.2.2 光照周期对培育周期及孵化周期的影响
在不同的光照周期条件下,L∶D(12 h∶12 h)组的培育周期最短,为34.00 d;L∶D(0 h∶ 24 h)最长,为37.33 d。L∶D(12 h∶ 12 h)组与依次增加L∶D(6 h∶ 18 h),L∶D(0 h∶ 24 h)组差异性显著差异(Plt;0.05),光照时间越长,孵化所需要的时间就越短。不同的光照周期下,孵化周期范围为4.33 —5.00 d,L∶D(0 h∶ 24 h)组的孵化周期最短,与其它各组之间差异性不显著(Pgt;0.05)。
2.2.3 光照周期对卵黄囊完全吸收率及初孵幼体体重的影响
不同的光照周期下,卵黄囊完全吸收率为69.58%—90.95%,L∶D(0 h∶ 24 h)组最高,为90.95%,与依次降低L∶D(6 h∶ 18 h)、L∶D(12 h∶ 12 h)组之间差异显著(Plt;0.05),卵黄囊完全吸收率随着光照时间增长而降低。初孵幼体体重为0.227—0.257 g,初孵幼体最重的L∶D(0 h∶ 24 h)组显著高于L∶D(6 h∶ 18 h)、L∶D(12 h∶ 12 h)组(Plt;0.05),初孵幼体体重随着光照时间增长而降低。
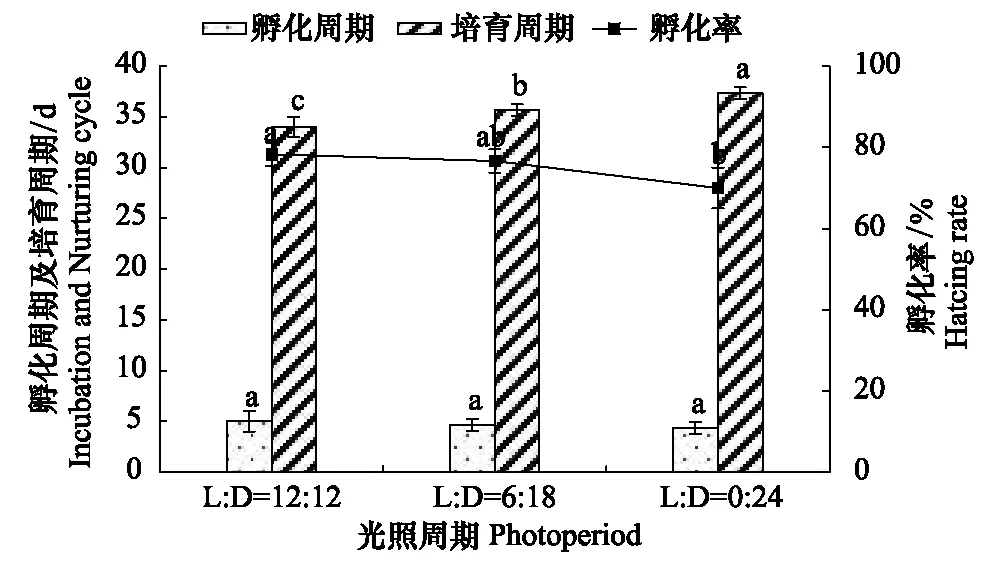
图4 光照周期对培育周期、孵化周期、孵化率影响Fig.4 Eiffects of photoperiod on hatching rate, incubation and nurtuning cycle
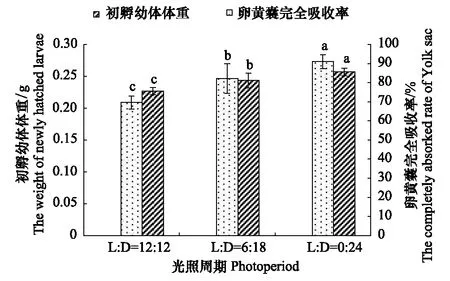
图5 光照周期对卵黄囊完全吸收率、初孵幼体幼体体重影响Fig.5 Eiffects of photoperiod on completely absorked rate of yolk sac and the weight of newly hatched larvae
2.3 孵化密度对胚胎发育的影响
由图6、图7可知,孵化密度对拟目乌贼胚胎培育周期、孵化周期、孵化率、卵黄囊完全吸收率、初孵幼体体重影响显著(Plt;0.05),相关系数为0.824—0.953,除了孵化周期以外,其它显示存在较强的负相关,其中与初孵幼体体重的相关系数最高、孵化周期最低。
2.3.1 孵化密度对孵化率的影响
孵化密度3—15 个/L时,孵化率为75.33%—96.67%,孵化率随着孵化密度升高而降低,孵化密度3 个/L时孵化率最高,为96.67%,与依次降低6、9 个/L组之间差异不显著(Pgt;0.05),与12、15 个/L组存在显著性差异(Plt;0.05)。
2.3.2 孵化密度对培育周期及孵化周期的影响
孵化密度3—15 个/L时,培育周期为27.33—30.00 d,培育周期随孵化密度的升高而降低,3 个/L时培育周期最长,为30.00 d,与依次降低6、9 个/L组之间差异不显著(Pgt;0.05),虽然与12、15 个/L组存在显著性差异(Plt;0.05),但相差不大;孵化周期为5.33—9.00 d,培育周期随孵化密度的升高而增加,3 个/L时孵化周期最短,15 个/L时孵化周期最长,3、6、9 个/L组之间差异不显著(Pgt;0.05)与12、15 个/L组存在显著性差异(Plt;0.05)。
2.3.3 孵化密度对卵黄囊完全吸收率及初孵幼体体重的影响
孵化密度3—15 个/L时,卵黄囊完全吸收率为18.39%—93.33%,卵黄囊完全吸收率随孵化密度的升高而降低,3 个/L时卵黄囊完全吸收率最高,为93.33%,与6 个/L相近(Pgt;0.05),二者均显著高于依次降低的9、12、15 个/L组(Plt;0.05);初孵幼体体重为0.190—0.252 g,15 个/L时初孵幼体最轻(0.190 g),与12 个/L相近(Pgt;0.05),二者均显著低于9、6、3个/L组(Plt;0.05)。
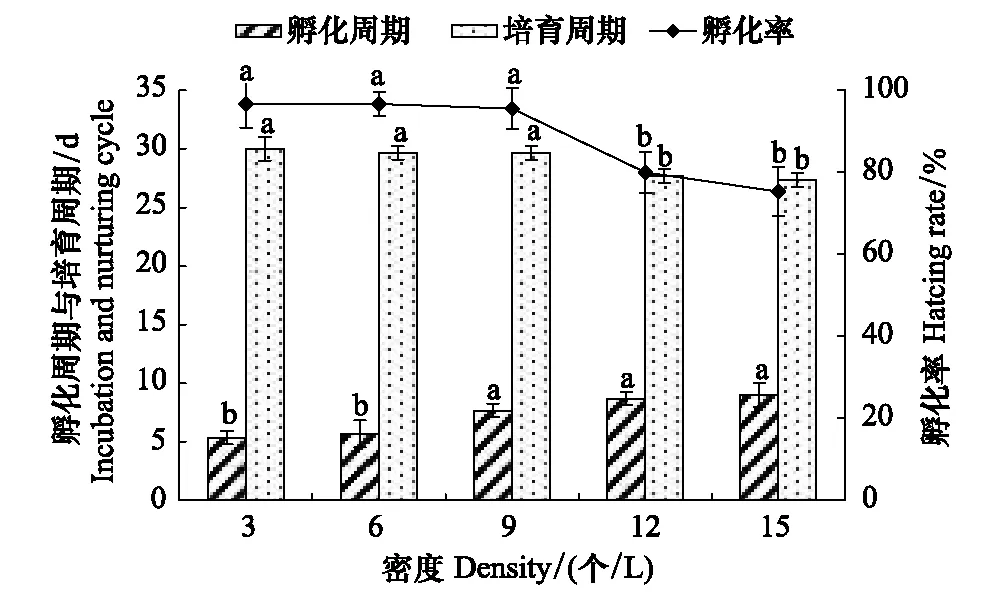
图6 孵化密度对培育周期、孵化周期、孵化率影响Fig.6 Eiffects of density on hatching rate, incubation and nurtuning cycle
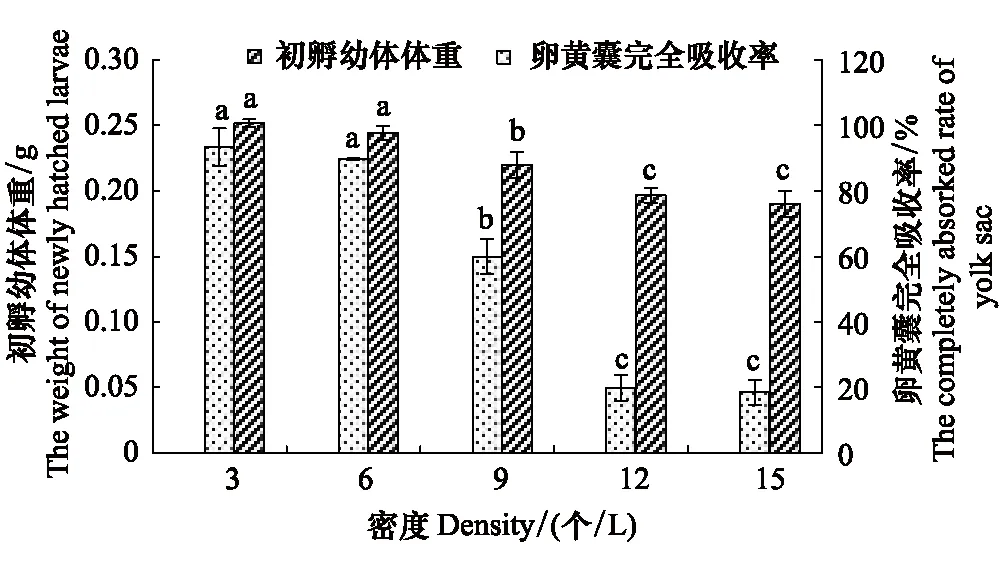
图7 孵化密度对卵黄囊完全吸收率、初孵幼体幼体体重影响Fig.7 Eiffects of density on completely absorked rate of yolk sac and the weight of newly hatched larvac
2.4 不同密度下充气与否对孵化率的影响
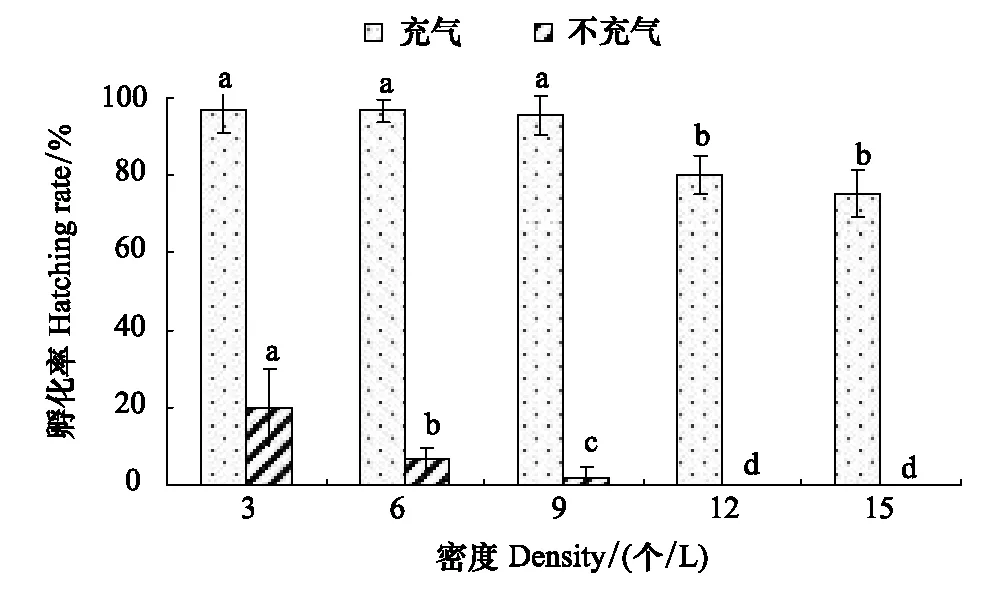
图8 溶氧对孵化率影响Fig.8 Eiffects of O2 on hatching rate
由图8可以看出,在同样的孵化密度下,充气与否,对孵化率有明显差异(Plt;0.05)。在充气的条件下3—9 个/L孵化率为95.57%—96.67%,而在不充气的条件下仅为1.67%—20.00%。对各试验组在实验过程中换水前后水中含氧如表1显示,在充气的条件下,前后变化不大;而在不充气条件下变化较大。对照图8和表1可知,水中含氧量≤5.55 mg/L时,会严重影响胚胎的正常发育,因此,在拟目乌贼生产育苗中应采用充氧方式,保证水中含氧量达到9.00 mg/L 以上,以确保拟目乌贼较高的孵化率。

表1 不同孵化密度下换水前后的水中氧含量
3 讨论
3.1 盐度对胚胎发育的影响
胚胎发育整个过程涉及一系列细胞分化、形态发生等过程,除了受到内部基因表达影响外,还受到外部环境因素影响,盐度是影响海洋生物的胚胎发育的重要因素之一[9- 13]。盐度影响胚胎渗透压平衡,渗透压调节作用主要由卵黄周围的薄层原生质外层进行,通常在适宜的盐度范围内胚胎渗透压可通过自身调节保持在相对稳定水平,若水体盐度超出其耐受范围,则会导致卵黄囊失水收缩变小以及胚胎发育停止[14]。所以需要外界提供一个适宜的环境保证其正常有效地进行。探索其胚胎发育的适宜盐度,对其在生产育苗中具有重要意义。
本试验结果显示,不同盐度对拟目乌贼胚胎的培育周期、孵化周期、孵化率、卵黄囊完全吸收率、幼体大小影响显著(Plt;0.05),在一定范围内孵化率、卵黄囊完全吸收率、初孵幼体体重随着盐度升高而增加,培育周期、孵化周期随盐度的升高而降低;综合以上5个指标的影响,得出适宜盐度为27—33,最适盐度为30,当盐度≥36或≤21导致胚胎死亡。这一结果与黄建盛等[15]、Paulij等[16]分别报道的虎斑乌贼(Sepiapharaonis)适宜盐度范围为27.0—33.0,乌贼(Sepiaofficinalis)为23.0—33.0相近,但与蒋霞敏等[17]报道的曼氏无针乌贼(Sepiellamaindroni)适宜孵化盐度为19.5—32.0、Sen等[18]报道的枪乌贼(Loligovulgaris)为32—40的结果不符,这可能与不同物种繁殖习性和分布范围有关。拟目乌贼与虎斑乌贼主要分布在南海、为热带繁殖习性,而曼氏无针乌贼主要分布在东海,为温带繁殖习性。
在实验中发现盐度过高会导致胚胎失水,而过低导致胚胎过量吸水,引起胚胎膨胀,这些都会导致胚胎发育受阻。同时,有研究表明当盐度过高或者过低时,由于渗透胁迫,导致头足类动物的胚胎畸形[16]。也有研究表明,在胚胎发育过程与需要的氧气通过卵膜扩散到胚胎内,盐度过高会导致水中溶解氧降低,会引起氧气扩散,限制胚胎的呼吸,最后导致胚胎滞后或者死亡[19- 21]。而盐度过低或过高导致胚胎内部模糊、出现云雾状,可能因为低盐条件下胚胎细胞骨架解体、高盐导致胚胎细胞运动过程受阻的缘故。在实验中还发现当盐度小于30时,卵黄囊完全吸收率与初孵幼体体重随着盐度增加而增加,大于30时呈现减少趋势。卵黄囊有贮存、分解、吸收和输送营养物质的功能,在胚胎发育过程中提供营养物质,直接关系到胚胎的健康发育[22]。王宏田等[23]在环境因子对海产鱼类胚胎及早期仔鱼发育影响的研究报告中指出卵黄囊的体积及吸收效率是评价海产鱼类胚胎及早期仔鱼发育重要指标之一。从结果来看,卵黄囊完全吸收率越高初孵幼体体重越重,同时还发现其个体活力佳,所以保持高的卵黄囊完全吸收率有利于提高生产育苗中的成活率。盐度过高或者过低影响到卵黄囊完全吸收率和初孵幼体的大小。
3.2 光照周期对胚胎发育的影响
光照也是影响海洋生物胚胎发育重要的因素之一[24]。从实验结果来看,光照周期对拟目乌贼胚胎发育的培育周期、孵化率、卵黄囊完全吸收率、初孵幼体体重影响显著(Plt;0.05);对孵化周期影响不显著(Pgt;0.05)。孵化率L∶D(12 h∶ 12 h)组的最高、培育周期最短,但与L∶D(6 h∶ 18 h)组相差不大,光照时间越长,孵化所需要的时间就越短;卵黄囊完全吸收率、初孵幼体重量随着光照时间增长而降低,L∶D(0 h∶ 24 h)组最高,初孵幼体体重。延长光照时间有利于加快孵化的速度,提高孵化率,但是不利于提高卵黄囊完全吸收率、初孵幼体的体重。光照的刺激有利于孵化酶的分泌,从而加快出膜。本实验发现L∶D(12 h∶ 12 h) 组胚胎表面远远比L∶D (0 h∶ 24 h) 组与L∶D(6 h∶ 18 h)容易长硅藻。而胚胎表面被藻类覆盖,可能会导致胚胎表面的气孔受堵,影响与外界的氧气交换。有研究表明低氧环境加快孵化速度,提前出膜。这可能就是导致L∶D(12 h∶ 12 h)比L∶D(6 h∶ 18 h)、L∶D(0 h∶ 24 h)培育周期短,而卵黄囊完全吸收率低、初孵幼体体重小的原因。L∶D(0 h∶ 24 h)组长期处于弱光的环境,稳定环境条件、减少环境刺激,这可能是导致出膜晚、个体大的缘故;但是弱光的环境条件下导致孵化时间长、孵化率低。所以在育苗实践中拟目乌贼胚胎孵化时,即不要采用长时间强光照,也不能长时间采用弱光环境;特别在太阳强烈时,应适当采用遮光,减少阳光的强度,有利于保证较高的孵化率同时,可以增加卵黄囊完全吸收率、增加初孵幼体的体重。
3.3 孵化密度与不同密度下充气与否对胚胎发育的影响
孵化密度和水中的氧含量是影响海洋生物胚胎发育的重要因素之一[15, 25- 26]。当孵化密度过大,水中氧气不足导致胚胎发育受阻、孵化率下降、畸形率增加等现象。从实验结果来看,随着孵化密度增加,拟目乌贼胚胎的孵化率下降,而孵化周期,培育周期变化不大。在充气的条件下孵化密度为3—9 个/L时,孵化率为95.57%—96.67%;而12—15 个/L时,孵化率低于80%;不同孵化密度对卵黄囊完全吸收率、幼体体重影响显著(Plt;0.05),随着孵化密度增加拟目乌贼胚胎卵黄囊完全吸收率、幼体体重而下降,同时发现初孵幼体的畸形率增加。当孵化密度为3—6 个/L时,卵黄囊完全吸收率89.64%—93.37%,幼体体重0.24—0.25g。而当9—15 个/L时,初孵幼体的畸形率大幅度增加,高达26.84—59.71%;卵黄囊完全吸收率下降到了18.39%—59.93%;幼体体重也出现明显的下降,只有0.19—0.21g。所以综合各方面因素分析,在育苗实践中在充气条件下拟目乌贼胚胎孵化密度最好控制在3—9 个/L左右为宜,最适合为6 个/L,以保证较高的孵化率、卵黄囊完全吸收率,较短的孵化周期、培育周期,较大、活力强的个体。
实验发现同样孵化密度3—15 个/L,不充气条件下孵化率明显下降。当水中溶氧≤5.55 mg/L 时,胚胎发育受阻,孵化率几乎为零。实验中发现,各个密度下从卵裂期到腕分化期的胚胎基本正常发育,当胚胎内乌贼个体基本成型、有明显心跳以后(心跳出现期),发现胚胎开始出现死亡现象。可见随着胚胎发育过程,对氧气的需要在不断增加,当氧气不足时,导致胚胎发育受阻。Cronin等[21]在研究澳大利亚巨乌贼(Sepiaapama)时,发现随着胚胎发育深入,对O2的需要呈指数级增长,需要达到5.5 mg/L以上,同时在培育周期过程中,通过扩大胚胎的体积来增加表面积,增大卵表面的气孔,增加O2接触面积和通过气量,同时也减小卵膜的厚度,来满足O2需要。这一研究与本研究结果相符,拟目乌贼胚胎先减轻后增重,腕分化期胚胎重量、体积为最小,从心跳出现期开始又迅速增大,当出膜时胚胎达到最大。体积约为最小时的2倍,可见心跳出现期开始对氧气的需要越来越高,这个阶段如果水中的溶氧不足,最容易导致出现胚胎死亡,所以在孵化期需要加大充气。
[1] Chen X J, Lun B L, Wang X G. Cephalopods of the World. Beijing: Ocean Press, 2009: 440- 441.
[2] Nagai T, Yamashita E, Taniguchi K, Kanamoric N, Suzuki N. Isolation and characterisation of collagen from the outer skin waste material of cuttlefish (Sepialycidas). Food Chemistry, 2001, 72(4): 425- 429.
[3] Wada T, Takegaki T, Mori T, Natsukaria Y. Sperm removal, ejaculation and their behavioural interaction in male cuttlefish in response to female mating history. Animal Behaviour, 2010, 79(3): 613- 619.
[4] Lucky N S, Ihara R, Yamaoka K, Hori M. Behavioral laterality and morphological asymmetry in the cuttlefish,sepialycidas. Zoological Science, 2012, 29(5): 286- 292.
[5] Kikkawa T, Watanabe Y, Katayama Y, Kita J, Ishimatsu A. Acute CO2tolerance limits of juveniles of three marine invertebrates,Sepialycidas,SepioteuthislessonianaandMarsupenaeusjaponicus. Plankton and Benthos Research, 2008, 3(3): 184- 187.
[6] Wen J, Jiang X, Wang Y, Chen D H. The reproductive behavior of cuttlefishSepialycidas. Fisheries Science, 2012, 31(1): 22- 27.
[7] Jiang X M, Peng R B, Luo J, Gao X Z, Jiang X M. Analysis and evaluation of nutrient composition in different tissues of wildSepialycidas. Chinese Journal of Animal Nutrition, 2012, 24(12): 2393- 2401.
[8] Zhang S J, Chen Q B. Application of statistical analysis software SPSS(5)---Correlation analysis and regression analysis. Animal Hushandry and Veterinary Medicine, 2003, 35(9): 16- 18.
[10] Rao X Z, Lin G, Zhang D C, Chen Y S, Xu Y Q. Combined effects of temperature and salinity on embryonic development and larval growth ofCapitulummitella. Acta Ecologica Sinica, 2010, 30(23): 6530- 6537.
[11] Palmegiano G B, D′Apote M P. Combined effects of temperature and salinity on cuttlefish (SepiaofficinalisL) hatching. Aquaculture, 1983, 35(2): 259- 264.
[12] Li Z M, Liu Z G, Yao R, Luo C J, Yan J F. Effect of temperature and salinity on the survival and growth ofMeretrixlyratajuveniles. Acta Ecologica Sinica, 2010, 30(13): 3406- 3413.
[13] Lin B S, Wu T M. The effects of temperature and salinity on the larvae ofSinonovaculaConstricta. Acta Ecologica Sinica, 1984, 4(4): 385- 392.
[14] Shen H D, Chen H C, Chen X L, Ran F, Shi Z Y, Xiong L P, Wang F. Influence of water salinity on embryonic development of sea-slugOnchidiumsp. Journal of Shanghai Fisheries University, 2006, 15(3): 297- 302.
[15] Huang J S, Chen G, Zhang J D, Feng L H. Effects of salinity on fertilized egg hatch and survival activity index of the larvae ofSepiapharaonis. Journal of Guangdong Ocean University, 2012, 32(1): 35- 38.
[16] Paulij W P, Bogaards R H, Denucé J M. Influence of salinity on embryonic development and the distribution ofSepiaofficinalisin the Delta Area (South Western part of The Netherlands). Marine Biology, 1990, 7(1): 17- 23.
[17] Jiang X M, Lu R Z, He H J, Ye P L, Ying Z, Wang C L. Effects of several ecological factors on the hatching ofSepiellamaindroniwild and cultured eggs. Chinese Journal of Applied Ecology, 2010, 21(5): 1321- 1326.
[18] Sen H. Incubation of European Squid (LoligovulgarisLamarck 1798) eggs at different salinities. Aquaculture Research, 2005, 36(9): 876- 881.
[19] Nabhitabhata J, Asawangkune P, Amornjaruchit S. Tolerance of eggs and hatchlings of neritic cephalopods to salinity changes. Phuket Marine Biological Center Special Publication, 2001, 25(1): 91- 99.
[20] Sherwood J E, Stagnitti F, Kokkinn M J, Williams W D. Dissolved oxygen concentrations in hypersaline waters. Limnology and Oceanography, 1991, 36(2): 235- 250.
[21] Cronin E R, Seymour R S. Respiration of the eggs of the giant cuttlefishSepiaapama. Marine Biology, 2000, 136(5): 863- 870.
[22] Mihelakakis A, Yoshimatsu T. SHORT COMMUNICATION Effects of salinity and temperature on incubation period, hatching rate and morphogenesis of the red sea bream. Aquaculture International, 1998, 6(2): 171- 177.
[23] Wang H T, Zhang P J. Effects of environmental conditions on fertilized eggs and early larva of marine fishes. Marine Sciences, 1998, (4): 50- 52.
[24] Zhou Q B, Jin S M, Wu X B, Zhang Y P, Yang F Q, Wu H D. Effects of the water depth and illumination on the hatching rate of zygote of ricefield eel(Monopterusalbus). Freshwater Fisheries, 2006, 36(2): 31- 33.
[25] Chen D F. Different densities of soft-shelled turtle(Triongxsinensis) hatching test. Reservoir Fisheries, 2001, 21(2): 21.
[26] Cintia A, Barón-Pedro J, Rivas-Andrés L. The effects of environmental factors on the embryonic survival of the Patagonian squidLoligogahi. Journal of Experimental Marine Biology and Ecology, 2004, 313(2): 225- 240.
参考文献:
[1] 陈新军, 刘必林, 王尧耕. 世界头足类. 北京: 海洋出版社, 2009: 440- 441.
[6] 文菁, 江星, 王雁, 陈道海. 拟目乌贼繁殖行为学的初步研究. 水产科学, 2012, 31(1): 22- 27.
[7] 蒋霞敏, 彭瑞冰, 罗江, 高秀芝, 姜小敏. 野生拟目乌贼不同组织营养成分分析及评价. 动物营养学报, 2012, 24(12): 2392- 2401.
[8] 张苏江, 陈庆波. 数据统计分析软件SPSS 的应用(五)——相关分析与回归分析. 畜牧与兽医, 2003, 35(9): 16- 18.
[10] 饶小珍, 林岗, 张殿彩, 陈寅山, 许友勤. 温度、盐度对龟足胚胎发育和幼虫生长的联合影响. 生态学报, 2010, 30(23): 6530- 6537.
[12] 栗志民, 刘志刚, 姚茹, 骆城金, 颜俊飞. 温度和盐度对皱肋文蛤幼贝存活与生长的影响. 生态学报, 2010, 30(13): 3406- 3413.
[13] 林笔水, 吴天明. 温度和盐度对缢蛏浮游幼虫发育的影响. 生态学报, 1985, 4(4): 385- 392.
[14] 沈和定, 陈汉春, 陈贤龙, 冉福, 施志仪, 熊柳平, 王飞. 盐度对石磺胚胎发育的影响. 上海水产大学学报, 2006, 15(3): 297- 302.
[15] 黄建盛, 陈刚, 张健东, 冯连华. 盐度对虎斑乌贼(Sepiapharaonis)受精卵孵化及幼体活力的影响. 广东海洋大学学报, 2102, 32(1): 35- 38.
[17] 蒋霞敏, 陆珠润, 何海军, 叶蓓蕾, 应震, 王春琳. 几种生态因子对曼氏无针乌贼野生和养殖卵孵化的影响. 应用生态学报, 2010, 21(5): 1321- 1326.
[23] 王宏田, 郑培军. 环境因子对海产鱼类受精卵及早期仔鱼发育的影响. 海洋科学, 1998, 122(4): 50- 52.
[24] 周秋白, 金善勉, 吴小波, 张燕萍, 杨发群, 吴华东. 水深和光照对黄鳝受精卵孵化率的影响. 淡水渔业, 2006, 36(2): 31- 33.[25] 陈德富. 不同密度的中华鳖孵化试验. 水利渔业, 2001, 21(2): 21.
EffectofseveralecologicalfactorsonembryonicdevelopmentofSepialycidas
PENG Ruibing,JIANG Xiamin*,YU Shuguang,LUO Jiang,TANG Feng,WANG Chunlin
CollegeofOcean,NingboUniversity,Ningbo315211,China
Sepialycidasbelongs to the genusSepia, the family Sepiidae, the orders Sepioidea, and the class Cephalopoda. It is a warm-ocean demersal Cephalopoda with larger size, delicious meat and high nutrition value. It inhabits off shore waters at a depth of 15—100 m, and is mainly distributed from the Indian Ocean to the western Pacific. The average weight ofSepialycidaswas 0.6 kg after 4 months cultivation, and the heaviest youngSepialycidascould reach 1 kg. Because of its short raising duration and high yield, raisingSepialycidashas a high development potential in China. Ecological factor is one of the important factors for the growth and development potential in China. Ecological factor is one of the important factors for the growth and development of marine organisms. The impact of ecological factors on the embryonic development ofSepialycidaswas studied in this paper, which helps us to learn the ececological principle and mechanism between them and the environment better. In order to get the optimum salinity, photoperiod, hatching density and dissolved oxygen concentration of embryonic development ofSepialycidas, their effects on embryonic development were investigated. Single-factor test was used to study the effects of salinity(18、21、24、27、30、33、36),photoperiod L∶D(0 h∶24 h、6 h∶18 h、12 h∶12 h), hatching density (3、6、9、12、15 ind/L) on hatching rate, nurturing cycle, incubation cycle, completely absorked rate of yolk sac and weight of newly hatched larvae ofSepialycidasembryos under indoor control condition.The results showed that the embryonic development ofSepialycidaswas significantly affected by salinity (Plt;0.05). The suitable salinity for hatching ranged from 27.0 to 33.0 and the optimum salinity was 30.0. Hatching rate, nurturing cycle, incubation cycle, completely absorked rate of yolk sacwas and weight of newly hatched larvae were (93.33±2.89)%, (25.67±0.58) d, (5.33±0.58) d, (89.27±0.33)% and (0.247±0.006) g under the optimum salinity respectively. Photoperiod had not a significantly effect (Pgt;0.05) on incubation cycle ofSepialycidas, but had a significantly effect on other indicators (Plt;0.05). The optimum photoperiod is L∶D(6 h∶18 h). Hatching rate, nurturing cycle, incubation cycle, completely absorked rate of yolk sacwas and weight of newly hatched larvae were (80.33±2.89)%, (35.67±0.57) d, (4.67±0.57) d, (82.18±7.72)% and 0.243±0.012 g under optimum photoperiod, respectively. The embryonic development ofSepialycidaswas significantly affected by dissolved oxygen concentration (Plt;0.01). Embryos could not develop when Oxygen concentration in water is less than 5.55 mg/L. The embryonic development ofSepialycidaswas also significantly affected by hatching density when air was provided(Plt;0.05). The suitable hatching density ranged from 3 ind/L to 9 ind/L and the optimum hatching density was 6 ind/L. Hatching rate, nurturing cycle, incubation cycle, completely absorked rate of yolk sacwas and weight of newly hatched larvae were (96.67±2.89)%, (29.67±0.58) d, (5.67±1.15) d, (89.65±0.31)% and (0.244±0.005) g under the optimum hatching density respectively. Taken together, our results indicated that the suitable salinity for hatching ranged from 27.0 to 33.0, optimum photoperiod was L∶D(6 h∶18 h), and suitable hatching density ranged from 3 ind/L to 9 ind/L, because of the high hatchability and post-hatching survival, and the fastest growth of hatchlings in these thermal regimes.
Sepialycidas; embryonic development; salinity; photoperiod; density; hatching rate
国家自然科学基金资助项目(40776076);国家农业成果转化资助项目(2009GB2C220415);宁波市科技重点资助项目(2011C11002)
2013- 01- 26;
2013- 06- 26
*通讯作者Corresponding author.E-mail: jiangxiamin@nbu.edu.cn
10.5846/stxb201301260167
彭瑞冰,蒋霞敏,于曙光,罗江,唐锋,王春琳.几种生态因子对拟目乌贼胚胎发育的影响.生态学报,2013,33(20):6560- 6568.
Peng R B,Jiang X M,Yu S G,Luo J,Tang F,Wang C L.Effect of several ecological factors on embryonic development ofSepialycidas.Acta Ecologica Sinica,2013,33(20):6560- 6568.
