生物转化合成左旋紫堇达明诱导剂筛选及优化
2013-12-09余伯阳刘吉华
宋 洋,王 严,余伯阳,刘吉华
(中国药科大学中药复方研究室,江苏南京211198)
左旋四氢巴马汀(l-tetrahydropalmatine,l-THP)是由防己科植物华千金藤(Stephania sinica Diels)中提取的一种异喹啉类生物碱,为中药罂粟科植物延胡索(Corydalis yanhusuo W.T.Wang)有效成分延胡索乙素的左旋体[1],具有镇痛、镇静和催眠作用。左旋紫堇达明(l-corydalmine,l-CDL)是l-THP 10位羟基化的产物,研究表明,由于l-CDL电子云密度和结构扭曲度增加,与多巴胺受体的亲和力增大,其镇痛活性显著强于 l-THP[2],且镇静催眠作用较弱。由于l-CDL属于中药中的微量成分,自然来源十分有限。与大多数生物碱一样,l-CDL具有复杂的稠环结构,难以通过化学合成或结构修饰方法获得[3]。
微生物转化(Microbial Conversion),是利用微生物代谢过程中产生的某个或某一系列的酶对底物进行的催化反应[4],与传统的有机反应相比,具有区域选择性高、立体选择性强和反应类型众多等特点,并能完成一些化学方法难以实现的反应[5]。目前微生物转化已成为天然产物结构修饰的重要手段[6],通过先导化合物经微生物转化方法寻找新的高活性、低毒性的药物已成为有效开发新药的一条途径。前期研究表明,Streplomyces griseus ATCC 13273具有生物转化l-THP生成l-CDL的活性,由包括细胞色素P450酶的复杂酶系所催化。对生物转化体系中催化反应的酶或酶系进行诱导可在不增加生产成本的基础上极大提高转化产物的产率[7],为后续的工业放大生产奠定基础。本研究在现有生物转化合成左旋紫堇达明体系的基础上,以苯甲酸、正己烷、苯巴比妥钠为诱导物,通过筛选生物转化体系的诱导剂并优化诱导条件,提高l-CDL的转化产率。
1 材料与方法
1.1 材料
1.1.1 菌种
灰色链霉菌 (Streptomyces griseus ATCC 13273),本研究室保存。
1.1.2 培养基
斜面及平板培养基(g/L):土豆200,磷酸二氢钾3,葡萄糖 20,硫酸镁 0.73,琼脂粉 20,维生素B10.01。
种子及发酵培养基(g/L):玉米粉30,磷酸氢二钾5,豆粕粉7.6,氯化钠5,酵母粉5,硫酸镁0.1,硫酸亚铁 0.1,葡萄糖 1.2。
1.1.3 仪器及试剂
Agilent 1260高效液相色谱仪;SW-CJ-IF超净工作台;LRH-250A生化培养箱;QHZ-DA全温大容量振荡培养箱;左旋四氢巴马汀(成都曼思特生物科技有限公司),左旋紫堇达明(本实验室分离纯化,HPLC检测纯度大于98%)。甲醇为色谱纯,乙酸乙酯,丙酮,正己烷均为分析纯试剂。
1.2 试验方法
1.2.1 菌种活化及液体菌种制备
将保藏的S.griseus ATCC 13273菌种转接于斜面培养基上,28℃活化培养6 d。以活化的斜面菌种转接液体种子培养基,于28℃,180 r/min振荡培养24 h即得液体菌种,发酵转化时以4%接种量转接至发酵培养基相同条件下培养转化。
1.2.2 l-THP 的微生物转化
向加入诱导物的转化体系中加入终浓度为0.4 mg/mL转化底物l-THP(丙酮助溶),28℃,180 r/min转化发酵96 h,HPLC检测l-CDL的转化产率。
1.2.3 诱导剂的筛选及诱导条件的优化
诱导剂的筛选:液体菌种转接至发酵培养基,28℃,180 r/min摇床培养10 h,分别加入苯甲酸或正己烷作为诱导物诱导培养6 h后加入l-THP,水溶性苯巴比妥钠于转接发酵培养基时加入。相同条件不加诱导物的转化体系为对照。比较各组l-CDL的转化产率,筛选转化体系的诱导剂。
诱导条件的优化:以单因素试验方法,对影响诱导效果的诱导剂浓度、诱导剂诱导时间进行优化。
1.2.4 l-CDL 转化产率测定
发酵液以等体积乙酸乙酯萃取3次,合并萃取液并减压浓缩至干,残渣用色谱甲醇溶解定容至20 mL,微孔滤膜过滤即得HPLC分析样品。HPLC分析条件为色谱柱:Hedera C18;流动相:0.6%乙酸水溶液(含0.06%三乙胺)-乙腈(77∶23);流速:1 mL/min;检测波长:281 nm;柱温:28℃;进样量:15 μL。
2 结果
2.1 转化体系诱导剂的筛选
参考相关文献[8],选择苯甲酸、正己烷、苯巴比妥钠为l-CDL转化体系诱导物,考察其对l-CDL转化产率的影响。结果(表1)显示:苯甲酸、正己烷、苯巴比妥钠均能显著提高l-CDL的转化产率,表明所选诱导物对S.griseus ATCC 13273转化合成l-CDL的转化活性均有诱导作用。

表1 三种诱导物对S.griseus ATCC 13273转化合成l-CDL产率的影响
2.2 诱导条件的优化
2.2.1 苯甲酸作为诱导剂诱导条件优化
苯甲酸类物质是芳香族化合物代谢中最常见的中间产物。在微生物中,由细胞色素P450酶催化的羟基化反应是苯甲酸的主要降解途径之一,苯甲酸对相应的细胞色素P450酶也有明显的诱导作用[9]。
2.2.1.1 苯甲酸浓度对转化体系诱导作用的影响
液体菌种转接转化发酵培养基,28℃,180 r/min培养10 h后,分别加入苯甲酸使其终浓度为1,2,3 mmol/L,按诱导剂优化方法进行 l- THP 转化,HPLC检测。结果(表2)显示:转化发酵培养基中苯甲酸终浓度为2 mmol/L时l-CDL的转化产率达到69.71%,对转化体系生物转化合成l-CDL活性诱导作用最强。

表2 苯甲酸对浓度S.griseus ATCC 13273转化合成l-CDL产率的影响
2.2.1.2 苯甲酸诱导时间对转化体系诱导作用的影响
液体菌种转接转化发酵培养基,28℃,180 r/min培养10 h后,加入终浓度为2 mmol/L苯甲酸,分别诱导培养6、9、12 h后进行l-THP生物转化。结果(表3)显示:2 mmol/L苯甲酸诱导培养9 h,转化体系具有最高转化能力,l-CDL转化产率达到79.57%。

表3 苯甲酸诱导时间对S.griseus ATCC 13273转化合成l-CDL转化产率的影响
2.2.2 正己烷作为诱导剂诱导条件优化
正己烷对多种微生物的细胞色素P450酶都有明显的诱导作用,而且诱导产生的细胞色素P450酶具有多样的功能,因而被称作细胞色素P450酶的多功能诱导剂。
2.2.2.1 正己烷浓度对转化体系诱导作用的影响
液体菌种转接转化发酵培养基,28℃,180 r/min培养10h后,分别加入 1,2,3 μL/(mL·h)的正己烷,按诱导剂优化方法进行l-THP转化,HPLC检测。结果(表4)显示:加入正己烷2μL/(mL·h)时l-CDL的转化产率达到62.86%,对转化体系生物转化合成l-CDL活性诱导作用最强。

表4 正己烷浓度对S.griseus ATCC 13273转化合成l-CDL转化产率的影响
2.2.2.2 正己烷诱导时间对转化体系诱导作用的影响
液体菌种转接转化发酵培养基,28℃,180 r/min培养10 h后,加入2μL/(mL·h)正己烷,分别诱导培养6、9、12 h后进行l-THP生物转化。结果(见表5)显示:加入2μL/(mL·h)的正己烷,诱导培养9 h,转化体系具有最高转化能力,l-CDL转化产率达到69.84%。

表5 正己烷诱导时间对S.griseus ATCC 13273转化合成l-CDL转化产率的影响
2.2.3 苯巴比妥钠作为诱导剂诱导条件优化
苯巴比妥钠是典型的、最先发现的细胞色素P450酶的诱导剂,在微生物细胞色素P450酶活性调控中常被采用[10]。
2.2.3.1 苯巴比妥钠浓度对转化体系诱导作用的影响
液体菌种转接发酵培养基的同时,分别加入苯巴比妥钠使其终浓度为 0.15,0.75,1.50 mmol/L,按诱导剂优化方法进行l-THP转化,HPLC检测。结果(表6)显示:转化发酵培养基中苯巴比妥钠终浓度为1.5 mmol/L时 l-CDL的转化产率达到66.12%,对转化体系生物转化合成l-CDL活性诱导作用最强。
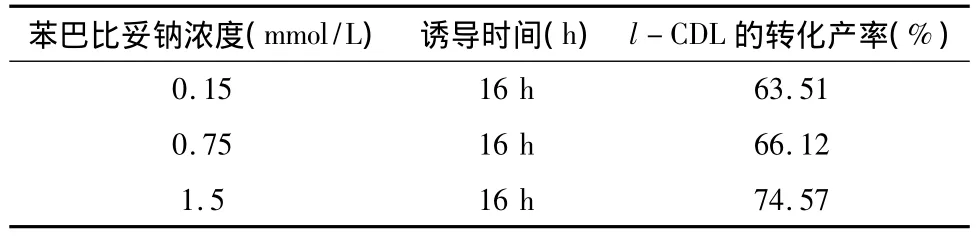
表6 苯巴比妥钠浓度对S.griseus ATCC 13273转化合成l-CDL转化产率的影响
2.2.3.2 苯巴比妥钠诱导时间对转化体系诱导作用的影响
液体菌种转接转化发酵培养基的同时,加入终浓度为1.5 mmol/L的苯巴比妥钠,分别诱导培养12、16、20 h后进行 l-THP生物转化。结果(见表7)显示:1.5 mmol/L苯巴比妥钠诱导培养16 h,转化体系具有最高转化能力,l-CDL转化产率达到74.57%。

表7 苯巴比妥钠诱导时间对S.griseus ATCC 13273转化合成l-CDL转化产率的影响
3 讨论
近年来,微生物转化技术已经广泛用于中药活性成分的结构修饰以及药物先导化合物的发现[11],在中药研究的多个领域发挥了重要作用。研究表明,S.griseus ATCC 13273转化合成l-CDL是由包括细胞色素P450酶的复杂酶系所催化,转化体系的催化活性的提高可在不增加成本的条件下极大提高转化产物的产率。本研究以l-CDL转化产率为指标,比较苯甲酸、正己烷、苯巴比妥钠对转化合成l-CDL活性的影响并优化其诱导条件,显著的提高了l-CDL的转化产率,为其后续的放大发酵奠定了基础。
从来源广泛,不影响产物分离考虑,优选正己烷为生物转化合成l-CDL的合适诱导剂。同时正己烷对转化底物l-THP具有良好的溶解性,在转化体系中可同时起到转化活性诱导及底物助溶的作用。
[1] 张文伟,余伯阳,彭娟.左旋四氢巴马亭生物转化为左旋紫堇达明的研究[J].药物生物技术,2003,10(3):165.
[2] 余伯阳.中药生物技术[M].北京:中国医药科技出版社,2005:274.
[3] 徐田,刘吉华,余伯阳.微生物转化左旋四氢巴马汀产生左旋紫堇达明高产菌株的紫外诱变选育[J].药物生物技术,2011,18(4):313-316.
[4] 杨若林,郑桂兰,张荣庆.黄柏酮微生物转化研究[J].中草药,2007,38(10):1471 -1472.
[5] Haq N B,Rasheed A K.Biological transformations of steroidal compounds:A review[J].Steroids,2012,77(12):1267 -1290.
[6] Lirui Q,Dan X,Jungui D,et al.Microbial transformation of lovastatin by Beauveria bassiana[J].Acta Pharmaceutica Sinica B,2012,2(3):300 -305.
[7] 吕斯琦,马琳,孙静,等.中药微生物转化的现状及前景[J].药物评价研究,2010,33(6):447 -451.
[8] 宁大亮.白腐真菌细胞色素P450转化难降解有机物的功能研究[D].北京:清华大学,2008.
[9] Fumiko M,Hiroyuki W.Functional diversity of cytochrome P450s of the white-rot fungus Phanerochaete chrysosporium[J].Biochemical and Biophysical Research Communications,2004,324(1):387-393.
[10] Sueyoshi T,Negishi M.Phenobarbital response elements of cytochrome P450 genes and nuclear receptors[J].Annu Rev Pharmacol Toxicol,2001,41:123 -143.
[11] 高宁,程玉鹏,毕珊珊,等.微生物转化在中药活性成分研究中的应用[J].中医药信息,2011,28(5):18 -20.
