荒漠区植物光合器官解剖结构对水分利用效率的指示作用
2013-12-08张海娜苏培玺李善家周紫鹃解婷婷赵庆芳
张海娜,苏培玺,李善家,周紫鹃,解婷婷,赵庆芳
(1. 中国科学院寒区旱区环境与工程研究所 临泽内陆河流域研究站,兰州 730000;2. 中国科学院寒旱区陆面过程与气候变化重点实验室,兰州 730000;3. 西北师范大学 生命科学学院,兰州 730070)
荒漠区植物光合器官解剖结构对水分利用效率的指示作用
张海娜1,2,苏培玺2,*,李善家1,2,周紫鹃1,2,解婷婷1,赵庆芳3
(1. 中国科学院寒区旱区环境与工程研究所 临泽内陆河流域研究站,兰州 730000;2. 中国科学院寒旱区陆面过程与气候变化重点实验室,兰州 730000;3. 西北师范大学 生命科学学院,兰州 730070)
植物生理功能的发挥以结构为基础,因此,植物光合器官(叶片或同化枝)解剖结构会对水分利用效率(WUE)有一定的指示作用。通过对黑河流域优势种灌木光合器官的解剖特征和表征WUE的稳定碳同位素比率(δ13C)进行分析,试图从解剖结构的角度为荒漠植物WUE寻求一个有效的指示指标。结果显示:(1)除花棒外,轴状光合器官植物的δ13C值均高于叶状。(2)不同荒漠植物光合器官及不同组织厚度变化范围较广,叶厚度(Tl)或轴直径(Da)、角质层厚度(Tc)、表皮厚度(Te)、栅栏组织厚度(Tp)、海绵组织厚度(Ts)、贮水组织厚度(Ta)的最大值分别约为最小值的6.9、5.8、11、4、3.5和3.5倍。荒漠区多数轴状光合器官植物的Da以及Te高于叶状。(3)所研究优势种灌木的δ13C值与Tl或Da之间存在极显著的正相关关系(r=0.719,Plt;0.01),与不同组织厚度(Tc、Te、Tp、Ts和Ta)之间相关性不显著。由此可知,从植物光合器官的解剖结构来看,荒漠区植物的WUE可以用Tl或Da来表征,叶片越厚,越有利于植物高效利用水分,且轴状光合器官植物的WUE高于叶状。
荒漠植物;解剖结构;长期水分利用效率;稳定碳同位素比率
在干旱区内陆河流域,水分亏缺是影响植物生长发育的关键因子[1- 3],为了适应干旱环境,荒漠区植物尽最大可能改变自身的形态特征,如叶片退化为同化枝,气孔下陷,角质层加厚、栅栏组织发达、海绵组织退化等,以此来抵抗干旱胁迫对植物的不利影响。目前关于叶片解剖结构与抗旱性及生态可塑性方面的研究已有很多[2,4- 6],并从叶片结构的角度对旱生植物进行了分类,说明旱生植物生态适应的多样性及演化趋势[7]。可见,叶片作为植物进化过程中对环境变化敏感且可塑性强的器官,其结构特征最能体现植物对环境的耐旱性[8]。
同样,水分利用效率也是反映植物耐旱性的有效指标,显示了植物有效利用水分的能力,即在相同条件下,水分利用效率高的植物其抗旱能力和对干旱的适应性也强[9]。Cowan等[10]认为,植物对干旱环境的适应有利于提高水分利用效率。植物的水分利用效率按时间尺度的不同,分瞬时和长期水分利用效率,其中,长期水分利用效率(WUE)反映了植物对环境的长期适应状况,其最有效的研究方法是碳同位素法,用于探讨植物与环境因子之间的关系[11- 12]。但由于δ13C值较高的测试成本[13- 14]和技术要求[15- 16],使其应用受到限制。许多研究者为此寻求了δ13C值的替代指标:灰分含量[17- 18],K,S浓度[16,19],N浓度[20]以及比叶重(SLM)[21- 22],用于研究植物叶片的WUE。
作为对环境长期适应的结果,荒漠区植物光合器官的δ13C值综合反映了其生活史[23],与其长期受环境影响形成的结构特征之间必然存在一定的相关性。δ13C值受植物光合作用中碳分馏的影响[24],而植物叶片的内部结构也制约了CO2在叶肉组织中的扩散和分馏,进而影响δ13C值[24]。但是,关于植物叶片解剖结构与δ13C值关系的研究鲜见报道。容丽[25]等研究了喀斯特峡谷石漠化区6种常见植物叶片解剖结构与δ13C值的相关性,但仅是说明植物叶片解剖结构的种间差异及影响不同植物δ13C值的结构主导因子,并没有为δ13C值寻求一个结构上的替代指标来表征WUE。
由于荒漠区的植物长期受到严酷环境的影响,比如干旱、强光、盐碱等胁迫,不同植物的光合器官在形态和解剖结构上存在较大差异[7],因此本文试图通过对荒漠区几种优势种灌木光合器官解剖结构特征与δ13C值的关系进行分析,来探讨植物在长期适应环境中所形成的结构特征对δ13C值的影响以及相互间的关系,进而从解剖结构的角度为荒漠区植物的WUE寻求有效的表征指标。
1 研究区概况
研究区位于内陆河黑河流域中游,属于中温带干旱荒漠区,多年平均降水量116.8 mm,年潜在蒸发量2110 mm,蒸发量是降雨量的近20倍[3];年均温7.6 ℃,最高气温39.1 ℃,最低气温-27 ℃,干旱、高温和多风是其主要气候特点。地带性土壤为灰棕荒漠土[3]。主要植被有灌木,如梭梭(Haloxylonammodendron)、沙拐枣(Calligonummongolicum)、泡泡刺(Nitrariasphaerocarpa)、花棒(Hedysarumscoparium)、柽柳(Tamarixgansuensis)、柠条(Caraganakorshinskii)、籽蒿(Artemisiaarenaria)、红砂(Reaumuriasoongorica)、紫菀木(Asterothamnusalyssoides)、荒漠锦鸡儿(Caraganaroborovskyi)、合头草(Sympegmaregelii)、骆驼刺(Alhagisparsifolia)等和一些草本植物,如雾冰藜(Bassiadasyphylla)、草麻黄(Ephedrasinica)、沙米(Agriophyllumsquarrosum)等。
2 研究方法
2.1 样品采集
2011年7月下旬,在黑河流域中游地区选取当地长势良好的优势灌木(表1),采取植物的主要光合器官,其中,梭梭和沙拐枣叶片退化,采集当年生同化枝中段;花棒有小叶和退化的叶轴,只采集叶轴;红砂采集短圆柱形肉质叶;珍珠和黄毛头采集锥形或三角形肉质叶;柽柳的叶在老枝发出的嫩枝上稍张开,形成半包茎叶,采样时将嫩枝和鳞片状小叶一起采集,其它植物采集中上部的成熟叶片。每种植物采集3—4株,在植株中部的向阳处采集,用锋利的小刀片切成5 mm左右,迅速放入装有FAA固定液的样品瓶,固定样品,带回实验室进行解剖特征显微观测。同时随机摘取植株相同部位各个方向的叶片或同化枝,装入信封,带回实验室,105 ℃杀青30 min后,在80 ℃烘至恒重,粉碎后用于测定δ13C。取样大约在11:00完成。
2.2 常规石蜡切片法
参照李正理植物制片技术[26]。取固定好(24 h以上)的植物叶和同化枝,用梯度酒精脱水、透明、浸蜡、包埋,切片机切片(厚度8 μm),番红-固绿对染,即用1%的番红(Safranin)水溶液浸泡12 h,再用0.5%固绿(Fast-green)染色,二甲苯透明,中性树胶封片[27],Olympus 显微镜下观察,选择有代表性的石蜡切片拍照,记录叶片和同化枝的横切面特征,并用ImageJ软件测量叶厚度、同化枝直径、角质层厚度、表皮厚度、栅栏组织厚度、海绵组织厚度、贮水组织厚度等指标,每个观察记录15个视野,计算平均值。
2.3植物光合器官δ13C的测定
烘干粉碎后的植物样品编号封存于塑料袋内。在中国科学院寒区旱区环境与工程研究所质谱分析室,采用MAT- 251质谱分析仪测定植物样品稳定碳同位素比率(13C/12C),并采用下列公式计算δ13C判别值:
δ13C(‰)=(R样品/R标准-1)×1000‰
式中,R样品和R标准分别表示样品和标样的碳同位素比值,结果以PDB为标准表示。δ13C值越大,水分利用效率越高[28- 29]。
2.4 数据分析
用Excel对数据进行处理,统计分析软件SPSS13.0进行方差分析、相关分析以及逐步回归分析,多重比较采用最小显著极差法。
3 结果与分析
3.1荒漠区植物光合器官δ13C值的比较
在黑河流域中游荒漠区,选取了14种优势植物,依据光合器官横截面的形状将这14种植物分为叶状和轴状两大类。叶状为叶片厚度远小于长或宽,呈片状;轴状为叶片厚度与长或宽相近,无法区分,包括同化枝、叶轴、圆柱形叶等。图1为这两种横截面光合器官各组织结构示意图。这些植物分别属于6科,其中藜科4种,豆科4种,菊科和柽柳科各2种,蒺藜科和蓼科各1种。这14种植物的生活型属于灌木或半灌木类(梭梭有的为乔木状,本研究采样为灌木状)。
就δ13C值来说,梭梭、珍珠、沙拐枣的δ13C值分别为-17.08‰,-17.38‰,-15.99‰,属于C4植物,其余11种多年生的灌木或半灌木属于C3植物(C3植物的δ13C值在-23‰—-32‰之间,C4植物在-6‰—-19‰的范围内[3])。除花棒外,轴状光合器官植物的δ13C值均高于叶状,说明轴状光合器官具有较高的WUE,对荒漠环境有更强的适应性(表1)。

图1 荒漠植物不同横截面各组织结构示意图(以荒漠锦鸡儿和合头草解剖图为例)Fig.1 Sketch map of different cross sections about various tissues of desert plants C. roborovskyi and S. regeliiTl:叶状光合器官厚度,简称叶厚度; Da:轴状光合器官直径,简称轴直径; Te:表皮厚度;Tp:栅栏组织; Tue:上表皮厚度;Tle:下表皮厚度;Ts:海绵组织厚度;Ta:贮水组织厚度
Table1TheplantspeciesinthemiddlereachesofHeiheRiverbasinandstablecarbonisotoperatio(δ13C)ofleavesorassimilatingshoots
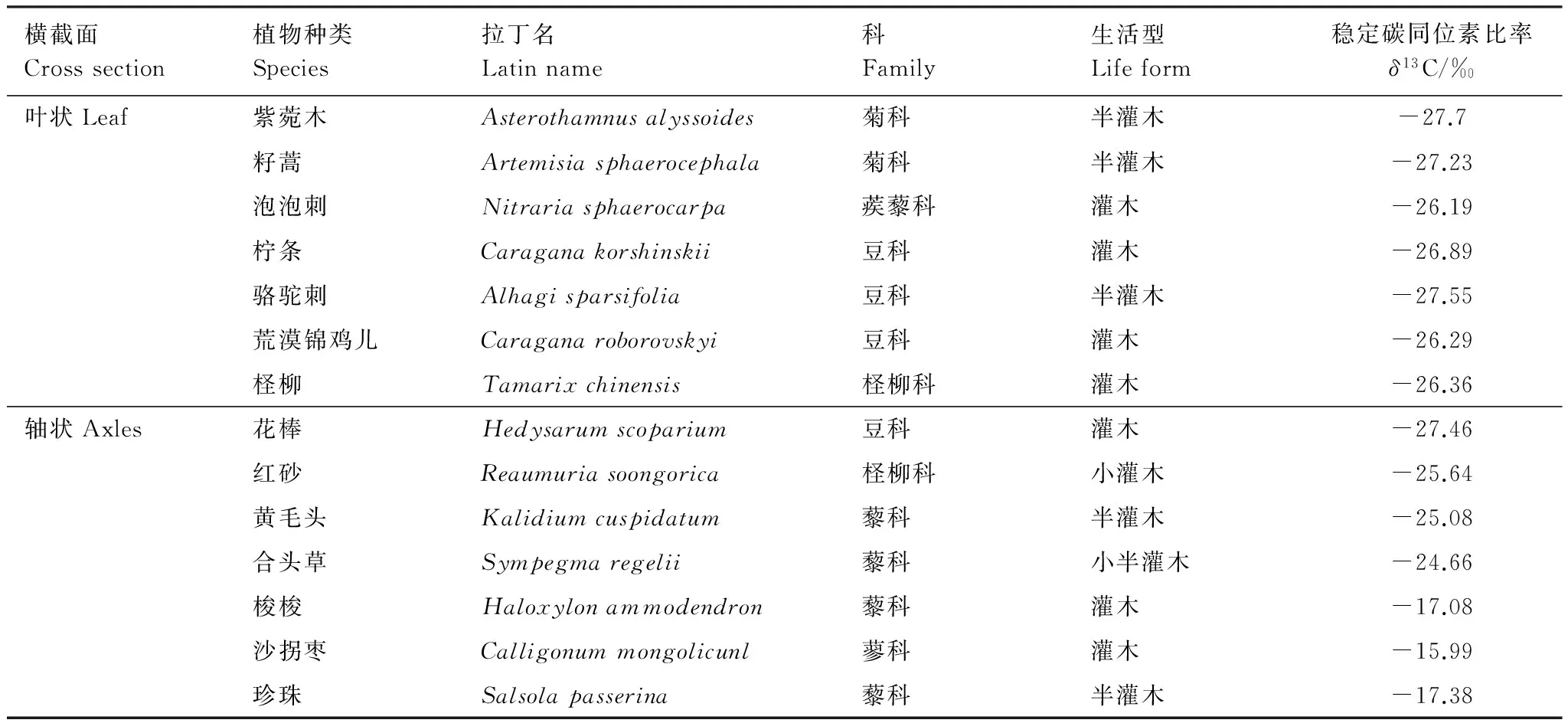
横截面Crosssection植物种类Species拉丁名Latinname科Family生活型Lifeform稳定碳同位素比率δ13C/‰叶状Leaf紫菀木Asterothamnusalyssoides菊科半灌木-27.7籽蒿Artemisiasphaerocephala菊科半灌木-27.23泡泡刺Nitrariasphaerocarpa蒺藜科灌木-26.19柠条Caraganakorshinskii豆科灌木-26.89骆驼刺Alhagisparsifolia豆科半灌木-27.55荒漠锦鸡儿Caraganaroborovskyi豆科灌木-26.29柽柳Tamarixchinensis柽柳科灌木-26.36轴状Axles花棒Hedysarumscoparium豆科灌木-27.46红砂Reaumuriasoongorica柽柳科小灌木-25.64黄毛头Kalidiumcuspidatum藜科半灌木-25.08合头草Sympegmaregelii藜科小半灌木-24.66梭梭Haloxylonammodendron藜科灌木-17.08沙拐枣Calligonummongolicunl蓼科灌木-15.99珍珠Salsolapasserina藜科半灌木-17.38
植物种类中斜体表示C4植物,其余为C3植物
3.2 荒漠区植物光合器官解剖结构差异
植物的光合器官完全暴露于空气中,对环境变化最为敏感,其形态结构产生了一定的适应性,尤其荒漠区的植物,常常形成不同于非旱区植物的特殊结构和功能,且不同种群间结构特征存在差异(表2)。结构是功能的基础,荒漠区植物光合器官各组织结构的差异引起功能的差异,进而影响植物的抗旱性和WUE。
整体来说,不同植物光合器官(叶片或同化枝)的厚度变化范围很大,从230.97—1587.64 μm,不同种之间差异显著。大多数轴状光合器官植物的Da高于叶状植物的TI。
从局部来看,荒漠区植物光合器官各组织厚度及其在整个组织中所占比例也不相同。
角质层的主要功能是减少水分散失,是植物水分蒸发的屏障。在荒漠区所研究的植物中,角质层厚度变化范围为0.96—5.59 μm,红砂最厚,在其叶片中所占比例最高,籽蒿次之。
表皮细胞具有保水作用,有利于增强植物的水分调节能力。所研究植物的Te变化范围较广,7.19—79.07 μm,最大值为最小值的11倍左右,Re的变化幅度为1.7%—11.81%,说明不同种荒漠植物在适应环境的过程中,表皮细胞的保水能力各不相同,黄毛头最高,沙拐枣次之。此外,轴状光合器官植物的Te范围大多在19—80μm之间,而叶状光合器官的Te小于16μm,普遍低于轴状光合器官。
干旱区植物的叶肉组织向着提高光合效能的方向发展,其中栅栏组织、海绵组织特征最能反映植物对光照的适应[25],贮水组织主要起渗透调节作用。在叶状光合器官中,栅栏组织为正常型或全栅型,如柠条、荒漠锦鸡儿、骆驼刺等为正常型,紫菀木为全栅型;轴状光合器官的栅栏组织多属于环栅型,是植物适应干旱环境的高级形式[30],如梭梭、沙拐枣、珍珠等。
如表2所示,Tp的变化范围是41.25—166.50 μm,Rp为6.64%—55.22%,其中C3和C4植物Tp的变化范围分别为59.35—166.50μm和41.25—60.18μm,Rp的大致范围分别为22.97%—55.22%和6.64%—12.28%,由此可见,大多数C3植物中Tp和Rp高于C4植物。海绵组织在某些植物中退化,尤其在多数轴状光合器官的植物中没有海绵组织的分化,如梭梭、花棒、沙拐枣、珍珠等;黄毛头与合头草的Ts分别为178.24μm和144.64μm,在所研究植物中居于前两位,但在整个叶肉组织中分布的区域远远小于栅栏组织(图1),处于退化状态,有被栅栏组织代替的趋势。较之叶状光合器官,轴状光合器官中有贮水组织分化,Ra高达58.16%,远远超过栅栏组织,部分轴状光合器官植物的贮水组织中有粘液细胞和含晶细胞分布,如沙拐枣、红砂、珍珠等(图未给出)。
3.3荒漠区植物光合器官解剖结构特征与δ13C值
指示植物长期水分利用效率的δ13C值主要受CO2扩散和分馏的影响[23- 24],在自然界中,植物的光合作用是产生碳同位素分馏的重要过程,而这个过程受到植物内部结构的影响,也就是说,解剖结构通过对叶片内部CO2导度的影响从而影响到植物的δ13C值[19]。具体来说,栅栏组织和海绵组织特征最能反映植物对光能的适应。栅栏组织发达,多层,排列紧密,大量的叶绿素促进光合作用,对叶肉中CO2的竞争增强,使CO2供应不足,同时,这种结构的遮荫效应以及阻碍CO2扩散的效应均会减弱植物的光合作用[31- 32],相反,栅栏组织中一定距离的范围内存在大的胞间隙,会更利于CO2的扩散和对光能的利用,海绵组织的分化也有利于CO2扩散。
此外,在水分极度贫乏的环境中,荒漠区植物的结构在保持水分和限制水分散失方面也有重要作用。叶片、表皮越厚,越利于保存体内水分,厚角质层限制了水分蒸腾和防止过强光照对内部结构的灼伤;贮水组织为周围细胞提供湿润的小环境,通过渗透调节保证生理代谢的正常进行,同时透明状的贮水组织减弱植物内部的遮光效应,增加光能利用率,此组织在轴状光合器官中普遍存在。
3.4荒漠区植物光合器官解剖特征与δ13C值的相关性分析
荒漠区植物各组织结构对δ13C值的影响程度不同,且各组织特征的变化也不同步。本研究通过6个最能代表光照和水分利用的解剖指标与δ13C值的相关关系进行了初步分析,从解剖结构的角度为荒漠区植物的水分利用效率寻求有效的表征指标(表3)。
荒漠区植物各组织结构之间以及与δ13C值的相关分析结果表明:δ13C值与TI或Da有着极显著的正相关关系,回归分析,可得:y=0.007x-29.056(r=0.719,Plt;0.01),同时,与植物的Tc,Te和Ts正相关,与Tp、Ta负相关,但相关性不显著。在植物的各组织之间,TI或Da与Te、Ts、Ta正相关,与Tc和Tp负相关,说明在影响δ13C值的因子上,具有相同功能的结构之间具有一致性。此外,Tc与Ta之间存在显著的负相关关系(r=-0.819,Plt;0.05),说明储水组织发达的植物,其减少水分流失的功能相对较弱。
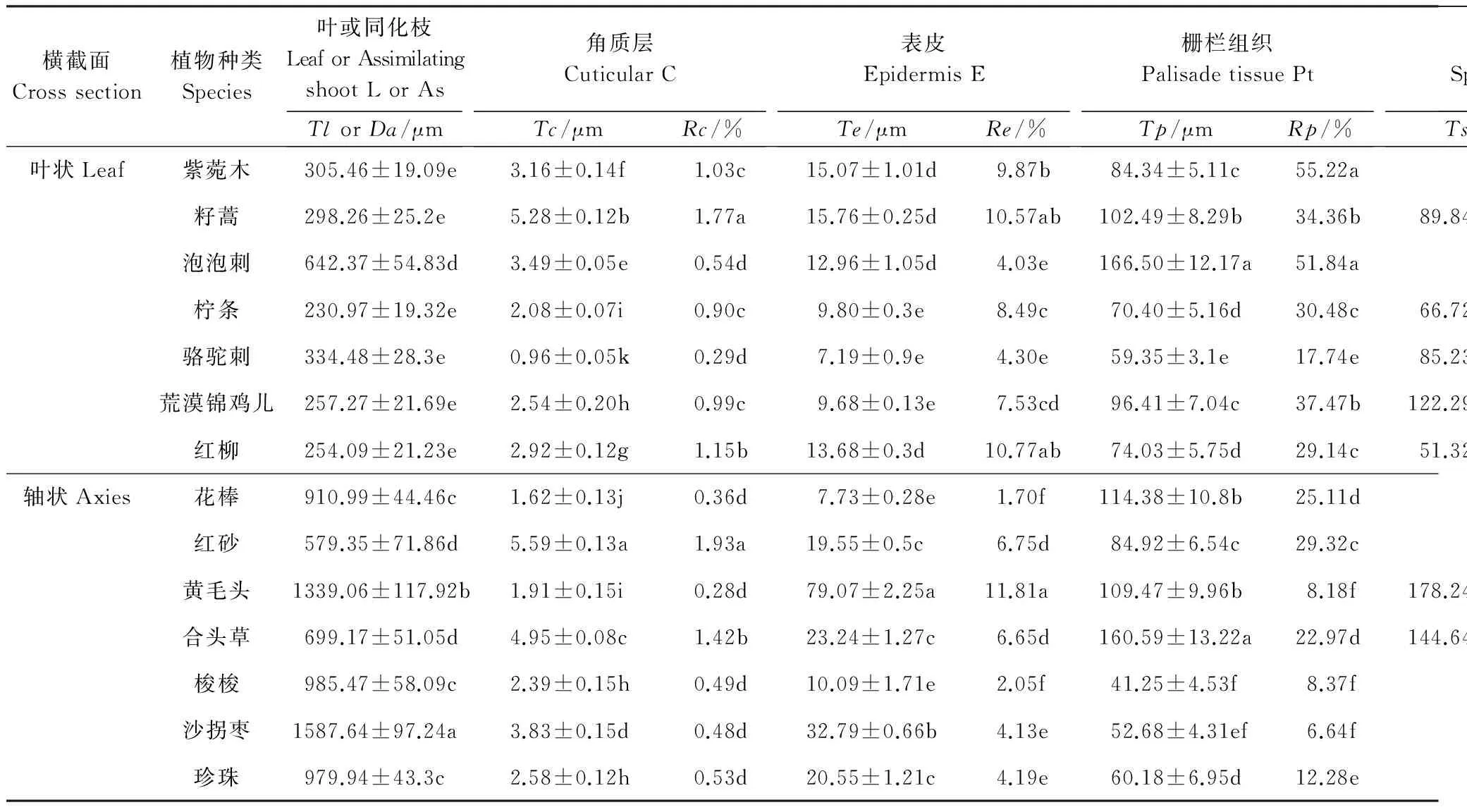
表2 荒漠植物光合器官不同组织的数量特征
植物种类中斜体表示C4植物,其余为C3植物; 表中数据是平均值±标准差; 不同组织厚度用T表示,叶厚度和轴直径分别用Tl和Da表示,各比值用R表示; L:Leaf; As: Assimilating shoot; C: Cuticular; E:Epidermis; Pt: Palisade tissue; St: Spongy tissue; At: Aqueous tissue; 同列不同字母表示差异显著,Plt;0.05
荒漠区植物不同组织厚度在整个光合器官中所占的比例与δ13C值之间的相关性分析可知:δ13C值与各组织比例之间存在不同程度的负相关关系,但与Rp呈极显著负相关(r=-0.638,Plt;0.01),与其它各组织比值之间关系不显著。

表3 荒漠区植物光合器官δ13C值与各组织结构的相关关系
左下角表示荒漠植物各组织厚度与δ13C值的相关系数,右上角黑体表示各组织比例与δ13C值的相关系数; *表示差异显著,Plt;0.05;**表示差异极显著,Plt;0.01
4 结论与讨论
水是干旱区植物生长的限制性因素,光合器官作为植物对环境变化较为敏感的部位,对可利用的水资源具有生理调节作用[33],并沿着有利于提高水分利用效率的方向发展,而植物这种功能的发挥以光合器官的结构为基础。干旱条件下,叶片解剖结构的改变能够通过气孔下腔定位羧基组成转变CO2导度[34],从而引起植物碳同位素分馏差异。可见,植物光合器官结构通过对光合速率的影响直接影响到δ13C值以及长期水分利用效率。
叶片厚度 整个叶片厚度或同化枝直径增加直接影响了水分散失速率,而且单位叶面积内叶肉组织的表面积增大,营养物质和光合系统也越丰富[35- 37],使水分得到高效利用。有研究表明,单位叶面积的干物质量(SLM)作为叶片光合能力和δ13C值的有效指示器[38],与叶片厚度和WUE存在正相关关系[21- 22]。容丽[25]等关于喀斯特峡谷石漠化区6种常见植物的解剖结构与δ13C值关系的研究表明:δ13C值与叶片厚度有着最为统一的正相关关系。本文所研究植物的叶片厚度变化范围很大,从230.97—1587.64 μm,不同种植物的差异显著,与δ13C值呈显著正相关,因此,可以将TI或Da作为植物水分利用效率的指示值,叶片越厚,WUE越高。
表皮特征 植物表皮与外界环境有着直接联系,表现植物对光照和空气环境的适应,角质层特征表现植物的水分蒸腾,相关性分析表明,Tc和Te与δ13C值正相关(表3),且Te的相关性较高。对所研究的C3植物来说,黄毛头和合头草的表皮厚度大于红砂,而角质层厚度低于红砂,但是δ13C值的大小与表皮厚度一致,这也说明了Te对δ13C值的影响高于角质层。这可能是由于叶片的表皮厚度与植物的吸水组织根系有关的缘故,根系较浅,水分吸收能力弱, 需要通过加厚叶片表皮来减少水分蒸腾,使叶肉细胞保持更多水分来维持高的渗透势,反之,根系发达,水分吸收和传输能力较强,防止水分蒸腾不是关键,因此不只是通过增加表皮厚度来保持水分[39]。本研究中,根系较深的灌木,如柠条[40]、荒漠锦鸡儿、骆驼刺、花棒等的表皮细胞相对较薄,而根系相对较浅的合头草、黄毛头[41],表皮细胞较大,需要更强的保水能力,在水分缺乏的荒漠区,更需要提高水分利用效率,其δ13C值较深根系的上述4种C3植物高。
叶肉特征 荒漠植物的叶肉组织向着提高光合效能的方向发展,高度发达的栅栏组织既可避免强光对叶肉细胞的灼伤,又可以有效利用衍射光进行光合作用[42- 43]。也就是说,栅栏组织越厚,细胞越小,排列越紧密,则植物利用光能的效率越高[44],但是光合作用加强的同时会加剧对叶肉细胞中CO2的竞争,使CO2供应不足,而且高度发达的栅栏组织会产生荫蔽效应并阻碍叶肉中CO2的横向扩散,光合作用受到限制[31]。不仅如此,Thoday[45]认为水分通过栅栏组织向表皮运输要比通过海绵组织多。由此推论,植物中栅栏组织越厚,在叶片中所占比例越大,反而会增加水分散失。本文中δ13C值与Tp或Rp呈负相关关系,说明荒漠植物的栅栏组织对CO2的扩散和分馏、荫蔽效应、水分散失方面的影响高于对光能的高效利用,可能是由于荒漠区光照强烈,植物通过荫蔽效应和散失水分来减弱光照对植物组织的灼伤,是荒漠区植物的一种防护对策。较之这种防护对策,提高水分利用效率的需求相对较弱。具有较高水分利用效率的C4植物,如珍珠、梭梭、沙拐枣等,它们的栅栏组织厚度较小,维管束鞘细胞形成的花环结构将CO2聚集在占有较小比例的栅栏组织中,有利于光合作用中CO2的分馏,δ13C值较高。
相对栅栏组织,海绵组织对植物光合作用和水分利用效率的提高有着积极的作用。疏松多孔的海绵组织有利于CO2的扩散和运输以及分馏[31],有利于提高WUE。本研究的相关性分析表明,δ13C值与Ts正相关(表3),与Mediavilla[31]关于叶片内部结构与光合资源利用率关系的研究结果一致,增加叶片内部组织胞间隙有利于提高WUE。
具有贮水组织的荒漠植物具有较高的抗旱能力,主要是由于贮水组织的水势较栅栏组织以及表皮细胞高,当植物受到干旱胁迫时,贮水组织向栅栏组织等提供水分,使叶肉细胞维持一定的渗透压,维持正常代谢[46],由此可见,贮水组织对植物叶片的渗透调节有着重要作用。此外,贮水组织除了阻碍CO2扩散外,还会溶解部分的CO2,减小叶片细胞间隙CO2浓度,δ13C值增加,这与δ13C值同Ci/Ca比值呈线性相关(Ci是叶片细胞间隙的CO2浓度,Ca是空气浓度)[23- 24]的结果一致。本研究中,轴状光合器官的植物有贮水组织的分化,其在整个光合器官中所占比例高达58.16%,在这7种植物中,除花棒外,其它6种轴状光合器官植物的δ13C值均高于叶状植物(表1),说明贮水组织有利于提高植物的WUE。
关于荒漠植物的抗旱性,黄振英[30]等指出,旱生叶片的结构向着栅栏组织发达,发展贮水组织以及叶片退化等方向发展。本研究结果与此不一致,Tp与δ13C值负相关,不利于水分利用效率的提高,说明荒漠植物对水分的高效利用和抗旱性在结构上的响应存在分歧,高的水分利用效率只是植物适应干旱的机制之一[47]。海绵组织退化,贮水组织在植物光合器官中的比例增大,充分体现了植物渗透调节的重要性。
综上所述,荒漠区植物内部多样的结构都说明了其环境适应性以及对WUE的影响,其中,δ13C值与叶片厚度或同化枝直径有着极显著的相关关系,可以作为WUE的形态表征指标。
[1] Klich M G. Leaf variations inElaeagnusangustifoliarelated to environmental heterogeneity. Environmental and Experimental Botany, 2000, 44(3): 171- 183.
[2] Li L Z, Shao L H, Yu Y W, Chen J G, Zhang D G. Study on leaf dissection structure and drought resistance of four shrubs growing in desert steppe in Tsaidam. Grassland and Turf, 2009, (3): 20- 23.
[3] Su P X, Yan Q D. Stable carbon isotope variation in plants and their indicating significances along the inland Heihe River basin of northwestern China. Acta Ecologica Sinica, 2008, 28(4): 1616- 1624.
[4] Li A P, Wang X J, Yang X Y, Zhang L. Evaluation of drought resistance capacity of desert shrubs in Hobq desert based on characteristics of leaf anatomical structure. Journal of Desert Research, 2010, 30(6): 1405- 1410.
[5] Gong W C, Zhuang L, Zhao W Q, Zhan D X, Zhang L. Ecological adaptation of morphological and anatomical structure of photopsynthetic organs ofTamarixramosissimaandHaloxylonammodendron. Journal of Desert Research, 2011, 31(1): 129- 136.
[6] Cai Z Q, Qi X, Cao K F. Response of stomatal characteristics and its plasticity to different light intensities in leaves of seven tropical woody seedlings. Chinese Journal of Applied Ecology, 2004, 15(2): 201- 204.
[7] Wang X L, Ma J. A study on leaf-structure and the diversity of xerophytes ecology adaptation. Acta Ecologica Sinica, 1999, 19(6): 787- 792.
[8] Wang Y L, Wang J. Plant Morphological Structure and Environment. Lanzhou: Lanzhou University Press, 1989: 57- 87.
[9] Richards R A, Rebetzke G J, Condon A G, van Herwaarden A F. Breeding opportunities for increasing the efficiency of water use and crop yield in temperate cereals. Crop Science, 2002, 42(1): 111- 121.
[10] Cowan I R. Regulation of water use in relation to carbon gain in higher plants // Lange O L, Nobel P S, Osmond C B, Ziegler H, eds. Physiological Plant Ecology Ⅱ. Encyclopaedia of Plant Physiology, New Series, vol 12B. Berlin, Heidelberg, New York: Springer, 1982: 589- 613.
[11] Ziegler H. Stable isotopes in plant physiology and ecology // Behnke H D, Lüttge U, Esser K, eds. Progress in Botany, Vol 56. Berlin: Springer-Verlag, 1995: 1- 24.
[12] Su B, Han X G, Li L H, Huang J H, Bai Y F, Qu C M. Responses ofδ13C value and water use efficiency of plant species to environmental gradients along the grassland zone of northeast China transect. Acta Phytoecologica Sinica, 2000, 24(6): 648- 655.
[13] Xie X Q. The research on the crop necessary water, consuming water and water use efficiency of agricultural ecosystem in main kind area in China // Farmland Ecologically Trial Study. Beijing: Weather Press, 1996: 64- 81.
[14] Hall A E, Richards R A, Condon A G, Wright G C, Farquhar G D. Carbon isotope discrimination and plantbreeding. Plant Breeding Reviews, 1994, 12: 81- 113.
[15] Araus J L, Amaro T, Casadesús J, Asbati A, Nachit M M. Relationships between ash content, carbon isotope discrimination and yield in durumwheat. Australian Journal of Plant Physiology, 1998, 25(7): 835- 842.
[16] Tsialtas J T, Kassioumi M, Veresoglou D S. Evaluating leaf ash content and potassium concentration as surrogates of carbon isotope discrimination in grassland species. Journal Agronomy and Crop Science, 2002, 188(3): 168- 175.
[17] Frank A B, Ray I M, Berdahl J D, Karn J F. Carbon isotope discrimination, ash and canopy temperature in three wheatgrass species. Crop Science, 1997, 37(5): 1573- 1576.
[18] Jones L H P, Handreck K A. Studies of silica in the oat plant. Ⅲ. Uptake of silica from soil by the plant. Plant and Soil, 1965, 23(1): 79- 96.
[19] Masle J, Farquhar G D, Wong S C. Transpiration ratio and plant mineral content are related among genotypes of a range of species. Australian Journal of Plant Physiology, 1992, 19(6): 709- 721.
[20] Sparks J P, Ehleringer J R. Leaf carbon isotope discrimination and nitrogen content for riparian trees along elevational transects. Oecologia, 1997, 109(3): 362- 367.
[21] Wright G C, Nageswara Rao R C, Farquhar G D. Water-use efficiency and carbon isotope discrimination in peanut under water deficit conditions. Crop Science, 1994, 34(1): 92- 97.
[22] Brown R H, Byrd G T. Relationships between specific leaf weight and mineral concentration among genotypes. Field Crops Research, 1996, 54(1): 19- 28.
[23] Williams D G, Ehleringer J R. Carbon isotope discrimination and water relations of oak hybrid populations in Southwestern Utah. Western North American Naturalist, 2000, 60(2): 121- 129.
[24] Farquhar G D, Richards R A. Isotopic composition of plant carbon correlates with water use efficiency of wheat genotypes. Australian Journal of Plant Physiology, 1984, 11(6): 539- 552.
[25] Rong L, Wang S J, Du X L, Yu G S. Relationship among leaf anatomical characters and foliarδ13C values of six woody species for Karst Rocky Desertification areas. Scientia Silvae Sinicae, 2008, 44(10): 29- 34.
[26] Li Z L. Plant Slice Technology. 2nd ed. Beijing: Science Press, 1987.
[27] Li Z L, Li R A. Observation on assimilating shoots of nine xerophtes pecies in Gansu. Chinese Bulletin of Botany, 1981, 23(3): 181- 183.
[28] Farquhar G D, Ehleringer J R, Hubik K T. Carbon isotope discrimination and photosynthesis. Annual Review of Plant Physiology and Plant Molecular Biology, 1989, 40(1): 503- 537.
[29] Marshall J D, Zhang J W. Carbon isotope discrimination and water-use efficiency in native plants of the North-Central Rockies. Ecology, 1994, 75(7): 1887- 1895.
[30] Huang Z Y, Wu H, Hu Z H. The structures of 30 species of psammophytes and their adaptation to the sandy desert environment in Xinjiang. Acta Phytoecologica Sinica, 1997, 21(6): 521- 530.
[31] Mediavilla S, Esudero A, Heilmeier H. Internal leaf anatomy and photosynthetic resource-use efficiency: interspecific and intraspecific comparisons. Tree Physiology, 2001, 21(4): 251- 259.
[32] Poorter H, Remkes C, Lambers H. Carbon and nitrogen economy of 24 wild species differing in relative growth rate. Plant Physiology, 1990, 94(2): 621- 627.
[33] Sobrado M A, Ehleringer J R. Leaf carbon isotope ratios from a tropical dry forest in Venezuela. Flora, 1997, 192: 121- 124.
[34] Evans J R, Caemmerrer S V, Setchell B A, Hudson G S. The relationship between CO2transfer conductance and leaf anatomy in transgenic tobacco with a reduced content of Rubisco. Australian Journal of Plant Physiology, 1994, 21(4): 475- 495.
[35] Niinemets U. Components of leaf dry mass per area thickness and density-alter leaf photosynthetic capacity in reverse directions in woody plants. New Phytologist, 1999, 144(1): 35- 47.
[36] Shipley B, Lechowicz M J. The functional coordination of leaf morphology and gase exchange in 40 wetland plant species. Ecoscience, 2000, 7(2): 183- 194.
[37] Slaton M R, Raymond H E, Smith W K. Estimating nearinfrared leaf reflectance from leaf structural characteristics. American Journal of Botany, 2001, 88(2): 278- 284.
[38] Martin B, Thorstenson Y R. Stable carbon isotope composition (δ13C), water use efficiency, and biomass productivity ofLycopersconesculentum,Lycopersconpennellii, and the F1 hybrid. Plant Physiol, 1988, 88(1): 213- 217.
[39] Ma J J, Ji C J, Han M, Zhang T F, Yan X D, Hu D, Zeng H, He J S. Comparative analyses of leaf anatomy of dicotyledonous species in Tibetan and Inner Mongolian grasslands. Life Science, 2012, 55(1): 68- 79.
[40] Fang X W, Wang W P, He X Q, Wang G. A study on vegetative compensatory growth of shrub,Caraganakorshinskii, under different clipping treatments in disturbance environment. Journal of Plant Ecology, 2006, 30(5): 810- 816.
[41] Shi Y J, Wang C L.Kalidiumfoliatum(Pall.) Moq. Journal of Traditional Chinese Veterinary Medicine, 2003, (S1): 142- 144.
[42] Yang S D, Chen G C, Zhang C L, Chen J, Wang X C. Some difference of capacity of osmotic regulation between lanceolate and broad-ovate leaves inPopuluseuphratica. Acta Botanica Boreali-Occidentalia Sinica, 2004, (9): 1583- 1586.
[43] Yang G, Wang C G. Preliminary study on leaf and tem structure of the xerophyte in Lop Nor. Arid Zone Research, 1984, 57(l): 57- 63.
[44] Li F L, BaoW K. Responses of the morphological and anatomical structure of the plant leaf to environment change. Chinese Bulletin of Botany, 2005, 22(S1): 118- 127.
[45] Thoday D. The significance of reduction in the size of leaves. Journal of Ecology, 1931, 19(2): 297- 303.
[46] Liu L, Ren Y. Water metabolism of several psammophyte. Journal of Inner Mongolia Forestry Science and Technology, 2011, 37(3): 8- 12.
[47] Hall A E. Physiological ecology of crops in relation to light, water, and temperature // Carroll C R, Vandermeer J H, Rosset P, eds. Agroecology. New York: Mc Graw Hill Publishing Company, 1990: 191- 233.
参考文献:
[2] 李林芝, 邵麟惠, 于应文, 陈建纲, 张德罡. 柴达木荒漠草原4种灌木叶片解剖结构与其抗旱性的研究. 草原与草坪, 2009, (3): 20- 23.
[3] 苏培玺, 严巧娣. 内陆黑河流域植物稳定碳同位素变化及其指示意义. 生态学报, 2008, 28(4): 1616- 1624.
[4] 李爱平, 王晓江, 杨小玉, 张雷. 库布齐沙漠几种沙生灌木叶解剖结构耐旱特征研究. 中国沙漠, 2010, 30(6): 1405- 1410.
[5] 公维昌, 庄丽, 赵文勤, 占东霞, 张莉. 多枝怪柳与梭梭光合器官形态解剖结构的生态适应性. 中国沙漠, 2011, 31(1): 129- 136.
[6] 蔡志全, 齐欣, 曹坤芳. 七种热带雨林树苗叶片气孔特征及其可塑性对不同光照强度的响应. 应用生态学报, 2004, 15(2): 201- 204.
[7] 王勋陵, 马骥. 从旱生植物叶结构探讨其生态适应的多样性. 生态学报, 1999, 19(6): 787- 792.
[8] 王勋陵, 王静. 植物形态结构与环境. 兰州: 兰州大学出版社, 1989: 57- 87.
[12] 苏波, 韩兴国, 李凌浩, 黄建辉, 白永飞, 渠春梅. 中国东北样带草原区植物δ13C值及水分利用效率对环境梯度的响应. 植物生态学报, 2000, 24(6): 648- 655.
[13] 谢贤群. 我国主要类型地区农业生态系统作物需水、耗水、水分利用效率研究 // 农田生态试验研究. 北京: 气象出版社, 1996: 64- 81.
[25] 容丽, 王世杰, 杜雪莲, 俞国松. 喀斯特峡谷石漠化区6种常见植物叶片解剖结构与δ13C值的相关性. 林业科学, 2008, 44(10): 29- 34.
[26] 李正理. 植物制片技术 (第二版). 北京: 科学出版社, 1987.
[27] 李正理, 李荣敖. 我国甘肃九种旱生植物同化枝的解剖观察. 植物学报, 1981, 23(3): 181- 183.
[30] 黄振英, 吴鸿, 胡正海. 30种新疆沙生植物的结构及其对沙漠环境的适应. 植物生态学报, 1997, 21(6): 521- 530.
[40] 方向文, 王万鹏, 何小琴, 王刚. 扰动环境中不同刈割方式对柠条营养生长补偿的影响. 植物生态学报, 2006, 30(5): 810- 816.
[41] 时永杰, 王朝凌. 盐爪爪. 中兽医医药杂志, 2003, (S1): 142- 144.
[42] 杨树德, 陈国仓, 张承烈, 陈珈, 王学臣. 胡杨披针形叶与宽卵形叶的渗透调节能力的差异. 西北植物学报, 2004, (9): 1583- 1586.
[43] 杨戈, 王常贵. 罗布泊地区几种旱生植物茎、叶结构的初步研究. 干旱区研究, 1984, 57(l): 57- 63.
[44] 李芳兰, 包维楷. 植物叶片形态解剖结构对环境变化的响应与适应. 植物学通报, 2005, 22(S1): 118- 127.
[46] 刘莉, 任昱. 几种沙生植物水分代谢问题探讨. 内蒙古林业科技, 2011, 37(3): 8- 12.
IndicativeeffectoftheanatomicalstructureofplantphotosyntheticorganonWUEindesertregion
ZHANG Haina1,2, SU Peixi1,2,*, LI Shanjia1,2, ZHOU Zijuan1,2, XIE Tingting1, ZHAO Qingfang3
1LinzeInlandRiverBasinResearchStation,ColdandAridRegionsEnvironmentalandEngineeringResearchInstitute,ChineseAcademyofSciences,Lanzhou730000,China2KeyLaboratoryofLandSurfaceProcessandClimateChangeinColdandAridRegions,ChineseAcademyofSciences,Lanzhou730000,China3CollegeofLifeSciences,NorthwestNormalUniversity,Lanzhou730070,China
Affected by the extreme arid environment caused by salinization, high temperature and intensive radiation, desert plants change their structural characteristics, such as fleshy leaf, assimilating shoots, lots of epidermal hairs, thick cuticle and so on, to improve their water use efficiency. Structure being basis of function, the anatomic structure of photosynthetic organ (including leaf and assimilating shoot) of desert plants can indicate their water use efficiency. It has been improved that stable carbon isotope (δ13C value), an indicator of long-term water use efficiency (WUE) of desert plants and a comprehensive value reflecting the whole life history of plants, was widely applied to illustrate the response ofδ13C values in plants to environment factors. Therefore, there must exist an important relevance between plant anatomical structure andδ13C value to some degree. However, most of studies on plant anatomical structure have been focused on its relationships with drought resistance, environmental plasticity and plant taxonomy for a long time, little was known about its response to WUE indicated byδ13C value. In this paper, the relationship between plant anatomical structure andδ13C value was analysed in the middle reaches of Heihe River basin, in order to find an effective indicator for WUE from the point of plant anatomical structure. The results showed that: (1)all the plants with axial photosynthetic organs had higherδ13C values that those with leafy organs butHedysarumscoparium. (2) The variation range of thicknesses of the photosynthetic organs and different tissues among different desert plants was large. The maximum value of the leaf thickness (Tl) or axis diameter (Da) was 6.9 times higher than the minimum, and those of cuticle thickness (Tc), epidermis thickness (Te), palisade tissue thickness (Tp), spongy tissue thickness (Ts) and aqueous tissue thickness (Ta) were 5.8,11,4,3.5 and 3.5 times higher than the corresponding minimum, respectively.TlorDaandTeof most desert plants with axial photosynthetic organs were higher than those with leafy organs. (3)The correlation analysis between different tissue thicknesses of desert plants and theirδ13C values indicated that: there was a significantly positive correlation betweenδ13C value andTlorDa, with the correlation coefficient 0.719 (Plt;0.01), while the correlations ofδ13C value with other tissue thicknesses were not significant. In conclusion, from the point of the anatomic structure of photosynthetic organs of desert plants, WUE could be indicated byTlorDa. The higherTlorDa, the higher WUE desert plant possesses, and WUE of plants with axial photosynthetic organs are higher than those with leafy organs.
desert plant; anatomical structure; long-term water use efficiency (WUE);stable carbon isotope ratio (δ13C value)
国家自然科学基金资助项目(91025026,31070359)
2012- 05- 16;
2012- 12- 24
*通讯作者Corresponding author.E-mail: supx@lzb.ac.cn
10.5846/stxb201205160729
张海娜,苏培玺,李善家,周紫鹃,解婷婷,赵庆芳.荒漠区植物光合器官解剖结构对水分利用效率的指示作用.生态学报,2013,33(16):4909- 4918.
Zhang H N, Su P X, Li S J, Zhou Z J,Xie T T, Zhao Q F.Indicative effect of the anatomical structure of plant photosynthetic organ on WUE in desert region.Acta Ecologica Sinica,2013,33(16):4909- 4918.
