铜和营养缺失对海州香薷两个种群生长、耐性及矿质营养吸收的差异影响
2013-12-08柯文山陈世俭熊治廷吴明煜李亚东
柯文山,陈世俭,熊治廷,吴明煜,李亚东
(1. 湖北大学生命科学学院, 武汉 430062;2. 中国科学院地球测量与物理研究所,武汉 430077;3. 武汉大学资源与环境科学学院,武汉 430079)
铜和营养缺失对海州香薷两个种群生长、
耐性及矿质营养吸收的差异影响
柯文山1,*,陈世俭2,熊治廷3,吴明煜1,李亚东1
(1. 湖北大学生命科学学院, 武汉 430062;2. 中国科学院地球测量与物理研究所,武汉 430077;3. 武汉大学资源与环境科学学院,武汉 430079)
以来自铜矿区(CS)和非矿区(UCS)两个海州香薷种群为对象,通过室内水培实验,分析了两种群幼苗在铜及营养缺失胁迫下植物生长、铜富集及矿质营养含量的差异。结果显示,铜、低营养胁迫及其相互作用对非矿区种群生长具有明显的抑制作用,而对矿区种群的影响则远比非矿区种群小,且较低铜浓度(25μmol/L Cu)明显促进了矿区种群的生长;从耐性指数结果看,矿区种群铜耐性指数和营养胁迫耐性指数均高于非矿区种群。这表明矿区种群不仅进化为铜耐受种群,同时也进化成营养胁迫耐受种群。低营养胁迫明显促进了植物对铜的吸收和运转,如在低营养胁迫和25μmol/L Cu复合处理下,矿区种群根铜含量约为单一铜处理的25倍,非矿区种群是单一铜处理5倍多。低营养胁迫和过量铜显著减少了非矿区种群矿质营养元素如P, Mg, K和Mn的吸收积累,而矿区种群则仍然能保持相对稳定;在铜和营养缺失复合作用下,两个种群矿质营养除Ca 和部分Fe外,均显著减少,但矿区种群减少程度明显比非矿区种群小。这些结果表明,矿区种群在胁迫条件下具有保持营养相对稳定和平衡的能力,这种能力使其能在高铜污染和营养缺乏的土壤中正常生长和定居。
海州香薷;铜耐性;营养缺失耐性;矿质营养积累
铜虽然是植物必需微量元素,但过量能引起植物其它必需元素的缺失[ 1- 2 ]。植物体内这些元素的缺失常常是重金属中毒的表现[ 3 ]。然而,和敏感植物相比,重金属抗性植物表现出对矿质元素缺失有更高的耐受性[ 3- 4 ]。以前的研究主要都集中在重金属的吸收、蓄积和耐性以及重金属对一些元素含量的影响[ 5- 6 ],很少知道铜矿区耐受种群是否对营养缺失也有耐受性,更不清楚这种铜耐受性和营养缺失耐受性有何关系。
海州香薷(ElsholtziahaichowensisS.)俗称铜草,广泛分布于长江流域,尤其在铜矿区,该植物是这些矿区旺盛生长的优势植物之一,是一种Cu矿指示植物[7- 8]。研究表明,海州香薷对Cu具有很强的富积能力和耐受能力[9- 10],是一种可应用于重金属污染土壤修复的本土资源植物[11]。且近年来的研究显示,生长于铜矿区或铜污染区的海州香薷在铜吸收控制、铜区隔脱毒、耐性蛋白等方面具有一系列耐铜机制[12- 20]。该植物也在非矿区有生长,但与矿区种群相比,其铜吸收对策、耐性、生理生化方面明显不同于矿区种群[16,21- 24]。铜矿废弃地由于长期开采和冶炼,导致土壤裸露,水土流失,污染严重,土壤不仅铜浓度高,而且营养也不足[25]。生长于铜矿区的海州香薷已进化形成很强的铜耐性,是否也进化为营养缺失耐性?为此,本研究拟通过水培实验对来自矿区和非矿区的海州香薷不同种群的对比研究,分析其对铜的耐受性和对营养缺失耐受可能的差异,揭示铜耐受性和营养缺失耐受性的关系。
1 材料和方法
1.1 植物材料和预处理
植物种子的采集、选择、消毒和萌发见文献[21]。种子萌发后,选择一致的小苗种于酸洗过的石英砂中培养,每天浇1/2Hogland营养液(HS)。营养液的组成(mmol/L):5KNO3, 5Ca(NO3)2·H2O, 2 MgSO4·7H2O, 1 KH2PO4, 0.02 FeSO4·7 H2O 和 0.02 Na2-EDTA, 0.045 H3BO3, 0.01 MnCl24 H2O, 和微量元素 (μmol/L) 0.8 ZnSO4, 0.3 CuSO4·5 H2O, 0.1 NaMoO4·2 H2O. 溶液pH用 0.1mol/L NaOH or 0.1mol/L HCl 调节至5.5±0.3。
1.2 铜和营养缺失处理
待幼苗长至6—8片小叶时,选择一致的幼苗用于水培实验。幼苗转移到装有500mL营养液(HS)白色塑料碗中。预培养1周后,分别给以不同铜水平处理(对照,25 和100μmol/LCu2+(CuSO4·5 H2O))、全营养缺失处理(1/50HS)或Cu和营养缺失复合处理。每3天换1次营养液,每处理3个重复, 每盘4株。14d后收获测定根长、生物量及元素分析。
1.3 耐受指数的确定
铜耐受指数计算用根长指数法[15],营养缺失耐受根据Antosiewicz于1995年的方法,即,用处理植物的干生物量相对于对照生物量的百分数来表示。
1.4 元素分析
收获的植物根系用5 mmol/L冷 Pb(NO3)2洗30min以脱去根表面吸附的铜,再用蒸馏水洗3次。然后分为根和地上部分,于70℃烘48h。干样磨成粉,湿消化法消化[15]。P元素用比色法测定,K用火焰分光光度计(6400-A,上海分析仪器厂)测定,其它如Cu, Ca, Mg,Fe等元素在等离子发射光谱仪(ICP-OES)上测定。
1.5 统计分析
二维方差分析方法分析处理(因素1)和种群(因素2)的差异(P<0.05),邓肯多重比较分析各处理间差异的显著性。
2 结果
2.1 铜、全营养缺失处理条件下,海州香薷矿区和非矿区种群的耐性和生物量差异
不同铜浓度处理幼苗14d后,两个种群的根长耐性指数表现出明显差异(图1): 矿区种群(CS种群)显著高于非矿区种群(UCS种群)(P<0.01)。较低Cu浓度(25μmol/L)明显促进CS种群根的生长(P<0.01),较高浓度(100μmol/LCu)没有明显的影响;而两个处理浓度对UCS种群根生长有显著的抑制作用。
在全营养缺失胁迫下,CS种群根生物量显著高于UCS种群(P< 0.01)(图2),且营养缺失促进了CS种群根的生长而抑制UCS种群根的生长;两个种群地上部分的生长明显抑制,但CS种群仍然显著高于(P<0.001)UCS种群。
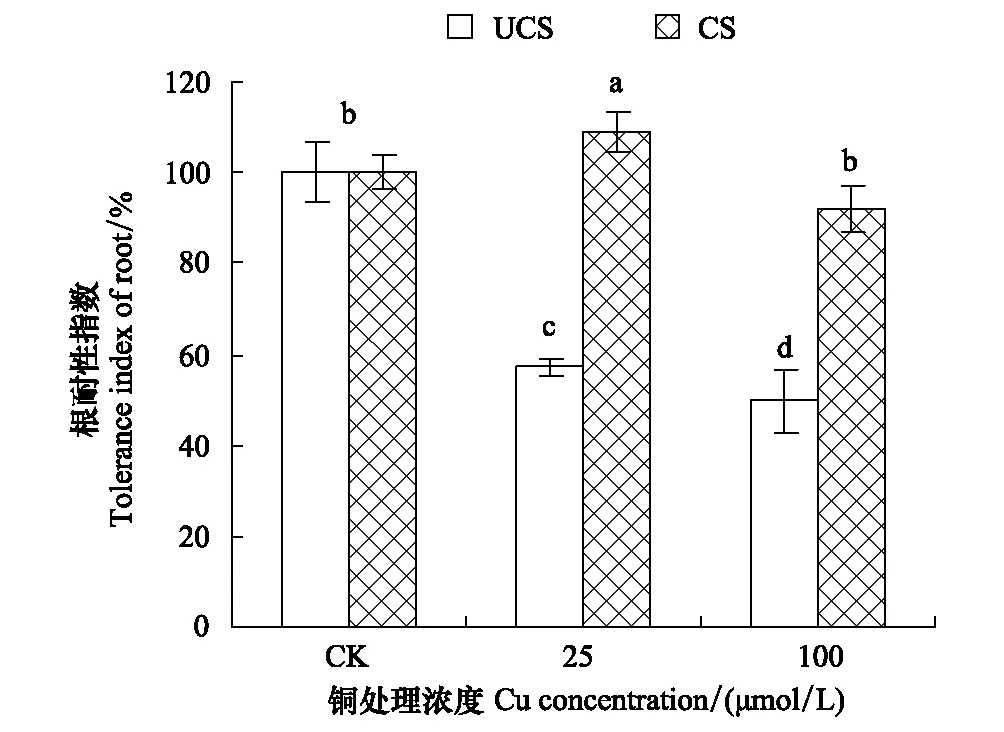
图1 水培条件下海州香薷铜矿区(CS)和非矿区(UCS)两个种群对铜的耐受性Fig.1 Tolerance index of two Elsholtzia haichouensis populations from Cu mine site (CS) and uncontaminated site (UCS) in hydroponic experiments图中不同字母表示显著性差异(P<0.01)
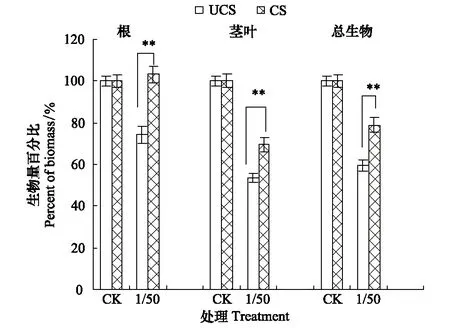
图2 海州香薷两个种群对全营养缺失的耐受性Fig.2 Tolerance difference of general nutrient deficiency between two E.haichouensis populations**指示种群间的显著性差异(P<0.01)
不同铜浓度处理对两个种群生物量(相对生物量)的影响表现出明显差异(表1)。较低浓度铜(25μmol/LCu)处理时, CS种群生物量明显增加,较高浓度铜(100μmol/L Cu)处理则略有降低,但没有表现出显著性;而UCS种群生物量在不同浓度铜均有显著减少。在铜与全营养缺失胁迫(1/50HS)复合作用下,海州香薷两个种群生物量都明显降低,但仍然可看出两个种群的差异:CS种群的生物量(相对生物量)普遍高于UCS种群,除了根在1/50HS和100μmol/LCu复合处理中没有显著差异外,其它都达到显著水平。和单一铜处理相比,复合胁迫条件下的两个种群的生物量都明显低于相应铜处理水平,但矿区种群仍然高于非矿区种群。
表1铜及与全营养缺失(1/50HS)复合胁迫对海州香薷两个种群生物量的影响
Table1Relativebiomasses(% of controls)oftwoE.haichouensispopulationsindifferentCuandmixturewithgeneralnutrientdeficiencytreatments(1/50HS)
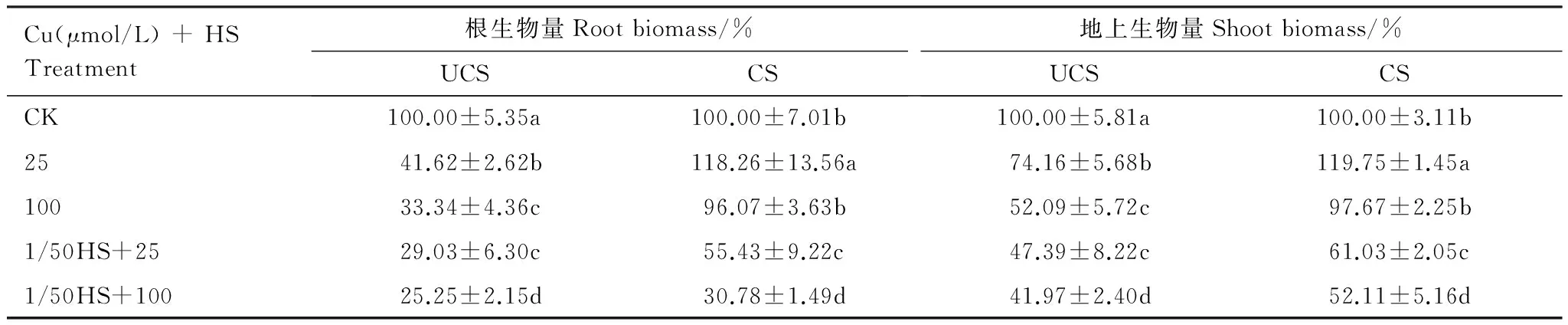
Cu(μmol/L)+HSTreatment根生物量Rootbiomass/%UCSCS地上生物量Shootbiomass/%UCSCSCK100.00±5.35a100.00±7.01b100.00±5.81a100.00±3.11b2541.62±2.62b118.26±13.56a74.16±5.68b119.75±1.45a10033.34±4.36c96.07±3.63b52.09±5.72c97.67±2.25b1/50HS+2529.03±6.30c55.43±9.22c47.39±8.22c61.03±2.05c1/50HS+10025.25±2.15d30.78±1.49d41.97±2.40d52.11±5.16d
同一行中的不同字母表示显著差异(P<0.05) (邓肯多重比较)
3.2 营养缺失对海州香薷Cu吸收、积累及运转的影响
表2显示的是营养缺失及与Cu复合对海州香薷两个种群Cu吸收的影响。在营养缺失条件下,两个种群根中的Cu含量明显降低(P<0.05),种群间没有明显的差异,矿区为对照的68.5%,非矿区为对照的70.3%。然而,非矿区种群地上部分则明显增加(P<0.05),是对照的150.5%,矿区种群略有增加。两个种群在营养胁迫条件下,地上部分和根的铜含量比值都明显增加。在25μmol/L Cu处理中,非矿区种群根Cu含量急剧增加,约是矿区的5倍。地上增加相对较少,非矿区种群略高于矿区。然而,在全营养缺失和25μmol/L Cu复合胁迫处理下,两个种群根和地上的Cu含量急剧增加(表2)。
表2营养缺失及与Cu复合处理14d对海州香薷两个种群Cu富集及运转的影响
Table2EffectofgeneralnutrientdeficiencyandCuonCuuptakeandtransportintwoE.haichouensispopulationsafter14daysofhydroponicculture
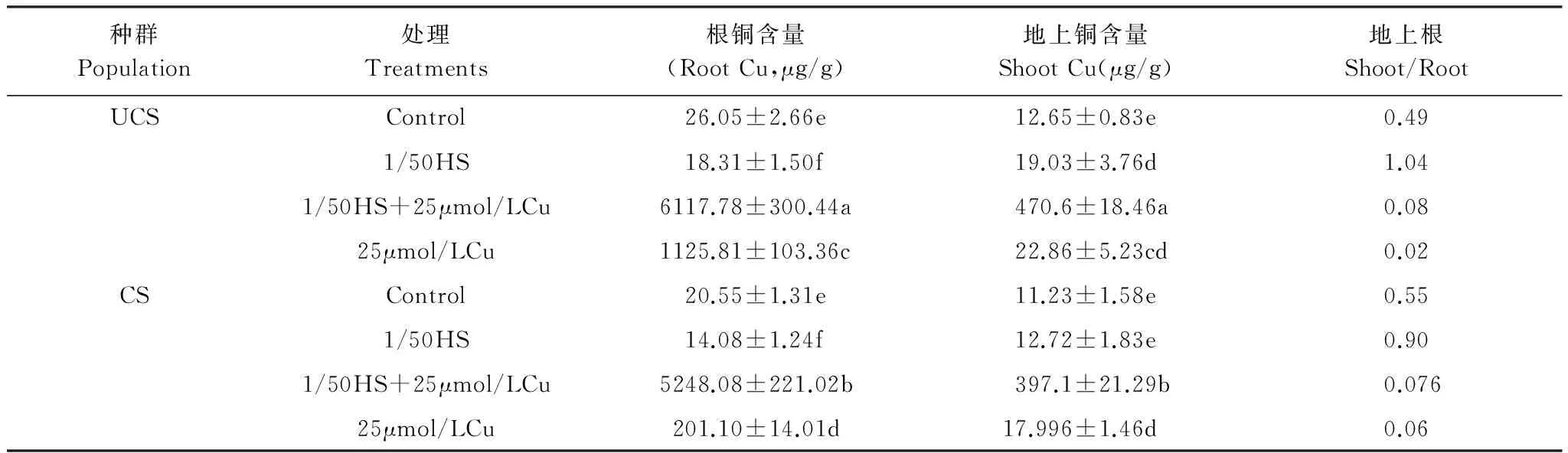
种群Population处理Treatments根铜含量(RootCu,μg/g)地上铜含量ShootCu(μg/g)地上根Shoot/RootUCSControl26.05±2.66e12.65±0.83e0.491/50HS18.31±1.50f19.03±3.76d1.041/50HS+25μmol/LCu6117.78±300.44a470.6±18.46a0.0825μmol/LCu1125.81±103.36c22.86±5.23cd0.02CSControl20.55±1.31e11.23±1.58e0.551/50HS14.08±1.24f12.72±1.83e0.901/50HS+25μmol/LCu5248.08±221.02b397.1±21.29b0.07625μmol/LCu201.10±14.01d17.996±1.46d0.06
表中结果是平均值±S.D. (n=3); 同一栏中的不同字母表示显著性差异(P<0.05)(根据邓肯多重比较)
3.3 全营养缺失及铜胁迫对海州香薷矿质元素吸收的影响
3.3.1 铜对海州香薷矿质元素吸收的影响
表3显示的是铜对海州香薷两个种群矿质元素吸收的影响。从表3可看出,过量铜对矿区种群植物矿质元素吸收积累的影响明显比非矿区种群小,如矿区种群P、Ca、Mg矿质元素含量的变化不明显,但非矿区种群除Ca含量变化较大外,均随铜浓度的增加而急剧减少;两个种群Fe、K和Mn元素随铜浓度的增加都有减少,但矿区种群量减少明显比非矿区小。尤其是根K和Mn,在较低铜浓度(25μmol/L Cu)处理时,非矿区种群K和Mn含量分别是其对照的41.7%和31.4%,而矿区种群分别为对照的88.2%和94.4%。
3.3.2 营养缺失及与铜复合对海州香薷矿质元素吸收的影响
表4显示的是营养缺失及与Cu复合对海州香薷两个种群矿质元素吸收的影响。营养缺失条件下,两个种群根中元素含量均有明显的减少,但仍然表现为非矿区种群降低的幅度比矿区种群大。地上部分元素含量的变化则没有根显著。在营养缺失和铜复合作用下,除根Ca和Fe元素增加外,其它元素含量均进一步减少。其中根K和Mn含量减少更为显著,矿区种群分别为对照的35.4%和25.97%,非矿区种群分别为对照的15.8%和8.7%。
4 讨论
重金属能干扰植物对必需营养元素的吸收和运输,从而影响植物体内矿质营养组成,最终导致植物金属毒性效应的产生[ 2]。铜虽然是植物必需重金属元素,但过量会导致植物毒害。在本实验中,过量铜明显减少了海州香薷非矿区种群对矿质营养P, Mg, K, Mn的吸收和运输,增加了根Ca的吸收和积累(表3),而对矿区种群的影响则不明显。这种现象在铜和全营养缺少复合胁迫下也有相同表现:矿区种群影响小,而非矿区种群影响显著(表4)。通常认为,铜毒产生的第一个效应是根细胞膜的损伤,继而引起离子流失、脂质过氧化及原生质膜受损[ 13]。根K元素含量的显著减少常常说明根膜受损程度,本实验中矿区耐性种群的减少量明显比非矿区少,说明矿区种群根膜受损程度比非矿区种群小。因此,海州香薷耐性种群可能具有较强的防止铜毒产生的能力,保证细胞膜不受或少受损伤,因而能维持植物体内矿质营养的相对稳定。
表3海州香薷两个种群在14d的铜处理后根矿质元素含量(mg/g干重; Mn: μg/g干重)
Table3Mineralconcentrations(mg/g DW; Mn and Zn: μg/g DW)inplanttissuesoftwoElsholtziahaichouensispopulationsafter14daysofhydroponicculturewithvariouscopperconcentrations
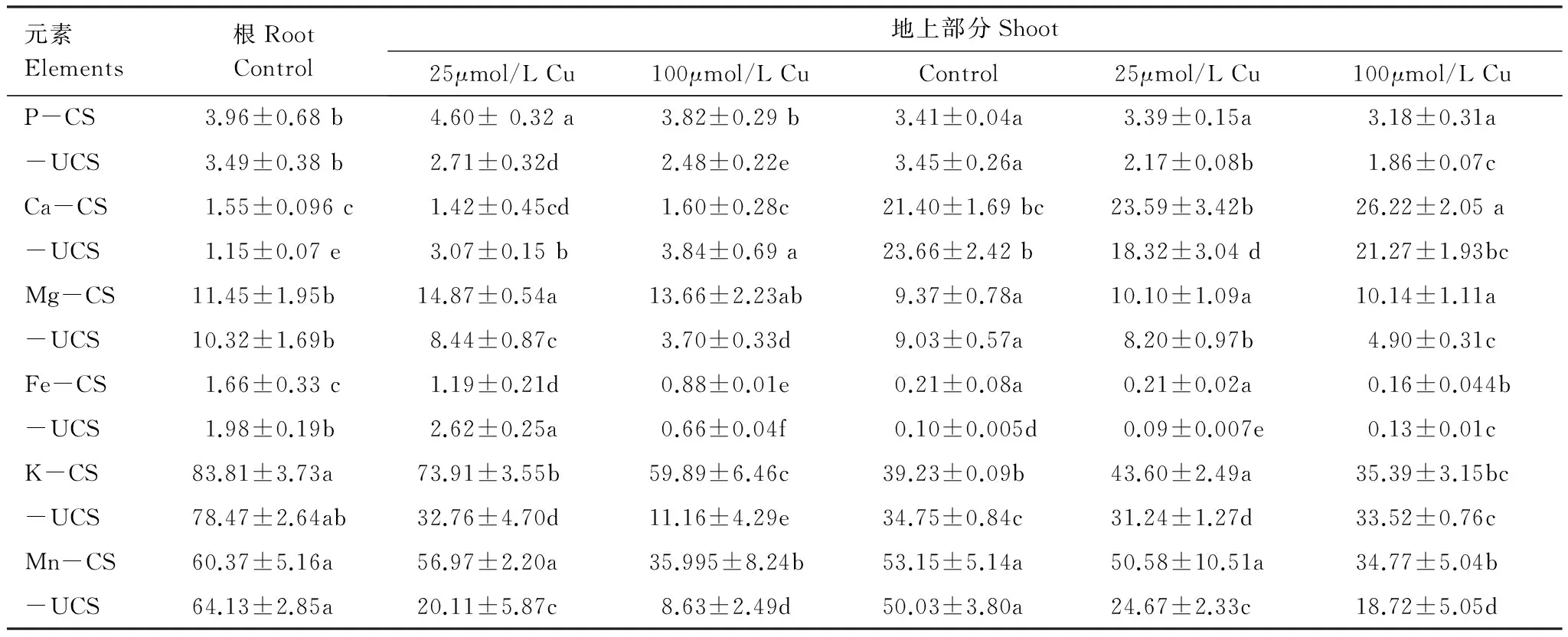
元素Elements根RootControl地上部分Shoot25μmol/LCu100μmol/LCuControl25μmol/LCu100μmol/LCuP-CS3.96±0.68b4.60±0.32a3.82±0.29b3.41±0.04a3.39±0.15a3.18±0.31a-UCS3.49±0.38b2.71±0.32d2.48±0.22e3.45±0.26a2.17±0.08b1.86±0.07cCa-CS1.55±0.096c1.42±0.45cd1.60±0.28c21.40±1.69bc23.59±3.42b26.22±2.05a-UCS1.15±0.07e3.07±0.15b3.84±0.69a23.66±2.42b18.32±3.04d21.27±1.93bcMg-CS11.45±1.95b14.87±0.54a13.66±2.23ab9.37±0.78a10.10±1.09a10.14±1.11a-UCS10.32±1.69b8.44±0.87c3.70±0.33d9.03±0.57a8.20±0.97b4.90±0.31cFe-CS1.66±0.33c1.19±0.21d0.88±0.01e0.21±0.08a0.21±0.02a0.16±0.044b-UCS1.98±0.19b2.62±0.25a0.66±0.04f0.10±0.005d0.09±0.007e0.13±0.01cK-CS83.81±3.73a73.91±3.55b59.89±6.46c39.23±0.09b43.60±2.49a35.39±3.15bc-UCS78.47±2.64ab32.76±4.70d11.16±4.29e34.75±0.84c31.24±1.27d33.52±0.76cMn-CS60.37±5.16a56.97±2.20a35.995±8.24b53.15±5.14a50.58±10.51a34.77±5.04b-UCS64.13±2.85a20.11±5.87c8.63±2.49d50.03±3.80a24.67±2.33c18.72±5.05d
表中结果是平均值± S.D. (n=3); 同一行中以及同一元素两个种群间的不同字母表示处理水平及种群间的显著差异(P<0.05),据邓肯检验
表4全营养缺失(1/50HS)及与Cu复合胁迫14d处理后海州香薷两个种群根和地上矿质元素含量(mg/g干重; Mn, μg/g干重)
Table4Mineralconcentrations(mg/g DW; Mn, μg/g DW)ofrootsinplanttissuesoftwoE.haichouensispopulationsafter14daysofhydroponicculturewithgeneralnutrientdeficiencyanditsmixwithCu
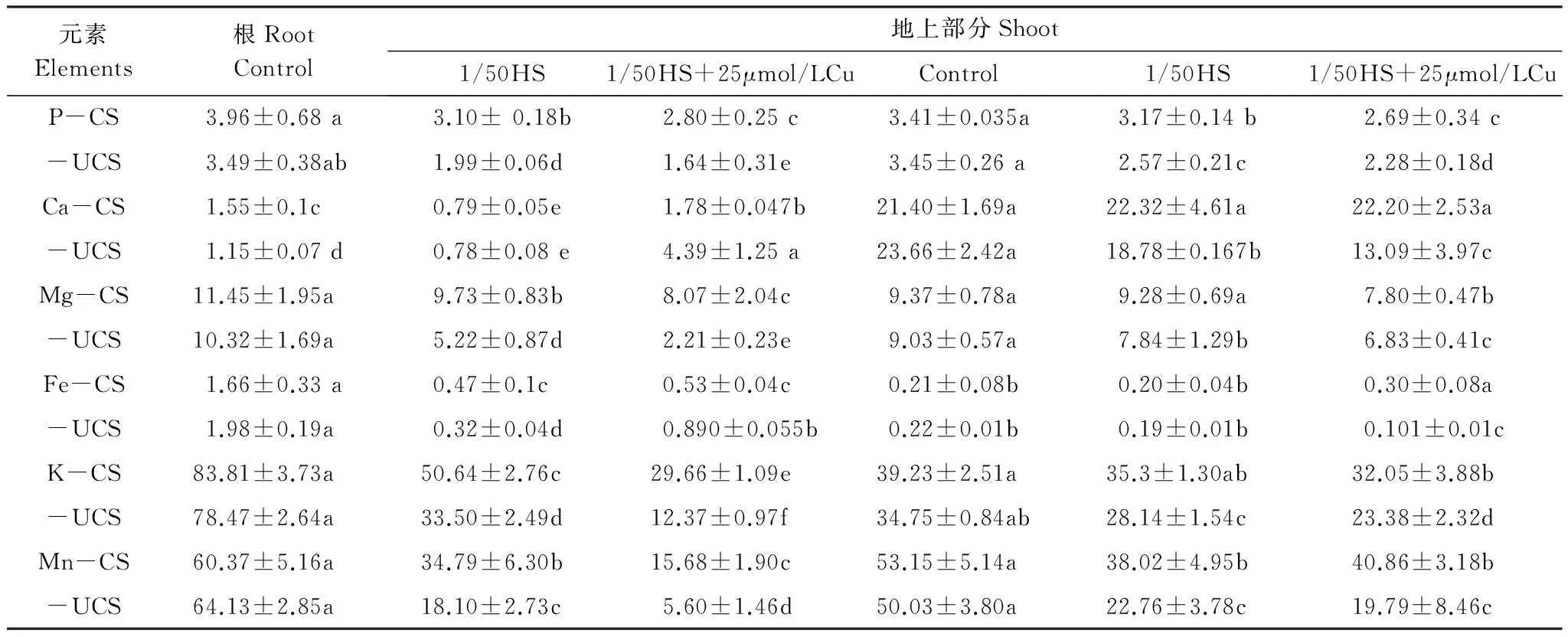
元素Elements根RootControl地上部分Shoot1/50HS1/50HS+25μmol/LCuControl1/50HS1/50HS+25μmol/LCuP-CS3.96±0.68a3.10±0.18b2.80±0.25c3.41±0.035a3.17±0.14b2.69±0.34c-UCS3.49±0.38ab1.99±0.06d1.64±0.31e3.45±0.26a2.57±0.21c2.28±0.18dCa-CS1.55±0.1c0.79±0.05e1.78±0.047b21.40±1.69a22.32±4.61a22.20±2.53a-UCS1.15±0.07d0.78±0.08e4.39±1.25a23.66±2.42a18.78±0.167b13.09±3.97cMg-CS11.45±1.95a9.73±0.83b8.07±2.04c9.37±0.78a9.28±0.69a7.80±0.47b-UCS10.32±1.69a5.22±0.87d2.21±0.23e9.03±0.57a7.84±1.29b6.83±0.41cFe-CS1.66±0.33a0.47±0.1c0.53±0.04c0.21±0.08b0.20±0.04b0.30±0.08a-UCS1.98±0.19a0.32±0.04d0.890±0.055b0.22±0.01b0.19±0.01b0.101±0.01cK-CS83.81±3.73a50.64±2.76c29.66±1.09e39.23±2.51a35.3±1.30ab32.05±3.88b-UCS78.47±2.64a33.50±2.49d12.37±0.97f34.75±0.84ab28.14±1.54c23.38±2.32dMn-CS60.37±5.16a34.79±6.30b15.68±1.90c53.15±5.14a38.02±4.95b40.86±3.18b-UCS64.13±2.85a18.10±2.73c5.60±1.46d50.03±3.80a22.76±3.78c19.79±8.46c
表中结果是平均值± S.D. (n=3); 根据邓肯多重比较分析,同一元素行中两个种群的不同字母表示显著性差异(P<0.05)
Antosiewicz[ 3]的研究证明,土豆和蝇子草的铅耐受品种对低营养胁迫同样表现出高的耐受性。海州香薷矿质营养胁迫实验结果显示,矿质营养缺失胁迫对海州香薷铜耐性种群生物量的影响明显小于非矿区(敏感)种群,在铜和低营养胁迫复合作用时也是如此(表1)。这表明,海州香薷铜耐性种群对低营养胁迫同样具有较高的耐受性。另一方面,在营养缺失胁迫条件下,铜耐性种群植物体内矿质营养组成(如P, Mg, K和Mn)的变化明显比非矿区种群小(表3)。因而,在营养胁迫或铜胁迫下,矿区种群具有较强的维持植物体内营养组成平衡的能力,这可能成为矿区种群在富铜土壤中正常生长的原因。也许矿区种群铜耐性和低营养胁迫耐性独立进化,但其生长的铜矿土壤因为具有高铜和低营养含量而选择在一起[26]。然而,这两者在遗传上和生理上是否有联系需要进一步研究。
本实验中,较低铜浓度(25μmol/L)明显促进了铜耐性种群的生长(生物量增加)(低营养胁迫也促进该种群根的生长),表现出明显的hormesis效应[27],但该浓度明显抑制了非矿区种群生长,这可能与来源不同的种群具有不同的耐性阈值有关。矿区种群因长期生长于高铜污染土壤,已经形成高铜耐性生态型[26],25μmol/L铜浓度对于矿区种群来说,处于低剂量促进效应范围,而对于非矿区种群则处于高剂量抑制效应范围。然而,当25μmol/LCu和低营养胁迫共同作用时,矿区耐性种群植物生长也明显受到抑制(表1)。这可能与其植物体内铜含量急剧增加有关。两因子共同处理时,矿区种群根铜含量是其单一铜处理的25倍,非矿区种群为5倍(表2)。显然,低营养胁迫显著促进了植物对铜的吸收和富集。即使作为铜耐性种群,铜的过量积累超过了植物耐受限度,使植物生长受到抑制,导致生物量减少。
6 结论
总之,在铜和低营养胁迫下,海州香薷两个种群在生长、铜富集、耐性及矿质营养组成上存在明显差异。矿区种群不仅进化成铜耐受生态型,也进化为营养胁迫耐受生态型。铜和低营养胁迫对矿区种群植物矿质营养组成的影响明显小于非矿区种群。这表明海州香薷铜耐性种群体内矿质营养组成的稳定和平衡,在其铜耐性中起重要作用,这也是其能定居于富铜土壤的重要原因。这些结果为从营养稳定和平衡理论的角度进一步理解铜耐性机制提供了很好的思路。同时,低营养胁迫促进了植物对重金属铜的吸收和运转,这间接表明,营养元素充足可以减少植物重金属富集,也为避免农作物在营养不足条件下因重金属积累而产生毒害提供科学参考。
[1] Godbold D L, Kettner C. Lead influences root growth and mineral nutrition ofPiceaabiesseedlings. Journal of Plant Physiology, 1991, 139(1): 95- 99.
[2] Monni S, Salemaa M, White C, Tuittila E, Huopalainen M. Copper resistance ofCallunavulgarisoriginating from the pollution gradient of a Cu-Ni smelter, in southwest Finland. Environmental Pollution, 2000, 109(2): 211- 219.
[3] Antosiewicz D M. The relationships between constitutional and inducible Pb-tolerance and tolerance to mineral deficits inBiscutellalaevigataandSileneinflata. Environmental and Experimental Botany, 1995, 35(1): 55- 69.
[4] Baker A J M, Walker P L. Ecophysiology of metal uptake by tolerant plants // Shaw A J, ed. Heavy Metal Tolerance in Plants: Evolutionary Aspects. Boca Raton, FL: CRC Press, 1990: 155- 177.
[5] Chen H M, Zhen C R, Tu C, Zhu Y G. Heavy Metal Pollution in Soils in Chian:Status and Countermeasures. AMBIO, 1999, 2: 130- 134
[6] Wallace A, Cha J W. Interactions involving copper toxicity and phosphorus deficiency in bush bean plants grown in solutions of low and high pH. Soil Science, 1989, 147(6): 430- 431.
[7] Xie X J, Xu Z B.Elsholtziahaichouensis-an indicator of copper mine. Geological Acta, 1952, 32(4): 360- 368.
[8] Ke W S, Xi H A, Yang Y, Wang W X, Chen S J. Analysis on characteristics of Phytogeochemistry ofElsholtziahaichowensisin Daye Tonglushan copper mine. Acta Ecologica Sinica, 2001, 21(6): 907- 912.
[9] Tang S R, Wilke B M, Brooks R R. Heavy-metal uptake by metal-tolerantElsholtziahaichowensisandCommelinacommunis from China. Communications in Soil Science and Plant Analysis, 2001, 32(5/6): 895- 905.
[10] Yang M J, Yang X E, Römheld V. Growth and nutrient composition ofElsholtziasplendensNakai under copper toxicity. Journal of Plant Nutrient, 2002, 25(7): 1359- 1375.
[11] Jiang L Y, Yang X E, He Z L. Growth response and phytoextraction of copper at different levels in soils byElsholtziasplendens. Chemosphere, 2004, 55(9): 1179- 1187.
[12] Shi J Y, Chen Y X, Huang Y Y, He W. SRXRF microprobe as a technique for studying elements distribution inElsholtziasplendens. Micron, 2004, 35(7): 557- 564.
[13] Lou L Q, Shen Z G, Li X D. The copper tolerance mechanisms ofElsholtziahaichowensis, a plant from copper-enriched soils. Environmental and Experimental Botany, 2004, 51(2): 111- 120.
[14] Chen Y X, Wang Y P, Lin Q, Luo Y M. Effect of copper-tolerant rhizosphere bacteria on mobility of copper in soil and copper accumulation byElsholtziasplendens. Environment International, 2005, 31(6): 861- 866.
[15] Liu J, Xiong Z T, Li T Y, Huang H. Bioaccumulation and ecophysiological responses to copper stress in two populations ofRumexdentatusL. from Cu contaminated and non-contaminated sites. Environmental and Experimental Botany, 2004, 52(1): 43- 51.
[16] Ke W S, Xiong Z T, Jin Z X, Ke S S. Differences of Cu uptake and acid phosphatase activities of twoElsholtziahaichowensisSun populations. Acta Ecologica Sinica, 2007, 27(8): 3172- 3181.
[17] Zhang H X, Zhang F Q, Xia Y, Wang G P, Shen Z G. Excess copper induces production of hydrogen peroxide in the leaf ofElsholtziahaichowensisthrough apoplastic and symplastic CuZn-superoxide dismutase. Journal of Hazardous Materials, 2010, 178(1/3): 834- 843.
[18] Wu B, Susnea I, Chen Y X, Przybylski M, Becker J S. Study of metal-containing proteins in the roots ofElsholtziasplendensusing LA-ICP-MS and LC-tandem mass spectrometry. International Journal of Mass Spectrometry, 2011, 307(1/3): 85- 91.
[19] Zhang J, Tian S K, Lu L L, Shohag M J I, Liao H B, Yang X E. Lead tolerance and cellular distribution inElsholtziasplendensusing synchrotron radiation micro-X-ray fluorescence. Journal of Hazardous Materials, 2011, 197: 264- 271.
[20] Zhang H X, Song Y F, Wang G P, Shen Z G. Identification of Cu-induced Protein in Root ofElsholtziahaichowensisunder Cu Stress. Acta Botanica Boreali-Occidentalia Sinica, 2011, 31(7): 1335- 1339.
[21] Ke W S, Xiong Z T, Xie M J, Xiong S L, Huang H, Li M J. Differences in Cu resistance and accumulation ofElsholtziahaichouensisSun andDaucuscarotaL. populations from Cu mine sites and uncontaminated sites. Chinese Journal of Environmental Engineering, 2007, 1(5): 94- 100.
[22] Ke W S, Xiong Z T, Chen S J, Wang Z H. Differences of Cu accumulation and Cu-induced ATPase activity in roots of two populations ofElsholtziahaichowensisSun. Environmental Toxicology, 2008, 23(2): 193- 199.
[23] Ke W S, Xiong Z T, Ke S S, Jin Z X. Effects of copper toxicity on photosynthesis and transpiration of threeElsholtziasplendensNakai ex F.Maekawa populations. Acta Ecologica Sinica, 2007, 27(4): 1368- 1375.
[24] Liu J, Xiong Z T. Differences in accumulation and physiological response to copper stress in three populations ofElsholtziahaichowensisS. Water, Air, and Soil Pollution, 2005, 168(1/4): 5- 16.
[25] Huang M H, Luo Y M. Land remediation and ecological restoration of mined land. Acta Pedologica Sinica, 2003, 40(2): 161- 169.
[26] Ke W S, Xiong Z T, Chen S J, Chen J J. Effects of copper and mineral nutrition on growth, copper accumulation and mineral element uptake in twoRumexjaponicuspopulations from a copper mine and an uncontaminated field sites. Environmental and Experimental Botany, 2007, 59(1): 59- 67.
[27] Calabrese E J, Baldwin L A. Defining hormesis. Human and Experimental Toxicology, 2002, 21(2): 91- 98.
参考文献:
[5] 陈怀满, 郑春荣, 涂从, 朱永官. 中国土壤重金属污染现状与防治对策. AMBIO- 人类环境杂志, 1999, 28(2): 130- 134.
[8] 柯文山, 席红安, 杨毅, 王万贤, 陈世俭. 大冶铜绿山矿区海州香薷 (Elsholtziahai-chowensis) 植物地球化学特征分析. 生态学报, 2001, 21(6): 907- 912.
[20] 张红晓, 宋玉峰, 王桂萍, 沈振国. 铜胁迫下海州香薷根中铜诱导蛋白的鉴定. 西北植物学报, 2011, 31(7): 1335- 1339.
[21] 柯文山, 熊治廷, 谢明吉, 熊双莲, 黄河, 李民敬. 不同来源的海州香薷和野胡萝卜的铜抗性及铜积累差异. 环境工程学报, 2007, 1(5): 94- 100.
[23] 柯文山, 熊治廷, 柯世省, 金则新. 铜毒对海州香薷 (Elsholtziasplendens) 不同种群光合作用和蒸腾作用的影响. 生态学报, 2007, 27(4): 1368- 1375.
Cuandnutrientdeficiencyondifferenteffectsofgrowth,toleranceandmineralelementsaccumulationbetweentwoElsholtziahaichouensispopulations
KE Wenshan1,*, CHEN Shijian2, XIONG Zhiting2, WU Mingyu1, LI Yadong1
1SchoolofLifeScienceofHubeiUniversity,Wuhan430062,China2GeodecyandGeophysicsInstituteofChinaAcademy,Wuhan430077,China3SchoolofResourceandEnvironmentalScienceofWuhanUniversity,Wuhan430079,China
TwoElsholtziahaichowensispopulations, one from a copper mine (CS) and the other from an uncontaminated site (UCS), were studied in hydroponic experiments for the plant growth, copper accumulation and mineral nutrients content under excess copper, nutrient deficiency and their interaction. The growth of UCS population was significantly inhibited by excessive Cu, nutrient deficiency and their interaction. But the growth of CS population was less affected by these factors, and 25μmol/L Cu stimulated significantly the growth of CS population. The tolerance indices of root length to Cu and biomass to mineral nutrient deficiency in the CS population were significantly higher than that in the UCS population. The results indicated that the CS population had evolved not only Cu tolerance but also tolerance to low nutrient supply. Nutrient deficiency increased significantly Cu uptake and transport in two populations. For example, at 25μmol/L Cu mixed with nutrient deficiency, root-Cu content of CS population was about 25 times that of CS population at 25μmol/L Cu treatment; root-Cu content of UCS population at interaction of 25μmol/L Cu and nutrient deficiency was more than 5 times that of CS population at 25μmol/L Cu treatment. Shoot-Cu contents in two populations also increased, but that in UCS population increased much more than in CS population. Excessive Cu reduced significantly uptake and transport of mineral nutrient including P, Mg, K and Mn. But contents of these mineral elements in CS population was less affected by excessive Cu. At interaction of nutrient deficiency and Cu (25μmol/L ), mineral element contents except Ca and some Fe decreased significantly. But the reduction in CS population is less than that in UCS population. The results indicated that the mineral composition homeostasis under the stresses was important in metal tolerance and colonizing normally in the Cu-enriched soils for the Cu-tolerant population.
Elsholtziahaichowensis; copper tolerance; nutrient deficiency tolerance; mineral element accumulation
国家自然科学基金资助 (30570322);中国科学院知识创新工程重大项目(KZCX1-YW-08-01-02)
2012- 05- 04;
2012- 11- 19
*通讯作者Corresponding author.E-mail: kokews2000@163.com
10.5846/stxb201205040642
柯文山,陈世俭,熊治廷,吴明煜,李亚东.铜和营养缺失对海州香薷两个种群生长、耐性及矿质营养吸收的差异影响.生态学报,2013,33(15):4737- 4743.
Ke W S, Chen S J, Xiong Z T, Wu M Y, Li Y D.Cu and nutrient deficiency on different effects of growth, tolerance and mineral elements accumulation between twoElsholtziahaichouensispopulations .Acta Ecologica Sinica,2013,33(15):4737- 4743.
