蓝莓果干粉制备工艺中载体添加及干燥技术的影响
2013-12-08吕兆林张柏林郭弘璇侯智霞
林 西,吕兆林 ,张柏林,3,郭弘璇,侯智霞
(1.北京林业大学生物学院,北京100083;2.北京林业大学分析测试中心,北京100083;3.林业食品加工与安全北京市重点实验室,北京100083;4.北京林业大学教育部省部共建森林培育与保护重点实验室,北京100083)
蓝莓(Vaccinium spp.)营养丰富,具有抗氧化[1-2]、抗癌[3]、保护视力[4]等功效,在中国产量很大[5]。但是季节性强、货架期短[6],过剩的蓝莓必须要冷冻或做其他处理,由于冷冻蓝莓耗费高,因此人们越来越关注经济的保存方法。国内市场上,蓝莓的深加工产品主要为饮料,果酱等[7-9],并且由于相关工艺研究缺乏,均存在产品营养成分含量低的问题。一种能够既保留蓝莓本身的营养价值,又方便储存、方便食用的深加工产品非常需要。将蓝莓鲜果加工成为粉末形式的食品,作为日常营养补充剂,鲜有研究,对这一类食品进行开发,将会有良好的市场前景。蓝莓果内含有较多低分子量的糖,在蓝莓果干燥后期易导致产品粘稠、吸湿等问题,因此现阶段蓝莓粉末产品多以胶囊形式上市,而蓝莓果干粉产品则很少见。在干燥过程中,由于酶降解、氧化、pH作用和热处理等原因,蓝莓中的活性成分(如花色苷)会流失。以往研究发现,麦芽糊精,玉米淀粉等大分子物质,不仅具有保护有效营养物质[10]的作用,还能通过提升玻璃态转变温度有效降低蓝莓果干粉的吸湿性[11]。因此,本实验分别选择麦芽糊精与羧甲基纤维素钠(CMC)作为载体进行对比,研究蓝莓果干粉的最佳干燥工艺。常用的干燥方法有:喷雾干燥、冷冻干燥、烘箱干燥等。喷雾干燥[12]适合大量生产、营养成分不易被破坏,但成本消耗大,不适合糖含量高的产品,易导致粘壁;冷冻干燥[13]由于无需高温处理,它亦具有保护产品营养成分的作用;烘箱干燥则具有成本低、干燥速率快的特点,特别适合一些热稳定性较好的物质。基于实验条件的考虑和经济、效果方面的考虑,本实验选择了烘箱干燥和冷冻干燥两种干燥方法进行对比研究蓝莓果干粉工艺。为了评价蓝莓果干粉,实验以感官评价、含水率为指标评价蓝莓果干粉外观形态,以花色苷含量、抗氧化能力为指标评价蓝莓中活性成分保留情况。
1 材料与方法
1.1 材料与仪器
6个种的蓝莓果供试材料 爱国者(Patriot)、杜克(Duke)、蓝丰(Bluecrop)、北蓝(Northblue)、埃利奥克(Elliott)及北陆(Northland)等质量混合;无水乙醇、甲醇、浓硫酸、氯化钾、乙酸钠、磷酸钠、钼酸铵及抗坏血酸(VC)、糊精、羧甲基纤维素钠(CMC) 均为分析纯试剂。
DHG-9420A型电热恒温干燥箱 上海一恒科学仪器有限公司;冷冻干燥机 Heto PowerDry LL3000冻干机;KS-130小型摇床 德国IKA;岛津紫外分光光度计(Shimadzu UV-120-02);EV311旋转蒸发仪 北京莱伯泰科仪器公司;LXJⅡ离心机上海民用分析仪器厂;ZSD-2J智能自动水份滴定仪上海市安亭电子仪器厂;榨汁机 美的BM255C型榨汁机;万分之一天平 Sartorious。
1.2 实验方法
1.2.1 制备蓝莓果干粉
1.2.1.1 添加不同载体 6个种的蓝莓果等量混合,用榨汁机将蓝莓果研磨成质地均匀细密的果泥备用。
组A加糊精处理,添加量以干燥后样品含水量低于5%、不易吸湿的最小量为准,经实验优化确定添加量为样品质量的10%~15%;具体方法:称量约120g样品、15g糊精,糊精加少量水溶解后混合物再次研磨使其充分混合,分别倒入A-1、A-2、A-3三个培养皿中,产品厚度约为3~4mm,准确称重。
组B加CMC处理,添加量以干燥后样品含水量低于5%、不易吸湿的最小量为准,经实验优化确定添加量为样品质量的4%~5%,具体方法:称量约120g样品、5g CMC,CMC加少量水溶解后混合物再次研磨使其充分混合,分别移入B-1、B-2、B-3三个培养皿中,厚度约为3~4mm,准确称重。
组C样品不做处理,准确称量样品120g分别倒入C-1、C-2、C-3三个培养皿中。A、B、C三组样品均进行3组重复。
1.2.1.2 不同干燥技术干燥处理 烘箱干燥法处理:将A-1、B-1、C-1三个培养皿置于70℃烘箱中干燥,每小时翻动样品1次,以免样品粘在培养皿壁上不易取得。干燥5h后,所有样品含水量低于5%,取出培养皿并冷却至室温,将样品收集至研钵中进行研磨、研磨后的样品过80目筛,分别密封收集,置于-4℃冰箱中冷藏备用。
冷冻干燥法处理:参考并优化文献[14]方法,将A-2、B-2、C-2三个培养皿置于-40℃冰箱中速冻,速冻时间为6h,在冷冻干燥机上冷冻干燥24h,真空度800Pa,冷阱温度:-46℃。干燥完成后,用药匙轻轻将蓝莓粉末刮下,过80目筛。样品分别密封收集,存放于-4℃冰箱中冷藏备用。
最后一组不干燥,A-3、B-3、C-3三个培养品直接用密封袋封口置于-4℃冰箱中冷藏备用。
1.2.2 蓝莓果干粉质量评价
1.2.2.1 含水量测定 采用卡尔·费休法测定,基本原理是碘氧化二氧化硫时,需要消耗定量的水,即I2+SO2+2H2O=2HI+H2SO4,通过颜色判断终点,用消耗的卡尔·费休试剂的量判断样品中水的含量。
采用卡尔·费休仪测定9组样品的含水量。在反应瓶中加一定体积(浸没铂电极)的甲醇,在搅拌下用卡尔·费休试剂滴定至终点;加10μL水,滴定至终点并记录卡尔·费休试剂的用量;准确称取试样50mg,滴定至终点并记录样品含水量;以两次平行结果之算术平均值为测定结果,两次测定结果之差不得大于0.1%。
1.2.2.2 花色苷含量测定 蓝莓果干粉中花色苷提取:本实验综合并改进文献[11,15-17]中的提取方法;准确称量0.5g的蓝莓果粉末样品,5g蓝莓果泥样品,加入100mL提取液进行提取(柠檬酸∶水 =1∶99);将样品置于摇床上振荡 5h,1500×g下离心10min,取上清液,该过程重复三次;合并上清液,用旋转蒸发仪在40℃下浓缩样品,最后用提取液稀释定容至100mL。
花色苷测定与计算:花色苷的定量采用pH示差分光光度法[17-20]。样品稀释至合适浓度,量取0.5mL分别与4.5mL的pH1的氯化钾缓冲液及p H4.5乙酸钠缓冲液按比例混合,使样品的吸光值在线性范围内(<1.2AU),分别在515和700nm波长下测量吸光度,以纯水为空白比色。以花色苷-3-糖配基为标准计算,结果以mg花色苷/100g蓝莓鲜重计算。所有样品称重并分析3组。花色苷含量用式(1)计算。
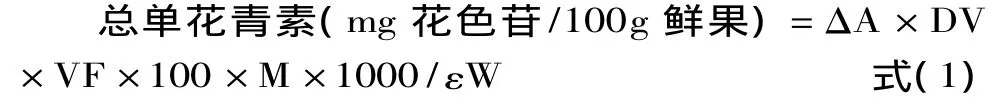
式中:ΔA=(A515nm-A700nm)pH1.0-(A515nm-A700nm)pH4.5;DV为稀释倍数;VF为蓝莓果干粉提取液体积(L);M为花色苷3-糖配基的相对分子质量449.2;ε为花色苷3-糖配基的摩尔吸光率26900;W为蓝莓果干粉质量(g)。
1.2.2.3 总抗氧化能力的测定 蓝莓果干粉中活性物质提取:准确称量0.5g样品,加入100mL提取液(柠檬酸∶甲醇∶水 =1∶49∶50)进行提取;将样品置于摇床上振荡5h,1500×g下离心10min,收集上清液,该过程重复三次;合并上清液,用旋转蒸发仪在40℃下浓缩样品,最后用提取液定量至100mL。

表1 不同干燥条件及前处理下蓝莓干粉的外观结构Table 1 Structure of blueberry powder in different drying method and pretreatment
绘制VC标准曲线:准确称取干燥后的VC标准品0.4999g用50%甲醇溶解定容于100mL容量瓶中,得19.996mg/mL的VC标准溶液,用移液管分别精密量取 VC标准液 30、40、50、80、100μL 置于 10mL容量瓶中定容。分别量取梯度稀释过的标准溶液0.5mL,加入到4.50mL反应溶剂中(0.60mol/L硫酸,28.00mmol/L磷酸钠,4.00mmol/L钼酸铵)。反应在95℃水浴中进行90min。反应物冷却到室温后,以试剂空白为参比,于695nm测定OD值。根据测定结果绘出标准曲线,得出线性回归方程:A=4.6965C-0.0989(A为吸光值,C为浓度mg/mL),R2=0.9988,线性范围:0.05~0.25mg/mL。
蓝莓果干粉总抗氧化能力测试:采用钼酸铵还原法。该方法参照Prieto等人[20]的方法测定。其原理是蓝莓粉末提取物可以使Mo(VI)还原为Mo(V),并且在酸性条件下形成绿色的Mo(V)的磷酸盐。取0.5mL蓝莓干粉提取液加入到4.50mL反应溶剂中(0.60mol/L硫酸,28.00mmol/L磷酸钠,4.00mmol/L钼酸铵)。反应在95℃水浴90min。反应物冷却到室温后,于695nm测定OD值。不加样品的空白试剂调零。被测物总抗氧化能力以相当于多少质量的VC来表示。
1.2.3 数据统计 以SAS作统计学分析,实验数据以平均数±标准差(±S)表示,采用t检验,显著性标准取p<0.05。
2 结果与讨论
2.1 不同处理条件下蓝莓果干粉的外观结构评价
对各组干燥后的蓝莓果干粉进行外观结构的评价,评价时保证光线充足,在相同的环境条件下进行观察,包括颜色、结构、干燥的难易程度、干燥粉末的粘稠程度、干燥粉末的吸湿难易程度等指标。观察结果见表1。
由表1可以看出,冷冻干燥的干粉在结构上更酥松,得到的干粉细腻,更适合商品化;而烘箱干燥的产品结构坚硬、较难收集、研磨,质构不好。添加了载体的干粉产品返潮速度降低,能更长时间地保持较好的干燥状态,而未添加载体的样品干燥后表面有粘稠的糖液,吸湿速度很快。两种载体亦有不同的干燥效果,由于CMC比麦芽糊精的玻璃体转变温度高,因此添加少量即可表现出降低干燥后粉末粘度的作用,而麦芽糊精的添加量则需要多于CMC的添加量;添加CMC后,产品的干燥速率明显降低,产品颜色也变为紫色,表现出蓝莓在碱性环境下的颜色,对于产品的感官是不利的。综合考虑以上外观结构,认为添加麦芽糊精的冷冻干燥工艺能够得到外观结构较好的产品,由于麦芽糊精添加在食品中安全性较高,因而添加载体量的问题并不会造成严重的影响。
2.2 不同处理条件下蓝莓果干粉的含水量
粉末产品的含水量低于5%时,得到的产品的品质较好:外观干燥、细腻,不易长菌,便于保存。因此,该研究检测了不同干燥条件下干燥所得产品的含水量,结果见表2。
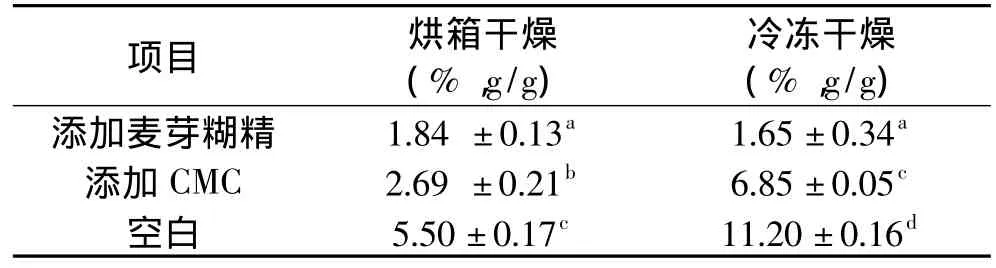
表2 不同干燥条件下干燥所得产品的含水量Table 2 Water quantity of the drying products in different drying method
由表2可知,未添加载体的空白组样品含水量最高,分别为5.50%(烘箱干燥),11.20%(冷冻干燥)。推测原因是未添加载体的样品吸湿性强,干燥后处于空气中含水量又会上升,因而较难达到合适的水分含量,这与外观评价中观察到的粘稠现象是一致的。
与烘箱干燥方法组相比,冷冻干燥组的产品普遍含水率较高,这是由于冷冻干燥需要消耗更高的能量、干燥速率也较慢,在同等的干燥条件及时间下,烘箱干燥得到的产品含水量更低。添加了载体的两组样品相比,添加麦芽糊精的样品组明显比添加了CMC的样品组含水量低,推测虽然CMC与麦芽糊精都是大分子物质,能有效降低单糖干燥过程中的粘稠;但二者的物理性质不同,在干燥过程中所需的时间差别很大。由实验结果看到,以麦芽糊精为载体,干燥产品的含水量更优。因而,认为以麦芽糊精为载体更有利于干燥,其含水量低于2%,是比较合适的粉末产品含水量。
2.3 不同干燥方法对蓝莓干粉中花色苷含量的影响
花色苷是蓝莓中最重要的营养成分,采用不同的干燥方法后,蓝莓中花色苷含量的变化是不同的,能够很好地反映该方法对蓝莓重要营养成分的保护效果。花色苷含量变化越小,该方法的营养损失越少。测定各组蓝莓样品的花色苷含量(mg/100g鲜果),结果见图1。

图1 不同干燥处理后的蓝莓花色苷含量Fig.1 Anthocyanin of the blueberry drying product
由图1可知,未添加载体的样品组,干燥后花色苷含量变化大,已经超过了50%,非常不利于干燥;添加了载体的样品组,营养的保存普遍较好,尤其是添加了CMC的样品组,花色苷的保留达到最高。鼓风干燥与冷冻干燥组对比,鼓风干燥的样品组花色苷含量变化均比冷冻干燥样品组变化大,因而损失了更多的重要营养成分。可见,添加了载体的冷冻干燥组得到的产品具有更好的营养保持,其中添加CMC的样品营养保持较优于添加糊精的结果,但差别不大。
2.4 不同干燥方法对蓝莓干粉中总抗氧化能力变化的影响
此前,此方法用于评价植物多酚类物质提取物的抗氧化能力,VC具有很强的抗氧化能力,常作为抗氧化能力的参照物。本实验为了比较蓝莓粉末提取物的抗氧化能力,首先测试了VC的抗氧化能力,即配制一系列不同浓度的VC水溶液,按照1.2.2.3方法程序测定不同浓度对应的OD值,绘制标准曲线,标准曲线中横坐标为VC的浓度C(mg/g),纵坐标为吸光度A值,即A=4.6965C+0.0989,相关系数 R2=0.9988。配制适当浓度的提取物50%甲醇溶液,使得测定的吸光度A值在0.5~0.9之间,将A值代入标准曲线中,计算出每克提取物相当的VC的质量。
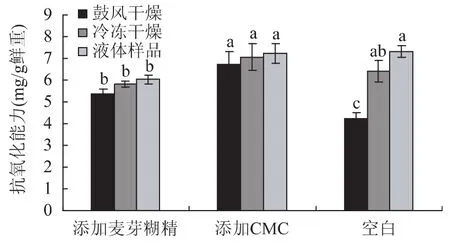
图2 干燥前后蓝莓果干粉抗氧化能力Fig.2 Antioxidant ability before and after the drying

表3 干燥后蓝莓果干粉抗氧化能力损失率Table 3 Loss ratio of antioxidant ability after the drying
分析图2中结果,未添加载体的样品组,干燥后抗氧化活性变化大,其中鼓风干燥方法组的变化明显,损失率为42.29%,非常不利于干燥,冷冻干燥组的损失率为12.39%,略低于烘箱干燥方法组,但结果仍不理想;添加了载体的样品组,不论干燥方法如何,营养的保存均超过了不添加载体的样品组,特别是添加了糊精的冷冻干燥组和添加了CMC的冷冻干燥组,其抗氧化能力损失降到了最低,分别是3.55%和2.51%。我们发现,蓝莓干燥前后抗氧化能力的变化与花青素含量的变化趋势有一致性,但也存在着差别,这可能是因为花青素是提供蓝莓抗氧化能力最主要的化合物之一。其变化上的差别可能是由一些多酚、黄酮类物质组成上的产别而产生的。
3 结论
综合分析各组样品外观及品质,得到添加麦芽糊精、冷冻干燥法制备的蓝莓果干粉为最佳工艺方法,经验证实验得到:蓝莓果干粉总花青素含量为132mg/100g鲜重,与鲜果花色苷154mg/100g鲜重相比仅下降了22mg/100g鲜重,营养价值保持良好;蓝莓果干粉抗氧化能力为5.816mgVC/g鲜重,保持率为96.45%。该方法针对性地解决了蓝莓中营养物质易流失、蓝莓中低分子糖含量高引起吸湿性强的问题;得到的蓝莓果干粉外观结构酥松,含水量低,总花青素含有率高,抗氧化能力较强。为生产优质蓝莓果干粉的工艺及进一步参数优化提供了新思路,为合理利用生物量丰富的蓝莓资源及制备高品质蓝莓干燥产品提供指导。
[1]Mazza G,Kay D,Tony Cotterll,et al.Absorption of anthocyanins from blueberies and serum antioxidant status in human subjects[J].Journal of Agricultural and Food Chemistry,2002,50(10):7731-7737.
[2]Serafini M,Testa M F,Villano D,et al.Antioxidant activity of blueberry fruit is impaired by association with milk[J].Free Radical Biology and Medicine,2009,46(6):769-774.
[3]唐丽萍,杨艳梅,李艳凤,等.越橘提取物抑制宫颈癌HeLa细胞增殖及诱导其凋亡的实验研究[J].中草药,2009,40(7):1120-1122.
[4]宋雪,韩勇,籍保平,等.笃斯越橘花色苷提取物对光损伤人视网膜色素上皮细胞的保护作用[J].食品科学,2010,31(21):324-328.
[5]植物志编辑委员会.中国植物志[M].第3分册.北京:科学出版社,1991,57:75-164.
[6]Li CY,Luo JW,MacLean D.A novel instrument to delineate varietal and harvest effects on blueberry fruit texture during storage[J].Journal of the Science of Food and Agriculture,2011,91(9):1653-1658.
[7]陈宏毅.多功能蓝莓保健茶的力口工工艺[J].北方园艺,2009(4):226-227.
[8]岳晓霞,何丽莹,孙静,等.蓝莓、胡萝卜复合水晶果糕的研制[J].食品与机械,2010,26(3):148-152.
[9]曹雪丹,赵凯,李芬芳.冷冻干燥法加工蓝莓汁固体饮料的研究[J].保鲜与加工,2011,11(1):25-27.
[10]Chakraborty M,Savarese M,Harbertson E,et al.Effect of the novel radiant zone drying method on anthocyanins and phenolics of three blueberry liquids[J].Journal of Agricultural and Food Chemistry,2010,58(1):324-330.
[11]韩磊,唐金鑫,吴亚飞,等.含糖类物料的喷雾干燥林[J].林产化学与工业,2006,26(2):117-121.
[12]黄立新,周瑞君,A S Mujumdar.近年来喷雾干燥技术研究进展和展望[J].干燥技术与设备,2008,6(1):3-8.
[13]乔晓玲,闫祝炜,张原飞,等.食品真空冷冻干燥技术研究进展[J].食品科学,2008,29(5):469-474.
[14]孟宪军,宋德群,王冠群,等.响应面法优化蓝莓花色苷提取工艺的研究[J].食品工业科技,2010,31(7):226-229.
[15]陈健,孙爱东,高雪娟,等.蓝莓花青素的提取及抗氧化性的研究[J].北京林业大学学报,2011,33(2):126-129.
[16]White B,Howard L R,Prior R.Impact of different stages of juice processing on the anthocyanin,flavonol,and procyanidin contents of cranberries[J].Journal of Agricultural and Food Chemistry,2011,59(9):4692-4698.
[17]樊梓鸾,王振宇,程翠林,等.5种野生浆果的抗氧化和抗细胞增值活性[J].食品科学,2010,31(17):148-152.
[18]杨桂霞,吴毅男.笃斯越橘花色素的分离鉴定及栽培种花色素的定量分析[D].长春:吉林农业大学,2004.
[19]杨兆燕.pH示差法测定桑葚红色素中花青素含量[J].食品科技,2007(1):201-203.
[20]Prieto P,Pineda M,Aguilar M.Spectrophotometric quantitation of antioxidant capacity through the formation of a phosphomolybdenum complex:Specific application to the determination of vitamin E[J].Analytical Biochemistry,1999,269(2):337-341.
