双水相体系萃取分离葡萄酒下脚料中葡萄皮蛋白质
2013-12-08张喜峰马吉福苏风贤张芬琴
张喜峰,马吉福,苏风贤,张芬琴
(河西学院农业与生物技术学院,甘肃张掖734000)
在葡萄酒加工过程中,每年产生约占葡萄加工量20%~30%的大量皮渣废弃物,其中主要是葡萄皮、种子和果梗[1]等。葡萄皮渣含有多酚类化合物[2]、白藜芦醇[3]、花色素[4]、萜类物质[5]、膳食纤维[6]、蛋白质[7]等多种功能性成分。目前我国对葡萄皮中蛋白质的研究相对较少。王战勇和苏婷婷[7]利用传统的碱液法浸提葡萄皮粗蛋白,但是在实际工业化生产中存在操作繁琐、周期较长的缺点。双水相萃取操作条件温和、处理量大、易于连续操作、且蛋白质能保持其天然的空间构型,不易失活[8]。本文采用聚乙二醇和硫酸铵双水相体系萃取葡萄酒下脚料中葡萄皮中的蛋白质。分别考察PEG相对分子质量、PEG质量分数、(NH4)2SO4质量分数、NaCl质量分数、样品加入量、p H、萃取时间、萃取温度对葡萄皮蛋白质分配系数及萃取率的影响,然后选取对萃取率影响较大的四个因素进行Box-Behnken的中心组合实验,获取最佳萃取条件。通过高效充分提取蛋白质,促进葡萄皮蛋白功能食品加工可持续发展,以期为葡萄皮蛋白利用开辟新的途径,为其工业化提取葡萄皮蛋白质奠定基础。
1 材料与方法
1.1 材料与仪器
葡萄酒下脚料 取甘肃滨河食品工业集团,经挑选、清洗、晒干,得到干净的葡萄皮;PEG(600、1000、2000、4000、6000)、硫酸铵、牛血清蛋白、考马斯亮蓝G-250、磷酸、95%乙醇、磷酸氢二钠、磷酸二氢钠、氯化钠 均为分析纯。
PL203电子天平 梅特勒-托利多仪器(上海)有限公司;XO-SM5O超声-微波反应系统 南京先欧仪器制造有限公司;DKB-501数显超级恒温水浴锅、DHG-9101.1电热恒温鼓风干燥箱 扬州市三发电子有限公司;722型分光光度计 上海光谱仪器有限公司;CR-21高速离心机 日本日立;漩涡混合器 上海精科实业有限公司。
1.2 实验方法
1.2.1 粗提液的制备 葡萄皮经干燥粉碎后,称取30g葡萄皮粉末置于450mL磷酸二氢钠-磷酸氢二钠缓冲液中,在恒温30℃下,浸提60min。在超声波微波反应系统下对葡萄皮蛋白进行提取,将得到的悬浊液于6000r/min离心10min,倾倒上清液可得到含葡萄皮蛋白质的粗提液,测定粗提液中蛋白质含量。
1.2.2 考马斯亮蓝G-250测定蛋白含量[9]5支试管中,分别精确吸取120μg/mL牛血清蛋白原液0.20、0.40、0.60、0.80、1.00mL,用蒸馏水全部稀释至1.0mL,然后分别加入5.00mL考马斯亮蓝溶液,混合均匀,于(25±1)℃的恒温水浴中保温10min,冷水浴中冷却后,立即于595nm波长处比色测定。以1.0mL蒸馏水代替样品液,加入5.00mL考马斯亮蓝溶液,其余操作同上,做空白对照。
1.2.3 双水相系统相图制作[10]精确称取质量分数为50%的不同相对分子质量的PEG于试管中,加入1g dd H2O,用滴定管缓慢滴加已配好的质量分数为40%(NH4)2SO4溶液,并在漩涡混合器上混合,观察溶液的澄清程度,直至试管中溶液开始出现浑浊为止。记录(NH4)2SO4的加量(g)。然后加水,使其澄清,继续向试管中滴加(NH4)2SO4溶液并不断混匀,直至再次达到浑浊,如此反复操作。计算每次达到浑浊时,PEG和(NH4)2SO4在系统总量中的质量分数(g/g),以PEG的质量分数为纵坐标,(NH4)2SO4的质量分数为横坐标作图,即得到一条双节线。
1.2.4 双水相萃取方法 固定体系总质量为10.00g,加入适量的PEG和(NH4)2SO4,充分振荡使成相物质溶解,同时完成了葡萄皮蛋白在双水相系统中的分配过程,在一定条件下萃取。此双水相系统静置一定时间,当两相达到相分离,葡萄皮蛋白富集于双水相系统的上相中,读取上下相体积,求相比R;分别测定上下相蛋白质浓度,计算葡萄皮蛋白的分配系数K及萃取率Y,如下式:
R=上相体积(Vt)/下相体积(Vb)
K=上相蛋白浓度(Ct)/下相蛋白浓度(Cb)
Y(%)=RK/(1+RK)×100
1.2.5 双水相萃取参数选择实验 分别设定PEG相对分子质量为 600、1000、2000、4000、6000,质量分数为 10%、14%、18%、22%、26%,(NH4)2SO4质量分数为 20%、22.5%、25%、27.5%、30%,p H5、6、7、8、9,NaCl质量分数为0.6%、1.2%、1.8%、2.4%、3%,样品加入量 2.4、2.9、3.4、3.9、4.4mL,温度 25、30、35、40、45℃,萃取时间 120、160、200、240、280min,确定最佳PEG相对分子质量。
1.2.6 Box-Behnken的中心组合设计 在分别研究萃取单因素实验的基础上,选取对葡萄皮蛋白质萃取率影响较大的四个因素,采用Design-Expert 8.0.5软件对Box-Behnken的中心组合的萃取实验结果进行分析[11]。
2 结果与讨论
2.1 标准曲线的绘制
用紫外可见分光光度计测595nm处吸光度,绘制蛋白总量-吸光度标准曲线,以试管中牛血清白蛋白的总量(mg)为横坐标,相应的吸光度值(A)为纵坐标作标准曲线,得到其线性方程为y=5.606x+0.0265(R2=0.9942)

表1 Box-Behnken设计因素水平表Table 1 Factors and levels of Box-Behnken design
2.2 双水相体系相图
在室温条件下,测定不同分子量 PEG/(NH4)2SO4双水相体系相图,结果见图1。考虑到萃取是在两相条件下进行的,因此选择在双节线上方的质量分数点作为单因素的参考条件。当(NH4)2SO4质量分数一定时,随着PEG相对分子质量的增大,形成双水相体系所需PEG的浓度降低。因为PEG相对分子质量越大,其憎水程度越强,且加大与(NH4)2SO4分相的动力,导致临界分相浓度降低[12]。
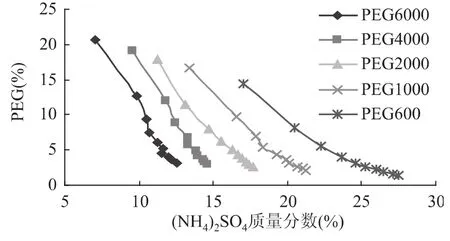
图1 不同相对分子质量PEG与(NH4)2 SO4的双水相相图Fig.1 Phase diagram of different relative molecular mass PEG and(NH4)2 SO4 in aqueous two-phase system
2.3 双水相萃取参数单因素实验结果
2.3.1 PEG相对分子质量对葡萄皮蛋白质分配行为的影响 成相聚合物的相对分子质量是影响分配平衡的重要因素,降低聚合物的相对分子质量,则蛋白质分配于富含该聚合物的相中。从图2可以看到,降低PEG的相对分子质量,葡萄皮蛋白质的分配系数和萃取率总体上呈现上升的趋势,是因为PEG分子量减小时,它的疏水性显著减弱,使葡萄皮蛋白质在上相的表面张力减小,从而易于向上相分配[13];综合考虑5种PEG中,PEG600的萃取效果最好,并且葡萄皮蛋白质在PEG600-(NH4)2SO4体系中的分配系数最高,故选PEG600为双水相系统成相物质。
2.3.2 (NH4)2SO4质量分数对葡萄皮蛋白质分配行为的影响 (NH4)2SO4用量不同,上下相电位差不同,而电位差的大小直接影响到分配系数和萃取率。随着(NH4)2SO4质量分数的增加,双水相体系离开成相临界点距离增大。图3显示,葡萄皮蛋白质的分配系数和萃取率随(NH4)2SO4质量分数的增加而总体降低,是由于(NH4)2SO4的质量分数愈高,会破坏蛋白质表面的水化层,使蛋白质发生盐析,从而使其分配系数和萃取率下降;另一方面,盐浓度过高不仅影响蛋白质的表面疏水性,而且扰乱双水相系统,改变各相中成相物质的组成[10]。固定PEG质量分数为10%的条件下,在(NH4)2SO4质量分数小于20%时,溶剂体系不能形成两相。因此,确定(NH4)2SO4的质量分数为20%。

图2 PEG相对分子质量对葡萄皮蛋白质分配行为的影响Fig.2 Effect of relative molecular mass of PEG on partitioning behaviour of grape skin proteins

图3 (NH4)2SO4质量分数对葡萄皮蛋白质分配行为的影响Fig.3 Effect of ammonium sulfate concentration on partitioning behaviour of grape skin proteins
2.3.3 PEG600质量分数对葡萄皮蛋白质分配影响
图4表明,随着PEG600质量分数的增加,蛋白质的分配系数和萃取率变化呈现先增加后减小的趋势,从分配理论上来讲,当 PEG600用量较低时,(NH4)2SO4的盐析作用起重要作用,随PEG600质量分数的增加,黏度增大,阻止相间分子转移的能力增加,相界面张力也增加[10,14]。由图 4 看到,当 PEG600质量分数为22%时,葡萄皮蛋白质的分配系数和萃取率最高,因此综合各方面因素,最终确定PEG600质量分数为22%最佳。

图4 PEG600质量分数对葡萄皮蛋白质分配行为的影响Fig.4 Effect of PEG 600 concentration on partitioning behaviour of grape skin proteins
2.3.4 NaCl质量分数对葡萄皮蛋白质分配行为的影响 盐的浓度对葡萄皮蛋白质分配行为的影响主要反映在对蛋白质疏水性的影响上。在影响生物分配的众多因素中,用所加盐的种类和其浓度变化来控制生物分子在双水相中的分配是一种很有效的方法;在双水相体系中,加入电解质时,其阴阳离子在两相中会有不同的分配,同时,由于电中性的约束,存在穿过相界面的电势差,它是影响荷电大分子如蛋白质分配的主要因素[15]。图5显示,随着NaCl质量分数的增加,葡萄皮蛋白质的分配系数和萃取率同步变化,都先增大后减小,即在离子强度较低时,有利于葡萄皮蛋白质分配到上相,但离子强度过高时,反而使分配系数和萃取率下降。因此选用NaCl质量分数为1.2%进行下一步实验。
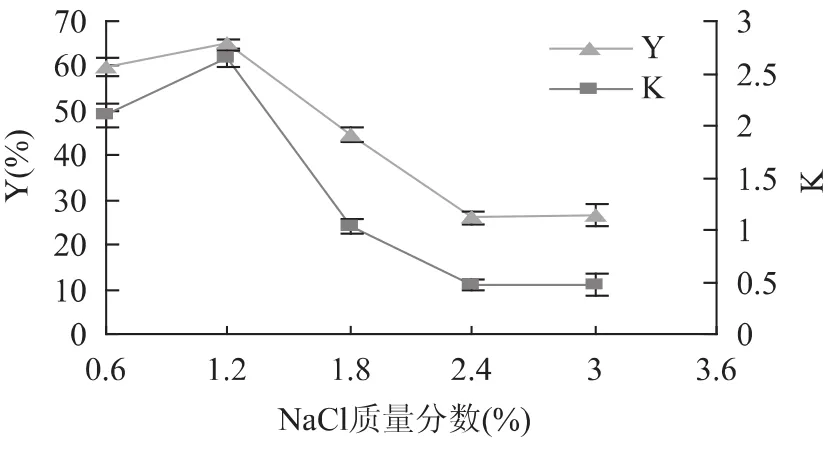
图5 NaCl质量分数对葡萄皮蛋白质分配行为的影响Fig.5 Effect of NaCl concentration on partitioning behaviour of grape skin proteins
2.3.5 p H对葡萄皮蛋白质分配行为的影响 相体系的pH对被萃取物的分配有很大的影响,是由于体系的pH变化能明显地改变两相的电位差,而且p H的改变还导致蛋白质带电性质的变化,即影响蛋白质分子可离解基团的离解度,从而改变蛋白质的表面电荷数来影响分配[13]。体系p H与葡萄皮蛋白质的等电点pI在4附近[16],相差越大,则蛋白质在两相中分配愈不平均。图6表明,葡萄皮蛋白质的分配系数和萃取率随着pH的增大呈现先增加后减小的趋势,可以看到,p H7时葡萄皮蛋白质的分配系数和萃取率最高,因此确定最佳pH为7。

图6 pH对葡萄皮蛋白质分配行为的影响Fig.6 Effect of pH on partitioning behaviour of grape skin proteins
2.3.6 样品加入量对葡萄皮蛋白质分配行为的影响 图7显示,样品加入量在1.9~4.4mL时,葡萄皮蛋白质的分配系数和萃取率有先增大后减小的趋势。当样品加入量为2.4mL时,葡萄皮蛋白质的分配系数和萃取率达到最大。因此确定样品加入量为2.4mL。
2.3.7 萃取时间对葡萄皮蛋白分配行为的影响 图8显示,在80~160min范围内,葡萄皮中蛋白质的分配系数和萃取率先增大后减小的程度较大,在120min时达到最大值,而后随着萃取时间的增加,基本上处于稳定状态,考虑到后续实验的进程,确定最佳萃取时间为2h。
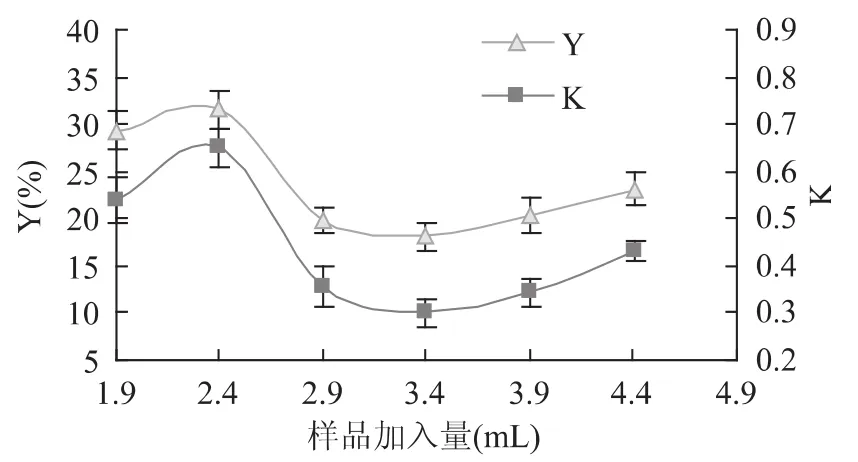
图7 样品加入量对葡萄皮蛋白质分配行为的影响Fig.7 Effect of sample volume added on partitioning behaviour of grape skin proteins

图8 时间对葡萄皮蛋白质分配行为的影响Fig.8 Effect of time on partitioning behaviour of grape skin proteins
2.3.8 萃取温度对葡萄皮蛋白质分配行为的影响温度的变化可以影响物质的成相浓度,进而影响其分配。但一般说来,1~2℃的温度改变不会影响目标产物的萃取分离。因此基于经济及操作的角度考虑,大规模的双水相操作一般在室温下进行[17]。图9显示,葡萄皮蛋白质的分配系数和萃取率对温度的变化较为敏感,温度通过影响相图进而影响分配系数,因此在实验中对某些敏感的相体系仍要注意温度影响。在临界点附近,温度对相图的影响最显著,对分配系数的影响最强。当远离临界点时,温度对相图的影响较小,分配系数对温度的变化也不敏感,这是因为远离临界点时,成相聚合物的浓度增大,对蛋白质的稳定作用增强[13]。实验结果表明,葡萄皮中蛋白质的分配系数和萃取率呈现不规则的变化,综合考虑,确定35℃为最佳温度。

图9 温度对葡萄皮蛋白质分配行为的影响Fig.9 Effect of temperature on partitioning behaviour of grape skin proteins
2.4 双水相萃取工艺优化
2.4.1 响应面结果分析 根据以上单因素的实验结果,采用响应面方法进一步优化实验条件。根据Box-Behnken的中心组合设计原理,以萃取率为响应值,在PEG600-(NH4)2SO4体系基础上,对pH(A)、NaCl质量分数(B)、样品加入量(C)和温度(D)设计了4因素3水平的29组实验,其中5组中心点重复实验。实验结果见表2。
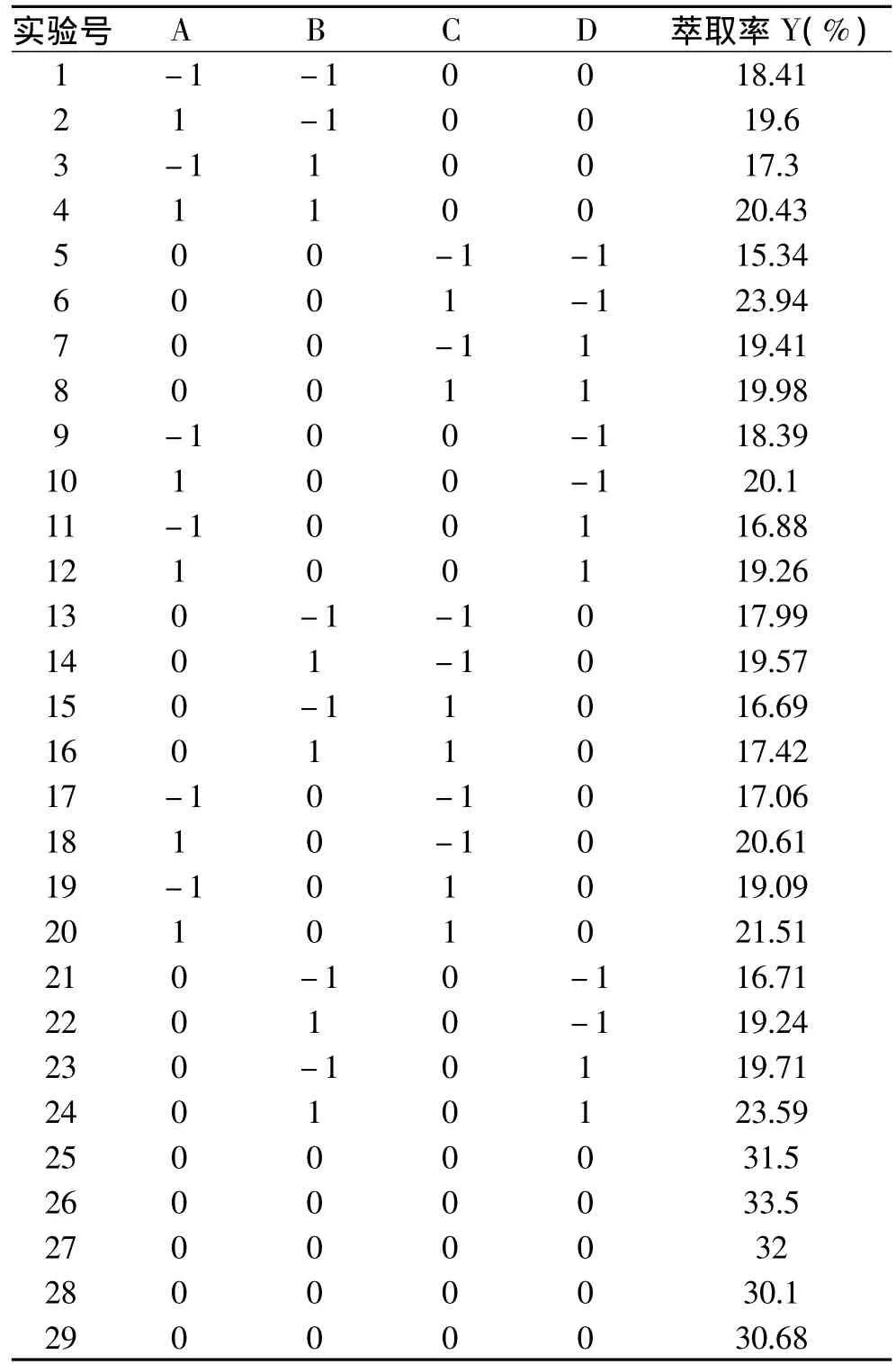
表2 Box-Behnken设计方案与结果Table 2 Arrangement and results of Box-Behnken design
2.4.2 Box-Benhnken Design实验数据分析 以葡萄皮蛋白质萃取率Y(%)为响应值,根据表2的实验结果,用Design-Expert 8.0.5.0软件进行多元回归分析,方差分析及F检验结果列于表3。经回归拟合后,实验因子对响应值的影响可用以下回归方程表示:
Y=31.556+1.198333A+0.703333B+0.720833C+0.425833D+0.485AB-0.2825AC+0.1675AD-0.2125BC+0.3375BD-2.0075CD-6.29092A2-6.53842B2-6.29467C2-5.80217D2
由表3可以看到,本模型拟合程度明显,其F=12.84,p<0.0001,说明仅有不到0.01%的概率模型不显著;对其失拟检验的F值为2.75,说明存在17.08%的概率失拟,失拟项在α=0.05水平上不显著(p=0.1708>0.05),模型决定系数为92.78%,说明该模型具有较好的可信度,自变量与响应值之间的线性关系显著,可用于实验的理论预测[18]。在表中p<0.05,对应项为模型影响显著项,因此该模型中显著项为 A2、B2、C2、D2。在所选取的各因素水平范围内,按照对结果的影响排序:p H(A)>样品加入量(C)>NaCl质量分数(B)>温度(D)。

表3 对拟合二次多元模型的方差分析结果Table 3 Variance analysis results for the fitted quadratic polynomial model
2.4.3 显著因素水平的优化 利用Design-Expert 8.0.5.0软件根据回归方程进行响应面分析,绘制响应面分析曲面图,结果如图10所示,每个响应面分析图分别代表着两个独立变量之间的相互作用,此时第3、4个变量保持在最佳水平。利用 Design-Expert 8.0.5软件对蛋白质萃取率的二次多项式数学模型进行求导,可获得该模型极值点,即pH7.1、NaCl质量分数为1.2%、样品加入量为2.41mL、温度为35.2℃。此时葡萄皮蛋白质的萃取率可达31.66%。
2.4.4 模型验证实验 以响应面实验优化得到双水相体系组成条件进行蛋白质萃取实验,做3组平行实验所得结果为31.08%,与预测值相差0.58%,由此可见,采用响应面分析法对葡萄皮蛋白质的最佳萃取条件的优化是行之有效的。
3 结论
通过单因素实验和响应面分析法,确定葡萄皮蛋白质所需的最佳萃取条件为:PEG600质量分数为22%,(NH4)2SO4质量分数为20%,pH为7.1,NaCl质量分数为1.2%,样品加入量为2.41mL,温度为35.2℃,萃取时间2h,萃取率为31.08%。因此,利用响应面分析方法对葡萄皮蛋白质的萃取条件进行优化,可以获得最优的工艺参数,能有效的减少工艺操作的盲目性,从而为进一步的实验研究奠定基础。
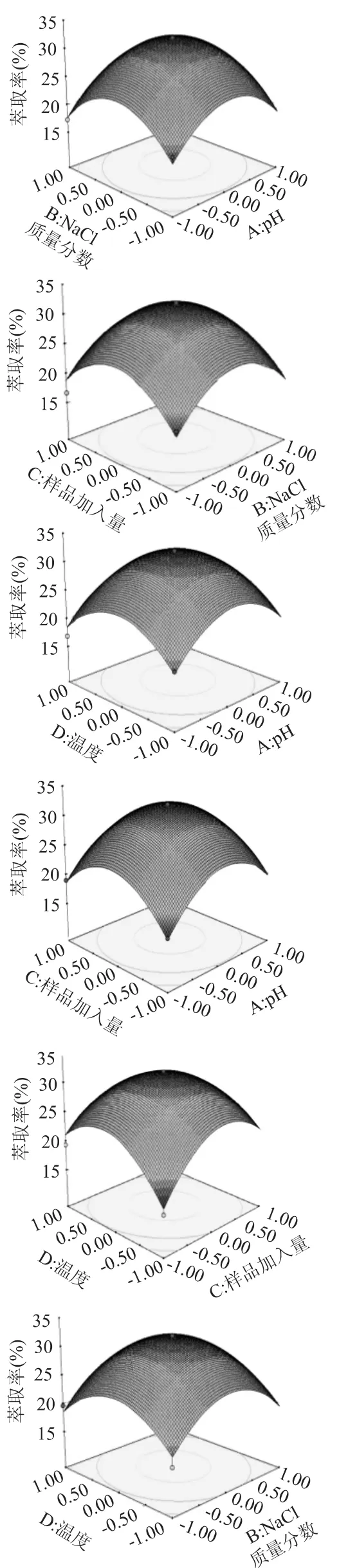
图10 各因素交互作用的响应面和等高线图Fig.10 Response surface plots for the pairwise interactive effects
[1]彭丽霞,黄彦芳,刘翠平,等.酿酒葡萄皮渣的综合利用[J].酿酒科技,2010(10):93-96.
[2]范济民,赵志换,穆瑞娜.葡萄皮中多酚的提取及其抗氧化活性研究[J].化学与生物工程,2010,27(10):59-61.
[3]向阳,张彤.高效液相色谱法测定葡萄皮和葡萄籽中白藜芦醇的含量[J].卫生研究,2005,32(5):490-494.
[4]杨夫臣,吴江.葡萄果皮花色素的提取及其理化性质[J].果树报,2007,24(3):287-292.
[5]田丽婷,马龙.超临界二氧化碳萃取葡萄皮渣中三萜类总组分[J].中国现代应用药学杂志,2004,21(1):6-8.
[6]孙艳,房玉林,张昂,等.葡萄皮渣中可溶性膳食纤维提取工艺研究[J].西北农林科技大学学报,2010,38(10):147-151.
[7]王战勇,苏婷婷.葡萄皮中粗蛋白提取条件的研究[J].氨基酸和生物资源,2004,26(2):6-7.
[8]马春宏,朱红,王良,等.双水相萃取技术的应用研究进展[J].光谱实验室,2010,27(5):1906-1913.
[9]刘叶青.生物分离工程实验[M].北京:高等教育出版,2007:81-82.
[10]周红航,王维香.聚乙二醇/硫酸铵双水相体系萃取猪胰蛋白酶[J].化工进展,2009,28(2):305-308.
[11]Jiang L F.Optimization of fermentation conditions for pullulan production by Aureobasidium pullulans using response surface methodology[J].Carbohydrate Polymers,2010,79:414-417.
[12]袁晶,宋达峰,胡炜力,等.响应面法优化植物乳杆菌素的双水相萃取条件[J].中国食品学报,2011,11(3):90-96.
[13]郑楠,刘杰.双水相萃取技术分离纯化蛋白质的研究[J].化学与生物工程,2006,23(10):7-9.
[14]曹对喜,杜征,韩玉婷,等.双水相萃取法提取木瓜蛋白酶的研究[J].农产品加工,2010(10):66-69.
[15]张兰威,陈一,韩雪,等.双水相萃取法从风干香肠中分离提取蛋白酶[J].分析化学,2008,36(7):901-904.
[16]张喜峰,李彩霞,崔玮,等.反胶团萃取分离葡萄酒下脚料中葡萄皮蛋白质[J].食品与发酵工业,2012,38(2):212-218.
[17]赵晓红.双水相萃取/浮选分离-富集环境中持久性污染物的研究[D].镇江:江苏大学,2011.
[18]孟宪军,王冠群,宋德群,等.响应面法优化蓝莓花色苷提取工艺的研究[J].食品工业科技,2010,31(7):226-229.
