红酵母发酵废糖蜜产类胡萝卜素的研究
2013-12-08张秀凤辛嘉英
张秀凤,辛嘉英,2,* ,畅 乐
(1.哈尔滨商业大学食品科学与工程重点实验室,黑龙江哈尔滨150076;2.中国科学院兰州化学物理研究所羰基合成与选择氧化国家重点实验室,甘肃兰州730000)
类胡萝卜素不仅是理想的食品着色剂和营养增补剂,更重要的是类胡萝卜素还具有预防血管硬化、抑制肿瘤发生、增加宿主免疫力和抗氧化等功能[1-4]。人们越来越意识到类胡萝卜素这种天然色素的重要作用,尽量降低类胡萝卜素的生产成本也成为目前学者主要的研究课题。废糖蜜是糖厂的副产物。北方地区盛产甜菜,甜菜糖蜜为甜菜加工量的3%~4%,来源十分丰富[5-6]。糖蜜中含有丰富的酵母,是可以利用的可发酵性糖[7-9]。但大部分厂家将其废弃,造成环境污染[10]。随着我国制糖工业的发展,糖蜜的产量日益增加,进行废糖蜜利用的研究是非常必要的。采用红酵母生产类胡萝卜素具有营养要求简单粗放、发酵周期短、培养方式简单、营养条件要求低、可高密度培养等优点。2004年张坤生研究了番茄酱、花生油对粘红酵母产类胡萝卜素的影响,类胡萝卜素产量分别比对照组提高了24.75%和13.1%。2005年Z.Aksu和A.Tugba在粘性红圆酵母中添加棉籽油和Tween80。甘蔗糖蜜作为碳源可获得最高色素产量125.0mg/L,乳清乳糖作为碳源时色素产量为35.5mg/g。2008年翟红梅研究了维生素对粘红酵母生产类胡萝卜素的影响,在培养基中添加 VB10.2mg/L、VB21.0mg/L、VC0.7mg/L 时,类胡萝卜素产量可达 12.35mg/L,比对照组提高了9.78%[11-13]。若能利用红酵母发酵废糖蜜生产类胡萝卜素,不仅可以丰富市场上增色饲料添加剂的种类,而且还能提高废糖蜜的利用价值,减少由废糖蜜带来的环境污染,从而增加糖厂的经济效益[14-17]。本文研究了红酵母发酵废糖蜜最佳的发酵培养基配方和发酵工艺条件,以及发酵过程中多因素对生物转化量的影响。
1 材料与方法
1.1 材料与仪器
3mol/L HCl溶液、丙酮溶液 分析纯;废糖蜜 依安糖厂;AS2.2241红酵母(Rhodotorula sp.)华东理工大学生物反应工程国家重点实验室交流菌种,以苯乙酮蒸气为唯一碳源,从土壤中分离筛选获得,现保存于中国普通微生物保藏中心;斜面培养基配方 葡萄糖 15g/L,蛋白胨 5g/L,琼脂 20g/L,KH2PO40.5g/L,K2HPO40.5g/L,NaCl 1g/L,MgSO40.54g/L,pH6.0,装量 100mL/250mL 三角瓶,121℃湿热灭菌20min;种子培养基配方 葡萄糖40g/L,蛋白胨10g/L,酵母粉10g/L,装量50mL/250mL三角瓶,pH6.0,121℃湿热灭菌2 min;发酵培养基配方 葡萄糖 40g/L,酵母粉10g/L,蛋白胨 10g/L,MgSO41g/L,K2HPO40.5g/L,装瓶量50mL/250mL三角瓶,pH6.0,121℃湿热灭菌20min。
Spectrum756P紫外可见分光光度计 上海光谱仪器有限公司;Sigma2-16K低温冷冻离心机 德国SIGMA公司;Spectrum756P紫外可见分光光度计 上海精密科学仪器有限公司;Scientz-IID超声波细胞粉碎机 宁波新芝生物科技股份有限公司;HZQ-C空气浴振荡器 哈尔滨市东明医疗仪器厂。
1.2 实验方法
1.2.1 培养基
1.2.1.1 斜面培养基培养 将红酵母菌株从保存培养基转接到斜面活化培养基上,将斜面培养基斜放在30℃恒温培养箱内,培养48h。
1.2.1.2 种子培养基培养 接两环斜面培养基的菌种于种子培养基中,28℃振荡(180r/min)培养48h。
1.2.1.3 发酵培养基的摇瓶培养方法 将种子液按接种量10%接入摇瓶培养基中,于28℃旋转摇床(250r/min)培养120h。
1.2.2 糖蜜预处理方法 原糖蜜+蒸馏水→稀糖蜜+硫酸(pH3.5~3.8)→石棉网、电炉→保持10min→自然冷却→常温放置12h→离心取上清液,弃沉淀→调节pH至6。
1.2.3 测定方法
1.2.3.1 红酵母破壁方法[18]酸热水解法:向10mL经离心(9000r/min,15min)弃上清液后的湿菌体中加入3mol/L盐酸6mL,室温振荡30min,在沸水浴中煮沸4~5min,迅速冷却。
研磨法:取10mL经离心(9000r/min,15min)弃上清液后的湿菌体于研钵中,加入少许石英砂,研磨至粘稠状,加入10mL丙酮,于50℃水浴中提取1h,取上清液即为色素粗提液。
细胞自溶法:取 10mL经离心(9000r/min,15min)弃上清液后的湿菌体于试管中,加入10倍质量的水,并按4%的用量加入NaCl作为质壁分离剂,调p H为6.0~7.0,控制温度55℃,自溶约3h后以9000r/min离心15 min,所获沉淀水洗后再离心,即得细胞碎片。
超声波破碎法:向 10mL经离心(9000r/min,15min)弃上清液后的湿菌体中加入10mL丙酮,于超声波破碎仪上破碎1h,离心取上清液即为色素粗提液。
超声波辅助酸热法:步骤和酸热水解法相同,在盐酸浸泡过程中将试管置于超声波条件下,利用超声波来辅助破碎细胞壁。每一种破壁方法结束之后,向细胞碎片中加入10mL丙酮作为浸提剂,浸泡30min,9000r/min离心15min,所得上清液即为丙酮的类胡萝卜素浸提液。
1.2.3.2 色素提取方法[19]采用丙酮提取法,将酸热破壁后的红酵母湿菌体与酸溶液混合物在9000r/min转速下离心15min,弃上清液,沉淀用蒸馏水洗涤2次后加入10mL丙酮。室温下振荡浸泡1h提取类胡萝卜素,然后于9000r/min离心15min得上清液即为类胡萝卜素提取液,如细胞碎片中仍有色素,加丙酮进一步提取,合并上清液。将浸提液适当稀释后用756型分光光度计在475nm下测定吸光度值。按式(1)、(2)计算类胡萝卜素产量:
式中:Aλmax-最大吸收波长475nm下的吸光度;D-测定试样的稀释倍数“1”;V-提取色素用有机溶剂体积(mL);W-单位体积发酵液中干酵母菌体重量(μg/mL);0.16-类胡萝卜素的摩尔消光系数。
每克细胞的类胡萝卜素产量(mg/g)=色素产量(mg/L)/细胞生物量(g/L) 式(2)
1.2.3.3 红酵母细胞生物量的测定 取10mL培养液,9000r/min离心15min;倒掉上清液,用蒸馏水洗涤2~3次;再用蒸馏水将菌体移入预先干燥至恒重M0的称量瓶中,置90℃电热恒温干燥箱中干燥至恒重,用精密电子天平称量称量瓶和菌体总重M,则细胞生物量公式如式(3):
W(g/L)=1000×(M-M0)/10 式(3)
式中:W-细胞生物量,g/L;M-称量瓶和菌体总重,g;M0-称量瓶净重,g。
1.2.4 液态发酵实验设计
1.2.4.1 糖蜜酸处理对色素产量的影响 取三份糖蜜,每份为170g/L,分别用盐酸、磷酸、硫酸处理,并另再取一份不作处理,作为空白样。其中酵母粉10g/L,蛋白胨10g/L,MgSO41g/L,K2HPO40.5g/L,初始p H6.0,转速250r/min,接种龄48h,装液量50mL/250mL,在28℃下按10%接种量发酵120h后测定类胡萝卜素的产量。
1.2.4.2 糖蜜添加量对色素产量的影响 选择糖蜜添加量为 40、45、50、55、60、65、70、75、80、85、90、95、100、110、120、130、140、150、160、170、180、190、200g/L,其中酵母粉 10g/L,蛋白胨 10g/L,MgSO41g/L,K2HPO40.5g/L,初始 p H6.0,转速 250r/min,接种龄48h,装液量50mL/250mL,在28℃下按10%接种量发酵120h后测定类胡萝卜素的产量。
1.2.4.3 培养时间对色素的影响 取糖蜜170g/L,发酵时间分别选择为 72、96、120、144、168、192、216、240h研究菌体生长变化。其中酵母粉10g/L,蛋白胨10g/L,MgSO41g/L,K2HPO40.5g/L,初始 pH6.0,转速250r/min,接种龄48h,装液量50mL/250mL,在28℃下按10%接种量发酵后测定类胡萝卜素的产量。
1.2.4.4 破壁方法对色素产量的影响 取糖蜜170g/L,用1.2.3.1中的五种方法破壁。
2 结果与讨论
2.1 糖蜜酸处理对红酵母产类胡萝卜素的影响
由图1可知,三个酸处理组的单细胞色素含量、细胞生物量、色素产量都高于未酸处理组,处理效果浓硫酸>磷酸>盐酸。原因可能是,糖蜜用浓硫酸处理后,加酸使部分双糖转化为单糖,可以为微生物所利用。再经过煮沸,可杀死营养细胞,驱逐挥发酸等有害气体。并且,经过离心,去掉了大部分杂质。因此,废糖蜜经过酸处理更有利于菌体生长和类胡萝卜素的积累,且硫酸的效果最好。

图1 酸处理糖蜜对红酵母产类胡萝卜素的影响Fig.1 Effect of acid-treated molasses on the production of carotenoids by Rhodotorula glutinis
2.2 糖蜜添加量对红酵母产类胡萝卜素的影响
由图2和图3可知,用糖蜜代替葡萄糖对红酵母进行发酵,其色素产量最大值为葡萄糖发酵的0.97倍,生物量为1.04倍,证明糖蜜可以替代葡萄糖作为红酵母液态培养基中的碳源,而用糖蜜做碳源在一定程度上提高了生物量,可能是因为糖蜜中富含的营养物质可以提高其生物量。产量几乎相同时,葡萄糖使用量为40g/L,而糖蜜添加量为170g/L,是葡萄糖的4.25倍。原因为本实验所用的每1g原甜菜糖蜜含有0.214g总糖,甜菜糖蜜所含糖类几乎全为蔗糖,而纯蔗糖培养红酵母产量比葡萄糖高,但其价格也高于葡萄糖,如果用糖蜜作碳源即使是在以170g/L添加量的情况下,其成本也较葡糖糖大幅度减少。由此证明甜菜糖蜜可以替代葡萄糖作为红酵母液态发酵的廉价碳源。糖蜜做碳源的培养基色素产量与葡萄糖的相比较低,主要原因可能是,糖蜜做碳源的培养基中的生物量远高于葡萄糖的,糖蜜延长了发酵时间。在发酵时间(5d)之内,仅促进了红酵母的生长,还未来得及进行色素积累,此方面还需要进一步研究。
从经济角度上看,近几年糖蜜的价格为800元/t,而葡萄糖浆为4300元/t。从图4中可以看出,在相同的添加量下,以葡萄糖浆为唯一底物培养基的色素产量为糖蜜的三倍,而价钱却高了五倍,综合成本考虑,糖蜜是一种廉价高效的培养基碳源替代物,将进一步研究。
2.3 培养时间对红酵母产类胡萝卜素的影响
如图5所示,在初始阶段,细胞生物量和色素产量都在缓慢增加,到120h后,单细胞色素含量也在逐渐增加,但细胞生物量开始下降但随后又开始增加。到达168h,单细胞色素含量和色素产量均为最高值。原因可能是因为糖蜜延长了发酵时间,产物积累得慢。因此选择最佳发酵时间为168h。

图2 不同糖蜜添加量对红酵母产类胡萝卜素的影响Fig.2 Effect of different additive molasses on the production of carotenoids by Rhodotorula glutinis

图3 糖蜜与葡萄糖最大产值时各因素情况Fig.3 Various factors effect of production value maximization of molasses and glucose

图4 糖蜜与葡萄糖相同添加量时各因素情况Fig.4 Various factors effect of the same addition of molasses and glucose
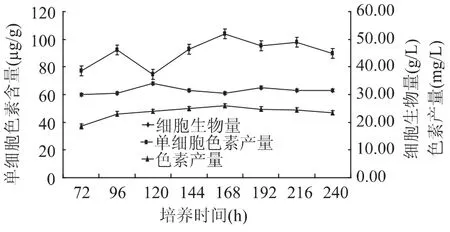
图5 培养时间对红酵母产类胡萝卜素的影响Fig.5 Effect of fermentation time on the production of carotenoids by Rhodotorula glutinis
2.4 破壁方法对红酵母产类胡萝卜素的影响
从图6可以看出,在五种破壁方法中,自溶的破壁效果最差,只有少部分类胡萝卜素被释放出来。其次是研磨法,研磨法的破壁效果一般,且研磨费时费力,容易造成研磨不充分,而且在转移时不能够完全转移,会有少量的损失。然后是酸热法和超声波破碎法及超声波辅助酸热法。其中酸热法的破壁效果显著,在某实验条件下酸热法具有最好的破壁效果,分析机制可能是由于酸热法使用了对细胞壁中原来结构紧密的某些成分具有强力疏松作用的盐酸,并配合沸水处理及冷却处理,使细胞壁结构得以破坏,胞内物质溶出。利用超声波辅助酸热法得到的类胡萝卜素的含量最高,酸热法次之,两者结果差异不显著(p>0.05),考虑到生产成本、工艺操作等因素,酸热法操作简单,成本低廉,破壁效果显著,所以本实验选择酸热法为最佳破壁方法。

图6 五种破壁方法对红酵母产类胡萝卜素的影响Fig.6 Effect of five cell disruption methods on the production of carotenoids by Rhodotorula glutinis
3 结论
经过单因素实验,确定了糖蜜预处理的最佳酸为硫酸,最佳破壁方法为酸热破壁法。得出红酵母(Rhodotorula sp.)AS2.2241,在以糖蜜添加量为170g/L、蛋白胨10g/L,酵母粉10g/L,培养基初始pH为6.0、摇床转速为 250r/min、接种龄 48h,装液量 100mL/500mL,在28℃下按10%接种量发酵,发酵时间为168h的培养条件下,菌株的生物量为30.75g/L,单细胞色素含量为104μg/g,色素产量为26mg/L。甘蔗糖蜜来源允足、价格低廉,作为原料发酵生产胡萝卜素成本较低。红酵母(Rhodotorula sp.)AS2.2241,发酵周期短,以蔗糖蜜作为原料,在优化的发酵条件下,菌株的生物量、类胡萝卜素含量及类胡萝卜素产量均得到较大提高,具有良好的应用前景。另外,类胡萝卜素为胞内脂溶性小分子物质,分子量在500左右,其提取方法也可以首先将酵母菌体干燥成粉末,再用有机溶剂浸提。这种方法简便可靠,有待于进行相关研究。
[1]王岁楼.红酵母产生类胡萝卜素的研究[J].中国粮油学报,2001,16(5):43-46.
[2]王伟霞,李福后.红酵母RY-8菌株类胡萝卜素与SOD的纯化及部分性质[J].食品科技,2009(8):31-33.
[3]张闯,张玉苍,何连芳.不同微生物生产类胡萝卜素的研究现状[J].食品研究与开发,2011(2):11-12.
[4]陈欣.红酵母发酵产类胡萝卜素条件的优化[J].食品科学,2009(15):49-50.
[5]赵颖,罗璇,钟晓凌,等.响应面法优化产类胡萝卜素红酵母液体发酵培养基的研究[J].化学与生物工程,2007(12):35-36.
[6]张闯,何连芳,张玉苍.红酵母生物合成类胡萝卜素的培养条件优化[J].中国酿造,2010(11):32-34.
[7] MALDONADE I R,RODRIGUEZ-AMAYA D B,SCAMPARINIA R P.Carotenoids of yeasts isolated from the Brazilian e-cosystem[J].Food Chemistry,2008,107(1):145-150.
[8]Frengova GI,Beshkova DM.Carotenoids from Rhodotorula and Phaffia:yeasts of biotechnological importance[J].Ind Microbiol Biotechnol,2009,36(2):163-180.
[9]Buzzini P,Innocenti M,Turchetti B,et al.Carotenoid profiles of yeasts belonging to the genera Rhodotorula,Rhodosporidium,Sporobolomyces,and Sporidiobolus[J].Can J Microbiol,2007,53(8):1024-1031.
[10]Breierová E,Gregor T,Marová I,et al.Enhanced antioxidant formula based on a selenium-supplemented carotenoid-producing yeast biomass[J].Chem Biodivers,2008,5(3):440-446.
[11]刘琦,辛嘉英.红酵母及红酵母产类胡萝卜素研究进展[J].食品工业科技,2010,11(3):23-26.
[12]张颖鑫,辛嘉英,刘书娟,等.金属离子对红酵母菌产类胡萝卜素影响的研究[J].食品工业科技,2010,31(1):10-11.
[13]韩梅,葛向阳,钱和,等.锁掷酵母高产类胡萝卜素的发酵条件的研究[J].食品工业科技,2011,32(12):47-48.
[14]Doucha J,Lívansky K,Kotrbácek V,et al.Production of Chlorella biomass enriched by selenium and its use in animal nutrition:a review[J].Appl Microbiol Biotechnol,2009,83(6):1001-1008.
[15]Bumbak F,Cook S,Zachleder V,et al.Best practices in heterotrophic high- cell- density microalgal processes:achievements,potential and possible limitations[J] .Appl Microbiol Biotechnol,2011,91(1):31-46.
[16]TINOI J,RAKARIYATHAM N,DEMINGR L.Simples optimization of carotenoid production by Rhodotorulag lutinis using hydrolyzed mung bean waste flour as substrate[J].Process Biochemistry,2005,40(7):2551-2557.
[17]顾国贤.酿造酒工艺学[M].北京:中国轻工业出版社,1999:323-325.
[18]梁慧星,李朝霞,陈欣.红酵母类胡萝卜素提取工艺及色素稳定性研究[J].湖北农业科学,2011,50(4):815-817.
[19]杨文,吉春明.一种简单的胞壁破碎方法[J].微生物学通报,1995,22(1):58-59.
