利用原生质体融合技术构建梨酒酵母工程菌
2013-12-08张大为洪磊东
张大为,张 洁,洪磊东,金 磊,高 健,梁 芳
(1.湖南科技大学生命科学学院,湖南湘潭411201;2.陕西科技大学生命科学学院,陕西西安710021)
原生质体融合(Protoplast Fusion),即通过酶降解微生物、植物及动物细胞的细胞壁,得到原生质体,采用化学、物理或生物学方法将不同属或属间的细胞进行细胞壁内的物质融合,使其遗传物质发生重组,表现出新性状的一门遗传育种技术,称之为原生质体融合[1]。原生质体融合技术是存在于自然界中的一种生物进化方式,人们很早就发现它的存在,但真正研究开始于上世纪五十年代,从此学者对此项技术进行了不断深入的研究,目前出现了很多融合的方法,比如化学融合、激光融合及电融合等常规方法,广泛应用于遗传育种领域[2-3]。随着研究的深入,相继出现了一些新的融合方法,比如离子束融合技术、空间融合技术和非对称融合技术等先进可行的方法。在酵母育种范围内主要集中在耐受高底物浓度及酒精度酵母菌种的改造、生料发酵酵母菌株的选育、耐受高温酿酒酵母的选育、高絮凝性酵母菌株的选育、降酸及嗜杀性酵母菌株的选育等方面[4]。当前用于梨酒生产的酵母主要是采用葡萄酒酵母或从自然界中分离得到的野生型酵母,这两种酵母生产出来的酒不能充分体现出梨酒自身的特点,酿造出的酒存在风味较差、出酒率低不具有梨酒典型性等缺点[5]。除此之外,梨酒香气不足也是影响酒品质的重要因素,故构建优良的梨酒专用酵母成为生产优质梨酒的前提条件。本研究将前期筛选得到的发酵性能与产香较好的两株酵母(Saccharomyces cerevisiaeYDJ05和Issatchenkia orientalisYS03)进行化学融合,期望得到酿造及产香性能优良的融合子作为梨酒酿造所用的酵母工程菌,为产业化奠定基础。

表1 氨基酸混合液及氨基酸添加浓度Table 1 Mixed amio acids and amino acid concentrarion
1 材料与方法
1.1 材料与仪器
梨 陕西蒲城酥梨;Saccharomyces cerevisiaeYDJ05和Issatchenkia orientalisYS03(前期分离得到,保存于湖南科技大学发酵工程实验室)分别作为融合亲本X和亲本Y;基本培养基、完全培养基、再生培养基、再生完全培养基、高氮基本培养基、产孢前培养基及产孢培养基,均详见参考文献[6]。
BSP-400型生化培养箱 上海博讯实业有限公司;SW-CJ-2F型超净工作台 苏州苏洁净化设备厂;AUY-120型分析天平 日本岛津公司;PB-10型pH计 北京赛多利斯仪器系统有限公司;YXQ-LS-75SII型立式压力蒸汽灭菌器 上海博讯实业有限公司医疗设备厂;SZX10摄影显微镜 日本OLYMPUS;MASTER-M型手持折光仪 日本ATGO;HC-2518R型高速冷冻离心机 科大创新股份有限公司中佳分公司。
1.2 实验方法
1.2.1 原生质体融合技术路线 本实验原生质体融合操作步骤如图1所示。

图1 原生质体融合步骤示意图Fig.1 Schematic diagram of the protoplast fusion step
1.2.2 亲本菌株Y营养缺陷型遗传标记的确定采用甲基磺酸乙酯(EMS)法诱变该菌株得到营养缺陷型,再将营养缺陷型菌株传代培养十次,进一步校验遗传标记的稳定性,找到遗传标记稳定的突变株。
亲本菌株Y的单倍体制备 将菌株Y置于活化后接种在产孢前培养基平板上,放在28℃培养箱中培养48h,之后接入产孢培养基平板培养,直至大量孢子形成。用0.9%无菌生理盐水制得孢子悬液,收集菌体。然后加入2%蜗牛酶液处理菌体(处理条件:33℃水浴4h,然后58℃水浴8min),待菌液冷却后加入无菌生理盐水和液体石蜡制得菌悬液,取0.1mL菌悬液接种于完全培养基上,继续培养直至长出菌落为止,通过显微镜镜检,不产生子囊孢子的酵母即为单倍体细胞。
单倍体菌株Y的诱变 采用EMS诱变法诱变,具体操作见参考文献[7-8]。
中间培养和饥饿培养 将经过诱变的菌悬液接种于完全培养基(液体)中,28℃培养24h。再次采用上述方法离心收集菌体并洗涤两次后转入基本培养基中培养8h,进行饥饿培养。
高氮培养 将制得的饥饿菌体培养液转入到高氮源培养基中,28℃培养3h后加入10μg/mL的制霉菌素,继续培养2h,再转入无菌生理盐水中制成菌悬液备用。
营养缺陷型突变株的检出 将上述菌悬液稀释成10-1~10-44个梯度,分别吸取0.2mL原液及稀释液于完全培养基平板上,每个稀释度涂布3个平板,28℃培养4d。选取菌落数合适的完全培养基平板,采用影印平板法将菌落复制到基本培养基平板上,28℃培养2d,对应在基本培养基上不能生长的菌落即为营养缺陷型菌株,将营养缺陷型菌株保存于完全培养基斜面上备用。
营养缺陷型菌株的鉴定 从上述斜面上取1环接种在5mL无菌生理盐水中,混匀洗涤,采用离心法收集菌体(条件为6000r/min,5min),再将菌体置于5mL无菌生理盐水中。将菌悬液0.3mL涂布于基本培养基平板上,放置1min后把蘸取1~6号氨基酸混合液(见表1)的滤纸片放到平板培养基上,28℃培养36h。根据菌体生长的位置来判断营养缺陷型种类(见表2)。

表2 缺陷型菌株对营养要求的位置Table 2 Auxotrophic strain and the nutritional requirements position
1.2.3 菌株X和Y原生质体制备与再生 原生质体制备及酶处理时间的确定:酶解温度为35℃,详细操作过程及计算公式参见文献[9]。
原生质体再生:分别将两亲本菌株的原生质体1mL与再生完全培养基软琼脂(1%琼脂)4mL混合后取0.1mL倒入再生培养基平板上,28℃培养4d,计算菌落数,即再生细胞数。计算两亲本菌株的原生质体再生率,其公式参照参考文献[9]。
1.2.4 亲本菌株X原生质体灭活时间的确定 取1mL菌株X的原生质体悬液在60℃的水浴锅中振荡处理 6、8、10、12、14min,然后取上述处理液 0.5mL,稀释适当的倍数后涂布于高渗完全培养基上,28℃培养5d,计算菌数并计算灭活率,公式见参考文献[9]。
1.2.5 原生质体融合 操作步骤详见文献[9]。
1.2.6 融合子的优选 将通过遗传标记筛选出的融合子接种到完全培养基上活化后,分别接种到10mL的带有杜氏管的试管中,28℃培养,根据产气情况、产酒精及产香情况筛选得到最优的融合子,作为梨酒的酵母工程菌[10]。
2 结果与分析
2.1 亲本菌株Y营养缺陷型的筛选结果
2.1.1 亲本菌株Y单倍体与原菌株的形态比较 亲本菌株Y(Issatchenkia orientalisYS03)的原菌株如图2中a所示,呈椭圆形或近似圆形,生殖方式以出芽生殖为主,少数出现子囊孢子,是典型的东方伊莎酵母的形态。单倍体菌株,如图2的b所示,菌株呈现球形,且个体较原菌株小,从菌落上看也明显小于原菌株,为下一步的原生质体融合做了准备。

图2 亲本菌株Y的原菌株和单倍体菌株的显微图片(10×40倍)Fig.2 Parental strain of Y strain and haploid strain in the microscopic picture(10×40)
2.1.2 亲本菌株Y突变株的检出与鉴定 比较在基本培养基和完全培养基上且经过诱变的菌落生长情况,得到1株的突变株,由图3看出该突变株只在4号和5号滤纸片上生长,结合表2可以断定该突变株是精氨酸缺陷型菌株。将该菌株传代10次,并在添加精氨酸的基本培养基和基本培养基上验证,发现该菌株只在添加精氨酸的培养基上生长,从而确定该菌株是具有稳定遗传特性的精氨酸营养缺陷型菌株。
2.2 原生质体的制备与酶处理时间的确定
2.2.1 亲本菌株X和Y的原生质体形态 亲本菌株X和Y的原生质体形态如图4和图5所示,经过蜗牛酶的降解,细胞壁被除去,由于细胞内容物失去细胞壁的束缚成为球形。

图3 亲本菌株Y营养缺陷型的检出结果Fig.3 Parent strain Y auxotrophic detection results

图4 亲本菌株X的原生质体显微图片(10×40倍)Fig.4 Photomicrographs of protoplasts of parental strain X(10×40)

图5 亲本菌株Y的原生质体显微图片(10×40倍)Fig.5 Photomicrographs of protoplasts of parental strain Y(10×40)
2.2.2 酶处理时间的确定 从表3的实验数据可知,随着酶处理时间的增加,两株菌的原生质体形成率均呈增加趋势,相对应的再生率呈下降趋势。经分析,原因在于:在较恰当的酶浓度下,酶解时间越长,细胞壁的分解越完全,所得的原生质体数量越大,故形成率越大;随着水解时间的延长,大部分原生质已经形成,此时酶继续发生作用会破坏已形成的细胞膜,故原生质体再生率下降。原生质体形成率和再生率直接影响融合的效果及融合子的检出。本实验通过不同酶解时间的水解效果,综合考虑形成率和再生率,得出在35℃条件下最佳酶处理时间:即酶处理时间为100min时,亲本菌株X和Y的形成率分别为93.6%和94.2%,相对应的原生质体再生率分别为27.8%和31.6%。
2.3 亲本菌株X原生质体灭活时间的确定
单亲灭活是原生质体融合技术中常见一种方法,在亲本菌株Y制作遗传标记的前提下,将菌株X进行灭活,灭活的情况直接决定融合的结果。本实验采用的灭活方法是热灭活,主要是通过水浴的方法在60℃条件下,随着加热时间的延长使原生质体的灭活率逐渐升高。从表4中可以看出,14m in时,原生质体可以完全灭活,故在本实验中原生质体X的灭活时间确定为14min。

表3 不同酶处理时间所对应亲本菌株X和Y的原生质体形成率与再生率Table 3 Protoplast formation rate and regeneration rate of the parent strain Y in the different enzyme treatment time

表4 亲本菌株X原生质体灭活时间的确定结果Table 4 Time determination results of the parent strain X inactivated protoplasts
2.4 亲本菌株X和Y的原生质融合
选取亲本菌株X和Y等量的原生质体,根据精氨酸缺陷型的遗传标记筛选融合子菌株,在加入促融剂之后,其融合情况如图6所示。计算得到融合率为5.8 ×10-5。

图6 亲本菌株X和Y的原生质体融合显微图(10×40倍)Fig.6 Photomicrographs of the parental strains X and Y protoplast fusion(10×40)
2.5 亲本菌株X和Y融合子的优选
通过杜氏管发酵法来考察融合子的产气情况发现,在上述融合子中有六株融合子具有良好的产气能力,其编号分别为DJ01~DJ06。后续再通过考察六株融合子的产酒精能力、产香能力及感官指标综合确定最佳酿造梨酒的融合子作为酵母工程菌。
2.5.1 各融合子产酒精能力的测定 通过考察融合子的产气情况,初步得到六株发酵能力较强的融合子,通过进一步的发酵实验定时测定其产酒精的能力,结果如图7所示。在整个发酵过程中酒精含量随着发酵时间的进行呈逐渐增加的趋势,但是增加的速度和幅度有较大的区别,从图中可以看出DJ02和DJ06的产酒精能力比较强,在发酵7d时酒精含量分别达到了9.87%和9.74%,均能满足果酒发酵的需求。DJ02的酒精浓度增加在第2~6d大部分时间内比DJ06要快,到第7d时两者产酒精速度趋于接近。为了进一步得到最优良的酵母工程菌,下面还要对两种融合子的产香能力进行测定。

图7 融合子DJ01~DJ06产酒精能力的测定结果Fig.7 Determination results of the fusions DJ01~DJ06 alcohol producing ablility
2.5.2 融合子DJ02和DJ06产香情况的测定 为了进一步确定最适合酿造梨酒的融合子,定时测定发酵酒样的总酯产生能力,从图8中可知随着时间的增加总酯含量呈现增加的趋势,到第7d达到高峰期。其中,DJ02的产总酯能力较DJ06要强,融合子DJ02在第7d达到高峰期为0.37g/L。
通过考察融合子菌株的产气能力、产酒精能力以及产香能力,发现融合子DJ02都是最优的,故确定融合子DJ02为梨酒酿造所用的酵母工程菌。
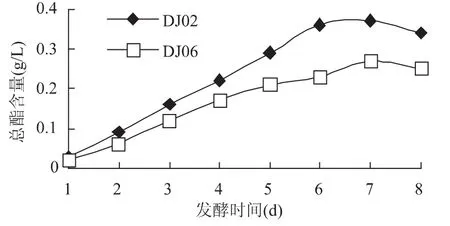
图8 融合子DJ02和DJ06产香能力的测定结果Fig.8 Determination results of the fusions DJ02 and DJ06 aroma-producing capability
3 结论
本研究以EMS诱变法诱变亲本菌株Y得到了一株精氨酸营养缺陷型菌株,以此作为遗传标记,通过单亲灭活法将亲本菌株X和Y进行融合。菌株X和Y的原生质体形成率分别为93.6%和94.2%,再生率分别为27.8%和31.6%,菌株X和Y的融合率为5.8×10-5。得到产酒、产香能力均较强的融合子DJ02,分别达到9.87%(v/v)和0.37g/L。
[1]彭帮柱,岳田利,袁亚宏,等.酵母菌原生质体融合技术[J].西北农业学报,2004,13(1):101-103.
[2]Gi-Work Choi,Hyun-Ju Um,Hyun-Woo Kang,et al.Bioethanol production by a flocculent hybrid,CHFY0321 obtained by protoplast fusion betweenSaccharomycescerevisiaeandSaccharomycesbayanus[J].Journal of Food Science,2010,34:1232-1242.
[3]赵春苗,徐春厚.原生质体融合技术及在微生物育种中的应用[J].中国微生态学杂志,2012,24(4):379-382.
[4]魏运平,叶俊华,赵光鳌.原生质体融合技术及其在酿酒酵母菌株选育中的应用[J].酿酒科技,2003(3):87-89.
[5]张琇,王永娟,马爱瑛,等.灵武长枣果酒酿酒酵母与红酵母原生质体融合的研究[J].西北农业学报,2011,20(6):164-167.
[6]郝琳.食品微生物学实验技术[M].北京:中国农业出版社,2001:46-73.
[7]陈海昌,刘波,张苓花,等.原生质体融合技术构建糖化型啤酒酵母的研究[J].微生物学通报,1997,24(3):159-165.
[8]常登龙,洪玉,杨永军,等.同种接合型酵母菌株Y2HGold的原生质体融合研究[J].食品工业科技,2012,33(22):233-238.
[9]亚当斯A,戈特施林DE,凯泽CA,等译.遗传学实验方法[M].北京:科学出版社,2000:56-61.
[10]彭帮柱.増香型苹果酒酵母的选育研究[D].杨凌:西北农林科技大学,2004:43-54.
