牛奶中酵母β-葡聚糖的应用与测定
2013-12-08付俊鹤望忠福余明华
付俊鹤,望忠福,余明华,张 彦
(安琪酵母股份有限公司,湖北宜昌 443003)
酵母β-葡聚糖(见图1)是酵母细胞壁的主要成分之一,分子量从几万到几十万不等[1],分子主链以β-1,3糖苷键结合,支链以β-1,6糖苷键结合,这种独特的三重超微螺旋结构是免疫活性最强、且最易被人体吸收的葡聚糖形式[2-3]。大量研究证明,酵母β-葡聚糖具有增强免疫功能[4-5]、抗辐射[6-7]与降血脂功能[8-9]。酵母β-葡聚糖已获得美国FDA的GRAS(Generally Regarded As Safe)认证,中华人民共和国卫生部也于2010年通过第9号公告,批准了酵母β-葡聚糖作为新资源食品,这使得酵母β-葡聚糖在食品行业有了更为广泛的应用前景。目前酵母β-葡聚糖的测定方法多采用苯酚-硫酸法测定[10],但该法精密度较差,并且不适合检测牛奶中的酵母β-葡聚糖。本实验在牛奶中添加了酵母β-葡聚糖,并对其含量进行测定,初步建立了牛奶中酵母β-葡聚糖的检测方法,该法精密度较高,重复性良好,为酵母β-葡聚糖在乳制品中的应用提供了实验基础。

图1 酵母β-1,3-D-葡聚糖分子结构Fig.1 Molecular structure of yeastβ-1,3-D-glucan
1 材料与方法
1.1 材料与仪器
鲜牛奶 宜昌喜旺食品有限公司;酵母β-葡聚糖 安琪酵母股份有限公司;葡萄糖 CAS:50-99-7,纯度99.5%,Sigma公司,配制成0.2g/L标准溶液待用;半乳糖 CAS:59-23-4,纯度99.5%,Sigma公司,配制成0.2g/L标准溶液待用;各种溶液 20%乙酸锌溶液,10%亚铁氰化钾溶液,37%盐酸溶液,40%氢氧化钠溶液。
D-7000高效液相色谱仪 配有示差检测器和糖柱,日本HITACHI公司;杜氏瓶 德国SCHOTT公司;BP221S电子天平 德国Sartorius公司;WH-2微型旋涡混合器 上海沪西分析仪器厂有限公司;BME100LII型实验室高剪切乳化机 启东市长江机电有限公司;YXQ.WY21.600卧式圆形压力蒸汽灭菌锅 上海华线医用核子仪器有限公司;Z326高速离心机 德国HERMLE公司。
1.2 实验方法
1.2.1 含酵母β-葡聚糖牛奶的制备 新鲜纯牛奶→加热至75~80℃→加入适量酵母β-葡聚糖→高速剪切10min→冷却。
1.2.2 葡聚糖的测定原理 牛奶中的碳水化合物主要为乳糖,几乎不含有其他的单糖或寡糖,在牛奶中,乳糖的含量约为3%。乳糖为一个半乳糖和一个葡萄糖结合的二糖,水解后分解为一个葡萄糖和一个半乳糖[11],而乳制品中的葡聚糖在水解后生产葡萄糖[12]:
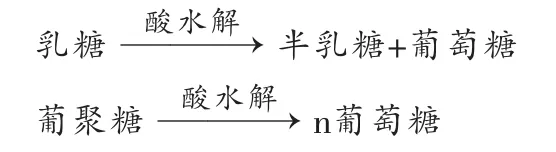
因此分别测定水解后样品中葡萄糖和半乳糖含量,葡萄糖比半乳糖多出的部分,就是葡聚糖的含量。
1.2.3 样品处理 精确称取25.0000g(精确至0.0002g)样品放入一个150mL离心管中,加入5mL 20%乙酸锌溶液和5mL 10%亚铁氰化钾溶液,于7000r/min离心10min,去掉上清液,沉淀加25mL纯水,振荡混合均匀后,于7000r/min离心10min,去掉上清液,沉淀加25mL 75%乙醇,振荡混合均匀后,于7000r/min离心10min,去掉上清液,沉淀再加25mL纯水,振荡混合均匀后,于7000r/min离心10min,去掉上清液,将沉淀转入杜氏瓶中,分别加入6.0、9.0、12.0、18.0mL盐酸(37%),加水至150mL,将瓶子放入高压灭菌锅121℃处理60min。完成后马上冷却,将溶液pH调到6~7,然后定容至200mL。使用0.45μm孔径的醋酸纤维素膜过滤备用。
1.2.4 高效液相色谱条件 色谱柱:Sugar-Pak TM 1,6.5mm×300mm(美国Waters公司);流动相:高纯水;流速:0.5mL/min;柱温:80℃;进样量:20μL。待仪器基线平稳后再进样。
1.2.5 建立标准曲线方程 吸取葡萄糖标液1、3、5mL到10mL容量瓶中,用高纯水定容到刻度,得到葡萄糖为20、60、100mg/L的混合标样。在上述色谱条件下准确进样20μL,得到色谱峰面积和标准物质量浓度之间的回归方程。
采用同样方法制定半乳糖标准曲线方程。
1.2.6 样品分析 在同样的色谱条件下,将处理好的样品注入色谱仪中,记录各色谱峰的保留时间和峰面积。用糖标样色谱峰的保留时间定性,用糖标样色谱峰的峰面积定量,计算出样品中葡萄糖和半乳糖的质量浓度。
1.2.7 结果计算 参考文献[13],结果计算采用如下公式:
乳品中葡聚糖含量(%)=(C葡萄糖-C半乳糖)×V×0.9×F/W×100
式中:C葡萄糖:样品水解定容后由HPLC测定得到了葡萄糖质量浓度,g/mL;C半乳糖:样品水解定容后由HPLC测定得到了半乳糖质量浓度,g/mL;V:样品水解后定容体积,mL;0.9:葡萄糖换算为葡聚糖的换算因子;F:葡聚糖水解校正因子,F=1.25;W:称量的牛奶样品质量,g。
2 结果与分析
2.1 葡萄糖与半乳糖的标准曲线方程
根据1.2.5的实验方法,得到葡萄糖与半乳糖的标准曲线方程,结果如下:
葡萄糖的标准曲线方程:y=5191.8x+12876,R2=1
半乳糖的标准曲线方程:y=5772.1x+11656,R2=1
2.2 葡萄糖与半乳糖的HPLC色谱图
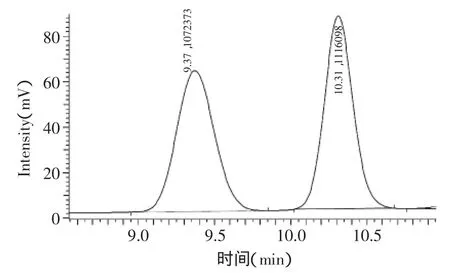
图2 葡萄糖与半乳糖的HPLC色谱图Fig.2 HPLCchromatogram of glucose and galactose
样品中葡萄糖与半乳糖的HPLC色谱图见图2,其中,葡萄糖的保留时间为9.37min,半乳糖的保留时间为10.31min。
2.3 不同浓度的水解用盐酸对实验结果的影响
为了考察使用不同盐酸浓度水解时对实验结果的影响,水解时,分别加入6.0、9.0、12.0、18.0mL盐酸(37%),加水至150mL,使其浓度分别为0.5、0.75、1.0、1.5mol/L。每个浓度做两个平行实验。实验结果见表1。

表1 不同浓度的水解用盐酸对实验结果的影响Table 1 Effect of hydrochloric acid at different concentrations for hydrolysis on the experimental results
实验结果显示,水解用盐酸浓度选用1.0mol/L时,样品水解较彻底,回收率大于80%,下一步将继续在水解用盐酸浓度1.0mol/L附近时开展大量重复实验,进一步确定水解用盐酸浓度。
2.4 水解用盐酸浓度的进一步确定
前期实验了0.5、0.75、1.0、1.5mol/L的盐酸浓度,初步发现:使用1.0mol/L的盐酸水解样品能获得较好的回收率。为了进一步确定水解用盐酸浓度,现开展如下细化实验:取同一批添加了酵母β-葡聚糖的牛奶,分别使用0.8、0.9、1.0、1.1、1.2mol/L的盐酸水解样品,每个样品做若干个平行。实验数据见表2。
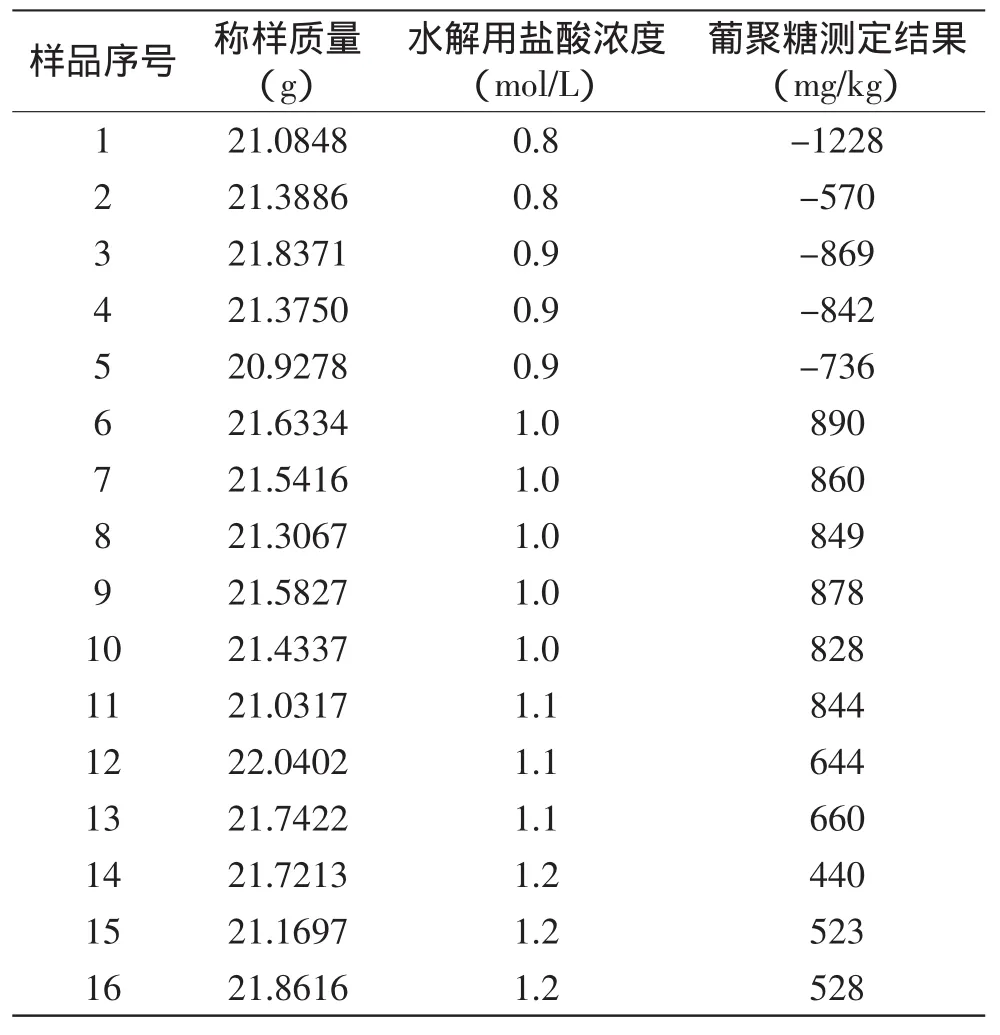
表2 水解用盐酸浓度的进一步确定Table 2 Further determination of the hydrochloric acid concentration for hydrolysis
实验结果表明,水解用盐酸浓度使用1.0~1.2mol/L时,结果较好,盐酸浓度选用1.0mol/L最佳。
2.5 精密度实验
取适量酵母β-葡聚糖含量为0.06%的牛奶,水解用盐酸浓度为1.0mol/L,根据上述检测方法,重复检测5次,结果见表3。

表3 精密度实验Table 3 Precision test
实验结果显示,当水解用盐酸浓度为1.0mol/L时,测定结果的RSD值为4.64%,测定结果稳定性良好。
2.6 回收率实验
依据上述实验确定的最佳酸体系(1.0mol/L盐酸),取同一批牛奶(酵母β-葡聚糖含量为0.06%)作为基础样品进行回收率实验。牛奶中酵母β-葡聚糖添加量分别为0.06%的80%、100%、120%,即0.048%、0.06%、0.072%。每个添加量重复三次实验,结果见表4。
回收率实验结果显示,当水解用盐酸浓度为1.0mol/L时,平均回收率在96.39%~97.22%之间,测定结果的RSD值在2.51%~5.38%之间,测定结果稳定性良好。

表4 回收率实验Table 4 Recovery test
3 结论
本实验对牛奶中的酵母β-葡聚糖进行高温水解-HPLC检测,确定水解用盐酸的浓度选用1.0mol/L较为适宜;该测定方法的稳定性良好,回收率较高。该检测方法的建立,为酵母β-葡聚糖在奶制品中的应用提供了实验基础。下一步将继续探讨盐酸水解时间、水解温度等因素对测定结果的影响。
[1]Magnelli P,Cipollo JF,Abeijon C.A refined method for the determination of saccharomyces cerecisiae cell wall composition and beta-1,6-glucan fine structure[J].Analytical Biochemistry,2002,301(1):136-150.
[2]Manners DJ, Masson AJ, Patterson JC.Structure of a β-(1-3)-D-glucan from yeast cell walls[J].Biochemical Journal,1973,135(1):19-30.
[3]Li B, Allendorf DJ, Hansen R, et al.Combined yeastβglucan and antitumor monoclonal antibody therapy requires C5a-mediated neutrophil chemotaxis via regulation of decayaccelerating factor CD55[J].Cancer Research,2007,67(15):7421-7430.
[4]Gu Y H,Takagi Y,Nakamura T,et al.Enhancement of radioprotection and anti-tumor immunity by yeast-derivedβ-Glucan in mice[J].Journal of Med Food,2005,8(2):154-158.
[5]Kulikova TA,Zhanaeva SY,Korolenko TA,et al.Regulation of activity of cathepsins B L and D in murine lymphosarcoma model at a combined treatment with cyclophosphamide and yeast polysaccharide[J].Cancer Letters,2005,223(1):77-83.
[6]Kogan G,Sandula J,Korolenko TA,et al.Increased efficiency of Lewis lung carcinoma chemotherapy with a macrophage stimulator-yeast carboxymethyl glucan[J].International Immunopharmacol,2002(2):775-781.
[7]Nicolosi R,Bell S J,Bistrian B R,et al.Changes in plasma lipids from a yeast-derived-glucan fiber in hypercholesterolemic patients[J].Submitted to Am JClin Nutr,1998,34:189-203.
[8]Kiran MD,Bhalchandra KV,Rekha SS,et al.Use of an artificial neural network in modeling yeast biomass and yield of yeastβglucan[J].Process Biochemistry,2005,40:1617-1626.
[9]Nancy DT,Leslie AB,John F,et al.Opportunitiesfor nutritional amelioration of radiation induced cellular damage[J].Nutrition,2002,18(10):905-912.
[10]Kiran M D,Bhalchandra K V,Rekha S S,et al.Use of an artificial neural netword in modeling yeast biomass and yield of glucan[J].Process Biochemistry,2005,40:1617-1626.
[11]郭本恒.现代乳品加工技术丛书一液态奶[M].北京:化学工业出版社,2004:5-6.
[12]张海波,戴军.酵母葡聚糖分子结构分析[J].食品与发酵科技,2011,47(5):31-33.
[13]陈少峰,望忠福.高效液相色谱法测定酵母β-葡聚糖[J].食品科技,2009(7):278-280.
