响应面分析优化酶法提取南瓜籽油的工艺研究
2013-12-08胡炜东
胡炜东,邹 寅
(内蒙古农业大学职业技术学院,内蒙古包头014109)
南瓜籽又称白瓜籽、金瓜籽,是葫芦科植物南瓜的成熟种子,含有丰富的必需脂肪酸、氨基酸、植物甾醇、蛋白质、维生素和多糖等,营养非常丰富,在我国种植范围广、种类多,资源丰富,极具开发价值。南瓜籽同时也是具有广阔开发应用前景的营养保健油源。南瓜籽中油脂含量较高,可占干质量的35%~50%,其中亚油酸38.60%、油酸28.63%、棕榈酸16.55%、硬脂酸8.42%。南瓜籽油不仅能明显降低血清胆固醇和甘油三酯,而且还能驱除寄生虫和防止前列腺疾病[1-2]。目前,南瓜籽油的提取方法有索氏提取法[3]、超临界流体萃取法[4]、压榨法[5]、酶法[6]和超声波法[7]。由于酶的反应条件温和,既可以保持油的有效成分,获得优质的南瓜籽油,又可以保持蛋白质和其他成分的性质,使其进一步被加工利用[8]。本研究采用酶法提取南瓜籽油,以用酶量、反应时间、反应温度与提取率为指标,在单因素实验的基础上,利用Box-Benhnken的中心组合设计原理及响应面分析法,确定最佳提油工艺参数。为南瓜籽油的提取提供新的有效途径,为生产实践进一步服务。
1 材料与方法
1.1 材料与仪器
南瓜籽 内蒙古河套地区籽用裸壳南瓜籽(水分含量5.7%,蛋白35.64%,纤维含量14.32%,可溶性还原糖35.63mg/100g);纤维素酶(活力为35000U/g)上海锐谷生物有限公司;所用试剂均为分析纯 内蒙鸿日公司。
TCL-16GB高速台式离心机 上海安亭科学仪器厂;LK-600B万能粉碎机 上海新诺仪器设备有限公司;索氏提取器 上海鲁硕实业有限公司;RE-52A旋转蒸发仪 上海亚荣生化厂;JA2003电子天平 上海民桥精密科学仪器有限公司。
1.2 实验方法
1.2.1 南瓜籽油含量的测定[9]采用索氏提取法(GB/T5009.6-2003)。
1.2.2 纤维素酶辅助提取南瓜籽油的工艺[10-11]
南瓜籽→预处理→粉碎→称量→酶解→有机溶剂萃取→离心分离→真空旋转蒸发→粗油→恒重→称量
1.2.3 纤维素酶辅助提取南瓜籽油实验步骤 将南瓜籽从瓜囊中摘出,洗净后,烘干至恒重,粉碎,过60目筛,准确称取50g,按固液比1∶4加入柠檬酸缓冲液,调节pH4.8,水浴5min,加入纤维素酶,搅拌,酶解后加入石油醚提取30min,作用完毕以8000r/min离心30min,对油相进行旋转蒸发,所得粗油干燥称重,计算提取率,4℃保存。
1.2.4 单因素实验 通过单因素实验,确定p H在4.6~5.0范围内南瓜籽油的提取率达到最大,而在此范围内pH对南瓜籽油提取率的影响差异非常小,因此选用纤维素酶的最适pH4.8为宜;当固液比(物料∶柠檬酸缓冲液)达1∶4时,增加固液比对南瓜籽油的提取率增加缓慢,从工艺角度考虑,按固液比1∶4加入柠檬酸缓冲液最佳。进一步选取对酶法提油工艺有显著影响的三个因素,即用酶量、酶解时间和酶解温度,按照上述方法对南瓜籽油进行提取实验,并计算提取率。
1.2.5 纤维素酶辅助提取南瓜籽油实验设计 在单因素实验结果的基础上,利用Box-Benhnken的中心组合设计原理,三个主要因素用酶量(mg/g)、酶解时间(h)、酶解温度(℃),分别用 X1、X2、X3来表示,每一个自变量的低、中、高实验水平分别以-1、0、+1进行编码,实验因素与水平设计见表1。

表1 响应面分析实验因素水平与编码表Table 1 Factors and levels of response surface experiments
1.2.6 南瓜籽油提油率计算

式中:W提取油为提取出南瓜籽油的质量;W原料为南瓜籽粉末的质量;α为南瓜籽含油率。
2 结果与分析
2.1 索氏提取法测定南瓜籽含油量
重复3次索氏提取实验,测得南瓜籽油含量为43.05%。南瓜籽含油量显著大于玉米胚芽油和大豆油[12]。
2.2 单因素实验结果与分析
2.2.1 用酶量对提取效果的影响 固定反应温度45℃,反应时间 2h,设定用酶量 5、10、15、20、25mg/g,考察用酶量对南瓜籽油得率的影响。得到用酶量与南瓜籽油提取率的关系如图1所示。
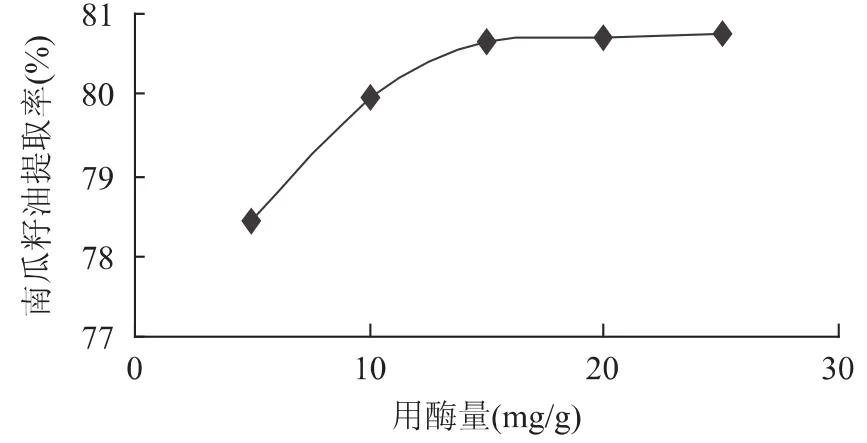
图1 用酶量对南瓜籽油提取率的影响Fig.1 Effect of cellulose concentration on pumpkin seed oil extraction rate
由图1可知,随着酶浓度的增加,南瓜籽油的提取率也在逐渐增大,当加酶量大于15mg/g时,油提取率趋于稳定,考虑到酶的成本及油的提取效果,宜将酶的添加量确定为15mg/g。
2.2.2 反应时间对提取效果的影响 固定用酶量为10mg/g,反应温度45℃,设定酶解时间 1、1.5、2、2.5、3、3.5h,考察时间对南瓜籽油得率的影响。得到酶解时间与南瓜籽油提取率的关系如图2所示。
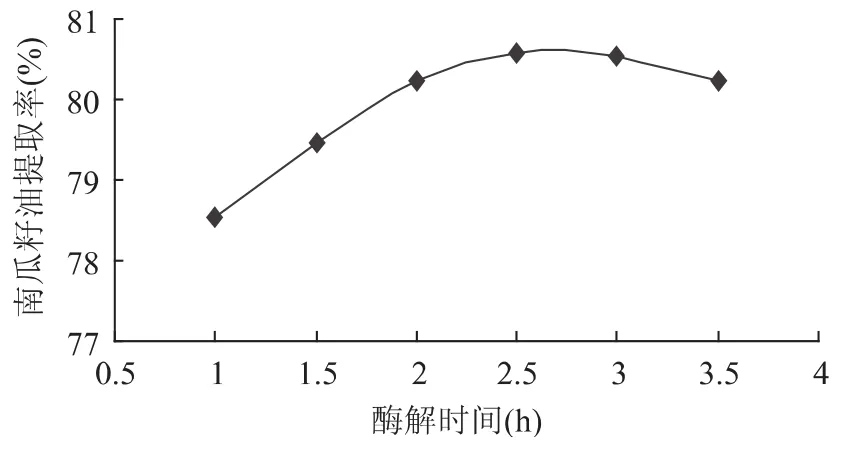
图2 酶解时间对南瓜籽油提取率的影响Fig.2 Effect of hydrolysis time on pumpkin seed oil extraction rate
由图2可知,随着酶解时间的延长,南瓜籽油提取率也随之增加,当酶解时间超过2.5h后提取率略有下降,考虑到实际生产需要,酶解时间以2.5h为宜。
2.2.3 反应温度对提取效果的影响 固定用酶量为10mg/g,反应时间 2h,设定酶解温度 35、40、45、50、55、60℃,考察温度对南瓜籽油得率的影响。得到酶解温度与南瓜籽油提取率的关系如图3所示。
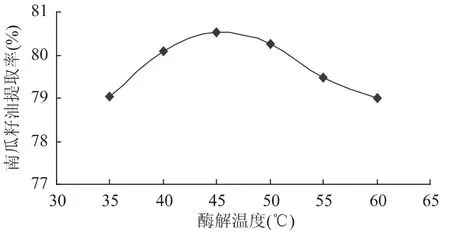
图3 酶解温度对南瓜籽油提取率的影响Fig.3 Effect of hydrolysis temperature on pumpkin seed oil extraction rate
由图3可知,酶解温度达45℃时南瓜籽油提取率最高为80.54%,但在40~50℃范围内提取率差异不大,在实际生产中,可根据实际生产条件选择45℃左右温度为宜。
2.3 响应面实验结果分析
2.3.1 实验结果 Box-Benhnken三因素三水平实验所得南瓜籽油提取率见表2,模型共设15个实验,其中1~12号实验为析因实验,13~15号为中心实验。析因实验构成三维定点,中心实验为区域的中心,重复三次中心实验以估计误差。
2.3.2 模型建立 利用Design-Expert 8.0.6软件对实验结果进行多元拟合,得到用酶量(X1)、酶解时间(X2)、酶解温度(X3)二次多项回归方程:Y=88.96667+2.48000X1+0.88375X2+2.19375X3+1.80500X1X2+ 0.05500X1X3+ 0.92750X2X3-4.30708X12-3.35458X22-3.87958X32
2.3.3 方差分析 利用Design-Expert 8.0.6软件对实验结果进行多元回归分析,结果见表3,方差分析表明,以南瓜籽油提取率为响应值建立的回归模型是显著的,而误差项不显著,说明回归方程与实际情况吻合度较好,确定系数 R2=98.91%,R2Adj=96.94%。因此,可用该模型回归方程代替真实实验点对实验结果进行分析。而且模型中一次项、二次项的影响是显著的,表明各因素对油提取率的影响是非线性关系。影响南瓜籽提取率的因素按主次顺序排列:用酶量(X1)>酶解温度(X3)>酶解时间(X2)。
2.3.4 响应面分析 根据回归分析结果做出相应的响应面分析图,由图4~图6可以看出存在极值的地方应该在等值线图的圆心,用酶量(X1)对南瓜籽油提取率影响最大,表现为曲线较陡;酶解温度(X3)、酶解时间(X2)次之,表现为曲线较平滑,随其数值的变化,响应值变化较小,从图5可以看出,响应面曲线较陡,说明用酶量(X1)和酶解温度(X3)对南瓜籽油提取率的影响较明显,这与方差分析的结果相一致。由图4~图6中等高线的形状可以反映出交互效应的强弱,椭圆形表示两因素交互作用显著,而圆形表示相反,图4等高线可以看出,用酶量(X1)与酶解时间(X2)交互作用对南瓜籽油的提取率影响显著,表现为等高线呈椭圆形,酶解时间(X2)和酶解温度(X3)交互作用次之,由图5可知,用酶量(X1)与酶解温度(X3)之间交互作用最小,表现为响应面曲线间差异小,等高线最接近于圆形。
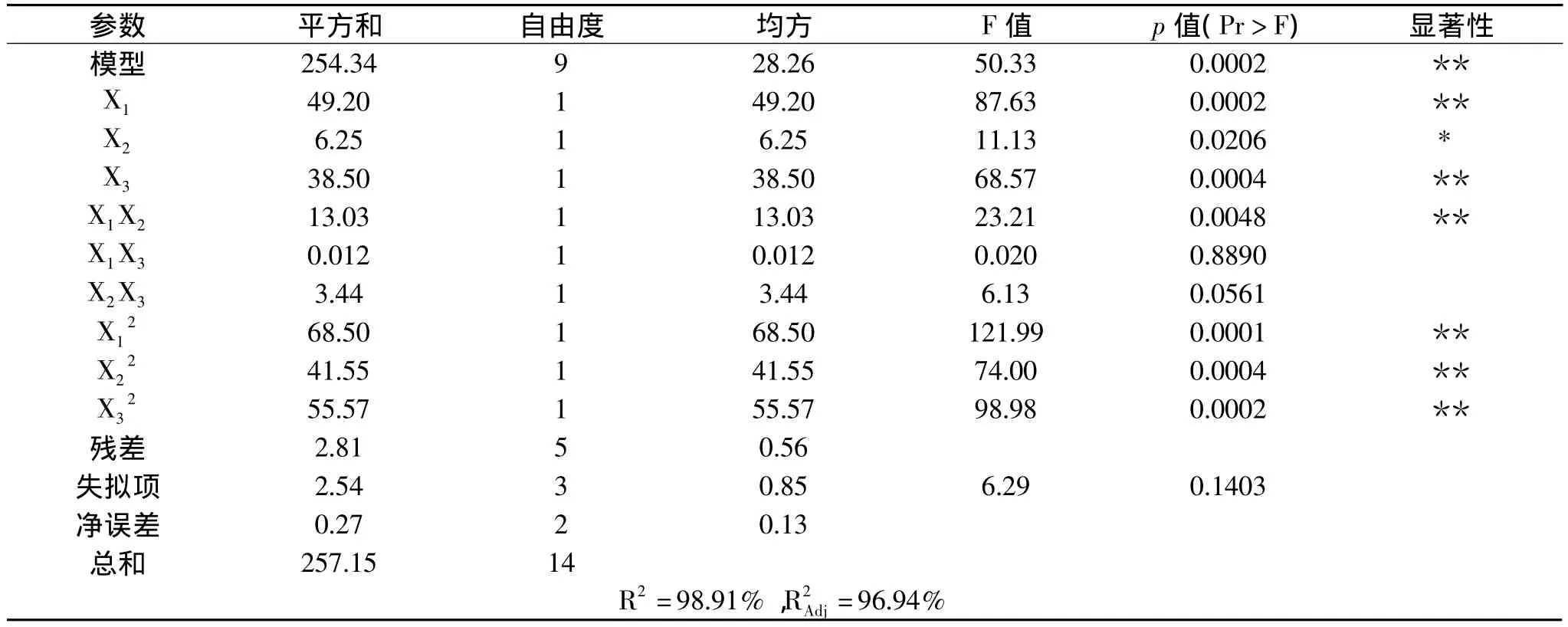
表3 回归分析结果Table 3 Analysis results of regression and variance
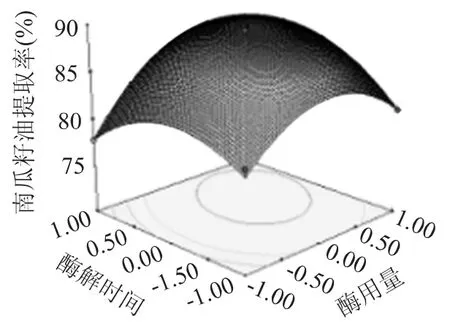
图4 用酶量与酶解时间对南瓜籽油提取率影响的响应曲面图Fig.4 Response surface of cellulose concentration and hydrolysis time on the extraction rate of oil
为了确定各因素的最优值,利用软件分析得X1、X2、X3的最大代码值 0.346、0.269 和 0.317,换算得出实际值为用酶量(X1)16.73mg/g,酶解时间(X2)为2.6345h,酶解温度(X3)为46.585℃,理论提取率为89.86%。
2.3.5 回归模型的验证实验 为检验响应面分析所得结果的可靠性,采用上述优化条件进行提取南瓜籽油实验,考虑到实际操作,将提取条件修正为用酶量17mg/g,酶解时间为2.64h,酶解温度为47℃,在此条件下提取3次,南瓜籽油平均提取率89.12%,实验值与理论值的相对误差为0.82%。由此可见该模型很好的反映了酶法提取南瓜籽油的条件,证明利用响应面法确立酶法提取南瓜籽油的工艺参数是可行的。
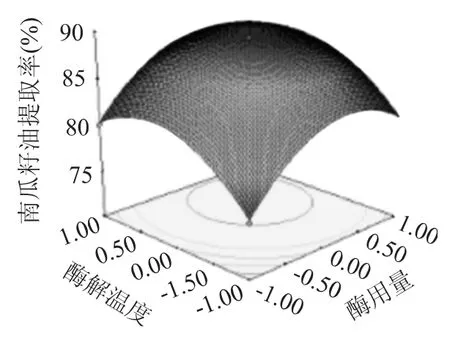
图5 用酶量与酶解温度对南瓜籽油提取率影响的响应曲面图Fig.5 Response surface of cellulose concentration and hydrolysis temperature on the extraction rate of oil
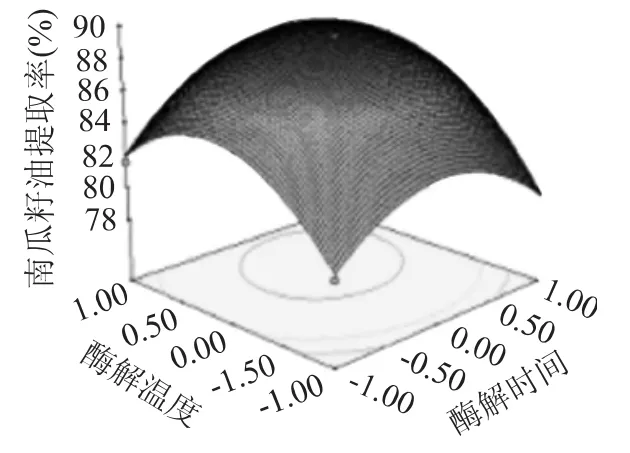
图6 酶解时间与酶解温度对南瓜籽油提取率影响的响应曲面图Fig.6 Response surface of hydrolysis time and hydrolysis temperature on the extraction rate of oil
3 结论
利用辅助酶法提取南瓜籽油,具有高效、温和、经济等特点,同时采用Box-Benhnken中心组合设计原理及响应面分析法,利用Design-Expert软件进行便捷、可靠的优化组合和数据分析,得出纤维素酶提取南瓜籽油的较佳工艺:用酶量17mg/g,酶解时间为2.64h,酶解温度为47℃,南瓜籽油提取率达89.12%。与理论预期值的拟合度较好。各因素主次关系为:用酶量(X1)>酶解温度(X3)>酶解时间(X2)。
[1]魏冰.南瓜籽油的开发和利用研究[J].粮油加工,2008(5):60-62.
[2]董国玲,田密霞,姜爱丽,等.南瓜籽油的开发利用价值[J].粮食科技与经济,2010(7):33-35.
[3]杨建新,宋琳琳.南瓜籽油的萃取工艺及其性质研究[J].食品工业科技,2010(1):263-264.
[4]牛广才,朱丹,孙清瑞,等.南瓜籽油超临界CO2流体萃取及其脂肪酸成分分析[J].中国粮油学报,2010(4):31-33.
[5]陈钊,赵敏生,白小芳,等.南瓜籽油的冷榨制取研究[J].食品科技,2005(8):88-90.
[6]王庆铃,张磊,姬华,等.水酶法提取南瓜子油工艺研究[J].粮食与油脂,2011(8):21-23.
[7]王小溪,陈贵林.超声波提取南瓜籽油的工艺条件优化研究[J].食品科学,2009(8):60-63.
[8]高璐,胡博然,祁妤琳,等.葡萄籽油提取工艺研究及对其理化性质的影响[J].食品科学,2009(22):81-83.
[9]李桂华.粮油油脂分析与检测[M].北京:化学工业出版社,2006.
[10]苗利利,夏德水,高丽娜.水酶法提取石榴籽油工艺研究[J].食品工业科技,2010,30(12):265-268.
[11]张郁松,寇炜材,贾颖周.水酶法提取苹果籽油的工艺研究[J].粮油加工,2007(4):49-51.
[12]崔宝贵,李珂.我国玉米胚芽制油的现状和发展趋势[J].农业机械,2010(9):65-67.
