依普利酮下调TNF-α、NF-κB抑制细胞表型转化的研究
2013-12-08梁丽娟沈正东姜国旺张晓曼安亚娟许庆友
梁丽娟,王 筝,王 蕊,沈正东,李 莉,姜国旺,张晓曼,安亚娟,许庆友
肾小管间质纤维化(renal interstitial fibrosis,RIF)是各种肾脏疾病进展为终末期肾衰竭的最终共同通路。肌成纤维细胞(MyoF)与RIF的发生有着密切的关系,是RIF发生的关键效应细胞,而α-SMA作为肾小管上皮细胞-肌纤维细胞表型转化的特异性标志物在RIF进展中的重要性日益受到人们的关注。
本研究采用单侧输尿管梗阻(UUO)大鼠模型,观察依普利酮(eplerenone,Epl)对炎性介质TNF-α、核转录因子NF-κB的调控作用以及上皮细胞表型转化标志物α-SMA异常表达的抑制效应,探讨Epl拮抗肾间质纤维化的作用机制。
1 材料与方法
1.1 实验动物及分组 选用清洁级♀ Wistar大鼠36只,体质量180~200 g,由河北医科大学动物实验中心提供,分为假手术组、UUO组、依普利酮组,每组12只。
1.2 药物及试剂 依普利酮由诺华公司提供;TNF-α 抗体选用 Santa Cruz产品;NF-κB(p65)、α-SMA、GAPDH抗体均选用Epitomics抗体。
1.3 造模方法 实验动物自由进食和饮水,温度(22±2)℃。适应性喂养1周后,大鼠给予10%水合氯醛注射后,于左侧中腹部切开皮肤,游离左侧输尿管,分别在输尿管上1/3处和中1/3处用丝线结扎,切断输尿管,逐层缝合皮肤。假手术组仅将输尿管游离但不结扎离断。依普利酮组大鼠给予依普利酮100 mg·kg-1·d-1。d 10 后摘取左侧肾脏,部分组织置于4%多聚甲醛中固定,脱水、石蜡包埋,切片行HE、Masson及免疫组化染色;其余组织 -70℃低温保存以备检测蛋白及mRNA。
1.4 观察指标及方法
1.4.1 HE、Masson 染色观察肾脏病理改变
1.4.2 免疫组化检测 TNF-α、NF-κB、α-SMA 表达
采用SABC法检测,一抗浓度均为1∶100,4℃过夜;滴加二抗,滴加SABC复合物,DAB显色,以光镜下出现棕黄色颗粒为阳性表达,苏木精复染、脱水、透明、封片。
1.4.3 Western blot检测 TNF-α 、NF-κB、α-SMA 蛋白表达 冰冻肾组织给予裂解液(含蛋白酶抑制剂)提取并测定蛋白含量;取样品按比例加入loading buffer,95℃ 煮沸 5 min后待电泳;配制 SDSPAGE 胶,上样蛋白 20 μg,电泳 90V 到底;0.22 μm PVDF膜(甲醛处理),20V,40 min半干转;5%脱脂牛奶封闭2~4 h,加入一抗(1∶1 000),4℃过夜,TBST清洗 3次,每次 10min;加入二抗(1∶20 000),室温60 min,TBST清洗3次,每次10 min,TBS清洗10 min后显影,所得结果使用内参较正。
1.4.4 Real time-PCR 检测 TNF-α 表达 提取RNA,反转录cDNA后扩增。Platinum SYBR Green qPCR Super Mix-UDG(2 × )10 μl,Forward primer(10 μmol·L-1)0.4 μl,Reverse primer(10 μmol·L-1)0.4 μl,ROX Reference Dye 0.4 μl,Template 2 μl,ddH2O 6.8 μl,Total volume 为 20 μl 。引物由Invitrogen公司合成。TNF-α引物序列为:上游引物:5'-GAAAGTCAGCCTCCTCTCCG-3',下游引物:5'-CTTGGGCAGGTTGACCTCAG-3'。β-actin 引物序列为:上游引物:5'-ATGTACGTAGCCATCCAGGC-3',下 游 引 物:5'-GGCGTGAGGGAGAGCATAG-3'。PCR扩增条件:95℃变性2 min(95℃15 s,各自的退火温度,60℃ 34 s)40个循环;50℃变性2 min。采用2-△△CT方法分析基因表达相对变化。
1.5 统计学方法 数据资料结果使用SPSS 13.0 for Windows统计软件分析处理。各组数据比较前先进行正态性及方差齐性检验,满足正态性及方差齐性者,采用单因素方差分析,多组比较采用单因素方差分析(One-way ANOVA),组间比较采用LSD检验;不满足者采用秩和检验。数值变量以¯±s表示。
2 结果
2.1 动物一般情况 假手术组大鼠精神状况、活动、毛发、饮食、饮水等无明显改变。UUO组大鼠表现为烦躁、易激惹,饮食、饮水量下降、体重减轻。依普利酮组一般状况略好于UUO组(Tab 1)。
Tab 1General situation of animals(¯±s)
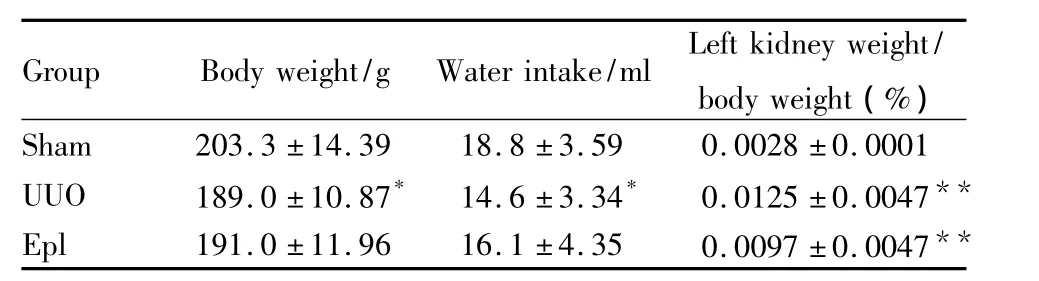
Tab 1General situation of animals(¯±s)
*P <0.05,**P <0.01 vs sham group
Group Body weight/g Water intake/ml Left kidney weight/body weight(%)?Sham 203.3 ±14.39 18.8 ±3.59 0.0028 ±0.0001 UUO 189.0 ±10.87* 14.6 ±3.34* 0.0125 ±0.0047**Epl 191.0 ±11.96 16.1 ±4.35 0.0097 ±0.0047**
2.2 肾脏组织病理学改变 HE染色结果显示:假手术组小鼠肾脏组织表现未见异常,上皮细胞排列正常,无细胞水肿。UUO组肾组织大量上皮细胞坏死、脱落,细胞浊肿,组织水肿;肾小管明显扩张,大量炎性细胞浸润。依普利酮组肾脏损伤与UUO组基本相同。Masson结果显示:假手术组肾间质仅有少量纤维成分,结构清晰。UUO组胶原成分明显增多,呈条索状或片状沉积于肾小管间质,肾小管萎缩。依普利酮治疗组肾间质胶原成分较假手术组增多,但较UUO组明显减轻(Fig 1、2)。
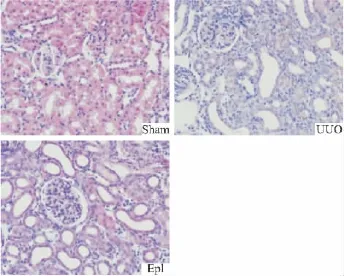
Fig 1 HE staining of kidney in rats with UUO
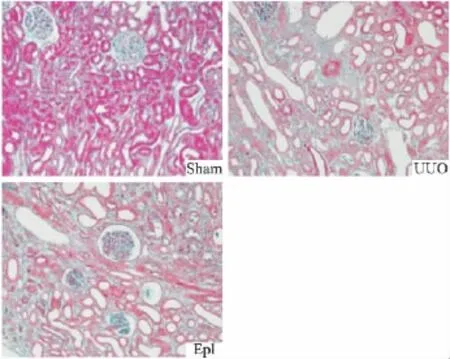
Fig 2 Masson staining of kidney in rats with UUO
2.3 肾组织 TNF-αmRNA 的表达 采用 Real time-PCR测定TNF-α mRNA表达,结果显示模型组较假手术组表达明显增强,差异有显著性;依普利酮组较UUO组明显下调,差异有显著性(Fig 3)。
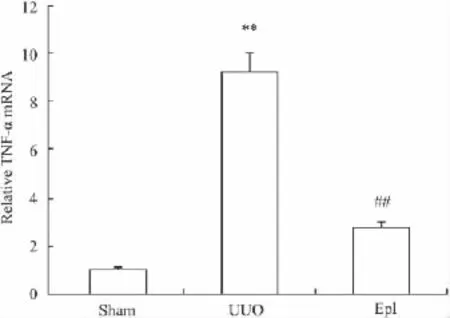
Fig 3 Expression of TNF-α mRNA in UUO ratswith Real time-PCR(n=3)
2.4 肾组织TNF-α及 NF-κB的表达 假手术组TNF-α及NF-κB呈弱表达,主要表达于肾小管上皮细胞;UUO组TNF-α及NF-κB表达明显增强,近曲小管尤为明显;依普利酮组TNF-α及NF-κB表达范围及强度较UUO组均明显减弱(Fig 4、5)。
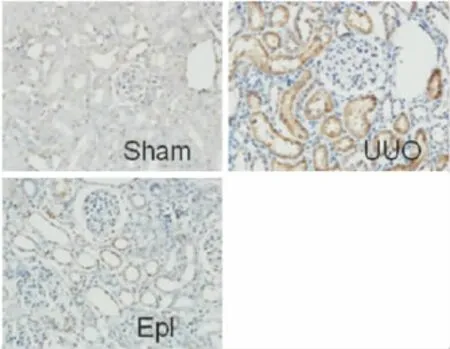
Fig 4 Expression of TNF-α in UUO rats with immunohistochemistry(10×20)
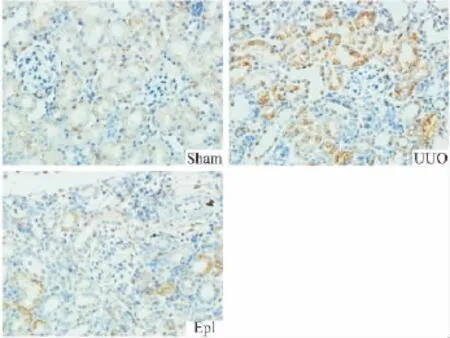
Fig 5 Expression of NF-κB in UUO rats with immunohistochemistry(10×20)
2.5 肾组织α-SMA的免疫组化检测 假手术组α-SMA仅表达于血管,肾间质及上皮细胞未见表达;UUO组表达明显增强,以扩张的肾小管表达为甚,间质亦可见到阳性表达;依普利酮组α-SMA局部呈中度表达,间质可见少量表达,较UUO组明显减弱(Fig 6)。
2.6 肾组织 TNF-α、NF-κB、α-SMA 的蛋白表达采用 Western blot检测肾组织 TNF-α、NF-κB、α-SMA蛋白表达,结果显示 UUO 组 TNF-α、NF-κB、α-SMA表达均较假手术组明显增强;依普利酮组的表达较UUO组明显减弱(Tab 2、Fig 7)。
3 讨论
炎症损伤在慢性疾病进展中的作用越来越受到重视,尽管起始因素不同,其持续进展过程中,炎症损伤发挥着关键作用,故抗炎治疗对于慢性疾病的治疗有着重要作用[1]。慢性肾脏的损伤过程中,有多种因素共同发挥作用,如血管活性物质、细胞因子、氧化损伤、RAS激活等。目前,对于血管紧张素Ⅱ的作用较为关注,ACEI及ARB的临床应用减缓了肾脏疾病的进展,有效地保护了肾功能。但不少患者,即便足量的ACEI及ARB治疗亦未能有效,说明有其他因素如氧化损伤、炎症损伤等因素的参与。近年来,随着对肾素-血管紧张素-醛固酮系统的深入研究,醛固酮对肾脏的损伤作用得以重视。当肾脏损伤时,会诱导醛固酮的活化,而醛固酮的活化又加重了肾脏的损伤,醛固酮活化后会诱导氧化损伤、炎症损伤,并与血管紧张素 II相互作用[2-4]。阻断醛固酮的炎症损伤作用,对于减缓肾脏病的进展有重要意义。
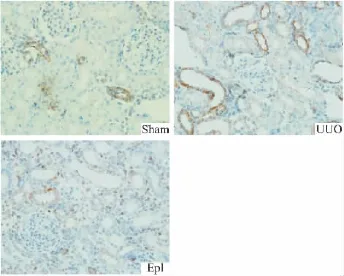
Fig 6 Expression of α-SMA in UUO rats with immunohistochemistry(10×20)

Tab 2 Expression of TNF-α,NF-κB and α-SMAin kidney of UUO rats with Western blot(n=4)
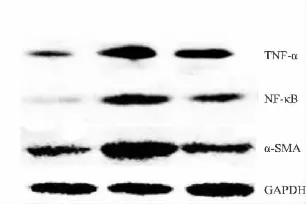
Fig 7 Expression of TNF-α、NF-κB、α-SMA in UUO rats with Western blot
肾间质纤维化是慢性肾脏疾病进展至后期的组织学改变[5],小管上皮细胞的表型转化参与了纤维化的进程。当小管上皮细胞受到刺激后,转分化为肌成纤维细胞,其标志物为α-SMA,不仅可以游走,且较固有成纤维细胞更多地分泌细胞外基质。α-SMA在正常肾脏仅表达于血管,若小管上皮细胞及间质有α-SMA的表达,说明肾脏的小管上皮细胞以及处于静止状态的成纤维细胞转化为肌成纤维细胞。因此,有效地控制其细胞表型转化将对肾间质纤维化的进展起到抑制作用。
细胞的表型转化与血管紧张素Ⅱ、转化生长因子-β以及一些炎性介质有关,其中TNF-α以及核转录因子NF-κB在其中起着关键作用。TNF-α是公认的直接炎性因子,在体内介导了广泛的细胞反应,是参与多种生理和免疫过程的重要递质。TNF-α可刺激系膜细胞表达黏附分子、血管活性肽等细胞因子,并刺激成纤维细胞增生,促进胶原纤维的沉积[6]。TNF-α诱导细胞表型转化的机制是通过NF-κB通路,刺激其活化,进入细胞核内,诱导细胞的表型转化。TNF-α与其受体 TNF-αR1结合后激活TRADD,释放TRAF2,与 IKK结合,此复合物被 RIP激活,可使 IκBα 磷酸化,从 NF-κB分离,从而激活炎性反应基因 NF-κB[7-8]。本实验观察磷酸化的NF-κB(p65)改变,检测其活性,证实其高表达可诱导肾小管上皮细胞向肌成纤维细胞转化,影响肾小管上皮细胞表型的改变并表达α-SMA。
NF-κB的激活被认为是细胞表型转化的启动因素[9],而活化的 NF-κB 反过来又增加 TNF-α 的形成,两者相互促进,使 NF-κB与 TNF-α 形成反馈环[10]。本实验证实TNF-α在梗阻性肾病小管上皮细胞呈高表达,与NF-κB、α-SMA表达呈正相关。
TNF-α的产生与多种因素有关,在梗阻性肾病中,其高表达考虑为醛固酮所介导。肾脏疾病进展中,肾素-血管紧张素-醛固酮系统除了对血液动力学有调控作用外,亦可引起氧化损伤、炎症损伤,血管紧张素Ⅱ在其中发挥着关键作用。此外,醛固酮的激活在炎症损伤中的作用也得以证实[4],故阻断醛固酮的效应可能具有肾脏保护作用。
依普利酮是新型的具有高度选择性的醛固酮受体阻断剂,目前在国外作为高血压、心脏病、肾脏病的主要治疗药物,大量的研究证实盐皮质激素受体阻断剂可以抑制 NF-κB活化、氧化损伤、动脉重构、炎性损伤、心脏纤维化和肾脏损伤等[11]。之前的实验已经证实依普利酮具有抑制细胞增殖,减轻肾损伤的作用[3、12]。依普利酮的剂量根据国外文献及我们前期的实验,动物实验以 100 mg·kg-1·d-1为宜,体外实验可设计不同的剂量。本次实验观察其对细胞表型转化的影响,结果证实依普利酮可以通过TNF-α/NF-κB通路,下调炎性介质表达,抑制其信号传导通路,抑制细胞的表型转化,从而减轻肾脏损伤。
[1] Tabas I,Glass C K.Anti-inflammatory therapy in chronic disease:challenges and opportunities[J].Science,2013,339(6116):166-72.
[2] Hollenberg N K.Aldosterone in the development and progression of renal injury[J].Kidney Int,2004,66(1):1 -9.
[3] 孙东云,许庆友,王香婷,等.依普利酮抑制细胞增殖拮抗急性环孢素A肾损伤的研究[J].中国药理学通报,2011,27(12):1678-82.
[3] Sun D Y,Xu Q Y,Wang X T,et al.Study on eplerenone inhibited cell proliferation in acute cyclosporine nephrotoxicity[J].Chin Pharmacol Bull,2011,27(12):1678 -82.
[4] Wagman G,Fudim M,Kosmas C E,et al.The neurohormonal network in the RAAS can bend before breaking[J].Curr Heart Fail Rep,2012,9(2):81- 91.
[5] Speca S,Giusti I,Rieder F,Lateela G.Cellular and molecular mechanisms of intestinal fibrosis[J].World J Gastroenterol,2012,18(28):3635 -61.
[6] Grande M T,Pérez-Barriocanal F,López-Novoa J M.Role of inflammation in túbulo-interstitial damage associated to obstructive nephropathy[J].J Inflammation,2010,7(19):1 -14.
[7] Meldrum K K,Misseri R,Metcalfe P,et al.TNF-α neutralization ameliorates obstruction-induced renal fibrosis and dysfunction[J].Am J Physiol Renal Physiol,2007,292(4):R1456 - R64.
[8] Wajant H,Pfizenmaier K,Scheurich P.Tumor necrosis factor signaling[J].Cell Death Differ,2010,5(1):45 -65.
[9] 雷向宏,涂卫平.NF-κB与肾脏疾病的研究进展[J].实用临床医学,2007,12(8):130 -3.
[9] Lei X H,Tu W P.Research progress of NF-κB and nephropathy[J].Practical Clin Med,2007,12(8):130 -3.
[10]李小波,李 均,师晶丽.桃仁对单侧输尿管梗阻大鼠肾组织NF-κB 、TNF-α 表达的影响[J].中国中医基础医学杂志,2006,12(7):526 -7.
[10] Li X B,Li J,Shi J L.The investigate of NF-κB and TNF-α expression in rats kidney after uniateral ureteral obstruction with semen persicae[J].Chin J Basic Med Tradit Chin Med,2006,12(7):526-7.
[11] Lea W B,Kwak E S,Luther J M,et al.Aldosterone antagonism or synthase inhibition reduces end-organ damage induced by treatment with angiotensin and high salt[J].Kidney Int,2009,75(9):936 -44.
[12]许庆友,贾晓明,丁英钧,等.依普利酮对环孢素A急性肾损伤小管上皮细胞坏死及再生的作用[J].中国药理学通报,2010,26(7):906-9.
[12] Xu Q Y,Jia X M,Ding Y J,et al.Effect of eplerenone on necrosis and regeneration of tubular epithelial cells in acute cyclosporine nephrotoxicity[J].Chin Pharmacol Bull,2010,26(7):906 -9.
