三七总皂苷对H9c2细胞P450酶mRNA表达的影响
2013-12-08胡东华王宇光陈志武马增春梁乾德肖成荣谭洪玲汤响林
胡东华,王宇光,陈志武,马增春,梁乾德,肖成荣,谭洪玲,汤响林,高 月
三七总皂苷(panax notoginseng saponin,PNS)是五加科植物三七[Panax notoginseng(Burk)F.H.Chen]的主要活性成分,其在三七中的含量高达12%。PNS中三七皂苷 R1、人参皂苷Rb1、Rg1、Rd和Re为其主要成分,约占总皂苷含量的80%[1],具有防止脂质在血管内沉积,抑制血管平滑肌细胞增殖,促纤溶及抑制血小板聚集,促进微循环,抗动脉粥样硬化,保护心肌等作用[2-3]。是临床用血栓通的主要成份,主要用于扩张血管,改善血液循环。
细胞色素P450酶(CYP450)最初发现于肝脏中,其在生物转化、药物代谢、解毒等方面进行广泛深入的研究;近年来发现心脏中也含有CYP,并且以CYP2和CYP4家族为代表与心血管疾病密切相关的CYP亚型也成为研究热点,内源性物质花生四烯酸(arachidonicacid,AA)经P450酶途径的代谢产物对心血管系统的影响近年来日益受到重视[4]。近年来许多CYP家族在心脏、血管内皮细胞和平滑肌细胞中得以鉴定,同时很多证据显示内源性物质经CYP的代谢产物在维持心血管内环境稳态中发挥重要作用[5]。研究表明,花生四烯酸可被CYP环氧酶(CYP2C11,2J3)代谢为环氧二十碳三烯酸(EET)或被 CYP ω-羟化酶(CYP4A,4F)代谢为20-羟基二十碳四烯酸(20-HETE)[6]。
以往对于PNS的药理机制研究主要集中在对心肌的保护作用、钙拮抗作用、对抗心肌肥大、抑制心室重构、抑制血管平滑肌细胞的增殖、抗血栓形成和抗动脉粥样硬化、保护血管内皮细胞作用、肝脏P450酶等方面[7-9]。目前尚未见 PNS对心脏细胞色素P450调控的研究,鉴于近年来发现心脏细胞色素P450在心血管系统中同样执行重要功能,PNS作为治疗心脑血管疾病的临床常用药物,其对心肌细胞色素P450影响和机制仍不是十分清楚。本研究利用Real Time PCR方法从心脏P450酶的层面考察PNS处理心肌细胞H9c2,细胞色素P450亚型表达的变化,以评价PNS对心脏P450酶亚型是否有抑制或诱导效应,为进一步深入研究PNS以心脏P450为靶点的心血管药理效应的机制提供线索,同时为指导临床合理用药提供实验依据。
1 材料与方法
1.1 试剂及药品 PNS[广西梧州制药(集团)股份有限公司],依据国家药品标准 WS-10460-(ZD-0460)-2002-2011Z检验合格;DMEM和血清(FBS)(Hyclone);胰酶(Sigma);MTS试剂盒(Promega);LDH试剂盒(普利莱基因技术有限公司);PBS(北京凯欣杰生物技术有限公司);RNApure超纯总RNA快速提取试剂盒(博迈德生物);Trans ScriptTMOne-Step RT-PCR Super Mix(北京全式金生物技术有限公司);Fast SYBR@Green Master Mix(Applied Biosystems),其他试剂均为市售分析纯。
1.2 仪器 细胞培养箱(NAPCO 5410);超净工作台(北京长城空气净化设备公司);倒置显微镜(Nikon 120型);Victor X5酶标仪(Perkin Elmer)PCR仪(Gene Amp 2400);核酸蛋白分析仪 (Beckman DU640);StepOne PlusTMReal Time PCR(Applied Biosystems)。
1.3 细胞培养 H9c2心肌细胞株来源于大鼠胚胎期心脏组织(购自北京协和细胞库),在37℃、5%CO2的条件下,培养于含有10%胎牛血清和高糖DMEM培养基中,融合率为80% ~90%时,按1∶3的比例传代。
1.4 PNS 母液配制(200 g·L-1)[10]精确称取2.000 g的PNS粉末,加入5 ml的去离子水,缓慢搅拌使其溶解,再加去离子水定容至10 ml,搅拌使其充分溶解;用0.22 μm孔径的微孔滤器过滤除菌;分装至1.5 ml EP管,4℃冰箱保存。
1.5 MTS法检测H9c2细胞活性 用DMEM培养基将对数生长期的H9c2细胞以2×104个/孔密度接种于96孔培养板(空白孔不种细胞),200 μl/孔,37℃、5%CO2培养 24 h;实验分为空白组,PNS组(浓度依次为 0.3125、0.625、1.25、2.5、5、10、20 g·L-1)和阴性对照组,培养48 h;每孔加MTS液8 μl,继续孵育4 h;用酶标仪测定490 nm处的光密度值(OD);按以下公式计算细胞存活率。
细胞存活率(IC)/%=(实验组OD值-空白组OD值)/(阴性对照组OD值-空白组OD值)×100%
1.6 乳酸脱氢酶比色法(LDH)检测H9c2细胞损伤 对数生长期的H9c2细胞以2×104个/孔密度接种于96孔培养板(空白孔不种细胞),200 μl/孔,37℃、5%CO2培养24 h;实验分组如上,培养48 h后,按照LDH试剂盒操作说明进行试验,按以下公式计算细胞的损伤。
细胞LDH释放率/%=细胞培养基中测定的酶活力单位/(细胞裂解液测定的酶活力单位+细胞培养基测定的酶活力单位)×100%
1.7 Real Time PCR测定H9c2细胞CYP450 mRNA水平影响 实验分为空白对照组,PNS组(浓度依次为 0.3125、0.625、1.25、2.5、5 g·L-1)接种 6孔板中,给药48 h后取各处理组H9c2细胞,按试剂盒说明提取心肌细胞总RNA,电泳分析表明18S和28S条带清晰可见,A260/A280比值在 1.7~2.0,总RNA片段完整未降解可用。取 2 μg RNA按照TransScriptTMOne-Step RT-PCR SuperMix说明进行逆转录反应,42℃ 30 min;85℃ 5 min。用 ABI StepOne PlusTMReal Time PCR进行 PCR反应,取2.0 μl逆转录反应产物作为PCR反应模板,加入上下游引物 20 μmol· L-1各 0.5 μl,Fast SYBR@Green Master Mix 10 μl,补充 Rase-free water 至 20 μl。反应参数:95℃ 20 s预变性,95℃ 3 s变性,60℃ 30 s退火,共40个循环。每次扩增设置β-actin内参照,进行PCR扩增产物的实时定量分析,用2-(△△Ct)方法分析。特异性引物序列见Tab 1。

Tab 1 Primers sequence used in Real Time PCR analy
1.8 统计学分析 所有数据重复3次,每次设置3个复孔,收集数据进行统计学分析。实验数据用¯±s表示,采用SAS统计学软件,两组间比较采用t检验。
2 结果
2.1 MTS法检测H9c2细胞活性 以PNS(浓度依次为 0.3125、0.625、1.25、2.5、5、10、20 g·L-1)处理H9c2细胞48 h以后,测定各处理组细胞存活率,结果显示随着三七总皂苷浓度的升高,细胞的存活率逐渐下降。低浓度的PNS对细胞的存活率没有影响(如0.3125、0.625 g·L-1)。用Origin8.0 软件拟合计算IC50(5.28±0.08)g·L-1(Fig 1)。
2.2 乳酸脱氢酶比色法(LDH)检测H9c2细胞损伤 对各处理组细胞的LDH进行测定,结果显示以PNS处理H9c2细胞48h后,随着PNS浓度的升高,乳酸脱氢酶的释放率逐渐增大,与空白组比较,5、10、20 g·L-1组的 LDH 释放率明显增高(P<0.01),而 0.3125、0.625、1.25 g·L-1组的 LDH 释放率没有变化(Fig 2)。
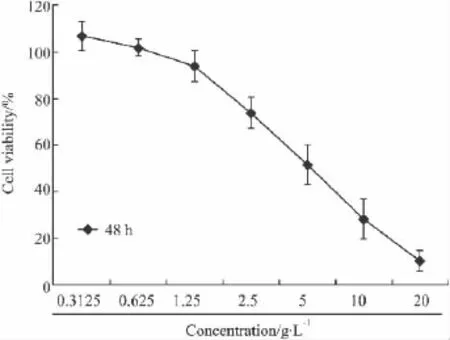
Fig 1Effect of PNS on cell viability of H9c2 cells(¯±s,n=5)
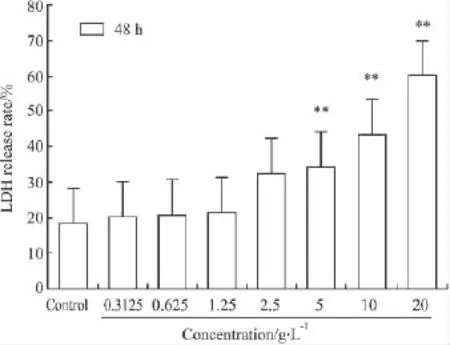
Fig 2Effect of PNS on LDH release rate of H9c2 cells(¯±s,n=5)
2.3 PNS对H9c2细胞P450酶 mRNA表达的影响
2.3.1 PNS对 H9c2细胞 CYP2C11和 CYP2J3亚型mRNA水平的影响 PNS对H9c2细胞CYP450酶Ⅱ家族mRNA表达的影响如Fig 3所示,与空白组比较,PNS对CYP2C11有下调趋势(P<0.05或P<0.01),而对CYP2J3有上调作用,且作用比较明显(P<0.01)。
2.3.2 PNS对 H9c2细胞 CYP4家族中 CYP4A1、CYP4A2、CYP4A3、CYP4F1、CYP4F4 和 CYP4F5 亚型mRNA水平的影响 如Fig 4所示,PNS对H9c2细胞 CYP4家族中 CYP4A1、CYP4A2、CYP4F1和CYP4F5有上调趋势(P<0.01),并且有一定的浓度依赖性。PNS对CYP4A3和CYP4F4,在低浓度时有下调作用(P<0.05或P<0.01),而在最大浓度时,对这两个亚型有一定的上调作用(P<0.01)。
3 讨论
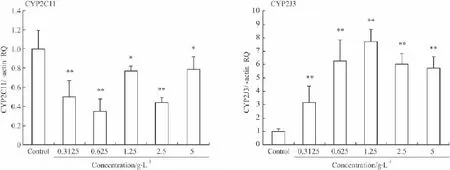
Fig 3Effect of PNS on CYP2C11 and CYP2J3 gene expression of H9c2 cells¯±s,n=3)
细胞色素P450(CYPs)酶是混合功能氧化酶系,多表达于肝脏,人体内约有75%的药物通过CYP450代谢[11]。EETs具有抗炎,抑制平滑肌细胞增殖与迁移,调节血管张力,促纤溶,抗动脉粥样硬化等作用,在心脑血管中有着广泛的生物学效应,主要有CYP2C11和 CYP2J3参与[12]。20-HETE在大鼠中主要由CYP450酶4家族代谢,这是一种强有力的缩血管物质,对血压调节有重要影响,主要有CYP4A和4F参与[13]。因此本文从心脏的主要药物代谢酶为研究对象,研究PNS对上述CYP亚型表达的影响,旨在探讨PNS对心血管药理作用新的可能机制。
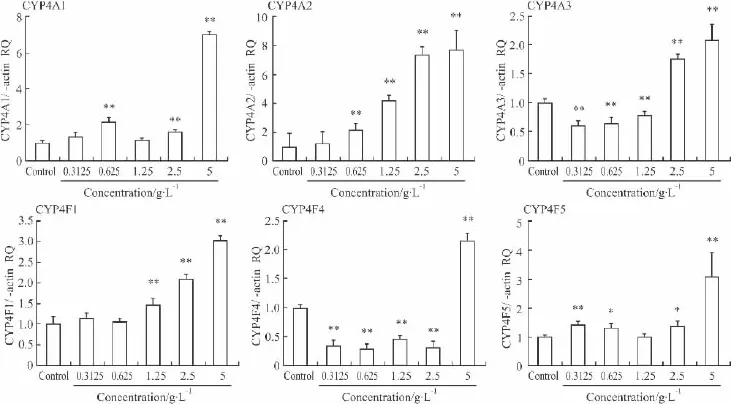
Fig 4Effect of PNS on CYP4A1,CYP4A2,CYP4A3,CYP4F1,CYP4F4 and CYP4F5 gene expression of H9c2 cells(¯±s,n=3)
MTS的测定结果可以反映细胞的存活程度。细胞受到损伤时,激活一系列的酶促反应造成细胞内LDH大量外释,并且诱导细胞的进一步损伤。通过PNS处理H9c2细胞48 h后,MTS结果表明随着PNS浓度的增大,细胞的存活率逐渐降低,并且呈浓度依赖性,低浓度对细胞的存活率没有影响(如 0.3125、0.625 g·L-1);LDH 的释放率随着浓度的升高而逐渐增大,0.3125、0.625、1.25 g·L-1组的LDH释放率没有变化。提示PNS在高浓度时可能会对细胞有一定的损伤。PNS对大鼠肾小球系膜细胞有一定的抑制作用,并呈剂量依赖性[14]。有研究显示PNS在治疗剂量下对肝脏损伤有保护作用,大剂量(150 mg·kg-1)对大鼠有肝肾毒性,在150 mg·kg-1以上时对心脏功能具有毒性效应[15-16]。结合本次研究结果,提示临床应用此类药物时应注意剂量。
CYP2J2/3主要表达于心脏,且主要合成具有心脏保护作用的EETs,而EETs有扩张血管的作用。大鼠心脏CYP2J3与人类心脏CYP2J2具有70%的同源性。Bhatnagar[17]研究发现 CYP2J对心脏表现为保护作用,而CYP2C则表现为加重损伤,提出CYP450不同亚型可能因产生氧自由基不同,而表现为加重或拮抗心肌缺血/再灌注损伤。PNS各浓度对CYP2C11有下调趋势,而对CYP2J3有上调作用,提示PNS有一定的保护心脏,扩张血管的作用。CYP450酶4家族羟化酶代谢花生四烯酸产生20-HETE,这是一种强有力的缩血管物质。PNS各浓度对 H9c2细胞 CYP4家族中 CYP4A1、CYP4A2、CYP4F1和CYP4F5有上调趋势,而对 CYP4A3和CYP4F4在低浓度时有下调作用,而在最大浓度时(5 g·L-1),对这两个亚型有一定的上调作用,这可能是高浓度对细胞的影响的结果。
PNS作为临床用血栓通的主要成份,本研究结果显示高浓度的PNS可能会有一定的毒性。同时PNS对CYP450酶不同的亚型有不同程度的诱导或者抑制作用,提示PNS对心脏和血管有一定的保护作用。因此使用PNS时应注意用药剂量,使其发挥疗效而尽量减少药物不良反应的发生,同时在临床应用时注意用药剂量。
[1] Li X Y,Wang G G,Sun J G,et al.Pharmacokinetic and absolute bioavailability study of total panax notoginsen-oside,a typical multiple constituent traditional Chinese medicine(TCM)inrats[J].Biol Pharm Bull,2007,30(5):847 -51.
[2] 李晓宇,孙建国,郑媛婷,等.三七总皂苷对抗H2O2所致大鼠脑微血管内皮细胞损伤的物质基础研究[J].中国药理学通报,2007,23(8):1030-4.
[2] Li X Y,Sun J G,Zheng Y T,et al.Protective effect study of major constituent in total panax notoginsenoside on rat brain microvessel endothelial cell(RBMEC)damage induced by H2O2[J].Chin Pharmacol Bull,2007,23(8):1030 -4.
[3] 吴 颖,孙 冰,肖 静,等.三七皂苷R1对LPS诱导的小鼠心肌损伤的保护作用[J].中国药理学通报,2013,29(2)179-84.
[3] Wu Y,Sun B,Xiao J,et al.Protective effect of Notoginesenoside R1 on lipopolysaccharide-induced myocardial dysfunction in mice[J].Chin Pharmacol Bull,2013,29(2):179 -84.
[4] Roman R J.P-450 metabolites of arachidonic acid in the control of cardiovascular function[J].Physiol Rev,2002,82:131 -85.
[5] Elbekai R H,El-Kadi A O.Cytochrome P450 enzymes:central players in cardiovascular health and disease[J].Pharmacol Ther,2006,112:564-87.
[6] Roman R J.P-450 metabolites of arachidonic acid in the control of cardiovascular function[J].Physiol Rev,2002,82:131 -85.
[7] 沈 央,方晓玲.三七总皂苷脂质体的生理适应性及其对心脑血管的保护作用[J].中国临床药学杂志,2004,13(5):269-73.
[7] Shen Y,Fang X L.Panax notoginseng liposomes:physiological compatibility and effects on cardio-cerebrovascular diseases study[J].Chin J Clin Pharmacy,2004,13(5):269 -73.
[8] Nah S Y,Park H J,McCleskey E W.A trace component of ginseng that inhibit Ca2+channels through a pertussis toxin sensitive G protein[J].Proc Natl Acad Sci USA,1995,92(19):8739 -43.
[9] 李晓宇,刘皋林,周佳纯,等.三七总皂苷注射液对大鼠肝CYP450酶的影响[J].中国临床药理学与治疗学,2009,14(8):849-54.
[9] Li X Y,Liu G L,Zhou J C,et al.Experimental study on the effects of liver cytochrome protein 450(CYP450)induced by panax notoginsenoside injection in rats[J].Chin J Clin Pharmacol Ther,2009,14(8):849 -54.
[10]陈少贤,杨 敏.三七总皂苷抗缺血诱导的大鼠心肌细胞凋亡的作用及机制研究[D].中国硕士论文数据库,2010:1-75.
[10] Chen S X,Yang M.Study of the anti-apoptotic effect and mechanism of panax notoginseng saponin on rat cardiomyocytes induced by ischemia[D].China’s Master’s Dissertaion Database,2010:1-75.
[11] Larsen B T,Gutterman D D,Hatoum OA.Emerging role of epoxyeicosa-trienoic acids in coronary vascular function[J].Eur J Clin Invest,2006,36:293 -300.
[12] Sun J,Sui X,Bradbury J A,et al.Inhibition of vascular smooth muscle cell migration by cytochrome p450 epoxygenase-derived eicosanoids[J].Circ Res,2002,90:1020 - 7.
[13] Zou A P,Fleming J T,Falck J R,et al.20-HETE is an endogenous inhibitor of the large-conductance Ca2+-activated K+channel in renal arterioles[J].Am J Physiol,1996,270:228 -37.
[14]赵 湘,邱莲女,郭俊华,等.三七总皂苷对大鼠肾小球系膜细胞增殖及细胞周期的影响[J].中华中医药学刊,2008,26(2):287-9.
[14] Zhao X,Qiu L N,Gou J H,et al.The effect of total Panax Notoginseng Saponins in regulating the cell proliferation and cell cycle in rat’s mesangial cells[J].Chin Arch Tradit Chin Med,2008,26(2):287-9.
[15]韩 刚,孙辉业,董延生,等.三七总皂苷对大鼠肝脏肾脏的毒性作用[J].中国新药杂志,2006,15(24):2115-8.
[15] Han G,Sun H Y,Dong Y S,et al.Rat’hepatic and renal toxicity of total saponins from panax notoginseng[J].Chin J New Drugs,2006,15(24):2115-8.
[16]徐 江,彭双清,闫长会,等.三七总皂苷对大鼠心脏血流动力学的毒性作用[J].中国新药杂志,2009,18(4):345-52.
[16] Xu J,Peng S Q,Yan C H,et al.Toxice ffects of Panax notoginseng saponins on cardiachemodynamics in rats[J].Chin J New Drugs,2009,18(4):345 -52.
[17] Bhatnagar A.Beating ischemia:a new feat of EETs[J]?Circ Res,2004,95(5):443 -5.
