Jasplakinolide通过稳定细胞骨架调控内皮细胞功能
2013-12-07孙金隆张晓芸唐可欣尹青令吴海燕王金红王济潍
靖 旭,孙金隆,张晓芸,唐可欣,尹青令,吴海燕,王金红,王济潍,成 敏
(潍坊医学院1.麻醉学系、2.医学研究实验中心,山东,潍坊 261053;3.山东大学医学院,山东 济南 250012)
随着对血管内皮生物学功能研究的不断深入,人们已经认识到内皮不仅是血管壁的衬里,而且具有复杂的表面结构和众多的生理功能[1],并在心血管系统稳态调节中起着重要作用。因此,内皮损伤是导致心血管疾病如动脉粥样硬化等发生、发展的重要环节[2-3]。内皮损伤表现为内皮细胞迁移、肥大、增殖和凋亡等,其细胞表型、形态结构与功能均发生改变。
细胞骨架是位于细胞核和细胞膜内侧面的一种纤维状蛋白基质,这些纤维状结构在细胞内具有网状、束状或带状等不同形态,包括微丝、微管和中间纤维3种组成成分。其中微丝由单体状态(G-actin)与聚合状态(F-actin)两种形式的肌动蛋白组成,调控细胞诸多生理活动,例如应力纤维的形成、细胞附着、迁移、凋亡、物质运输、跨膜信息传递以及受体的聚集[4-6]。有研究提示内皮细胞结构和功能的完整性与肌动蛋白细胞骨架息息相关,而细胞骨架的损害往往先于内皮细胞形态结构的损伤[7]。故明晰肌动蛋白细胞骨架对内皮细胞功能的调控可进一步阐明动脉粥样硬化等心血管疾病的发病机制,为其防治提供理论及实验依据。本研究利用细胞骨架聚合剂(Jasplakinolide,JAS)促进微丝的聚合,改变肌动蛋白细胞骨架,探讨JAS对培养的HUVECs细胞生物特性的影响,以进一步阐明细胞骨架在内皮细胞功能调控中所起的作用。
1 材料与方法
1.1 材料 HUVECs细胞株购自中南大学湘雅医学院细胞库。M199培养基(Gibco,美国);胎牛血清(Hyclone,美国);生长因子 VEGF、bFGF(invitrogen,美国);Matrigel(BD,美国);CCK8(DOJINDO,日本),Phalloidin-FITC(ENZO,美国),4',6-二脒基-2-苯基吲哚(DAPI)(ROCHE,德国),纤维粘连蛋白(Roche,德国)。
1.2 方法
1.2.1 细胞培养 HUVECs于 37℃ 恒温、含 5%CO2的细胞培养箱内无菌培养。培养液为全M199培养液(含 15%FBS、VEGF 10 μg·L-1及 bFGF 5 μg·L-1)。细胞用0.25%胰酶-0.02%EDTA消化传代。
1.2.2 免疫荧光检测细胞骨架 HUVECs胰酶消化后,接种于载玻片上。用含JAS(100 nmol·L-1)或DMSO的培养基分别孵育15 min、30 min、1 h及24 h后。取出载玻片,PBS漂洗3次,4%多聚甲醛固定10 min。用DAKO免疫组化笔画标出染色区,加入F-actin免疫荧光染料Phalloidin-FITC,DNA免疫荧光染料DAPI,37℃孵育1 h。荧光显微镜下观察,每张载玻片取4个视野,观察细胞骨架的改变。
1.2.3 细胞增殖能力测定 将经JAS或DMSO作用的HUVECs消化成单细胞悬液后接种于96孔板(4 000个细胞/孔),待细胞融合80%左右,弃去各孔培养基,加入CCK-8试剂和培养基的混合液(按1∶10比例),在培养箱内孵育60 min,利用酶标仪测定各孔在450 nm波长的吸光度。
1.2.4 细胞粘附能力测定 用10 mg·L-1的纤维粘连蛋白预包被6孔板2 h,PBS洗3遍。HUVECs分别用JAS(100 nmol·L-1)和DMSO处理1 h后消化成单细胞悬液,分别接种于包被有纤维粘连蛋白的6孔板中。37℃,5%CO2孵育1 h后,PBS冲洗3次,每孔随机取5个高倍镜 (×100)视野计数贴壁细胞。
1.2.5 细胞迁移能力测定 采用改良的Boyden小室法观察细胞迁移情况,胰酶消化经JAS和DMSO处理的HUVECs,用含10%血清的培养基制成悬液计数,50 μl细胞(2×104)悬浮液注入上室,用培养基加满下室。置于37℃、5%CO2和饱和湿度的培养箱内。8 h后,刮去滤膜上面的未移动细胞,PBS洗涤3次,4%多聚甲醛固定,DAPI染色,显微镜下随机选取5个视野(×100),计数迁移细胞,取其平均数。
1.2.6 细胞体外成血管能力测定 在预冷的96孔板中用Matrigel包被(冰上操作),在细胞培养箱中孵育1 h。将HUVECs(2×107L-1)接种于包被有Matrigel的96孔板中,用DMSO、JAS干预1 h,换全M199继续孵育6 h后倒置相差显微镜观察,计数成血管数目,测量微血管长度及面积。
1.2.7 统计学处理 所有实验均重复3~4次。采用SPSS 13.0进行统计分析,实验数据以±s表示。两组间比较采用t检验。
2 结果
2.1 JAS对 H UVECs细胞骨架的影响 JAS对HUVECs细胞骨架的作用具有时间依赖性:100 nmol·L-1JAS处理15 min后较 D MSO对照组,细胞微丝结构增多;JAS处理1 h后细胞骨架明显变粗,荧光强度增加,而作用24 h后,细胞皱缩,细胞骨架聚集为团块状(Fig 1)。
2.2 JAS对HUVECs增殖能力的影响 以CCK-8法测定细胞的增殖能力,与DMSO处理的对照组比较,JAS对HUVECs的增殖无明显影响(Fig 2)。
2.3 JAS对HUVECs黏附能力的影响 在黏附实验中,将HUVECs与纤维黏连蛋白黏附1 h后,洗去未黏附的细胞,倒置显微镜下观察发现,相同视野范围内JAS处理组的HUVECs黏附细胞数(41.43±1.631)明显多于DMSO对照组(32.86±2.098),即JAS增加HUVECs与细胞外基质——纤维黏连蛋白的黏附 (P<0.05)(Fig 3)。
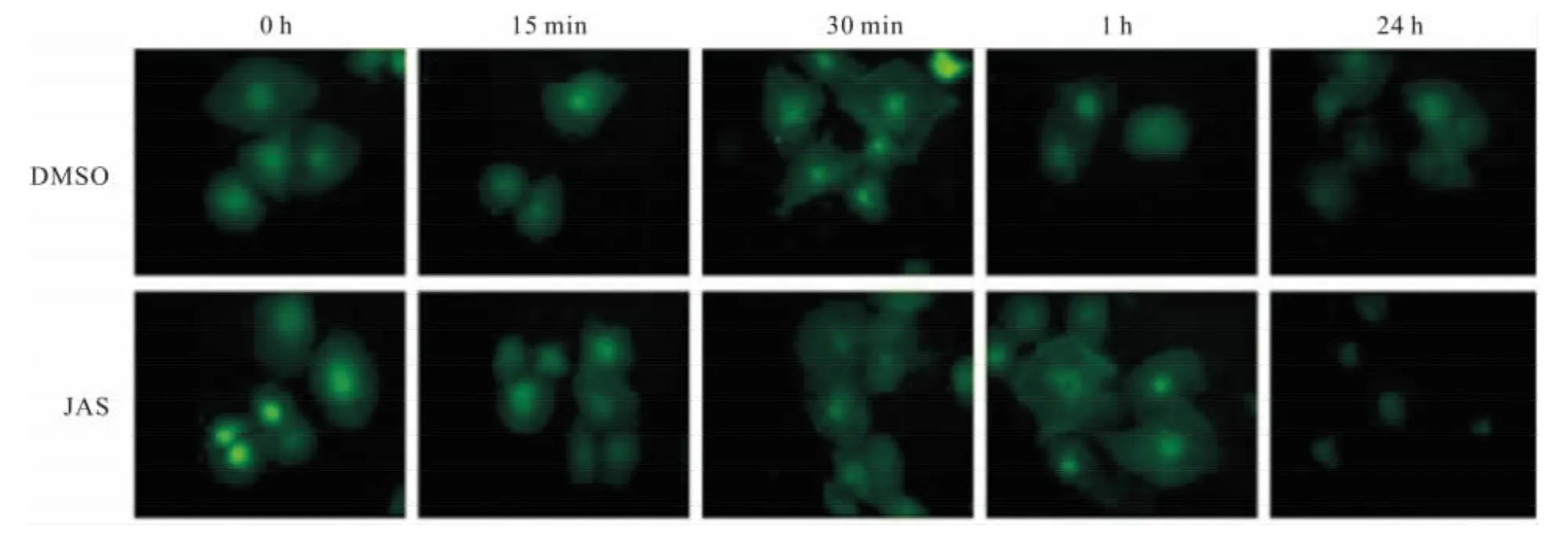
Fig 1 Time-dependent effects of JAS on actin distribution of HUVECs(×200)
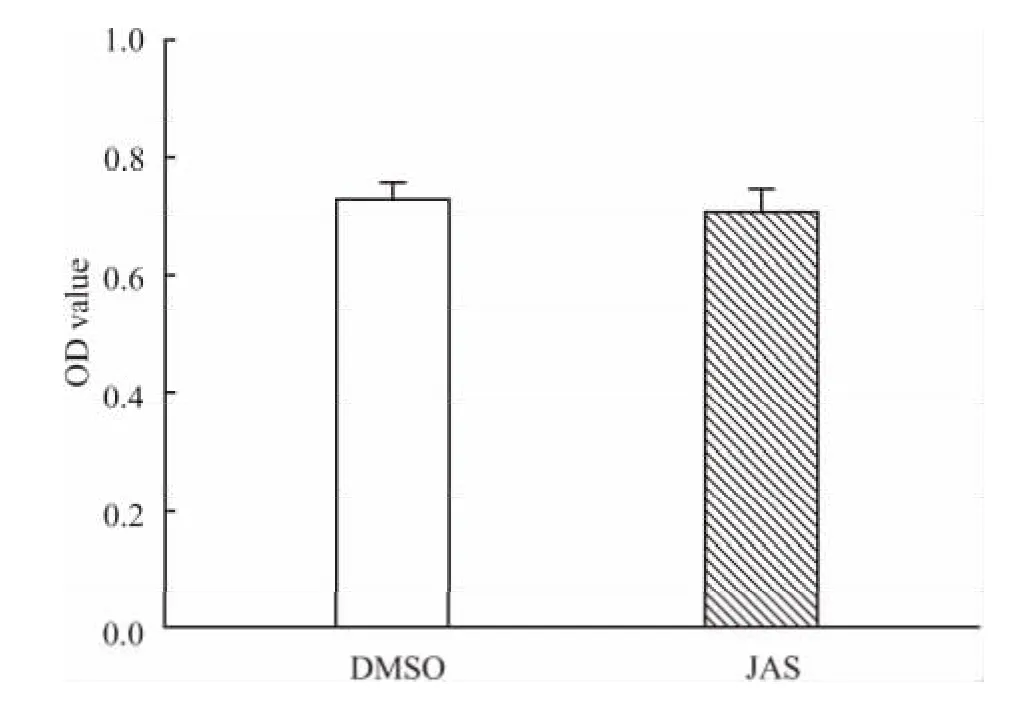
Fig 2 Effect of JAS on cell proliferation of HUVECs
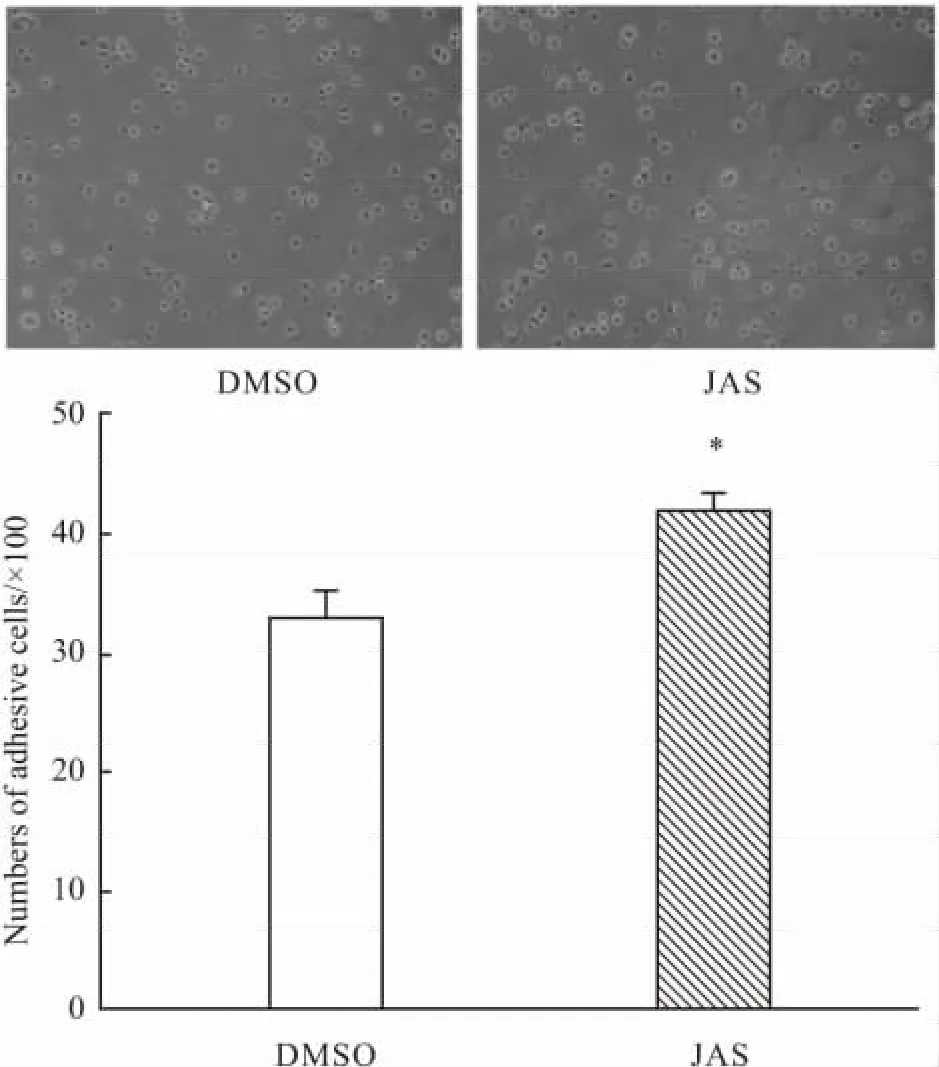
Fig 3 JAS enhances the adhesion of HUVECs
2.4 JAS对 HUVECs迁移能力的影响 Boyden小室细胞迁移实验证实JAS增强HUVECs的迁移,其迁移细胞数分别为 21.09±1.648(JAS组),16.09±1.826(DMSO组)(Fig 4)。
2.5 JAS对HUVECs体外成血管能力的影响 体外成血管实验显示,HUVECs具有体外成血管能力,种植于Matrigel上的细胞首尾相连成条索状,形成血管网样结构。JAS可明显促进HUVECs体外管样结构的形成(Fig 5A),图像分析及统计学结果显示,JAS处理组HUVECs形成的血管样结构其管腔长度及面积均高于 DMSO处理组(Fig 5B,C)(P<0.05)。
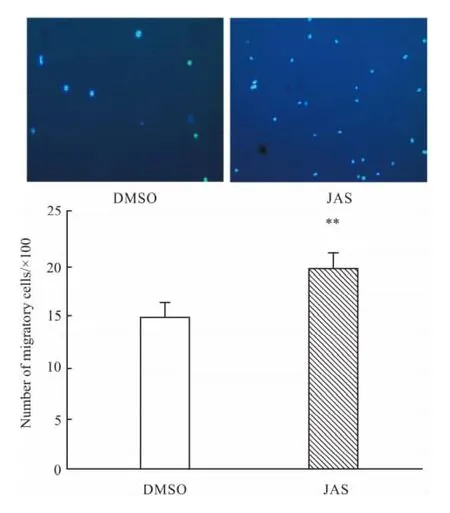
Fig 4 Modified Boyden chamber analyse the effect of JAS on the migration of HUVECs
3 讨论
肌动蛋白细胞骨架可以通过控制自身的聚合和解聚导致细胞骨架发生重排,而细胞骨架的重组和分布的改变,将直接影响细胞内信号的整合和转导、细胞周期的改变和基因表达,进而影响细胞增殖、分化、迁移、分裂和黏附能力[8]。为了研究细胞骨架在内皮细胞生理功能中的作用,本研究利用细胞骨架聚合剂JAS促进微丝的聚合,改变肌动蛋白细胞骨架。结果显示:JAS对HUVECs细胞骨架的作用具有时间依赖性,JAS短时间(譬如15 min或1 h)作用于HUVECs,细胞内微丝结构明显增多;而JAS长时间作用(24 h),则可致细胞结构皱缩,微丝结构变得模糊不清,聚集成团块状。可能的机制为短时间JAS作用可诱导G-Actin聚合成F-Actin,即微丝,及竞争性结合F-Actin,稳定微丝,而长时间的JAS作用则对细胞产生了毒性作用[9]。同时,我们在预实验中选择了3种浓度,分别为50、100及200 nmol·L-1,其中 50 nmol·L-1对细胞骨架影响不明显,而200 nmol·L-1表现的则为毒性作用,因此在后续对HUVECs功能的研究中我们选择的JAS的作用浓度为100 nmol·L-1,作用时间为1 h。
内皮细胞的功能很大程度上依赖于细胞的增殖、粘附、迁移及成血管等能力。就增殖而言,有研究表明细胞骨架的改变可以促进成骨细胞增殖[10],但抑制内皮祖细胞的增殖[11]。本实验中我们发现,JAS作用后,对HUVECs增殖的影响并不明显。以上结果提示细胞骨架对细胞增殖的影响,在不同的细胞有所不同。

Fig 5 Effect of JAS on cell tube formation capability of HUVECs
另外,我们结果显示,以JAS聚合细胞骨架后可增强HUVECs的黏附及迁移。细胞骨架中的肌动蛋白是维持细胞形态及细胞黏着的结构基础[12],培养细胞的黏着位点为黏附斑,其外部结构为整合素等蛋白。研究证实内皮细胞的黏附主要由细胞表面的整合素 α5β1 and αVβ3 调控[13],因此 JAS 促进黏附的机制可能是细胞骨架聚合促进了细胞表面整合素β1及β3的表达。细胞迁移的主要过程为细胞外部信号引起细胞的极化,从而使细胞沿移动方向形成突起,细胞的突起与基底形成黏附,这些黏附点作为细胞收缩的支点。当细胞收缩时,细胞整体向前移动,细胞尾部与基底的黏附点得以释放[14-16]。肌动蛋白参与了细胞突起的形成[17],因此其对内皮细胞的迁移影响至关重要。类似于肌动蛋白在血小板的伪足形成、变形、收缩等生理过程中所起的重要作用[18]。细胞松弛素B和D被发现可通过抑制肌动蛋白聚合来抑制成纤维细胞、中性粒细胞和神经胶原瘤细胞的迁移[19-20]。JAS与细胞松弛素B和D的作用相反,是一种肌动蛋白聚合剂,与之对应的,本实验结果表明肌动蛋白被JAS聚合后,HUVECs的迁移能力明显增强。
内皮细胞在血管的完整性及血管的形成中起非常重要的作用,其成血管能力的强弱直接关系着新生血管的形成和血管的自身修复。为了研究细胞骨架对HUVECs成血管能力的影响,本实验利用JAS促进微丝的聚合,改变肌动蛋白聚合、分离的动态变化过程。结果显示,JAS可增强HUVECs的体外成血管能力。内皮细胞成血管能力主要受细胞增殖、黏附及迁移等多种因素的影响。JAS作用后尽管HUVECs的增殖没有发生明显的改变,但其黏附及迁移能力增强,这必将有助于HUVECs的体外成血管能力。
本实验通过利用JAS促进微丝的聚合,初步探讨了肌动蛋白细胞骨架对培养的HUVECs细胞生物特性的影响,发现JAS短时间预处理可稳定细胞骨架,促进Actin骨架蛋白的聚合,进而提高HUVECs的黏附、迁移及体外成血管能力,但是细胞骨架在内皮细胞功能调控中的具体机制及相关的信号转导是极其复杂的,有待进一步研究。
[1]温 克,贺平年,娄建石.血管内皮细胞糖萼与心血管疾病[J].中国药理学通报,2008,24(8):981-4.
[1]Wen K,He P N,Lou J S.Endothelialglycocalyx and cardiovascular disease[J].Chin Pharmacol Bull,2008,24(8):981- 4.
[2]Vita J A.Endothelial function[J].Circulat,2011,124(25):e906-12.
[3]Landmesser U,Drexler H.The clinical significance of endothelial dysfunction[J].Curr Opin Cardiol,2005,20(6):547-51.
[4]Kustermans G,El B J,Piette J,et al.Perturbation of actin dynamics induces NF-kappaB activation in myelomonocytic cells through an NADPH oxidase-dependent pathway[J].Biochem J,2005,387(Pt 2):531-40.
[5]Genesca M,Sola A,Hotter G.Actin cytoskeleton derangement induces apoptosis in renal ischemia/reperfusion[J].Apoptosis,2006,11(4):563-71.
[6]王应灯,张 薇,徐莉英,等.血管紧张素Ⅱ对肾小球内皮细胞骨架和单层通透性的影响[J].中国药理学通报,2007(7):963-7.
[6]Wang Y D,Zhang W,Xu L Y,et al.Effects of F-actin and monolayer permeability on the injury of rat glomerular endothelial cells induced by Angiotensin[J]?Chin Pharmacol Bull,2007,23(7):963-7.
[7]Yu P K,Yu D Y,Cringle S J,et al.Endothelial F-actin cytoskeleton in the retinal vasculature of normal and diabetic rats[J].Curr Eye Res,2005,30(4):279-90.
[8]Bugyi B,Carlier M F.Control of actin filament treadmilling in cell motility[J].Annu Rev Biophys,2010,39:449-70.
[9]Bubb M R,Spector I,Beyer B B,et al.Effects of jasplakinolide on the kinetics of actin polymerization.An explanation for certainin vivoobservations[J].J Biol Chem,2000,275(7):5163-70.
[10]Rosenberg N.The role of the cytoskeleton in mechanotransduction in human o steoblast- like cells[J].Hum Exp Toxicol,2003,22(5):271-4.
[11]Zhang X,Cui X,Cheng L,et al.Actin stabilization by jasplakinolide affects the function of bone marrow-derived late endothelial progenitor cells[J].PLoS One,2012,7(11):e50899.
[12]邵开峰,吴泽志,王伯初,等.细胞骨架对肝癌细胞粘附性的影响[J].重庆大学学报(自然科学版),2000(3):9-11.
[12]Shao K F,Wu Z Z,Wang B C,et al.The effects of cytoskeleton on the adhesion of liver cancer cells[J].J Chongqing Univ(Nat Sci Edit),2000(3):9-11.
[13]Angelos M G,Brown M A,Satterwhite L L,et al.Dynamic adhesion of umbilical cord blood endothelial progenitor cells under laminar shear stress[J].Biophys J,2010,99(11):3545-54.
[14]Horwitz R,Webb D.Cell migration[J].Curr Biol,2003,13(19):R756-9.
[15]Raftopoulou M,Hall A.Cell migration:Rho GTPases lead the way[J].Dev Biol,2004,265(1):23-32.
[16]Schwarzbauer J E.Cell migration:may the force be with you[J].Curr Biol,1997,7(5):R292-4.
[17]Latham S L,Chaponnier C,Dugina V,et al.Cooperation between beta-and gamma-cytoplasmic actins in the mechanical regulation of endothelial microparticle formation[J].Faseb J,2013,27(2):672-83.
[18]刘 文,宋芝娟,梁念慈,等.槲皮素一硫酸酯对凝血酶诱导的猪血小板聚集和肌动蛋白聚合的影响[J].中国药理学通报,1998,14(1):100-1.
[18]Liu W,Song Z J,Liang N C,et al.Effects of Quercetin-sulfate on the pig platelet aggregation and actin polymerization induced by thrombin[J].Chin Pharmacol Bull,1998,14(1):100-1.
[19]Planck S R,Becker M D,Crespo S,et al.Characterizing extravascular neutrophil migrationin vivoin the iris[J].Inflammat,2008,31(2):105-11.
[20]Du L,Zhou J,Zhang J,et al.Actin filament reorganization is a key step in lung inflammation induced by systemic inflammatory response syndrome[J].Am J Respir Cell Mol Biol,2012,47(5):597-603.