miR-106b~25基因簇增强乳腺癌MCF-7肿瘤干细胞相关耐药性
2013-12-07胡蕴慧盛梦瑶张孝云李双静范冬梅熊冬生
胡蕴慧,盛梦瑶,张孝云,李双静,范冬梅,熊冬生,周 圆
(1.中国医学科学院北京协和医学院血液病医院(血液学研究所),实验血液学国家重点实验室,天津 300020;2.天津医科大学附属肿瘤医院乳腺三科,天津 300060)
乳腺癌是危害女性健康的常见恶性肿瘤之一,化疗在乳腺癌的综合治疗中占有重要地位,但其耐药性的形成仍是导致患者临床化疗失败及预后不良的主要原因。2003年Al-Hajj等[1]首次证实了乳腺癌干细胞的存在,按照肿瘤干细胞学说,肿瘤干细胞是化疗后肿瘤复发的根本原因[2],但乳腺癌耐药性的形成与肿瘤干细胞之间的相互关系尚未完全明确。
微小RNA(miRNA)是一类高度保守的长度约为22个核苷酸的非编码RNA,其对转录后调控的作用日益显现[3]。现已发现,在乳腺癌细胞中,miRNA的表达异常可导致多种重要基因表达紊乱,这与肿瘤干细胞及细胞的耐药性密切相关[4]。定位于人基因组7号染色体的miR-106b~25基因簇包含miR-106b、miR-93和miR-25 3个 miRNA,该基因簇经常作为致癌因素,通过抑制抑癌基因和细胞周期调控基因的表达参与肿瘤发生发展[5]。本研究通过慢病毒感染,提高乳腺癌细胞MCF-7内miR-106b~25表达水平。通过观察其对细胞耐药性及干细胞特性的影响,进一步明确该miRNA基因簇与肿瘤耐药发生的关系。
1 材料与方法
1.1 细胞培养 人乳腺癌细胞株MCF-7与人胚肾上皮细胞系HEK293T由英国帝国理工大学Ernesto Yague博士惠赠,细胞用含10%胎牛血清的DMEM培养基培养,置于37℃,CO2体积分数为5%的培养箱中培养。
1.2 FUW-miR-106b~25真核表达载体的构建与慢病毒感染 从MCF-7细胞基因组DNA中扩增出miR-106b~25基因簇,上游引物5'-GGGGATCCATAGCCATGTGCCGCGAGAAGCAGCCCATG-3',下 游引物5'-GGGAATTCCTAGCTGTCTGCCCCTTGTCTCC TAGAAGAGAG-3',PCR产物连接至载体 pCR2.1-TOPO上,测序鉴定基因碱基序列无误后用BamHI与EcoRI做双酶切,酶切产物连接至慢病毒载体FUW中,构建成FUW-miR-106b~25(FUW-mirC)真核表达载体。
取对数生长期HEK293T细胞接种于培养皿中,待汇合度达到95%时,按照Invitrogen公司Lipofectamine 2000说明书进行质粒转染,质粒包括20μg慢病毒表达质粒,8 μg PAX2 与 2 μg Vsvg 慢病毒包装质粒,8 h后终止转染,加入含10%胎牛血清的DMEM培养基,48 h后收集病毒上清并用0.45微米滤膜过滤,加入终浓度为8 mg·L-1聚凝胺后感染MCF-7细胞,8 h后终止病毒感染换新鲜培养基,继续培养以用于后续实验。取对数生长期细胞按5×104细胞/孔接种于12孔板,从次日起每日取3个孔的细胞进行计数,连续进行6 d后绘制生长曲线。
1.3 基因表达检测 按照Exiqon-miRCURY RNA提取试剂盒的说明书提取细胞中包括总RNA,取2 μg RNA使用MMLV逆转录酶逆转成cDNA,SYBR Green法检测 MDR1与 ALDH1的的表达,按照Takara公司SYBR Premix Ex Taq说明书进行操作。PCR引物序列见 Tab 1。miR-25、miR-93与 miR-106b的表达应用Taqman实时定量PCR法检测,操作方法与数据分析按照ABI-TaqMan microRNA assay说明书进行。
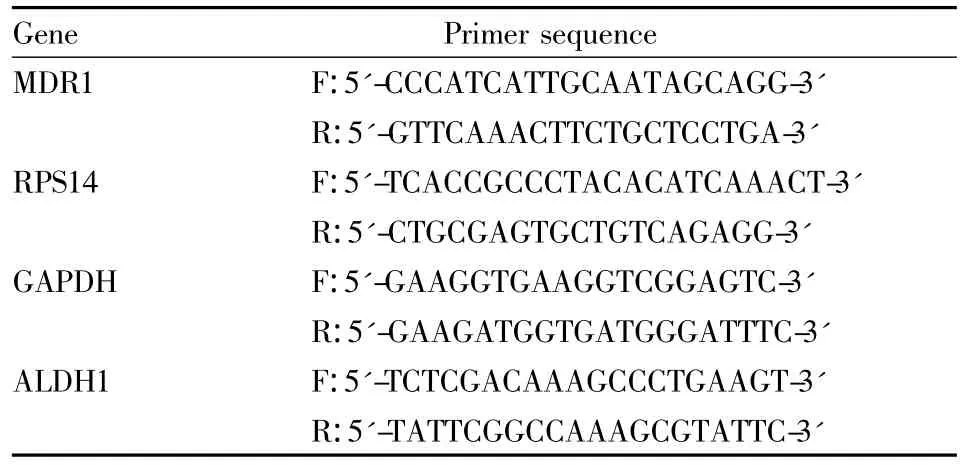
Tab 1 primer sequence for RT-QPCR assay
1.4 MTT细胞毒性实验 参考文献方法[6],取对数生长期细胞,按1×104细胞/孔接种于96孔板,24 h后加入不同浓度阿霉素,培养72 h加入MTT,继续培养4 h后弃上清,每孔加入100 μl DMSO,室温震荡10 min,在酶标仪上测定592 nm波长处各孔的吸光度(OD值),取3个重复孔的平均OD值,计算阿霉素对细胞的半数抑制浓度(IC50)。
1.5 耐药克隆形成实验 取对数生长期细胞,按3×105细胞/25 cm2接种于培养瓶,贴壁过夜。用不同浓度阿霉素处理各组细胞5 d后换新鲜培养基继续培养,14 d后用4%多聚甲醛液室温固定30 min,然后0.2%结晶紫溶液室温染色30 min,去离子水漂洗数次后风干、拍照。
1.6 细胞衰老相关β-半乳糖苷酶检测 取对数生长期细胞按3×105细胞/25 cm2接种于培养瓶,贴壁过夜。用不同浓度阿霉素处理各组细胞5 d后换新鲜培养基继续培养,14 d后按照 Cell Signaling Technology公司senescence β-galactosidase试剂盒对细胞进行染色,倒置显微镜下观察,蓝色细胞为衰老细胞。
1.7 细胞P-gp的表达检测 收集对数生长期细胞,PBS洗1遍,加PE标记的P-gp直标抗体4℃避光孵育1 h,PBS洗2遍后用400 μl PBS重悬细胞,用流式细胞仪检测。
1.8 ALDH1的表达检测 收集对数生长期细胞,PBS洗1遍,按照StemCell Technology-ALDH检测试剂盒说明书操作,流式细胞仪检测。
1.9 Mammosphere形成实验 收集对数生长期细胞重悬于含有 B27、20 μg·L-1EGF 与 20 μg·L-1bFGF的无血清乳腺上皮细胞培养基,按2×103细胞/孔接种于超低粘附培养板中,14 d后倒置显微镜下对形成的mammosphere计数拍照。收集培养板中的mammosphere,用胰酶消化并反复吹打成单细胞悬液,计数,并重新接种于超低粘附培养板中,10 d后对二次形成的mammosphere计数、拍照。
1.10 统计学方法 应用SPSS统计软件进行统计分析,计量数据以±s表示,两样本均数间的比较采用t检验。
2 结果
2.1 miR-106b~25基因簇过表达细胞系MCF-7-mirC的建立 体外构建慢病毒表达载体FUW-mirC,联合慢病毒包装质粒PAX2与Vsvg共转染至HEK293T细胞,收集病毒上清液感染MCF-7细胞。提取各组总RNA,检测miR-25、miR-93与miR-106b表达水平。结果表明,实验组3种miRNA的表达量均高于对照组(Fig 1A),而且体外培养观察MCF-7-FUW与MCF-7-mirC细胞生长曲线并无明显差异(Fig 1B)。
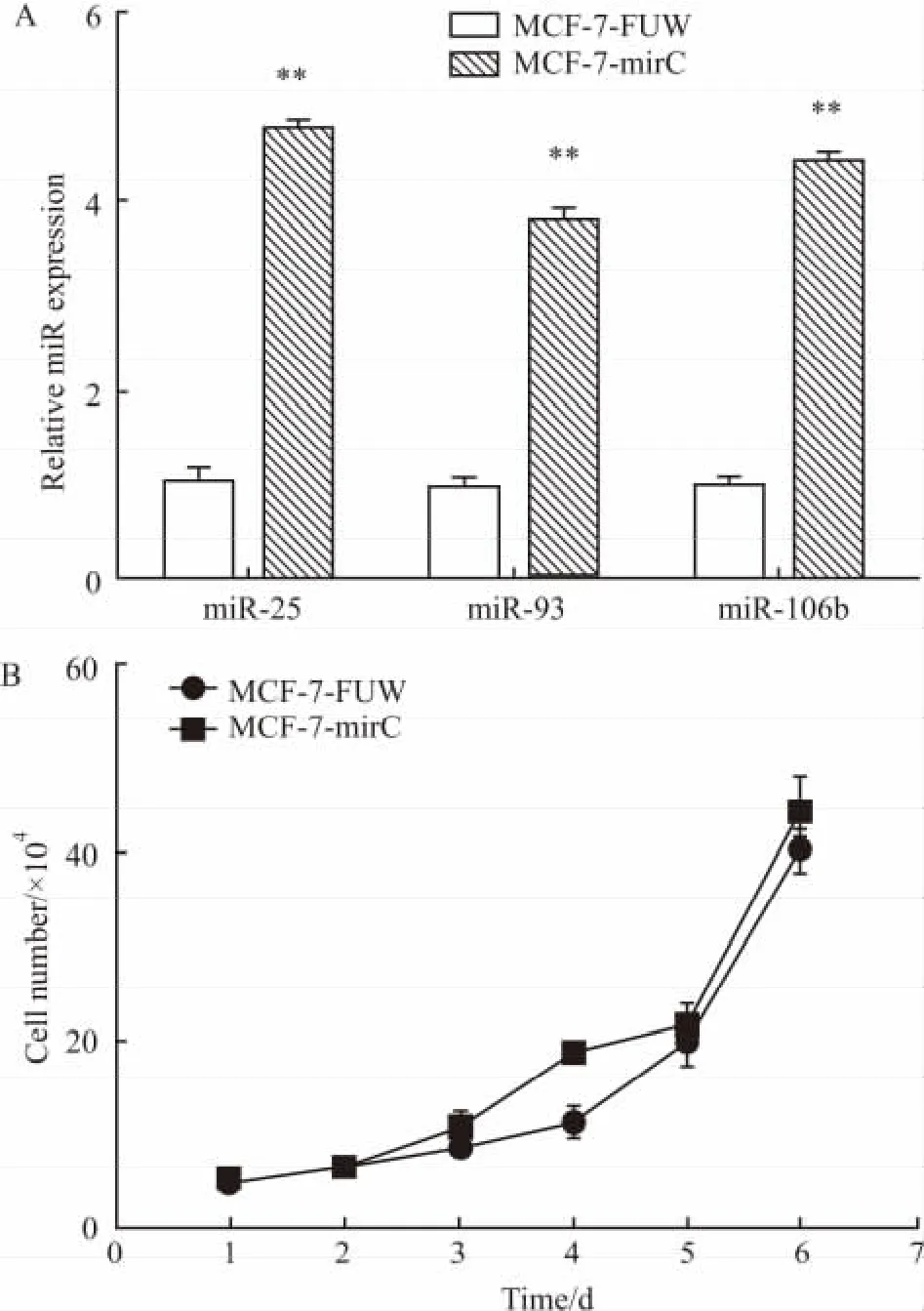
Fig 1Establishment of MCF-7-mirC cell line(±s,n=3)
2.2 miR-106b~25基因簇对阿霉素敏感性的影响
MTT法比较MCF-7-FUW与MCF-7-mirC细胞对阿霉素72 h IC50的影响,结果显示过表达miR-106b~25对细胞短期内的耐药性没有明显影响(Fig 2A)。但耐药克隆形成实验结果表明,过表达miR-106b~25基因簇能帮助细胞更快脱离阿霉素诱导产生的细胞衰老样状态(Fig 2B),重新进入正常的细胞增殖,从而导致更多耐药克隆的形成(Fig 2C)。
2.3 miR-106b~25基因簇不改变P-gp的表达miR-106b~25基因簇能赋予MCF-7细胞对阿霉素的耐药性,但实时定量PCR结果表明在过表达miR-106b~25基因簇之后,P-gp蛋白的编码基因MDR1在mRNA水平上并未升高(Fig 3A)。流式细胞术检测结果同样显示各组细胞在P-gp荧光强度上也没有明显差别(Fig 3B),证明miR-106b~25基因簇并未通过促进P-gp表达增加细胞耐药性。
2.4 miR-106b~25基因簇对乳腺癌细胞干性的影响 越来越多的研究证明肿瘤干细胞的存在是肿瘤耐药及复发的根本原因。ALDH1作为肿瘤干细胞阳性标记物,实时定量PCR与ALDH1活性检测结果均显示,与对照组相比,MCF-7-mirC组细胞中ALDH1在mRNA水平上表达升高,ALDH1high细胞群比例增多(Fig 4A,B)。Mammosphere形成实验结果显示,与对照组相比,MCF-7-mirC细胞形成的mammosphere体积更大而且比例更高(Fig 4C,D)。二次mammosphere形成实验进一步显示了两组细胞间的差距,提示miR-106b~25基因簇能增强乳腺癌肿瘤干细胞特性。
3 讨论
miRNA是近年来在真核生物中新发现的一类长约22个核苷酸的内源性非编码单链RNA,主要通过与靶mRNA的3’UTR结合导致靶mRNA降解及抑制转录后翻译[7]。miRNAs涉及多个基因及信号传导网络,不仅影响乳腺癌的发生、发展,还对乳腺癌耐药的形成发挥重要影响[8]。已有研究证明多个miRNA参与调控乳腺癌细胞对化疗药物的敏感性,例如miR-451与miR-326已被证实可直接靶向MDR1基因,参与乳腺癌MCF-7细胞对阿霉素以及依托泊苷耐药性的获得[9-10]。miR-328通过调控ABC家族BCRP蛋白表达,在米托蒽醌耐药的乳腺癌细胞中发挥重要作用[11]。另外,miR-21、miR-221/222、miR-17-5p、miR-34 等 miRNA 可通过调控肿瘤抑制因子、DNA损伤、细胞凋亡与细胞周期相关通路间接对乳腺癌细胞的耐药性发挥作用。
乳腺癌干细胞是指乳腺癌细胞中少数成瘤能力极强、具有自我更新能力和一定分化潜能的细胞。乳腺癌干细胞高表达ABC家族转运蛋白和抗凋亡基因等而逃避化疗药物对它们的作用,最终导致肿瘤的复发[2]。乳腺癌干细胞耐药机制目前还未完全研究清楚,近年来发现乳腺癌干细胞中miRNA表达异常与乳腺癌干细胞的生物学行为密切相关。

Fig 2 Effects of miR-106b-25 overexpression on chemoresistance of MCF-7 cells
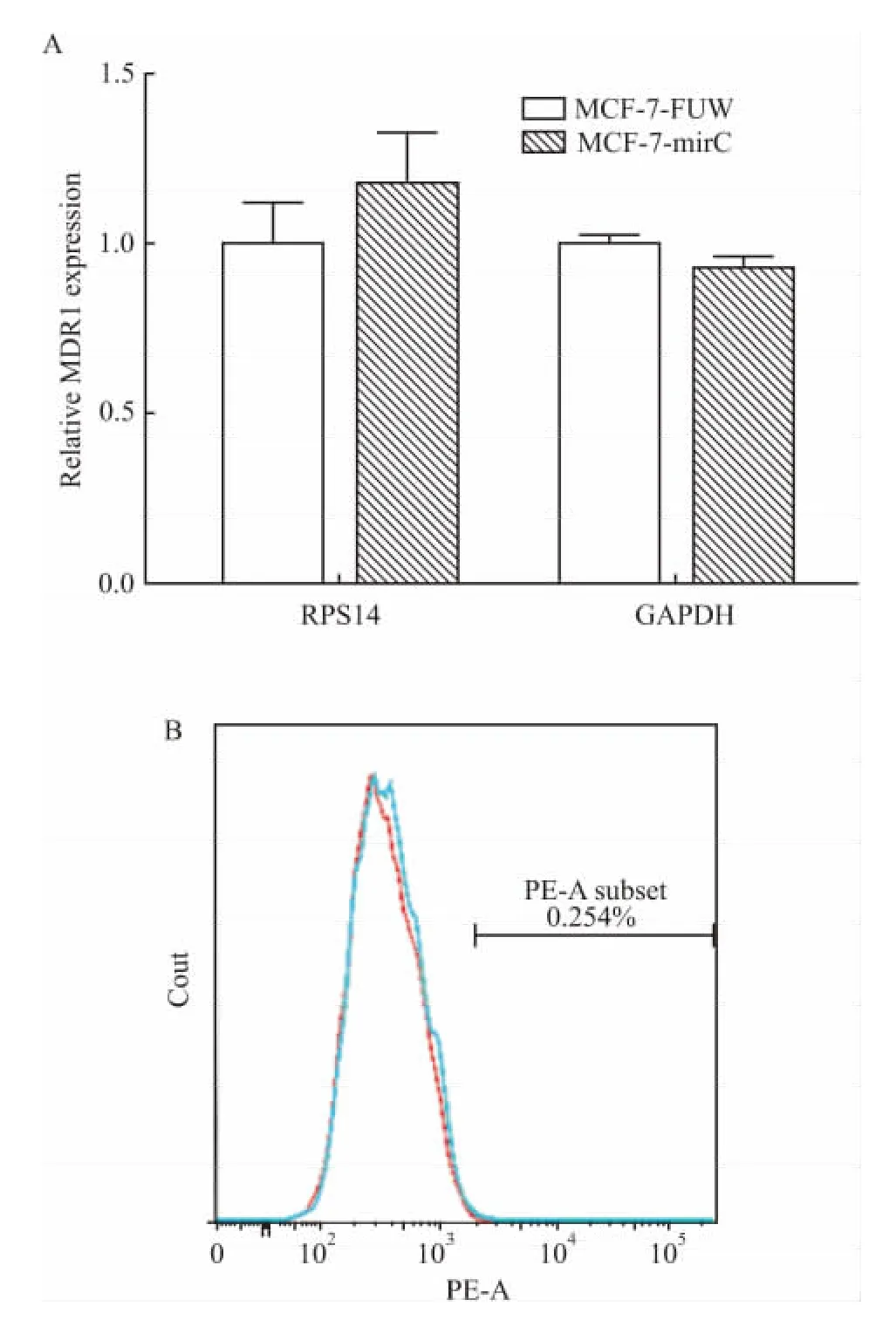
Fig 3Expression of P-gp/MDR1 in MCF-7-mirC(±s,n=3)
miR-106b~25基因簇广泛表达于人肺、淋巴、脾脏、睾丸、肠等组织,现已发现miR-106b~25基因簇过表达于多种肿瘤组织。临床数据显示,该基因簇能够促进乳腺癌的发生发展,并可能与乳腺癌的不良预后相关[12]。研究结果表明,miR-106b~25基因 簇 可 通 过 调 控 Bim[13]、p21[14]、PTEN[15]、Smad7[16]表达,作用于细胞凋亡通路、改变细胞迁移侵袭能力、影响细胞周期及肿瘤细胞的微环境[15],但是该基因簇对于肿瘤耐药形成的作用机制尚未阐明。本研究通过慢病毒感染技术在乳腺癌MCF-7细胞中稳定过表达 miR-106b~25基因簇,获得MCF-7-mirC细胞。用相同剂量阿霉素处理MCFFUW与MCF-7-mirC细胞后,MCF-7-mirC细胞能更快的脱离细胞衰老样状态,重新恢复正常的细胞增殖,并形成更多耐药细胞克隆,这些结果均显示miR-106b~25基因簇能降低乳腺癌细胞对阿霉素的敏感性。但不同于ABC转运蛋白家族介导的经典耐药机制,miR-106b~25在mRNA水平未能提高MDR-1基因的转录,在蛋白水平也不能提高P-gp的表达,即不能在短时间内将药物从细胞内外排至细胞外,这也解释了MCF-7-mirC细胞对于阿霉素在72 h的IC50相比于MCF-7-FUW并未有明显升高。进一步研究发现miR-106b~25能够提高MCF-7细胞中乳腺癌干细胞的比例。ALDH1高表达已被证实为乳腺癌干细胞的重要标记物之一,本研究中证明过表达miR-106b~25后ALDH1high细胞的比例从1.1%上升至2.7%,且微球体形成实验进一步证明miR-106b~25基因簇促进了乳腺癌干细胞特性,该结果与Simth等[16]的研究发现miR-106b~25过表达可增加MCF-7细胞中CD44+CD24-乳腺癌干细胞比例的结果相一致。
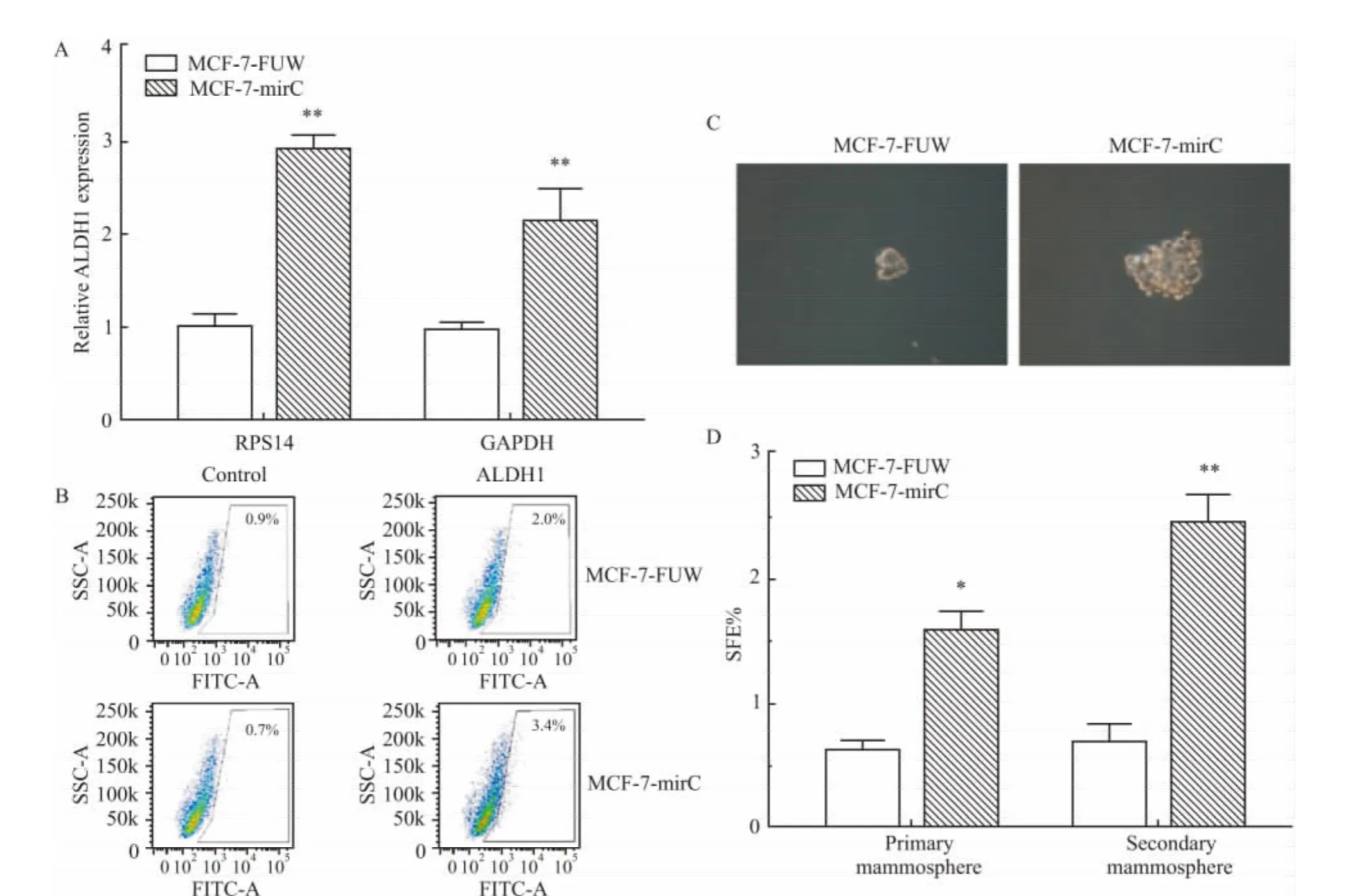
Fig 4 Overexpression of miR-106b~25 cluster on cancer stem cell-like characteristics of breast cancer cells
综上所述,miR-106b~25基因簇可以促进乳腺癌细胞耐药性形成,且该作用不是通过改变P-gp表达实现的。MiR-106b~25基因簇增加乳腺癌细胞耐药形成可能至少与促进乳腺癌干细胞特性相关。
[1]Al-Hajj M,Wicha M S,Benito-Hernandez A,et al.Prospective identification of tumorigenic breast cancer cells[J].Proc Natl Acad Sci USA,2003,100(7):3983-8.
[2]Dean M,Fojo T,Bates S.Tumour stem cells and drug resistanc[J].Nat Rev Cancer,2005,5(4):275-84.
[3]Kim V N,Nam J W.Genomics of microRNA[J].Trends Genet,2006,22(3):165-73.
[4]Wang Z,Li Y,Ahmad A,et al.Targeting miRNAs involved in cancer stem cell and EMT regulation:An emerging concept in overcoming drug resistance[J].Drug Resist Updat,2010,13(4-5):109-18.
[5]Petrocca F,Vecchione A,Croce C M.Emerging role of miR-106b-25/miR-17-92 clusters in the control of transforming growth factor beta signaling[J].Cancer Res,2008,68(20):8191-4.
[6]邹凌琳,周 圆,杨 铭,等.钙调素拮抗剂O-(4-乙氧基-丁基)-小檗胺对人白血病细胞K562和K562/A02生长的抑制作用[J].中国药理学通报,2009,25(10):1313-7.
[6]Zhou L L,Zhou Y,Yang M,et al.The growth inhibiting effect of calmodulin antagonist O-(4-ethoxiyl-butyl-)berbamine on leukemia cells K562 and K562/A02[J].Chin Pharmacol Bull,2009,25(10):1313-7.
[7]Zamore P D,Haley B.Ribo-gnome:the big world of small RNAs[J].Science,2005,309(5740):1519-24.
[8]O'Day E,Lal A.MicroRNAs and their target gene networks in breast cancer[J].Breast Cancer Res,2010,12(2):201.
[9]Kovalchuk O,Filkowski J,Meservy J,et al.Involvement of microRNA-451 in resistance of the MCF-7 breast cancer cells to chemotherapeutic drug doxorubicin[J].Mol Cancer Ther,2008,7(7):2152-9.
[10]Liang Z,Wu H,Xia J,et al.Involvement of miR-326 in chemotherapy resistance of breast cancer through modulating expression of multidrug resistance-associated protein 1[J].Biochem Pharma-col,2010,79(6):817-24.
[11]Pan Y Z,Morris M E,Yu A M.MicroRNA-328 negatively regulates the expression of breast cancer resistance protein(BCRP/ABCG2)in human cancer cells[J].Mol Pharmacol,2009,75(6):1374-9.
[12]Blenkiron C,Goldstein L D,Thorne N P,et al.MicroRNA expression profiling of human breast cancer identifies new markers of tumor subtype[J].Genome Biol,2007,8(10):R214.
[13]Gupta S,Read D E,Deepti A,et al.Perk-dependent repression of miR-106b-25 cluster is required for ER stress-induced apoptosis[J].Cell Death Dis,2012,3:e333.
[14]Zhao Z N,Bai J X,Zhou Q,et al.TSA suppresses miR-106b-93-25 cluster expression through downregulation of MYC and inhibits proliferation and induces apoptosis in human EMC[J].PLoS One,2012,7(9):e45133.
15]Poliseno L,Salmena L,Riccardi L,et al.Identification of the miR-106b~25 microRNA cluster as a proto-oncogenic PTEN-targeting intron that cooperates with its host gene MCM7 in transformation[J].Sci Signal,2010,3(117):ra29.
[16]Smith A L,Iwanaga R,Drasin D J,et al.The miR-106b-25 cluster targets Smad7,activates TGF-beta signaling,and induces EMT and tumor initiating cell characteristics downstream of Six1 in human breast cancer[J].Oncogene,2012,31(50):5162-71.