酸敏感离子通道1a在酸诱导的大鼠关节软骨细胞自噬的作用及其机制研究
2013-12-07张晨晨葛金芳林梅英陈飞虎
张晨晨,唐 杰,胡 伟,葛金芳,林梅英,陈飞虎
(1.安徽医科大学药学院,安徽合肥 230032;2.安徽医科大学第二附属医院药剂科,安徽合肥 230601)
类风湿关节炎(rheumatoid arthritis,RA)是一种慢性全身性自身免疫性疾病,慢性多关节炎症为其主要临床表现。研究表明RA关节局部组织酸化导致的关节软骨和骨质的破坏是RA致残的主要原因[1-2],积极寻找导致关节软骨破坏及骨组织病理生理改变的关键环节并以此为靶点开发新型治疗药物成为该病的研究热点和重点。
酸敏感离子通道(acid-sensing ion channels,ASICs)是一类由细胞外H+直接激活的阳离子通道,属于 ENaC(epithelial Na+channel)/DEG(degenerin)超家族。当胞外pH降低时,开放的通道对Na+、Ca2+具有通透性,进而引起细胞一系列生理病理变化[3]。本课题组前期研究证实ASIC1a在模拟RA发病历程的大鼠佐剂性关节炎(adjuvant arthritis,AA)关节软骨上有较强表达,抑制ASICs,尤其是ASIC1a的表达可抑制胞外酸化诱导的软骨细胞凋亡,对关节软骨具有保护作用[4-5]。提示 ASIC1a在组织酸化导致的软骨细胞损伤中发挥作用,但具体机制不清。
自噬和凋亡是细胞在炎症等不良刺激下的主要应激反应形式。文献报道[6],RA患者关节软骨细胞的自噬过度激活在关节破坏中发挥重要作用。本研究以大鼠原代软骨细胞为研究对象,采用胞外酸化模拟AA大鼠关节滑液环境,研究ASIC1a是否在酸化诱导的软骨细胞自噬中发挥作用及其分子机制。
1 材料与方法
1.1 实验动物 SPF级Sprague-Dawley(SD)大鼠25只,♂,体质量180~200 g,购自安徽医科大学实验动物中心,合格证号:皖动准字01号。实验室温度控制在20℃ ~25℃,湿度在50% ~60%,自由饮水。
1.2 药物和试剂 Amiloride,Sigma公司产品;PcTX1,Alomone公司产品;PD98059和 SB203580,Tocris Bioscience公司产品;抗LC3抗体购自Sigma公司;抗ERK1/2抗体、抗p38MAPK抗体购自Cell Signaling Technology公司;抗 pERK1/2抗体、抗 pp38MAPK抗体购自CST公司;Ⅱ型胶原酶,美国Sigma公司产品,临用时现配;胰蛋白酶,高糖DMEM液体培养基为Hyclone公司产品;胎牛血清,Gibco公司产品;D-Hanks溶液,碧云天公司产品;Alcian染液试剂盒,瑞士Fluka公司产品;TRIzol试剂,美国Invitrogen公司产品;逆转录试剂盒和PCR扩增试剂盒,立陶宛Fermentas公司产品;ECL显色试剂盒,Thermo Scientific公司产品。
1.3 大鼠关节软骨细胞分离、培养、鉴定 按本实验室常规方法进行大鼠关节软骨细胞的分离与培养[5],采用 Alcian染色法进行关节软骨细胞的鉴定,倒置显微镜下观察拍照。
1.4 软骨细胞自噬的诱导及药物处理
1.4.1 将软骨细胞分别在 pH 为 7.4、7.0、6.5、6.0、5.5不同的胞外环境下培养3 h,观察细胞自噬情况,建立关节软骨细胞自噬体外模型。
1.4.2 将软骨细胞分组如下:pH 7.4正常组、pH 6.0 组、pH 6.0+Amiloride 组(100 μmol·L-1)、pH 6.0+PcTX1 组(100 μg·L-1)。各组于给药30 min后,加入pH 6.0的培养基共培养3 h,收集细胞检测ASIC1a活化后,酸化诱导的软骨细胞自噬及ERK1/2、p38MAPK蛋白磷酸化水平的变化及抑制ASIC1a的表达对上述指标的影响。
1.4.3 将软骨细胞分为pH 7.4正常组,pH 6.0酸化组,pH 6.0+PcTX1组,以及经 ERK1/2、p38MAPK磷酸化抑制剂(PD98059、SB203580)处理的酸化组。各组于给药30 min后,加入pH 6.0的培养基共培养3 h,收集细胞检测 ERK1/2及 p38MAPK在ASIC1a调控大鼠关节软骨细胞自噬中的作用。
1.5 半定量逆转录聚合酶链反应(RT-PCR)检测软骨细胞自噬基因Beclin-1 mRNA表达 将1×106个细胞接种于培养瓶中,实验分组同1.4.2、1.4.3。按 TRIzol一步法提取细胞总 RNA,以紫外分光光度计测RNA含量和纯度(RNA在260 nm和280 nm的光密度比值为1.8~2.0之间),以1.5%琼脂糖凝胶电泳鉴定其完整性(28S和18S RNA条带比值I>2.0)。用5 μg总RNA为模板,逆转录成cDNA。按RT-PCR试剂盒说明书进行扩增反应,用β-actin为内标。根据基因Gene bank提供的Beclin-1和β-actin序列,由上海生工生物有限公司合成引物,Beclin-1的序列为:Forward primer:5'-GGAGATGTTGGAGCAAATGAA-3',Reverse primer:5'-GTCGCATTGAAGACATTGGTT-3',PCR反应产物长度为321bp。β-actin的序列为:Forward primer:5'-ACCACAGCTGAGGGAAATCG-3',Reverse primer:5'-AGA GGTCTTTACGGATGTCAACG-3',PCR反应产物长度为345 bp。Beclin-1、β-actin反应条件:预变性94℃5 min;变性 94℃ 40 s;退火 51℃ 40 s;延伸 72℃1 min;35个循环后72℃延伸10 min。PCR产物经1.5%琼脂糖凝胶电泳,结果用凝胶自动成像2 000系统扫描,取其分值作为量化指标,以特异性基因条带与β-actin基因条带的密度比值表示不同样本间的相对量。以3次实验结果的均值做统计学分析。
1.6 Weston blot检测自噬蛋白LC3的表达 将软骨细胞消化,以1×106个细胞接种于培养瓶中,实验分组同“1.4”。加入pH 6.0的培养基培养3 h后,弃培养液,用预冷PBS洗涤3遍,每瓶加入400 μl RIPA裂解液(含10%PMSF)裂解30 min,用细胞刮将细胞转移到1.5 ml EP管中,离心取上清,使用BCA蛋白定量试剂盒进行蛋白定量。将上清与上样缓冲液按4∶1的比例进行分装,100℃煮10 min变性,-80℃保存待用。等量的蛋白样品进行SDS-PAGE,将电泳分离的蛋白转移到PVDF膜上。TBST洗膜10 min。室温下用含5%脱脂奶粉(TBST溶解)封闭3 h。随后加入一抗(1∶500)4℃孵育过夜。TBST洗脱4次,加入相应的二抗,孵育1 h,漂洗4次。将PVDF膜用化学发光剂ECL染1 min,暗室中曝光到X线片上。结果采用Image-Pro Plus图像分析管理系统分析。
1.7 透射电子显微镜法观察自噬小体数量的变化将软骨细胞以1×106个接种于细胞培养瓶中,实验分组同“1.4.2”。待细胞贴壁后,将培养的软骨细胞用0.25%胰蛋白酶消化后进行收集,4℃,1 200 r·min-1离心5 min成肉眼可见的细胞团块,弃去上清液,加入 PBS洗1次后进行离心4℃,1 200 r·min-15 min。先用预冷的2.5%戊二醛4℃固定2 h,在经缓冲液多次清洗后,用1%的锇酸在4℃下后固定1.5 h。经梯度丙酮脱水(先90%丙酮一次15 min,后100%丙酮3次每次10 min),采用环氧树脂618 60%浸透包埋,样品包埋后进入烤箱进行聚合,经过 37℃(16 h)、45℃(12 h)、60℃(14 h)聚合变硬后,用温水将胶囊壳去除,擦净包埋块,备切片使用。超薄切片机切片,染色后电子透射电镜观察。
2 结果
2.1 软骨细胞形态观察及鉴定 刚分离的原代大鼠关节软骨细胞呈圆球形,悬浮状态(Fig 1a),培养24 h后,一些细胞开始贴壁,伸展形成突起(Fig 1b),培养72 h后细胞贴壁较多,成簇生长,逐渐伸展为多角形并连接成片(Fig 1c),软骨细胞经爱先蓝染液鉴定显示细胞分泌蛋白多糖呈蓝色,胞核部分呈清晰的红色,细胞呈梭形铺路石状排列(Fig 1d)。

Fig 1 Morphological observation of the articular chondrocytes(×200)
2.2 胞外酸化对体外培养的软骨细胞自噬的活化作用 不同pH的胞外环境对软骨细胞自噬的影响与酸性程度成正相关,如图所示,与pH 7.4正常组相比,软骨细胞自噬蛋白LC3表达量随胞外酸化程度的增加而升高。其中 pH 6.0、pH 5.5组与pH 7.4组相比差异有统计学意义(Fig 2),且这两组之间LC3表达量基本一致,本实验中选取pH 6.0为胞外酸化条件。
2.3 ASIC1a对酸诱导的大鼠关节软骨细胞自噬的影响
2.3.1 ASIC1a对大鼠关节软骨细胞Beclin-1 mRNA表达的影响 结果如图所示,与正常组相比,酸化刺激组大鼠关节软骨细胞Beclin-1 mRNA表达明显增加,且差异具有显著性(P<0.01)。与酸化组比较,ASIC1a特异性阻滞剂PcTX1组可抑制大鼠关节软骨细胞Beclin-1 mRNA表达(Fig 3)。
2.3.2 ASIC1a对大鼠关节软骨细胞LC3蛋白表达的影响 Western blot结果显示,与pH 7.4组相比,酸化组大鼠软骨细胞LC3蛋白表达明显增加,且差异具有显著性(P<0.01)。与酸化组比较,ASIC1a特异性阻滞剂PcTX1组可抑制大鼠关节软骨细胞LC3蛋白表达(Fig 4)。

M:DNA marker;1:Control;2:pH 6.0 group;3:pH 6.0+Amiloride group;4:pH 6.0+PcTX1 group.** P< 0.01 vs normal group;##P<0.01 vs pH 6.0 group
2.3.3 ASIC1a对大鼠关节软骨细胞自噬小体数量的影响 采用透射电子显微镜法观察各组细胞自噬小体数量的变化。如图所示,正常组软骨细胞胞质中可见较完整的细胞器结构,且形态规则(Fig 5a),与pH 7.4组相比,酸化组软骨细胞胞质中出现较多的由双层膜包裹的细胞自噬小体(Fig 5b),与酸化刺激组比较,ASIC1a特异性阻滞剂PcTX1组胞质中自噬小体的数量明显减少,细胞器形态趋于正常(Fig 5d)。
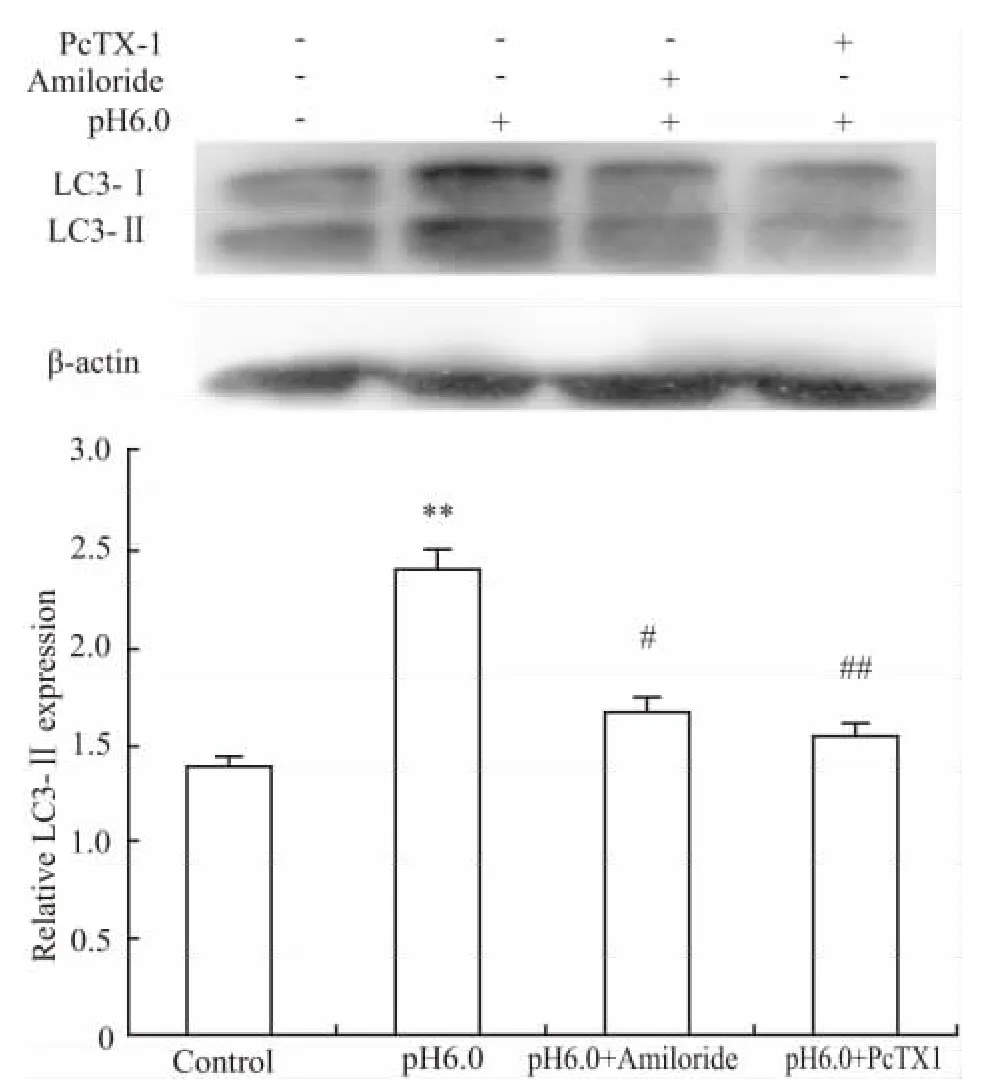
Fig 4 Effect of ASIC1a on protein expression of LC3 in acid-induced chondrocytes(±s,n=3)
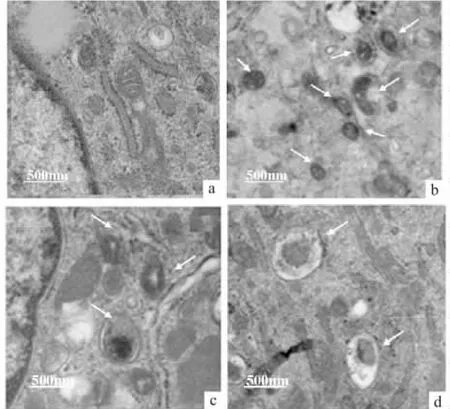
Fig 5 Representative ultrastructural morphology of autophagy(×20 000)
2.4 ASIC1a对酸化的大鼠关节软骨细胞ERK1/2和p38MAPK蛋白磷酸化的影响 Western blot结果如图所示,与pH 7.4组比较,酸化刺激组大鼠关节软骨细胞ERK1/2、p38MAPK磷酸化蛋白表达均明显增加,且差异有统计学意义(P<0.01)。与酸化组相比,ASIC1a特异性阻滞剂PcTX1组可抑制ERK1/2及p38MAPK磷酸化蛋白表达(Fig 6)。
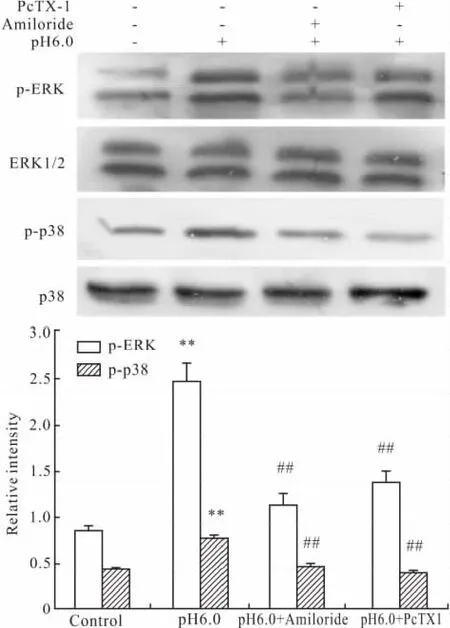
Fig 6 Effects of acid-sensing ion channel 1a on phosphorylation of ERK1/2 and p38 in acid-induced articular chondrocytes( ± s,n=3)
2.5 ERK1/2、p38MAPK 在 ASIC1a调控大鼠关节软骨细胞自噬中的作用
2.5.1 ERK1/2、p38MAPK 对大鼠关节软骨细胞Beclin-1 mRNA表达的影响 RT-PCR法检测结果如图所示,与pH 7.4正常组比较,酸化组Beclin-1 mRNA表达量升高,且差异具有显著性(P<0.01)。与酸化组比较,ASIC1a特异性阻滞剂 PcTX1、ERK1/2磷酸化抑制剂PD98059预处理组抑制Beclin-1 mRNA表达。而与酸化组比较,p38MAPK抑制剂SB203580未明显改变大鼠关节软骨细胞Beclin-1 mRNA表达(Fig 7)。
2.5.2 ERK1/2、p38MAPK 对大鼠关节软骨细胞LC3蛋白表达的影响 Westernblot结果显示,与pH 7.4正常组比较,酸化组LC3蛋白表达量升高。ASIC1a特异性阻滞剂PcTX1、ERK1/2磷酸化抑制剂PD98059预处理组与酸化组相比LC3蛋白表达量降低,而p38MAPK抑制剂SB203580组LC3蛋白表达量没有明显改变(Fig 8)。
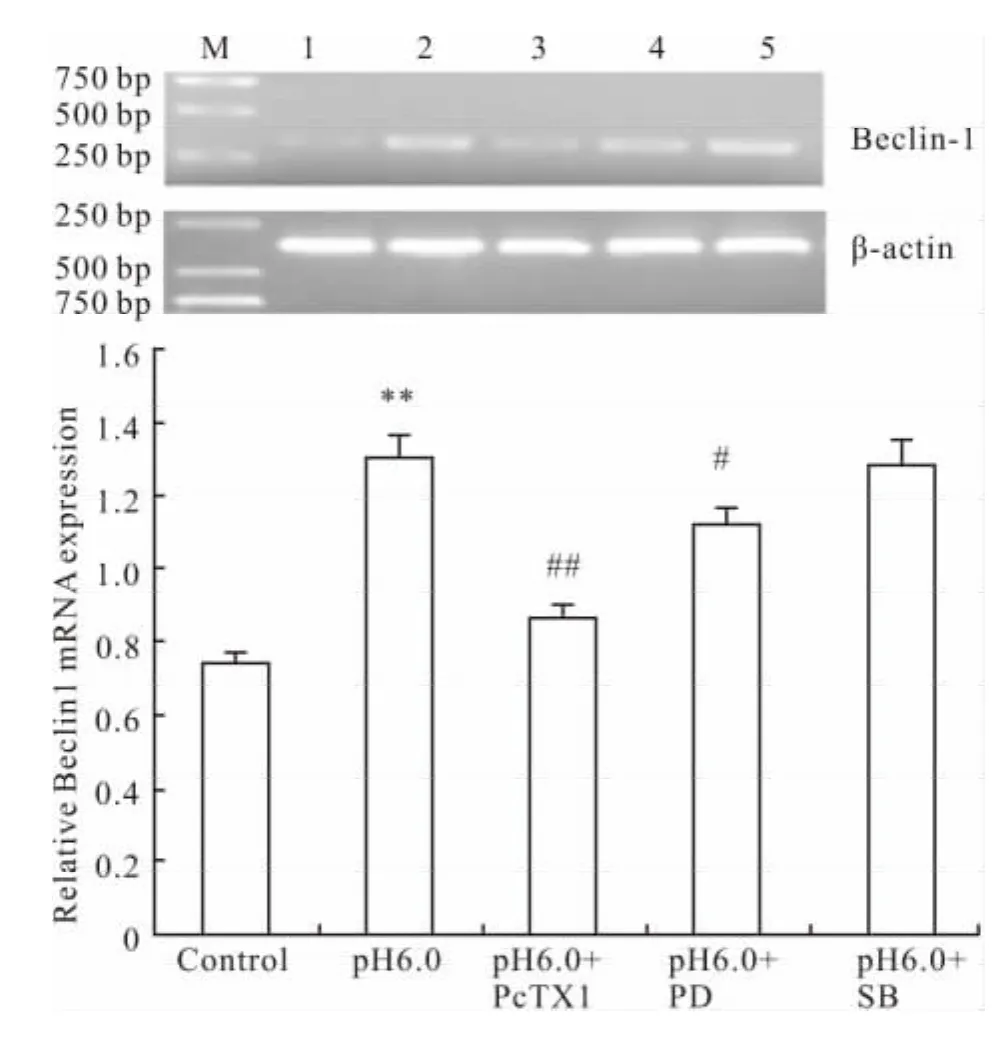
Fig 7 Effect of inhibitor of phosphorylated ERK1/2 and p38MAPK on mRNA expression of Beclin-1(±s,n=3)
3 讨论
细胞自噬(autophagy)是一种溶酶体依赖性的细胞内多余大分子物质和受损细胞器降解的过程,生命体借此维持蛋白代谢平衡及细胞环境稳定。过度的自噬可以导致细胞的程序性死亡,称为Ⅱ型程序性细胞死亡[7]。研究表明[8-9],自噬水平的异常与神经退行性疾病、肿瘤及自身免疫性疾病的发展有关。饥饿、缺氧和胞外酸化是诱发自噬活化的主要原因。组织酸化性疾病RA患者关节软骨上也存在有自噬的激活并在关节破坏中发挥重要作用[6],但具体机制尚不清楚。
软骨细胞自噬和细胞凋亡的失衡是参与关节软骨损伤的主要形式[10]。本课题组前期研究已证实,AA大鼠关节软骨的酸化刺激可诱导ASIC1a激活继而诱发关节软骨损伤,抑制ASIC1a的表达能保护因酸化导致的软骨细胞损伤。但对于ASIC1a在自噬中的作用尚不清楚。本研究首先采用胞外不同pH刺激,观察大鼠关节软骨细胞的自噬情况。结果表明,pH6.0和pH5.5均能明显激活软骨细胞自噬,表现为自噬标志性蛋白LC3的表达升高,但pH 6.0和pH 5.5条件下差异无显著性。在此基础上,本研究选择pH 6.0为胞外酸化条件,使用 ASIC1a非特异性和特异性阻滞剂,观察了ASIC1a在酸化诱导的软骨细胞自噬中的作用。结果表明,抑制ASIC1a的表达后自噬基因Beclin-1和自噬蛋白LC3表达均明显降低。透射电镜结果证实细胞自噬小体数量的变化与上述结果一致。提示抑制ASIC1a的激活参与酸化诱导的关节软骨细胞自噬。
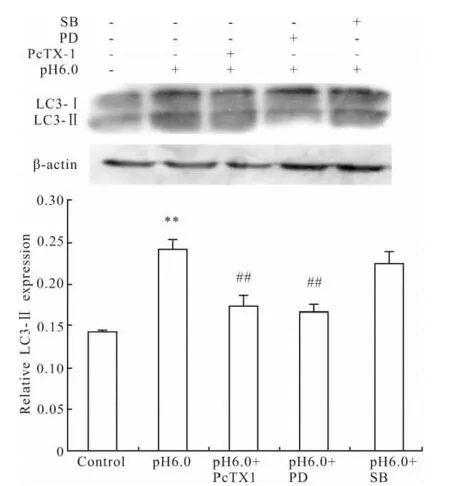
Fig 8 Effect of inhibitor of phosphorylated ERK1/2 andp38MAPK on protein expression of LC3(±s,n=3)
MAPK信号通路在细胞功能性调控上起重要作用,众多研究表明,它参与细胞生长、分化、凋亡和自噬[11]。Ca2+作为细胞内的第二信使在信号转导中有极其重要的作用,几乎参与了人体生命的所有活动功能。持续升高的胞质内Ca2+可以激活ERK1/2和p38MAPK信号通路。ASIC1a属于钙渗透性酸敏感离子通道,胞外酸化激活可介导ASIC1a通道开放、胞外Ca2内流引发一系列生物学效应[12-13]。本研究结果表明,酸化刺激后大鼠关节软骨细胞磷酸化状态的ERK1/2和p38MAPK表达明显增强,阻断ASIC1a可抑制酸化刺激导致的软骨细胞ERK1/2、p38MAPK磷酸化水平升高,提示 ERK1/2和p38MAPK蛋白参与了ASIC1a介导的大鼠关节软骨细胞信号传导。进一步采用ERK1/2、p38MAPK磷酸化抑制剂,观察它们在酸化刺激诱导软骨细胞自噬中的作用。结果表明,ASIC1a特异性阻滞剂PcTX1、ERK1/2磷酸化抑制剂PD98059均可明显降低细胞 Beclin-1 mRNA和LC3蛋白表达。然而,p38MAPK磷酸化抑制剂SB203580组软骨细胞的自噬水平则无明显改变,提示ERK1/2参与了酸化刺激诱导ASIC1a激活继而引发大鼠关节软骨细胞的自噬过程,这与文献报道的ERK1/2参与自噬过程的信号调控[14]的结果相一致。
综上所述,本研究证实胞外酸化刺激可激活关节软骨细胞自噬,阻断大鼠关节软骨细胞ASIC1a的表达可有效减轻酸化刺激诱导的软骨细胞自噬,其机制可能与阻断ASIC1a抑制ERK1/2磷酸化有关,这将为研究与酸化相关的关节疾病中类风湿关节炎的发病机制提供了新的视角。然而,本研究仅仅观察了体外酸化环境下ASIC1a在软骨细胞自噬激活与软骨破坏中的作用,对于其在RA病程中各个时期的具体作用尚不清楚,有待于我们在以后的研究中采取整体实验继续探索。
[1]Scott D L,Wolfe F,Huizinga T W.Rheumatoid arthritis[J].Lancet,2010,376(9746):1094-108.
[2]Kolker S J,Walder R Y,Usachev Y,et al.Acid-sensing ion channel 3 expressed in type B synoviocytes and chondrocytes modulates hyaluronan expression and release[J].Ann Rheum Dis,2009,69(5):903-9.
[3]Jetti S K,Swain S M,Bera A K,et al.Evaluation of the role of nitric oxide in acid sensing ion channel mediated cell death[J].Nitric Oxide,2010,22(3):213-9.
[4]袁凤来,陈飞虎,陆伟国,等.酸敏感离子通道阻断剂amiloride对佐剂性关节炎大鼠关节软骨损伤的影响[J].中国药理学通报,2009,25(7):895-900.
[4]Yuan F L,Chen F H,Lu W G,et al.The effects of inhibitor of acid-sensing ion channels by amiloride on articular cartilage destruction in rats with adjuvant arthritis[J].Chin Pharmacol Bull,2009,25(7):895-900.
[5]Yuan F L,Chen F H,Lu W G,et al.Acid-sensing ion channel 1a mediates acid-induced increases in intracellular calcium in rat articular chondrocytes[J].Mol Cell Biochem,2010,340(1):153-9.
[6]Sasaki H,Takayama K,Matsushita T,et al.Autophagy modulates osteoarthritis-related gene expression in human chondrocytes[J].Arthritis Rheum,2012,64(6):1920-8.
[7]Abounit K,Scarabelli T M,McCauley R B.Autophagy in mammalian cells[J].World J Biol Chem,2012,3(1):1-6.
[8]尤寿江,石际俊,张艳林,等.ROS介导的自噬及其在相关疾病中的作用[J].中国病理生理杂志,2011,27(1):187-95.
[8]You S J,Shi J J,Zhang Y L,et al.The role of ROS-mediated autophagy in the related diseases[J].Chin J Pathophysiol,2011,27(1):187-95.
[9]Marino M L,Pellegrini P,Di L G,et al.Autophagy is a protective mechanism for human melanoma cells under acidic stress[J].J Biol Chem,2012,287(19):30664-76.
[10]Almonte-Becerril M,Navarro-Garcia F,Gonzalez-Robles A,et al.Cell death of chondrocytes is a combination between apoptosis and autophagy during the pathogenesis of osteoarthritis within an experimental model[J].Apoptosis,2010,15(10):631- 8.
[11]Chen Y J,Liu W H,Kao P H,et al.Involvement of p38 MAPK-and JNK-modulated expression of Bcl-2 and Bax in Naja nigricollis CMS-9-induced apoptosis of human leukemia K562 cells[J].Toxicon,2010,55(7):1306-16.
[12]Katz S,Boland R,Santillan G.Modulation of ERK1/2 and p38MAPK signaling pathways by ATP in osteoblasts:involvement of mechanical stress-activated calcium influx,PKC and Src activation[J].Int J Biochem Cell Biol,2006,38(4):2082- 91.
[13]Herrera Y,Katnik C,Willing A,et al.Sigma-1 receptor modulation of acid-sensing ion channel 1a(ASIC1a)and ASIC1a-induced Ca2+influx in rat cortical neurons[J].J Pharmacol Exp Ther,2008,327(7):491-520.
[14]Chen K L,Chang W S,Cheung C H,et al.Targeting cathepsin S induces tumor cell autophagy via the EGFR-ERK signaling pathway[J].Cancer Lett,2012,317(1):89-98.