Urantide对大鼠心肌缺血/再灌注后心肌细胞凋亡的作用及机制研究
2013-12-07张骏艳孙璇君陈志武
张骏艳,姚 华,李 晟,孙璇君,陈志武
1.抗炎免疫药理学省部共建教育部重点实验室,国家中医药管理局中药药理三级实验室,安徽医科大学基础医学院药理学教研室,安徽 合肥 230032;2.安徽医科大学生命科学院生物学教研室,安徽合肥 230032)
近年来,动脉搭桥术、溶栓疗法、经皮腔内冠脉血管成形术、体外循环心脏外科手术和心肺脑复苏术等手段的建立和推广应用,使得缺血心脏能在短时间内重新获得血液灌注并恢复氧供应。但临床研究发现这种在心肌缺血基础上恢复血流后,组织损伤加重、甚至发生不可逆性损伤的现象称为心肌缺血/再灌注损伤(myocardial ischemia-reperfusion injury,MIRI)。活性氧自由基在缺血和再灌注过程中产生增加并在该病理过程中发挥了重要的作用[1]。而且再灌注可加速由于心肌缺血促发的心肌细胞凋亡过程,证实细胞凋亡也参与了缺血/再灌注的病理损伤过程[2]。
Urantide是在UrotensinⅡ基础上衍生的肽类UT受体拮抗剂,与 hUⅡ结构相似,为环11肽[3]。Urantide与重组人、猴、猫、鼠等多种动物的UT受体均具有相当高的亲和力。本课题组前期研究表明Urantide对心肌缺血/再灌注大鼠的心脏具有保护作用,其作用机制可能与改善低灌流、清除氧自由基及抗脂质过氧化、增加NOS活性、促进NO合成及抑制钙超载有关[4]。最近研究表明[5],urantide 预处理减轻心肌缺血/再灌注(ischemia/reperfusion,I/R)损伤的作用还与磷脂酰肌醇-3-激酶/蛋白激酶B(phosphatidylinositol 3-kinase/protein kinase B,PI3K/Akt)和PKC信号通路有关。
本文旨在整体动物模型基础上研究PI3K/Akt信号通路和PKC信号通路在urantide抗氧化应激反应和抗心肌细胞凋亡中的作用,为urantide用于心肌保护提供新的理论依据。
1 材料与方法
1.1 药品和试剂 Urantide:吉尔生化(上海)有限公司合成,经HPLC检测纯度≥95%,冻干粉剂,实验前用生理盐水稀释至所需浓度;盐酸维拉帕米注射液(Ver):上海禾丰制药有限公司;LY294002:san-ta cruz biotechnology(sc-201426);白屈菜红碱(Chelerythrine Chloride,CHE):santa cruz biotechnology(sc-3547);伊文思兰:国药集团化学试剂有限公司产品;TTC:Sigma公司产品;超氧化物歧化酶(SOD)、丙二醛(MDA)、一氧化氮(NO)试剂盒购自南京建成生物医学工程研究所。兔抗Bax多克隆抗体及兔抗Bcl-2多克隆抗体均为Santa Cruz产品;免疫组化试剂盒:北京中杉金桥生物技术有限公司产品;TUNEL检测试剂盒:德国Roche公司产品。
1.2 动物 选用SD大鼠,♂,体质量300~380 g,由安徽医科大学动物中心提供。合格证号:SCXK(皖)2005-0001号。
1.3 仪器 HX-300动物呼吸机:成都泰盟科技有限公司;BL-420生物机能实验系统:成都泰盟科技有限公司;TDZ4-WS低速台式离心机:长沙湘仪离心机仪器有限公司;SpectraMax 190型全波长酶标仪:美国MD公司。
1.4 方法
1.4.1 冠状动脉左前降支(LAD)结扎/松开致大鼠心肌缺血/再灌注损伤模型的制备 大鼠腹腔注射10%的水合氯醛3 ml·kg-1麻醉。大鼠颈前及胸前皮肤常规备皮,仰卧位固定。在环状软骨上方0.5 cm处,颈部正中纵形切口显露气管,剪一倒“T”型口,置入气管导管,接小动物呼吸机,呼吸频率为50~60次/分。四肢皮下插入电极,连接BL-420E生物机能实验系统,持续记录心电图(Ⅱ导联,ECG)。沿左锁骨中线心脏搏动处纵向切开皮肤2~3 cm,在第4、5肋间打开胸腔,逐层钝性分离皮下组织及肌肉,轻轻剪开心包,用自制开胸器扩张切口,使心脏充分暴露。结扎左冠状动脉前降支,方法为用持针器将6-0真丝带针线,在动脉圆锥与左心耳之间冠状静脉处进针,将结扎线从PE管(直径2 mm)中间穿出,用PE管一端阻断冠状动脉血流,另一端用动脉夹固定。心肌缺血即阻断血流30 min(缺血表现为其支配的局部心肌组织发绀或苍白,心电图ST段明显抬高或T波高耸,以此作为冠状动脉结扎成功的标志),松开动脉夹及PE管再灌注90 min(局部心肌组织转红恢复血流,心电图抬高的ST段下降50%以上)。实验结束后取血离心,取上清放入-20℃冰箱冻存,严格按试剂盒操作测SOD、MDA、NO、NOS等生化指标。
1.4.2 实验分组及给药 大鼠随机分为8组,分别为:①假手术组(sham group):仅穿线,不结扎冠状动脉;②模型组(model group):结扎左冠状动脉30 min后,松开结扎线再灌注90 min;③ Urantide 3 μg·kg-1组:于缺血前5 min舌下静脉1 min内一次推注 urantide 3 μg·kg-1;④ Urantide 10 μg·kg-1组:于缺血前5 min舌下静脉1 min内一次推注urantide 10 μg·kg-1;⑤ Urantide 30 μg·kg-1组:于缺血前5 min舌下静脉1 min内一次推注urantide 30 μg·kg-1;⑥ Ver 1.6 mg·kg-1组:于缺血前 5 min 舌下静脉1 min内一次推注Ver 1.6 mg·kg-1;⑦ Urantide 30 μg·kg-1+CHE(Chelerythrine,PKC 特异性阻断剂)组:在穿线稳定后,舌下静脉快速推注CHE 1 mg·kg-1,5 min后舌下静脉快速推注 urantide 30 μg·kg-1,稳定10 min后再行缺血/再灌注操作;⑧Urantide 30 μg·kg-1+LY294002(PI3K/AKT 信号通路阻断剂)组:在穿线稳定后,舌下静脉快速推注LY294002 0.3 mg·kg-1,5 min 后舌下静脉快速推注 urantide 30 μg·kg-1,稳定 10 min 后再行缺血/再灌注操作。
1.5 检测指标
1.5.1 大鼠血清中SOD、NO活力以及 MDA含量的测定 SOD和NOS采用化学比色法测定,测定波长分别为550 nm和530 nm;MDA采用硫代巴比妥酸盐法检测;NO采用硝酸还原酶法测定,各操作步骤严格按照说明书进行。
1.5.2 TUNEL法检测大鼠心肌细胞凋亡 各组实验结束后,取心尖部位心肌组织放入4%甲醛溶液中固定。常规石蜡包埋,切片,用脱氧核苷酸转移酶介导的dUTP缺口末端标记法(TUNEL)检测凋亡细胞(测法遵照罗氏凋亡检测试剂盒说明书)。从各组取5张石蜡切片,二甲苯脱蜡,梯度乙醇脱水,磷酸盐缓冲液(PBS,pH 7.2)冲洗5 min,3次;蛋白酶K(20 mg·L-1)37℃ 消化 8 min,PBS 冲洗,3 次;3%H2O2室温下处理5 min以阻断内源性过氧化物酶活性,PBS冲洗,含0.1%TritonX-100的0.1%枸橼酸溶液以去除细胞膜表面污物(冰上4 min),PBS冲洗,3次;加50 μl TUNEL反应混合液,包括脱氧核苷酸转移酶液,37℃ 孵育60 min,PBS冲洗,3次;加POD液37℃孵育30 min,PBS冲洗,二乙胺四乙酸(DAB)显色。在400倍显微镜下,于缺血区边缘随机采集5个非重叠视野,检测100个心肌细胞中TUNEL阳性细胞数,取其平均值。凋亡指数/%=(凋亡细胞数/细胞总数)×100%。
1.5.3 免疫组化检测大鼠心肌组织中Bcl-2和Bax的表达水平 石蜡切片用二甲苯和梯度酒精脱蜡至水后,蒸馏水冲洗,PBS(pH 7.4)浸泡切片5 min;3%过氧化氢室温孵育5 min,以消除内源性过氧化物酶的活性,PBS冲洗3次;在切片上滴加10%正常山羊血清(PBS缓冲液稀释),放置在湿盒中,室温孵育10~15 min,以封闭游离的结合位点,减少非特异性染色;甩去多余山羊血清,勿洗,滴加一抗(抗bcl-2和抗bax的多克隆抗体,用0.01 mol·L-1PBS缓冲液稀释成1∶100),4℃孵育过夜;PBS漂洗3次;滴加生物素标记的二抗 (羊抗兔 lgG工作液),37℃孵育30 min;PBS漂洗3次;滴加辣根酶标记链霉卵白素工作液,37℃孵育20 min;PBS漂洗3次;DAB显色,在光学显微镜下控制显色时间,镜下观察核中出现黄色颗粒及胞质黄染后及时终止;自来水终止显色、梯度乙醇脱水、二甲苯透明、中性树胶封片;阴性对照用PBS代替一抗,按上述步骤同步进行。在高倍镜下(×400)随机选取心肌组织连续3个视野,采用形态学图像分析系统(捷达科技)测量所要观察区域内免疫阳性细胞单位面积平均光密度。
Tab 1 Changes of segment ST(mv)of ECG by urantide treatment and its modification by CHE and LY294002 in myocardial I/R injury rats(±s,n=10)
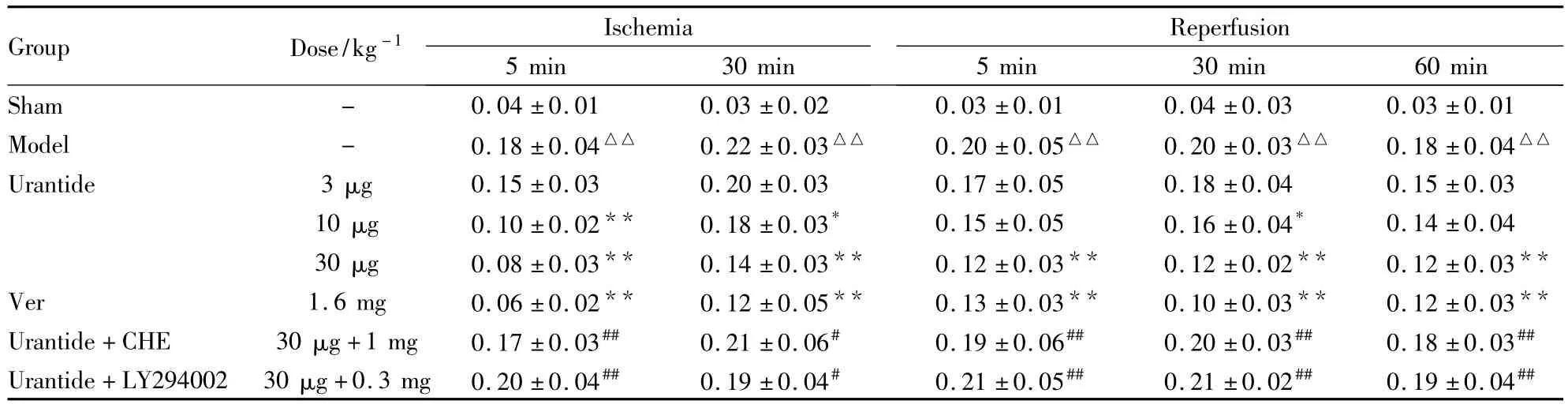
Tab 1 Changes of segment ST(mv)of ECG by urantide treatment and its modification by CHE and LY294002 in myocardial I/R injury rats(±s,n=10)
△△ P<0.01 vs sham;*P<0.05,**P<0.01 vs model;#P<0.05,##P<0.01 vs 30 μg·kg-1urantide
Group Dose/kg-1Ischemia 5 min 30 min Reperfusion 5 min 30 min 60 min Sham - 0.04 ±0.01 0.03 ±0.02 0.03 ±0.01 0.04 ±0.03 0.03 ±0.01 Model - 0.18 ±0.04△△ 0.22 ±0.03△△ 0.20 ±0.05△△ 0.20 ±0.03△△ 0.18 ±0.04△△Urantide 3 μg 0.15 ±0.03 0.20 ±0.03 0.17 ±0.05 0.18 ±0.04 0.15 ±0.03 10 μg 0.10 ±0.02** 0.18 ±0.03* 0.15 ±0.05 0.16 ±0.04* 0.14 ±0.04 30 μg 0.08 ±0.03** 0.14 ±0.03** 0.12 ±0.03** 0.12 ±0.02** 0.12 ±0.03**Ver 1.6 mg 0.06 ±0.02** 0.12 ±0.05** 0.13 ±0.03** 0.10 ±0.03** 0.12 ±0.03**Urantide+CHE 30 μg+1 mg 0.17 ±0.03## 0.21 ±0.06# 0.19 ±0.06## 0.20 ±0.03## 0.18 ±0.03##Urantide+LY294002 30 μg+0.3 mg 0.20 ±0.04## 0.19 ±0.04# 0.21 ±0.05## 0.21 ±0.02## 0.19 ±0.04##
2 结果
2.1 各组大鼠心电图结果 结果如Tab 1所示,与假手术组比较,模型组大鼠在心肌缺血及再灌注时ST段抬高明显,再灌注30 min时尤为明显;与模型组比较,urantide(10,30 μg·kg-1)能明显抑制缺血/再灌注大鼠心电图中ST段的抬高,加快再灌后心脏功能的恢复;阳性药(Ver)也有类似的作用。而应用了 PKC抑制剂 CHE和 PI3K/Akt抑制剂LY294002能取消urantide改善ECG的作用。
Tab 2 Serum SOD activitiy and MDA content by urantide treatment and its modification by CHE and LY294002 in myocardial I/R injury rats(±s,n=10)

Tab 2 Serum SOD activitiy and MDA content by urantide treatment and its modification by CHE and LY294002 in myocardial I/R injury rats(±s,n=10)
△△P<0.01 vs sham;*P<0.05,**P<0.01 vs model;#P<0.05 vs urantide(30 μg·kg-1)
Group Dose/kg-1 SOD/U·ml-1 MDA/μmol·L -1 Sham - 180.28 ±5.15 2.28 ±0.96 Model - 145.24 ±19.28△△ 4.94 ±1.55△△Urantide 3μg 156.17 ±13.35* 3.97 ±0.89 10μg 164.65 ±16.17** 3.59 ±1.15 30μg 171.47 ±13.37** 3.40 ±1.14*Ver 1.6 mg 175.90 ±5.99** 3.33 ±0.88*Urantide+CHE 30 μg+1 mg 149.94 ±16.57# 4.42 ±0.90 Urantide+LY294002 30 μg+0.3 mg 148.22 ±19.26#4.04 ±0.95
2.2 各组大鼠血清中SOD活力和MDA含量的测定 结果如Tab 2所示,大鼠心肌缺血/再灌注模型组MDA含量明显高于假手术组,SOD的活力明显降低,与假手术组比较差异有显著性(P<0.01)。与模型组比较,urantide 3、10、30 μg·kg-1能升高SOD 活性,urantide 30 μg·kg-1能够明显减少血清中MDA的生成;而urantide+CHE组与urantide+LY294002组与模型组相比,对SOD活性与MDA含量影响不大。
Tab 3 Serum NO content and NOS activity by urantide treatment and its modification by CHE and LY294002 in myocardial I/R injury rats(±s,n=10)

Tab 3 Serum NO content and NOS activity by urantide treatment and its modification by CHE and LY294002 in myocardial I/R injury rats(±s,n=10)
△△P<0.01 vs sham;*P<0.05,**P<0.01 vs model;#P<0.05,##P<0.01 vs urantide(30 μg·kg-1)
Group Dose/kg-1 NO/μmol·L -1 NOS/U·ml -1 Sham - 57.43 ±16.83 16.80 ±1.88 Model - 27.13 ±4.86△△ 10.98 ±1.90△△Urantide 3 μg 28.86 ±3.70 11.53 ±3.93*10 μg 32.76 ±4.46 13.36 ±1.68**30 μg 43.58 ±6.63** 15.40 ±3.38**Ver 1.6 mg 51.52 ±8.76** 15.59 ±1.58**Urantide+CHE 30 μg+1 mg 28.43 ±6.91## 11.51 ±1.31#Urantide+LY294002 30 μg+0.3 mg 30.30 ±8.80# 11.68 ±1.20#
2.3 各组大鼠血清中NOS活力和NO含量的测定
如Tab 3所示,与假手术组相比,模型组NO含量明显减少,NOS活力明显减低;Urantide 30 μg·kg-1及 Ver 1.6 mg·kg-1可增加血清中 NO 含量,urantide 3,10,30 μg·kg-1及 Ver 1.6 mg·kg-1均可提高血清中NOS活性。与模型组比较,在静脉注射urantide 30 μg·kg-1之前分别给予阻断剂 CHE 和LY294002均可以使urantide升高NOS活性和NO含量的作用消失。

Fig 1 Representative photomicrographs of in situ detection of TUNEL-positive nuclei by in vivo urantide treatment and its modification by CHE and LY294002(magnification,×400)
2.4 各组大鼠心肌细胞凋亡指数 由Fig 1可见TUNEL法标记的凋亡心肌细胞,凋亡阳性细胞核被染成棕黄色或棕褐色,正常心肌细胞核被苏木精复染成蓝色。由Fig 2可见与假手术组的凋亡指数(9.29±3.44)%相比,模型组凋亡指数明显升高为(43.54±3.16)%,urantide 3个剂量组均可以不同程度的降低缺血/再灌注大鼠的心肌细胞凋亡指数,在 urantide10 μg·kg-1和 urantide30 μg·kg-1两个剂量组中,心肌细胞凋亡指数与模型组比较差异有显著性(P<0.01)。而urantide+CHE组与urantide+LY294002组的凋亡指数与urantide用药组相比明显升高,与模型组相比无统计学意义。

Fig 2 Effect of urantide treatment and its modification by CHEand LY294002 on I/R-induced apoptosis assayed by TUNEL
2.5 各组大鼠心肌组织中Bcl-2和Bax表达水平
免疫组化结果显示,含Bcl-2或Bax蛋白的细胞浆着染成棕黄色。假手术组大鼠心肌组织Bcl-2蛋白表达明显,而Bax蛋白表达较弱。而在缺血/再灌注组大鼠心肌组织中可见Bcl-2蛋白表达减弱,Bax蛋白表达则有显著增加;Urantide 3、10、30 μg·kg-1组及阳性药Ver可不同程度增强Bcl-2蛋白的表达,而减弱Bax的表达;合用1 mg·kg-1CHE或0.3 mg·kg-1LY294002后,urantide对 Bax和 Bcl-2蛋白表达的作用明显减弱。(见Fig 3,Fig 4)
图像分析结果显示,缺血/再灌注组大鼠心肌组织Bcl-2和Bax阳性细胞平均光密度与假手术组比较差异有显著性(P<0.01)。Urantide各用药组及阳性药Ver能够增加Bcl-2蛋白表达,减少Bax蛋白表达,使Bcl-2/Bax的比值增大,表明urantide具有抗心肌细胞凋亡的作用。而CHE或LY294002能明显抑制urantide对Bcl-2表达增强和Bax表达减弱的作用(P<0.05或P<0.01),urantide合用CHE或LY294002组中Bcl-2和Bax的蛋白表达与模型组相比差异无显著性(P>0.01),表明urantide的这种抗凋亡作用可以被蛋白激酶C的阻断剂CHE和PI3K/AKT信号通路特异性阻断剂LY294002所阻断。见Tab 4。
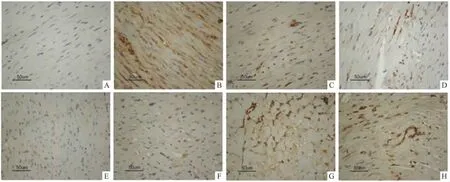
Fig 3 Effect of urantide on the Bax protein immunoreactivity cells in cardiomyocytes of I/R rats(×400,n=4)
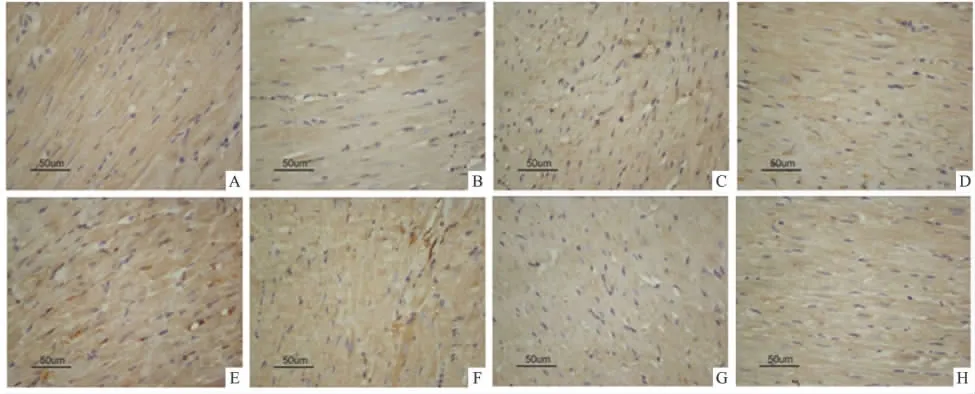
Fig 4 Effect of urantide on the Bcl-2 protein immunoreactivity cells in cardiomyocytes of I/R rats(×400,n=4)
3 讨论
本实验采用的在体左冠状动脉前降支结扎/松开术是经典的心肌缺血/再灌注模型,具有较好的稳定性和重复性。本研究采用的缺血30 min、再灌注90 min模型能较好的诱导心肌缺血/再灌注损伤[6]。
Tab 4 Effect of urantide on the mean optical density of Bcl-2 and Bax of myocardium in myocardial I/R rats( ± s,n=6)

Tab 4 Effect of urantide on the mean optical density of Bcl-2 and Bax of myocardium in myocardial I/R rats( ± s,n=6)
△△P<0.01 vs sham;*P<0.05,**P<0.01 vs model;#P<0.05,##P<0.01 vs urantide(30 μg·kg-1)
Group Dose/kg-1Mean optical density Bcl-2 Bax Sham - 0.504 ±0.162 0.233 ±0.077 Model - 0.217 ±0.016△△ 0.728 ±0.199△△Urantide 3 μg 0.287 ±0.044 0.476 ±0.127*10 μg 0.317 ±0.077* 0.409 ±0.060**30 μg 0.370 ±0.135* 0.286 ±0.036**Ver 1.6 mg 0.314 ±0.068* 0.259 ±0.071**Urantide+CHE 30 μg+1 mg 0.232 ±0.059# 0.557 ±0.073##Urantide+LY294002 30 μg+0.3 mg 0.220 ±0.099# 0.554 ±0.185##
心肌细胞凋亡在缺血/再灌注损伤中的作用长期以来受到关注,如何保护心肌细胞,减少凋亡细胞的数量,减小梗死周边危险区(area of risk)成为心血管领域研究的热点[7]。已知心肌缺血/再灌注期间的氧化应激能够诱导心肌细胞凋亡[8],亦可降低细胞内信号分子一氧化氮的生物利用度,从而抵消了一氧化氮的保护作用[9]。大量氧自由基的产生可导致心肌线粒体功能的不可逆损伤和心肌细胞死亡[10]。
PKC是一组具有单一肽链结构的丝氨酸/苏氨酸蛋白激酶,广泛参与细胞信息传递、分泌、离子通道调节、细胞增生、分化等一系列与生命现象相关过程。在心肌缺血预适应的触发阶段,腺苷、缓激肽和阿片受体都被激活,尽管这3种受体从不同通路触发信号转导,最终均汇聚在PKC通路上。活化的PKC通过磷酸化或耦合其他蛋白使A2b腺苷受体激活,从而进一步活化 PI3K-Akt和 ERK信号通路[11]。
PI3K/Akt信号通路是膜受体信号向细胞内转导的重要途径,调节着细胞生长、凋亡及细胞一些重要基因的表达。研究发现在某些条件下,激活PI3K/Akt信号通路可有效抑制低氧诱导的心肌细胞凋亡的发生[12]。
本研究表明urantide可以减少心肌缺血/再灌注大鼠体内氧自由基的生成,增加NO含量,提高NOS活性。同时降低心肌细胞凋亡率,下调促凋亡蛋白Bax的表达,上调抗凋亡蛋白Bcl-2的表达。而urantide的上述作用均可以被PI3K-Akt信号通路和PKC信号通路阻断剂所逆转。提示urantide可以通过激活PKC信号通路和PI3K/Akt信号通路,发挥抗心肌细胞脂质过氧化作用,进一步干预凋亡基因Bcl-2、Bax蛋白的表达,抑制细胞凋亡的发生,减轻心肌缺血/再灌注损伤。而这两条信号通路之间的相互作用,以及有无其他信号通路参与其中的作用,有待于进一步研究证实。
[1]Rajadurai M,Stanely Mainzen Prince P.Preventive effect of naringin on lipid peroxides and antioxidants in isoproterenol-induced cardio toxicity in Wistar rats:biochemical and histopathological evidences[J].Toxicol,2006,228(2-3):259-68.
[2]Ottani A,Giuliani D,Galantucci M,et al.Melanocortins counteract inflammatory and apoptotic responses to prolonged myocardial ischemia/reperfusion through a vagus nerve-mediated mechanism[J].Eur J Pharmacol,2010,637(1-3):124-30.
[3]姚 华,陈志武.Urantide对心肌缺血性损伤的保护作用[J].药学学报,2008,43(2):150-6.
[3]Yao H,Chen Z W.Protective effect of urantide against myocardial ischemia injury[J].Acta Pharm Sin,2008,43(2):150-6.
[4]姚 华,张骏艳,陈志武.Urantide对心肌缺血/再灌注损伤的保护作用[J].中国药理学通报,2010,26(5):661-6.
[4]Yao H,Zhang J Y,Chen Z W.Protective effect of urantide against myocardial ischemia- reperfusion injury[J].Clin Pharmacol Bull,2010,26(5):661-6.
[5]Zhang J Y,Chen Z W,Yao H.Protective effect of urantide against ischemia-reperfusion injury via protein kinase C and phosphtidylinositol 3’-kinase-Akt pathway[J].Can J Physioland Pharmacol,2012,90(5):637-45.
[6]陈洪涛,雷春亮,李宝金,等.七氟烷后处理对大鼠缺血/再灌注损伤心功能和ERK1/2表达的影响[J].中国药理学通报,2011,27(2):258-64.
[6]Chen H T,Lei C L,Li B J,et al.Effect of sevoflurance postconditioning on cardiac function and ERK1/2 of isolated rat heart with acute myocardial ischemia-reperfusion injury[J].Clin Pharmacol Bull,2011,27(2):258-64.
[7]Machado N G,Alves M G,Carvalho R A,Oliveira P J.Mitochondrial involvement in cardiac apoptosis during ischemia and reperfusion:can we close the box[J].Cardiovasc Toxicol,2009,9(4):211-27.
[8]Raedschelders K,Ansley D M,Chen D D.The cellular and molecular origin of reactive oxygen species generation during myocardial ischemia and reperfusion [J].Pharmacol Ther,2012,133(2):230-55.
[9]吴锦波,吴平生.心肌缺血/再灌注损伤与细胞凋亡[J].医学综述,2011,17(19):2961-3.
[9]Wu J B,Wu P S.Myocardial ischemia/reperfusion injury and myocardial apoptosis[J].Med Recap,2011,17(19):2961-3.
[10]Andreadou I,Iliodromitis E K,Farmakis D,Kremastinos D T.To prevent,protect and save the ischemic heart:antioxidants revisited[J].Expert Opin Ther Targets,2009,13(8):945-56.
[11]Yang X,Cohen M V,Downey J M.Mechanism of cardioprotection by early ischemia preconditioning [J].Cardiovasc Drugs Ther,2010,24(3):225-34.
[12]Matsui T,Li L,del Monte F,et al.Adenoviral gene transfer of activated phosphatidylinositol 3’-kinase and Akt inhibits apoptosis of hypoxic cardio-myocytesin vivo[J].Circulation,1999,100(23):2373-9.