利用基因芯片筛选藜芦定碱对SH-SY5Y细胞神经毒性相关基因
2013-12-07王艳丽王宇光梁乾德马增春肖成荣谭洪玲汤响林张伯礼
王艳丽,王宇光 ,梁乾德,马增春,肖成荣,谭洪玲,汤响林,张伯礼,高 月
(1.解放军医学院,北京 100853;2.军事医学科学院放射与辐射医学研究所药理毒理研究室,北京 100850;3.天津中医药大学,天津 300193)
藜芦为百合科藜芦属植物,根及根茎入药,有大毒。藜芦所含化学成分中有多种甾体生物碱。据报道,藜芦生物碱可以作用于中枢神经系统,使大脑先兴奋后抑制,出现意识障碍症状如痉挛、抽搐以及昏睡昏迷[1]等。已有研究显示藜芦生物碱是钠通道失活门的抑制剂,浸浴藜芦生物碱可使大鼠初级感觉神经元产生一种可能与触发痛的发作有关的触发性振荡[2]。小剂量的藜芦生物碱具有一定的降压作用,而剂量较大时能使分离的神经细胞内Ca2+升高,成为一种脂溶性神经毒素[3]。
以往的研究多集中于藜芦对神经细胞离子通道或电生理的影响及其与神经毒性的关系,但其对神经细胞相关基因表达的影响尚未见文献报道。藜芦定碱有可能通过改变神经细胞相关基因的表达,进而影响神经细胞相关信号通路,造成亚急性或慢性损伤。
SH-SY5Y细胞系来源于人神经母细胞瘤细胞,形态及生理生化功能与正常神经元相似,是目前国际上研究神经系统功能公认的一种细胞模型[4],常用于神经毒性、帕金森病、阿尔采末病[5]等的研究。
基因芯片技术可代替传统的动物毒理学实验进行早期的毒性筛查和线索发现,其最显著的特点是在毒性线索发现阶段可以给出海量的信息[6],有助于更深入的毒性机制研究。从基因组水平上研究藜芦定碱与相关基因表达的关系,通过基因表达图谱改变发现藜芦定碱的毒性作用机制不失为一种有效的技术手段。
1 材料与方法
1.1 材料
1.1.1 细胞株 SH-SY5Y细胞购买于协和细胞中心。
1.1.2 实验药物 藜芦定碱(veratridine,批号:D00114760)购自Merck公司。
1.1.3 主要试剂 RPMI 1640培养基(批号:C11875500BT)由Gibco BRL公司提供,新生胎牛血清(FBS,批号:NXF0650)和0.25%胰蛋白酶(批号:SLBC1656)购自 Hyclone公司,TRIzol(批号:15596018)购自Invitrogen公司;基因芯片检测试剂盒Amino Allyl Message AmpTMⅡaRNA Amplification Kit(Ambion#AM1753,CA,USA);HOA 5.1基因芯片 (Phalanx Biotech Group,Inc,Taiwan)。
1.1.4 仪器与软件 CO2培氧箱(Thromeo公司),倒置显微镜(重庆光学仪器厂);图像扫描仪AX-ON4000B(Molecular Device,CA,USA);数据处理软件 Rosetta Resolver®System(Rosetta Biosoftware,USA)。
1.2 方法
1.2.1 SH-SY5Y细胞培养、处理和收集 将 SHSY5Y细胞培养于RPMI 1640(含15%灭活FBS,100 U/mL青霉素和100 U/mL链霉素),37℃、5%CO2孵育,2~3 d换液,取对数生长期细胞进行实验。将藜芦定碱分别以终浓度为50,200,800 μmol·L-1加入SH-SY5Y细胞中,分别标记为低浓度(L)组、中浓度(M)组、高浓度(H)组;另外设置正常对照组加空白培养液,标记为N组,加药作用8 h。
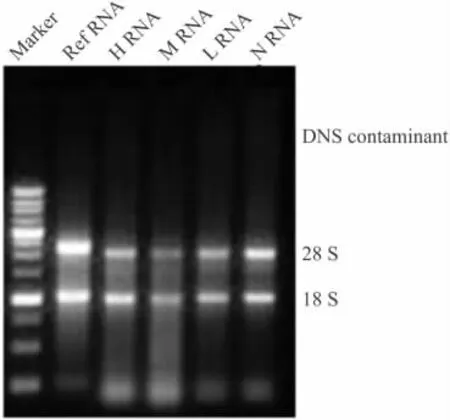
1.2.2 电泳检测 RNA品质 TRizol法提取 SHSY5Y细胞的总RNA,将纯化的总RNA样品置于70℃水浴保温1 h,各取5 μl用 RNase-free Water稀释50倍,用甲醛变性胶电泳检测提取的RNA纯度,观察18和28 s rRNA条带的强弱和有无拖尾现象,同时计算两条带的灰度比,并在220~320 nm紫外波长范围内进行扫描,定量[7]。
1.2.3 cDNA的合成及其探针标记 使用基因芯片检测试剂盒 Amino AllylMessageAmpTMⅡ aRNA Amplification Kit(Ambion#AM1753,CA,USA)进RNA反转录、细胞外转录放大与标记。以1 μg总RNA起始反转录为cDNA探针,荧光染料Cy5接dUTP上,在细胞外转录放大同时掺入进行标记成为Cy5 标记的 aRNA[8]。
1.2.4 基因芯片杂交与洗涤 取10 μg Cy5标记的aRNA,以试剂盒Ambion#AM8740进行片段化后,加入120 μl的1.5倍OneArray杂交液中。基因芯片 HOA 5.1(Phalanx Biotech Group,Inc,Taiwan)以100%无水酒精进行变性20 s后加入OneArray®预杂交缓冲液 (5x SSPE,0.1%SDS,1%BSA)于42℃静置2 h完成芯片预杂交。将已片段化的Cy5-aRNA加入1.5 x OneArray®杂交缓冲液至总反应体积180 μl于95℃反应5 min变性后,加入已完成预杂交的芯片,50℃反应16 h。完成杂交后以清洗液Ⅰ、Ⅱ、Ⅲ(清洗液I:2x SSC+0.2%SDS;清洗液Ⅱ:2x SSC;清洗液Ⅲ:0.2x SSC)分别于42℃,42℃,25℃清洗 5,5 min,5 s 后甩干[9]。
1.2.5 图像扫描与数据处理 用 AXON4000B(Molecular Device,CA,USA)扫描仪扫描杂交后芯片,利用GenePixTM4提取基因表达的荧光信号强度值撷取,获得初级数据格式gpr档案为原始数据。将gpr导入 Rosetta Resolver®System(Rosetta Biosoftware,USA)软件进行数据前处理与均一化,剔除在所有芯片中flag值皆为-50的探针后,对三样本重复进行median scaling校正后的均值,即为每一样本均一化后的讯号值。接下来套用Rosetta Resolver的error model计算两两实验样本间的Cy5荧光讯号的log2比值及P-value。挑选|log2比值|≥1P-value<0.05的基因为显著差异表达基因。
2 结果
2.1 细胞形态变化 SH-SY5Y细胞受藜芦定碱作用后细胞体积收缩、变圆,树突数量减少,细胞连接明显减少,细胞增殖率降低,高剂量组出现细胞体积收缩、变圆,树突融解、消失,细胞连接明显减少,细胞增殖率明显降低。

Fig 1 Cell morphology of the different treated groups(100×)
2.2 电泳检测RNA纯度 由RNA电泳图可以看RNA在28S和18S有两条清晰的表达条带,没有拖尾,说明无DNA残留;并且28S与18S的表达均约为2∶1。因此可知细胞中提取的RNA完整性好,品质合格,可以进行后续实验。
2.3 SH-SY5Y细胞受藜芦定碱毒性作用前后的显著差异表达基因 SH-SY5Y细胞受藜芦定碱作用后L、M、H组与N组相比较,显著差异表达基因分别有71、182、77 条,其中上调基因分别有 45、81、45条,下调基因分别为26、101、32条。在差异表达基因中包括GSH相关基因,RNA功能、DNA修复及蛋白合成相关基因,细胞物质与能量代谢 、线粒体功能相关基因,细胞周期、细胞分化、细胞凋亡相关基因,蛋白氧化磷酸化作用、细胞信号传导相关基因,以及一些代谢相关酶类相关基因。
2.4 差异表达基因聚类分析 用Cluster 3.0软件对4组差异表达基因进行处理,选择传统聚分析方法,聚类结果如Fig 3所示。由聚类分析可知,N组与L组可以聚为一类,M组与H组可以聚为一类。在前一类中差异表达基因较少,而后一类差异表达基因较多。表明差异表达基因可以很好的区分藜芦定碱不同浓度处理组。

Tab 1 Part of the significant upregulated genes in SH-SY5Y treated by veratridine 50 mmol·L -1
Tab 3 Part of the significant upregulated genes in SH-SY5Y treated by veratridine 200 μmol·L -1

Tab 4 Part of the significant downregulated genes in SH-SY5Y treated by veratridine 200 μmol·L -1

Tab 5 Part of the significant upregulated genes in SH-SY5Y treated by veratridine 800 μmol·L -1
3 讨论
基因芯片技术是一种新的基因表达研究方法,它利用核酸杂交的原理,在固体支持物上一次检测成百上千乃至上万种基因的表达水平,具有传统方法无可比拟的高通量特点,达到了一定意义上的全基因表达谱的检测。本文采用基因芯片技术筛选藜芦定碱对神经细胞毒性作用的差异表达基因,试图初步揭示其毒性发生机制。

Tab 6 Part of the significant downregulated genes in SH-SY5Y treated by veratridine 800 μmol·L -1
本研究通过利用表达谱基因芯片筛选藜芦定碱对SH-SY5Y细胞神经毒性相关基因,发现神经细胞受藜芦定碱毒性作用过程中,相关基因表达水平有显著变化。本实验对表达差异基因运用系统聚类分析,按照藜芦定碱不同处理浓度与基因表达的关系,将药物处理浓度各视为一类,在此基础上考察藜芦定碱对神经细胞毒性作用的基因表达结果,并将结果进行合并分析。
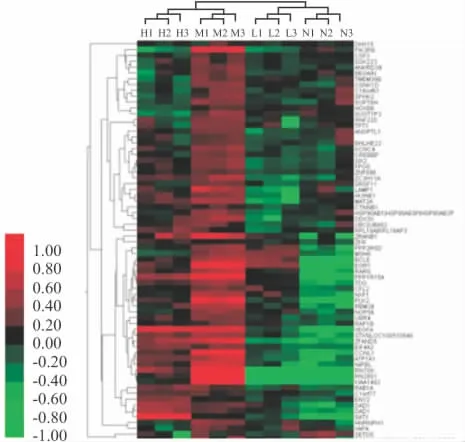
Fig 3 Cluster analysis result of differentially expressed genes
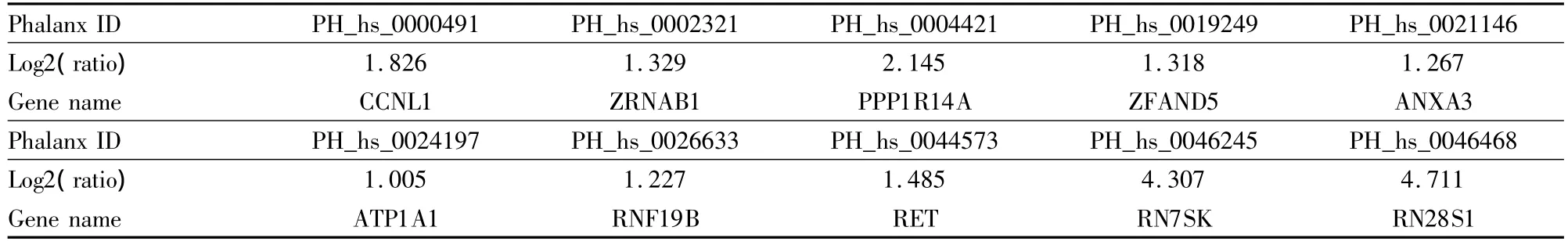
在神经细胞SH-SY5Y的基因表达谱中,藜芦定碱低浓度组与对照组比较显著性差异表达基因共有71条,其中上调基因45条,下调基因26条;中浓度组与对照组比较显著性差异表达基因共有182条,其中上调基因81条,下调基因101条;高浓度作用组与对照组比较显著性差异表达基因共有77条,其中上调基因45条,下调基因32条。在差异表达基因中,涉及GSH相关基因(DCAF12),RNA修复及蛋白合成相关基因(RPS11,RPS27A,RPSAP58),RNA功能相关基因(RN7SK,RN28S1),细胞物质与能量代谢相关基因(ATP1A1),线粒体功能相关基因(MRPL16),蛋白氧化磷酸化相关基因(PPP1R),细胞信号传导相关基因(MAPKAP1,MAP4K4,RNF),细胞周期相关基因(CCNL1),细胞分化相关基因(ZNF),细胞凋亡相关基因(USP38,ANXA3),以及一些代谢相关酶类相关基因(GLT,GCAT)。
GSH在生命活动中起着直接或间接的作用,参与对细胞的保护、基因表达调控、酶活性和物质代谢、氨基酸转运、免疫功能调节等,且在中枢神经系统中可以充当神经递质发挥神经递质的作用;GSH是机体主要的抗氧化剂之一[10],其含量的降低是一种潜在的凋亡早期激活信号,因为随后产生的氧自由基可促使细胞发生凋亡。
细胞凋亡过程中线粒体也发挥着相当重要的作用,在外部刺激作用下,线粒体能够释放促凋亡因子如细胞色素C,激活凋亡蛋白酶Caspase;活化后的Caspase可以反作用于线粒体,引发更大量的细胞色素C的释放,形成细胞色素C释放的正向反馈调节机制,从而激发下游的凋亡执行者,最终导致细胞凋亡。
从研究结果中,我们看到与细胞信号传导有关的基因如蛋白激酶和MAPK相关基因也有差异性表达,MAPK蛋白激酶途径是一种重要的信号转导途径,该信号通路广泛参与多种神经系统疾病的发生发展过程,且MAPK蛋白激酶在细胞周期调控中发挥着重要的作用。
上述基因的变化可能与藜芦定碱对SH-SY5Y细胞毒性作用有关,同时推测,这些基因参与了毒性作用过程。在聚类分析结果图中我们看到,藜芦定碱200 μmol·L-1处理后,基因表达普遍上升,而800 μmol·L-1处理时,基因表达又有所降低,此现象,从生物学意义上来说是可能的。由于聚类分析图所表示出来的只是一部分差异较显著的基因,在聚类分析结果里,变化的模式有很多种,从研究结果中我们能达到利用基因芯片技术筛选藜芦定碱对SH-SY5Y细胞神经毒性的相关基因的目的,而后续研究将挑选具体变化模式做进一步的验证工作。综上,该实验结果为研究藜芦定碱对SH-SY5Y毒性作用的机制提供了实验依据,为临床安全合理应用藜芦和藜芦神经中毒救治提供参考。
[1]赵 瑜,陆国才,张卫东.藜芦生物碱药理和毒理学研究进展[J].中国新药与临床药理,2008,19(3):240-2.
[1]Zhao Y,Lu G C,Zhang W C.The Veratrum alkaloids pharmacological and toxicological studies progress[J].Tradit Chin Drug Res Clin Pharmacol,2008,19(3):240- 2.
[2]段建红,段玉斌,邢俊玲,等.藜芦碱致使大鼠背根神经节A类神经元产生触发性振荡[J].生理学报,2002,54(3):208-12.
[2]Duan J H,Duan Y B,Xing J L,et al.Triggered oscillations in type A dorsal root ganglion neurons induced by veratridine[J].Acta Physiol Sinica,2002,54(3):208-12.
[3]卢步峰,鲁友明,黄诒森.藜芦碱对分离的大鼠神经细胞内游离钙的影响[J].中国药理学通报,1994,10(3):214-6.
[3]Lu B F,Lu Y M,Huang Y S.Effects of veratridine on intracellular free Ca2+conce ntration in dissociated rat neurons[J].Chin Pharmacol Bull,1994,10(3):214- 6.
[4]孙 蓉,张丽美,王 丽,等.毒理芯片技术在中药毒理学研究中的应用及前景[J].药物警戒,2008,5(3):158-61.
[4]Sun R,Zhang L M,Wang L,et al.Application and Prospect of Toxicchip Technology in Researching for the Toxicology of Traditional Chinese Medicine[J].Chin J Pharmacovigilance,2008,5(3):158-61.
[5]Wonsuk Y,Evelyn T C,Hyun C K,et al.Paraquat activates the IRE1/ASK1/JNK cascade associated with apoptosis in human neuroblastoma SH-SY5Y cells[J].Toxicol Let,2009,191:203-10.
[6]刘丽敏,刘华钢.氯化两面针碱对于人肝癌裸鼠移植瘤基因表达谱的影响[J].中国药理学通报,2012,28(11):1522-7.
[6]Liu L H,Liu H G.Effects of nitidine chloride on gene expression profile in human hepatocarcinoma HepG2 transplanted tumor in nude mice[J].Chin Pharmacol Bull,2012,28(11):1522-7.
[7]Kiela P R,Midura A J,Kuscuoglu,N,et al.Effects of Boswellia serrata in mouse models of chemically induced colitis[J].Am J Physio Gastrointest Liver Physiol,2005,288(4):798.
[8]Komissarova V E,Li P,Uddin N A,et al.Gene expression levels in normal human lymphoblasts with variable sensitivities to arsenite:I-dentification of GGT1 and NFKBIE expression levels as possible biomarkers of susceptibility[J].Toxicol Applied Pharmacol,2008,226(2):199-205.
[9]Zhang D,Zhang J J,Liu G T,etal.The novel squamosamide derivative(compound FLZ)attenuated 1-methyl,4-phenyl-pyridinium ion(MPP+)-induced apoptosis and alternations of related signal transduction in SH-SY5Y cells[J].Neuropharmacol,2007,52:423-9.
[10]Haider R,Annie J.4-Hydroxynonenal induces mitochondrial oxidative stress,apoptosis and expression of glutathione S-transferase A4-4 and cytochrome P450 2E1 in PC12 cells[J].Toxicol Applied Pharmacol,2006,216:309-18.