营养物质纳米运送系统的研究与应用
2013-12-06刘晨光
李 雪,刘晨光
(中国海洋大学海洋生命学院,生物化学实验室,山东青岛266003)
随着功能食品产业规模在全球范围内的剧增和纳米技术的迅猛发展,越来越多的目光正投向纳米功能性食品的开发利用。这些食品所谓功能性的发挥效果取决于其中生物活性成分的保持及其生物可利用度。口服是人体营养摄入的主要方式,但许多营养物质在口服后只仅少部分可以被机体所利用,其功能发挥受到极大限制。因此,如何能够使营养分子保持活性并在最终被人体充分吸收利用,是功能性食品工业正在面临的挑战。包埋体系的研发应用曾经给口服途径低生物利用率难题的克服带来希望。在过去的几十年里,医药领域已经研制出多种包埋药物分子的聚合物药物运送系统(drug delivery system,DDS),在保持分子活性并实现靶向运送功能。而在此基础上进行的营养物质运送系统(nutrient delivery system,NDS)研究,则是专门用于运输营养类大分子的载体系统,在将营养物质溶解、包埋或附于载体基质上后运输到身体各部分。在众多运送系统中,基质包埋类和微球(囊)类是近几年来关注的热点。运输基质的成分多为可食用生物聚合物,即达到食品级安全的蛋白质或多糖类物质,其中可食性蛋白质凝胶的研究最为深入。而微球(囊)营养物质运送系统的制备方法简便,多适用于工业化大规模生产,并且可用于多种疏水或亲水性物质甚至微生物的运输,目前已在食品工业中得到了广泛的应用[1]。
1 营养物质纳米运送系统
纳米技术是指开发研究结构尺寸在0.1~100nm范围内材料的性质和应用的一种技术。纳米技术早已深入医药领域并成功应用于预防、诊断、监测、治疗等各个方面。单在药物运送方面,现在已经设计出多种智能化、靶向性的纳米药物运送体系,尽可能使药效达最大化且副作用最小化。
纳米运送系统对食品工业来说是一个全新的内容,附带着大量未解决的问题。比如在运送系统的选材上,营养运送系统的载体必须安全无毒而且可食用,再加上相关法律限制,使得一些药用载体材料无法直接用于营养的运送,因而选择余地更为有限[2]。同时这也是营养运送载体的发展远远落后于给药系统的原因之一。例如FDA允许聚乳酸甘醇酸用于药物但不可添加入食品。纳米载体在营养运送系统方面的应用范围广泛,也是纳米技术应用研究的全球热点之一,其制备过程中可形成稳定的内环境包埋亲水性物质,或者通过疏水作用包埋疏水性物质。而属食物业应用纳米技术第二大范畴的纳米囊化技术,则是近几年对功能食品中活性成分靶向传送可行性讨论的热点[3]。它将纳米载体技术与在食物业沿用多年的微囊化技术相结合,掩盖食物添加剂金枪鱼鱼油的不良气味和味道,同时也保证ω-3脂肪酸等活性成分在到达胃部后才开始释放[4]。
2 用于营养物质的纳米运送系统的优点
纳米运送系统由于其自身特性使其在营养输送方面具有许多优势:
首先是具尺寸效应和体内分布特异性。与微米载体相比,纳米载体体积更加微小,并且其纳米结构能够直接作用于体内某些蛋白质和细胞,控制营养物质的释放位置和作用时间,提高营养物质的生物利用度[5]。纳米载体进入血液后与糖蛋白发生吸附作用,再被网状内皮系统(RES)内的巨噬细胞识别吞噬,进而通过RES达到不同的靶器官。改变载体的大小,则可以控制最终到达的特定的组织部位,从而达到被动靶向的作用。而小粒径纳米载体更加可以利用其良好粘附性而在肠道内滞留更长时间,使营养成分吸收利用得更加充分[1]。
其次,经表面修饰后的载体可以延长在血液中的半衰期,并增添主动靶向性。用聚乙二醇等亲水性材料进行表面修饰后的纳米脂质体可兼具“长循环(long-circulation)”和“隐形(stealthy)”或“立体稳定(stereo-stable)”的特点,同时减少肝脏巨噬细胞吞噬、阻碍血液蛋白质成分粘附,延长循环时间[6]。纳米载体在经过表面耦联特异性靶向分子(特异性的配体、单克隆抗体等)后,可通过靶向分子与靶位点特异性受体的结合实现营养物质的主动靶向运输,在靶位点形成有效成分局部高浓度区,并保持较长时间[7]。
再次,加强了肠道吸收和生物利用率。营养物质通过化学或物理的作用,以较高包封效率存在于纳米载体的内部或吸附于表面上,在缓释的过程中大大提高了营养物质的有效接触时间。以苹果汁为例,将苹果汁包于天然脂类中制成纳米微粒,再分散入水相得到纳米苹果汁。进入人体后纳米苹果汁在肠道中的滞留时间延长至原先的2~3倍,同时避免了胃肠道各种天然生物因子的破坏,在缓释过程中纳米粒子也更易吸附在肠道上被人体吸收利用,从而大大增加了各种营养物质的生物利用率[8]。
另外,可以提高营养物质的稳定性,避免提前降解,特别是胃肠特殊pH环境以及各种消化酶作用。这对于脂类、多肽和蛋白质营养物质的有效输送十分重要。一些营养物质由于自身溶解或分散特性欠佳,亦或由于消化道的不稳定性而不能直接口服,而且这些物质只有在特定部位才能发挥效果,在纳米载体的包被下可以防止体内酸碱和消化酶的分解,使营养物质运输到靶位点后仍能保持生理活性。
而对于难溶性营养物质,则可以大大提高它们的吸收。纳米载体可以提高营养物质的溶解度,增加粘附性以及消除粒子大小差异产生的过饱和现象。由于脂溶性维生素、多肽以及不饱和脂肪酸在血液中的溶解度很低,单纯口服上述物质后,大部分无法得到运输吸收,最终进入血液的可能不足10%,远远无法满足需要。纳米载体的应用大大提高了难溶营养物质的溶解度,更多的营养成分可以随血液被运输,减少了服用的次数和机体排泄未溶解部分的浪费,提高了营养成分的生物利用度。
最后,安全无毒且生物可降解。载体—营养物质复合物在进入靶位点并完成营养物质的释放后,载体残留部分必须彻底降解,并最终经肾脏或大肠排出体外,避免外来物质在组织中积累所产生毒副作用。并且不得在整个过程中出现因载体特殊纳米结构所引发的不良反应。纳米粒在人体内具体的摄入吸收和排除过程详见图1。现用于纳米载体研究的生物可降解聚合物主要包括可食用的生物大分子(如蛋白质,脂类,多糖),低分子量表面活性剂及部分共聚物(例如蛋白质-多糖聚合物等)。
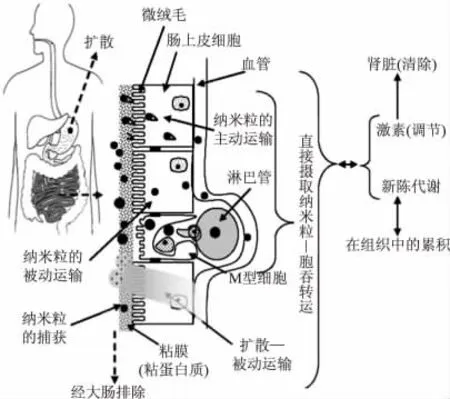
图1 活性成分在使用纳米运送系统时的摄取吸收机制示意图[9]Fig.1 Schematic of the mechanisms of active ingredient uptake using nanoparticle systems
3 纳米载体的制备方法
制备纳米载体的方法有很多,这取决于原材料的性质和载体的功能需要,总的说来,纳米载体的制备方法分成以下三类:
自上而下法(Top-down methods):又称由大到小法,是用物理方法将肉眼可见的宏观材料分割成小单元而制成载体,即由宏观物质逐步细化而成。常见方法包括喷雾干燥,蒸发冷凝,喷雾包埋,机械碾磨和均质化方法等,也可在原子力显微镜下将化学药品有序置于宏观原料上,使材料在纳米化过程中产生特有所需属性[10]。众多聚合物特性的不明朗和生产装备更新换代的不及时是此类技术发展不足的主要原因[11]。
自下而上法(Bottom-up methods):又称由小到大法,是从原子和分子出发构筑纳米结构,通过分子或者胶体颗粒自组装形成载体。主要包含结晶法、逐层沉淀、溶剂萃取/蒸发,自组装,微生物合成和生物质能反应等方法[11]。利用这种方法是在生物化合物自组装基础上设计实验,是提前设置好所需材料结构,将原材料放置在理想反应条件下,技术性操控分子自我导向和自我组装形成结构复杂的成品[10]。这样一来,虽然所需资源大大减少,但前期需要进行不同成分兼容性的研发工作[12]。而溶剂的残留问题、过程控制困难和一些脂溶性药物仍难溶于有机相等问题使得自下而上法目前并不能涉足商品化生产[13]。
综合法(Combined methods):这种方法是通过自上而下和自下而上两种方法的结合制成纳米载体的[14]。
其中,自下而上法(由小到大法)是主流技术,由于它能在原子、分子尺度上对载体的结构和性能进行设计和剪裁,所以得到的材料质量很高。
4 纳米营养运送系统中载体的种类
用于纳米营养运送系统的载体可分为天然纳米载体和人工合成纳米载体两大类,后者又可以细分为胶束,纳米脂质体,纳米乳,聚合物纳米粒。
4.1 天然纳米营养运送载体
聚合物以其多样化的机械性能,物理和化学性质和易于处理加工的特点成为缓释载体的首选材料。而自然来源的聚合物又称为生物大分子,包括各种常见高分子物质,如明胶,淀粉,丝绸和树脂等[15]。人们对营养载体的首要要求就是载体材料的安全性,正巧许多可食用多糖,蛋白质和脂质就以纳米尺寸存在,有些甚至就是天然的营养载体,因此成为功能性营养物质运送载体的首选。以牛奶中的酪蛋白为例,它在牛乳中95%以上以胶束形式存在,尺寸在100~300nm左右,具两亲性,富含钙、磷和8种人体必需氨基酸,所以在完成营养载体功能的同时还可以提供氨基酸、钙磷等营养物质。2006年,Semo等[16]应用商品酪蛋白重新组装成纳米胶束,通过内核的疏水作用成功包载了脂溶性维生素D2,实验证明其回收率是空白维生素D2的5.5倍。此外,多糖和脂质作为营养物质的纳米载体也有报道,Partanen[17]利用淀粉成功的包载了一种植物油,而Leser[18]也利用脂质体在包载香料方面取得了成功。
4.2 人工合成纳米营养运送载体
4.2.1 胶束 在水溶液中不断加入表面活性剂至溶液的界面张力趋于恒定的最低值,如果继续加入,就会形成亲水基向外、疏水基向内的表面活性剂分子缔合体,称为胶束(micelle),形成胶束的表面活性剂的最低浓度叫做临界胶束浓度(critical micelle concentration,CMC)[19]。胶束粒径小而均匀,透过性良好,可在具有渗漏性血管的组织聚集,具有天然的被动靶向作用。胶束为难溶性生物分子提供了亲脂性基团,增溶并加强其生理屏障的透过性和在生物体内的分布。而改变胶束的组成或调整亲水和疏水聚合物的长度,则能够较容易地控制胶束的各种特性。刺激敏感性胶束和配体介导性胶束等对病变区域的靶向能力更是有所增强[20]。胶束在作为治疗性和诊断性药物载体上的良好前景早已显现,但直到近几年才逐渐开始用于营养物质的包埋。目前已有柠檬油精、番茄红素、维生素E和ω-3脂肪酸在胶束载体上得到成功运输[19]。
4.2.2 纳米脂质体 纳米脂质体(liposome)是一种经疏水缔合在水中自发形成的一种分子有序组合体人工制备的携有双层包膜的纳米磷脂小囊,具有独特的双层包膜结构,构成双分子层的亲水性的头部形成膜的内表面,而亲脂性的尾部则处于膜的中间。脂质体作为功能性物质的载体具有天然无毒,高组织相容性且生物可降解的巨大优势。其中,粒径在120~200 nm之间的固体脂质体更是能够最大限度的避免网状内皮系统的清除作用,在功能性油脂产品的制备中显示出巨大的应用前景,被认为是新一代功能食品—“灵巧食品”(smart foods)[21]。作为食品工业载体,纳米脂质体仍存在稳定性不高、靶向性不明、包封率低、制备工艺复杂等问题,影响了其发挥空间,但随着新型脂质体的研发和相关工业生产技术的进步,这些问题正在逐渐被攻克解决[22]。
4.2.3 纳米乳 纳米乳(nanoemulsion)油滴分散在水相介质中且借助表面活性剂分子维持稳定的体系。液滴所具有的小体积大表面积等特性使整个分散系在长期储存期间具动力学稳定性,且不会出现任何明显的絮凝或聚结,并且可以有效增强材料的生物相容性,增加溶出率和溶解度,提高黏膜通透性[23]。不同成分、结构、功能表现的乳液完全可由市场现有商品原料(如脂质、乳化剂、纯净水)经简单步骤制备得到。再加上许多研究结果表明疏水生物活性成分的摄入与包埋粒子大小呈负相关,这都使得以纳米乳化为基础的功能性食品和药品的包埋输送系统愈加引人注目[24]。以姜黄素为例,这种天然多酚类物质具有抗氧化、抗肿瘤、消炎杀菌等大量潜在有益生物活性。但介于其极低的水相溶解度,很难作为功能性食品发挥作用。与结晶态和水相分散体系相比,乳化包埋后可以大大改善姜黄素的溶解和生物利用度[25]。食品级原料制备纳米乳液正在越来越多地运用在食品工业中,封装,保护和提供脂溶性的功能部件,如生物活性脂质(如ω-3脂肪酸,共轭亚油酸)和油溶性香精,维生素,防腐剂和营养品[26]。
4.2.4 聚合物纳米粒 与其他载体系统相比,聚合物纳米粒(polymeric nanoparticle,PNP)的种类更加繁多,缓释控释特性和环境响应性等优势更加明显。在众多的聚合物纳米载体中,基于蛋白质的纳米粒由于制备的简易性和粒径分布的可预见性而备受关注[27]。蛋白质在经过多糖、脂质或其他聚合物修饰后,其结构发生变化,通过非特异性连接或者巯基基团,达到携带多种营养物质的目的[28]。Chen[2]曾以三聚磷酸钠为离子交联剂制备出粒径100nm左右,包封率达60%,具有pH响应性和胃酸环境耐受性的壳聚糖-β-乳球蛋白纳米粒。实验结果显示,纳米粒直到到达肠道时外壳中β-乳球蛋白被胰酶降解,释放出营养物质。Anil Kumar Anal等[29]制备了粒径随pH和氯化钠浓度的变化而变化的壳聚糖-酪蛋白纳米粒,控制制备条件可以得到稳定性良好的纳米粒,在作为药物和营养载体方面具有发展潜力。
5 展望
营养物质纳米运送载体的应用已经受到人们越来越多的关注,无论是发达国家还是发展中国家都在鼓励扶持此类技术的开发研究。另外,在广受关注的食品安全方面,由于现有数据资料不足,无法全面了解纳米材料的潜在危害或食品应用风险,或者预测特定纳米材料的毒理学特性[4],因此尚未制订出权威安全评估指引[30]。Edgar Acosta 等[9]曾提出,即使成分是纯食品级的载体也并不意味着零副作用的产生。加上长期性实验项目的缺乏,纳米技术所引发的人体组织的毒性物质积累和人类生存环境的污染也开始引发担忧[31]。与此同时,注重提高载体的稳定性,控制载体的自组装行为以及靶向性,如何将营养物质完整、精确地输送到靶位置也是相关产业未来的发展方向[30]。除此之外,要想作为商业成品投放市场,消费者接受程度、纳米材料的生产成本和综合收益等因素更是有待考量。相信在不久的将来,会有更多更加精确安全的纳米载体在营养领域出现,为人类健康造福。
[1]Chen L,Remondetto G E,Subirade M.Food protein-based materials as nutraceutical delivery systems[J].Food Science &Technology,2006,17(5):272-283.
[2]Chen L,Subirade M.Chitosan/β- lactoglobulin core- shell nanoparticles as nutraceutical carriers[J].Biomaterials,2005,26(30):6041-6053.
[3]Hsieh YHP,Ofori J A.Innovation in food technology for health[J].Asia Pacific Journal of Clinical Nutrition,2007,16:65-73.
[4]Food and Agriculture Organization of the United Nations(FAO)and World Health Organization(WHO).Report of Joint FAO/WHO Expert Meeting on the Application of Nanotechnologies in the Food and Agriculture Sectors:Potential Food Safety Implications[R].2009.
[5]Sanguansri P,Augustin MA.Nanoscale materials development-a food industry perspective[J].Trends in Food Science and Technology,2006,17(10):547-56.
[6]平其能.纳米药物和纳米载体系统[J].中国新药杂志,2002,11(1):42-46.
[7]聂亚莉,徐明.纳米粒载体研究进展[J].国外医学(生物医学工程分册),2005,28(3):179-183.
[8]刘彩云,周围,毕阳,等.纳米技术在食品工业中的应用[J].食品工业科技,2005,26(4):185-187.
[9]Acosta E.Bioavailability of nanoparticles in nutrient and nutraceutical delivery[J].Current Opinion in Colloid & Interface Science,2009,14(1):3-15.
[10]Nickols-Richardson S M.Nanotechnology:Implications for Food and Nutrition Professionals[J].Journal of the American Dietetic Association,2007,107(9):1494-1497.
[11]Brody A L,Bugusu B,Han J H,et al.Innovative food packaging solutions[J].Scientific Status Summary,2008,73(8):107-117.
[12] Dupas C, Houdy P, Lahmani M.Nanoscience:Nanotechnologies and Nanophysics[M].Berlin:Springer-Verlag Berlin and Heidelberg GmbH & Co,2004:25-79.
[13]Irache JM,Esparza I,Gamazo C,et al.Nanomedicine:Novel approaches in human and veterinary therapeutics[J].Veterinary Parasitology,2011,180(1-2):47-71.
[14]Lesmes U,McClements DJ.Structure-function relationships to guide rational design and fabrication of particulate food delivery systems[J].Food Science & Technology,2009,20(10):448-457.
[15]Kasapis S,Norton I T,Ubbink J B.Dérick Rousseau.Modern Biopolymer Science-Bridging the Divide between Fundamental Treatise and Industrial Application[M].USA:Academic Press,2009:519-557.
[16]Semo E,Kesselman E,Danino D,et al.Casein micelle as a natural nano- capsular vehicle for nutraceuticals[J].Food Hydrocolloids,2007,21(2):936-942.
[17]Partanen R,Yoshii H,Kallio H,et al.Encapsulation of sea buckthorn kernel oil in modified starches[J].Journal of the American Oil Chemists’Society,2002,79(3):219-223.
[18]Leser M E,Sagalowicz L,Michel M,et al.Self-assembly of polar food lipids[J].Advances in Colloid and Interface Science,2006,123-126:125-136.
[19]陆彬.药物新剂型与新技术(第二版)[M].北京:人民卫生出版社,2005:55-56.
[20]黄健,高春生,梅兴国.胶束纳米载体在药物投送系统中的应用前景[J].国际药学研究杂志,2007,34(6):453-455.
[21]陈洪,赵元弟,魏芳,等.新型纳米脂质功能食品研究进展[J].中国农业科技导报,2011,13(5):64-72.
[22]王瑞莲,刘成梅,刘伟.食品科技脂质体在食品工业中的应用前景[J].江西食品工业,2007(2):44-45.
[23]Chen H,Khemtong C,Yang X,et al.Nanonization strategies for poorly water-soluble drugs[J].Drug Discovery Today,2011,16(7-8):354-360.
[24]Li Y,Zheng J,Xiao H,et al.Nanoemulsion-based delivery systems for poorly water-soluble bioactive compounds:Influence of formulation parameters on polymethoxyflavone crystallization[J].Food Hydrocolloids,2012,27(2):517-528.
[25]Ahmed K,Li Y,McClements DJ,et al.Nanoemulsion-and emulsion-based delivery systems for curcumin:Encapsulation and release properties[J].Food Chemistry,2012,132(2):799-807.
[26]McClements D J,Rao J.Food- Grade Nanoemulsions:Formulation,Fabrication,Properties,Performance,Biological Fate,and Potential Toxicity[J].Critical Reviews in Food Science and Nutrition,2011,51(4):285-330.
[27]MacAdam A B,Shafi Z B,James S L,et al.Preparation of hydrophobic and hydrophilic albumin microspheres and determination of surface carboxylic acid and amino residues[J].International Journal of Pharmaceutics,1997,151(1):47-55.
[28]Weyermanna J,Lochmanna D,Georgens C,et al.Albuminprotamine-oligonucleotide-nanoparticles as a new antisense delivery system.Part 2:Cellular uptake and effect[J].European Journal of Pharmaceutics and Biopharmaceutics,2005,59(3):431-438.
[29]Anal AK,Tobiassen A,Flanagan J,et al.Preparation and characterization of nanoparticles formed by chitosan-caseinate interactions[J].Colloids and Surfaces B:Biointerfaces,2008,64(1):104-110.
[30]Barlow S,Chesson A,Collins J D,et al.Scientific Opinion of the Scientific Committee on the Potential Risks Arising from Nanoscience and Nanotechnologies on Food and Feed Safety[J].The EFSA Journal,2009,958:1-39.
[31]Chau C-F,Wu S-H,Yen G-C,et al.The development of regulations for food nanotechnology[J].Trends in Food Science &Technology,2007,18(5):269-280.
