大麦发芽过程中蛋白质组的变化研究
2013-09-04刘宝祥朴永哲翟明昌郭敏利周华成赵长新
刘宝祥,朴永哲,翟明昌,董 亮,郭敏利,周华成,赵长新,*
(1.大连工业大学生物工程学院,辽宁大连116034;2.大连民族学院生命科学学院,辽宁大连116600;3.华润雪花啤酒(中国)有限公司,河北三河065201)
大麦是一种重要的粮食作物和酿造啤酒的主要原料。蛋白质是大麦的一种主要成分之一,主要分为清蛋白、球蛋白、醇溶蛋白和谷蛋白等亚组分,大麦中蛋白质对啤酒的泡沫、风味、稳定性等指标有很大的影响。其中,清蛋白和球蛋白是麦汁中蛋白质的主要来源,与麦芽质量和啤酒的泡持性、非生物稳定性有着重要关系[1]。大麦发芽之前,水分含量小于13%,一切生理活动几乎停止,大麦蛋白质处于稳定状态。大麦经浸渍后含水量迅速达到30%~35%,胚芽产生赤霉素激活糊粉层中的水解酶,使种子获得新陈代谢能力[2-3]。在蛋白酶酶系的作用下,胚乳细胞壁被分解,胚乳储存的物质开始降解并为胚轴生长提供营养[4-5]。随着发芽的进行,α-淀粉酶、纤维素酶、蛋白酶、植酸酶、β-葡聚糖酶的活力显著提高,大麦的酶量和种类大量增加,形成了麦粒中的亚组分含量变化[6]。大麦总蛋白质含量基本上保持不变,但清蛋白含量增加,球蛋白、醇溶蛋白和谷蛋白含量下降;部分高分子储藏类蛋白分解为肽和氨基酸,作为营养分泌到胚,部分用于合成新的根芽和叶芽细胞[7]。即发芽过程是大麦蛋白质不断分解与合成的过程[1,8]。这些物质变化使麦粒中的高分子物质得到一定降解,营养物质更容易溶解,有利于后期的糖化过程[9]。目前大多数研究侧重于大麦蛋白质的鉴定和功能分析,或制麦过程中热稳定蛋白和酶活力的变化,而对大麦发芽过程中的蛋白质组的变化研究报道较少[7,10-12]。发芽过程是麦粒中各类酶系及其存贮蛋白质和淀粉发生作用的统一体,发芽进程的正常与否取决于大麦中酶系及其蛋白质能否适度的溶解。双向电泳技术是蛋白质组学的有力工具,是目前可以在一块凝胶上显示上千种蛋白质的方法,对于研究大麦蛋白质组具有无可比拟的优势。本实验利用双向电泳监测大麦发芽过程中水溶蛋白质组的变化,进一步明确大麦发芽过程中蛋白质组的变化规律,为麦芽制造和大麦发芽生理的研究提供一定理论依据。
1 材料与方法
1.1 材料与仪器
大麦品种:Schooner,澳大利亚产,经精选机精选的Ι级大麦,水分:10.9%,千粒重:43.0g,发芽率99%,蛋白质含量10.8% 中粮麦芽(大连)有限公司惠赠;蛋白质提取过程所用试剂为优级纯,其余步骤为分析纯,所用水均为双蒸水。
多功能电泳仪 北京六一厂;Binta 2020D凝胶成像系统 BINTA;PDQuest8.0分析软件 Biorad公司。
1.2 实验方法
1.2.1 麦芽制备及蛋白质提取 取100g大麦浸麦30h(湿浸6h→干浸16h→湿浸5h→干浸3h),浸麦度达到45%。发芽过程模拟箱式发芽,麦层温度16~18℃,相对湿度 90%,发芽开始记为 0h,发芽共96h,定时取样10g,真空干燥后,液氮研磨提取蛋白质。
水溶蛋白质组的提取和裂解采用缓冲液苯酚法,Bradford 法测定蛋白质浓度后分装[13],置于-80℃冰箱备用[14]。
1.2.2 双向电泳
1.2.2.1 胶条制作 在翟明昌的方法[15]基础上略加改进:取0.6g尿素,540μL双蒸水,200μL 30%丙烯酰胺溶液,pH4~6 载体两性电解质24μL,pH3~10 载体两性电解质溶液4.8μL,轻缓混匀后依次加入5μL 10%过硫酸铵和4μL TEMED。混匀后快速吸取100μL上述混合液,从玻璃管(直径1mm,长10cm)的一端缓慢均匀灌入,注胶量保证每根胶长度为7cm,室温聚合1h。
1.2.2.2 等电聚焦及电泳 阴极电泳缓冲液:20mmol/L NaOH 150mL,阳极电泳缓冲液:10mmol/L磷酸200mL。
电泳条件:接通电源,室温下200V恒压电泳30min,500V恒压电泳30min,1350V恒压电泳4h。
等点聚焦结束后将胶条从玻璃管中均匀挤出,在 0.05mol/L Tris-HCl(pH8.8)、30%(W/V)甘油、2.3%(W/V)SDS、6mmol/L尿素的平衡缓冲液中平衡30min,转移至12%分离凝胶,20mA恒流电泳。所得到的凝胶进行“Blue Silver”考马斯亮蓝染色,双蒸水脱色[16]。
1.2.4 凝胶图像分析 通过Binta 2020D型凝胶成像系统进行拍照,PDQuest 8.0软件进行分析。
2 结果与分析
2.1 大麦发芽过程中水溶蛋白质含量变化
大麦发芽过程中就其总氮而言是不变化的,但其蛋白亚组分(清蛋白,球蛋白、醇溶蛋白和谷蛋白)含量在发芽前后发生显著变化,麦粒充分吸水后胚内产生的赤霉素诱导糊粉层中的淀粉酶、蛋白酶等各种水解酶及天冬氨酸转氨酶等合成酶的激活和生成[7,10]。反映在水溶蛋白质含量上仍然是增加的,这也有利于糖化过程的蛋白质溶出[2-3]。
图1可见,随着发芽进行,水溶性蛋白质含量逐渐上升,发芽48h达到最高峰,发芽结束时略有下降。实验也证实经过发芽,水溶蛋白质含量是增加的,但发芽过程中大麦水溶蛋白质含量不是一直升高的过程:前期主要是大麦吸水、酶系重新合成和蛋白质降解的过程,水溶蛋白质含量下降,可见,这一阶段主要以蛋白质的降解为主[5];随着发芽的进行,酶系的不断作用,部分醇溶蛋白残基形成交联变为水溶,同时还会新合成一些水溶蛋白,使得蛋白质含量显著上升,发芽48h水溶性蛋白达到最高峰[17];最后,由于酶活力的增加,蛋白质继续降解,一些水溶性蛋白质输送至根芽,麦粒中水溶性蛋白质含量略有下降[6]。总体来看,发芽后绿麦芽水溶蛋白质含量高于未发芽大麦。

图1 大麦发芽过程中水溶蛋白质含量的变化Fig.1 Changes of barley content during the malting process
2.2 双向电泳解析
有研究表明大麦的水溶性蛋白质大部分为酶蛋白,所以水溶性蛋白质组的变化在一定程度上可以反映酶本身变化和其催化的结果[18]。大麦发芽过程中水溶蛋白质双向电泳图谱如图2(A~E)所示,运用Pdquest 8.0 软件分析,分别有 804、549、547、572、450、476个蛋白质斑点。大麦在发芽过程中有379种蛋白质的浓度降低或消失,同时77种蛋白质随着发芽进行,新增或浓度升高。这些蛋白质很大一部分具有一定功能的糖类和蛋白质的降解酶、各种代谢酶,以及抗菌和自身排异的蛋白质类[10]。
图2(A)白框区域1、2分别放大为图3~图4,结合图2分析,在大麦发芽的浸麦阶段图2(A~B),小分子蛋白质的降解消失尤其明显;浸麦阶段大麦迅速吸水后,胚产生激素激活糊粉层重新合成水解酶系[5],水溶小分子蛋白质最先受到酶的水解作用或参与合成体系,为胚乳中营养物质的降解提供内在条件。发芽0~24h图2(B~C),降解和新合成的蛋白质数量基本相等,但蛋白质总数量上在这一阶段基本无变化。24~48h图2(C~D),新产生的蛋白质明显增加,高于蛋白质的降解,表现为蛋白质组总数量的增加和2.1中发芽48h,水溶性蛋白质含量达到最高峰。48~72h图2(D~E)主要表现为蛋白质的降解和丰度减小,表明此时酶活力已经达到最大,几乎没有新蛋白质产生。72~96h图2(E~F),蛋白质种类变化很小,蛋白质仍然有降解但种类上已经趋于稳定。

图2 大麦发芽过程中水溶蛋白质双向图谱Fig.2 Changes of barley proteome during the malting process

图3 区域1蛋白质发芽过程中的变化Fig.3 Changes of barley proteome(area 1)during the malting process
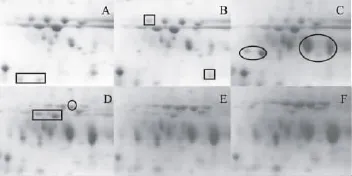
图4 区域2蛋白质发芽过程中的变化Fig.4 Changes of barley proteome(area 2)during the malting process
3 结论
3.1 通过研究大麦发芽过程中的水溶蛋白质组变化,表明大麦发芽不仅仅是蛋白质的降解过程:从种类上看,大麦中的802种水溶蛋白质,只有少于424种蛋白质能保留下来,超过379种蛋白质降解消失或丰度降低,有77种新蛋白质产生;水溶蛋白质含量上看,最终蛋白质含量高于大麦,说明发芽可以促进大麦的溶解,增加大麦蛋白质的水溶性,有利于大麦在糖化过程的溶解。综合上述蛋白质组变化表明:浸麦阶段主要是蛋白质的降解过程;发芽初始阶段蛋白质的降解和合成转化是一个逐渐趋于平衡的过程;到达发芽后期蛋白质的变化基本趋于平衡。
3.2 本文运用双向电泳检测大麦发芽过程中水溶蛋白质的变化,从水溶蛋白质组的层面探究了大麦发芽的生理变化过程。通过每24h取样,对大麦发芽过程蛋白质组的变化有一个比较直观、全面的认识,为下一步蛋白质鉴定奠定基础。
[1]管敦仪.啤酒工业手册[M].北京:中国轻工业出版社,2007:17-18.
[2]Bewley J D.Seed germination and dormancy[J].Plant Cell,1997,9(7):1055-1066.
[3]Zentella R,Yamauchi D,Ho T D.Molecular dissection of the gibberellin/abscisic acid signaling pathways by transiently expressed RNA interference in barley aleurone cells[J].Plant Cell,2002,14(9):2289-2301.
[4]Fincher G B.Molecular and cellular biology associated with endosperm mobilization in geminating cereal grain[J].Annual Review of Plant Physiology and Plant Molecular Biology,1989,40:305-346.
[5]Christine Finnie,Birgit Andersen,Azar Shahpiri,et al.Proteomes of the barley aleurone layer:A model system for plant signalling and protein secretion[J].Proteomics,2011,11:1595-1605.
[6]张善飞,成建国,董亮,等.外源添加肌醇对大麦发芽过程中一些水解酶活力的影响[J].麦类作物学报,2012,32(3):465-468.
[7]朱玉魁,李琳,刘国琴,等.大麦发芽后蛋白质含量及其酶活力变化与麦芽品质的关系[J].河南工业大学学报:自然科学版,2008,29(5):22-25.
[8]顾国贤.酿造酒工艺学[M].北京:中国轻工业出版社,2008:62-72.
[9]Bamforth C W,Barclay A H P.Malting technology and the uses of malt[J].American Association of Cereal Chemists Inc,1993:297-354.
[10]Kristian Sass Bak- Jensen,Sabrina Laugesen,Peter Roepstorff,et al.Two-dimensional gel electrophoresis pattern(pH 6-11)and identification of water-soluble barley seed and malt proteins by mass spectrometry[J].Proteomics,2004,4:728-742.
[11]孙俊,张天雪,孙丽华,等.大麦发芽过程中热稳定蛋白质的变化及部分生化特性[J].大连工业大学学报,2008,27(7):223-227.
[12]管斌,李珊,荀娟,等.啤酒大麦制麦过程中淀粉酶活性变化动态的研究[J].食品工业科技,2009,30(7):148-154.
[13]Marion M bradford.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein- dye binding[J].Analytical Biochemistry,1976,72:248-254.
[14]夏先锋,朴永哲,沈海萍,等.大麦和麦芽水溶性蛋白提取方案的优化及双向电泳图谱的建立[J].食品科技,2012,37(7):260-264.
[15]翟明昌,朴永哲,王祥余,等.混菌发酵中不同分子量代谢产物对非酿酒酵母胞内蛋白及酒体有机酸的影响[J].微生物学通报,2011,38(9):1443-1448.
[16]Giovanni Candiano,Maurizio Bruschi,Luca Musante,et al.Blue silver:A very sensitive colloidal Coomassie G-250 staining for proteome analysis[J].Electrophoresis,2004,25:1327-1333.
[17]Inge Celus,Kristof Brijs,Jan A Delcour.The effects of malting and mashing on barley protein extractability[J].Journal of Cereal Science,2006,44:203-211.
[18]李秀琳,李晓军,董亮,等.高蛋白含量大麦发芽过程中蛋白质组分及其含量变化分析[J].中国粮油学报,2009,24(10):98-102.
