茉莉酸甲酯处理对软枣猕猴桃生理生化变化的影响
2013-12-06胡文忠姜爱丽刘程惠田密霞
胡文忠,姜爱丽,蔡 慧,马 杰,刘程惠,田密霞
(1.大连民族学院生命科学学院,辽宁大连116600;2.吉林农业大学园艺学院,吉林长春 130118;3.甘肃农业大学食品科学与工程学院,甘肃兰州730070)
茉莉酸类物质(Jasmonates,JAS)广泛存在于自然界中,是植物天然合成的信号分子,在植物发育和果实成熟过程中发挥着重要的作用,作为植物中介导生物和非生物胁迫反应的一类信号分子,此类物质现已发现30余种。其中主要典型代表物质是茉莉酸(Jasmonic acid,JA)和茉莉酸甲酯(Methyle Jasmonate,MeJA),JA/MeJA在植物防御反应中的作用得到了人们的广泛关注。大量的研究结果表明,茉莉酸类物质处理能够诱导增强多种果实的抗冷性,减轻果实采后冷害的发生,提高果实采后贮藏保鲜效果,例如,茉莉酸类物质处理能够诱导增强芒果[1]、木瓜[2]、桃[3]、番石榴[4]、枇杷[5]等多种果实的抗冷性,减轻果实采后冷害的发生,提高果实采后贮藏保鲜效果。目前,人们对MeJA提高植物抗逆性的机理了解尚不足,MeJA对软枣猕猴桃的影响至今未见报道。本实验以软枣猕猴桃为实验试材,研究了不同浓度的MeJA处理对软枣猕猴桃果实生理生化变化的影响,以期为MeJA在软枣猕猴桃中的应用提供理论依据。
1 材料与方法
1.1 材料与仪器
供试材料 为软枣猕猴桃,品种“丰绿”,于2011年8月底采自中国农业科学院特产研究所软枣猕猴桃园,选择果面新鲜且无机械损伤,无病虫害,成熟度、颜色、大小基本一致的果实做实验试材,采后在3℃条件下预冷24h。
PL203型精密电子天平 梅特勒-托利多仪器上海有限公司;Lamda-25型紫外可见分光光度计 美国PE;GC-2010型气相色谱仪 日本岛津公司;SIMF140型制冰机 日本三洋;BR4i型台式高速冷冻离心机、T-25型匀浆器 德国IKA;FHM-1型果实硬度计、PAL-1型便携式速显糖度计 日本京都电子公司。
1.2 实验处理与方法
贮藏前分别用浓度为0.15mmol/L和0.3mmol/L的MeJA溶液浸泡果实,以清水浸果为对照。浸泡15min后随机放入保鲜盒后用保鲜膜封装,每盒约250g。放置于(1±1)℃冷库中进行贮藏。每隔7d测定一次各项生理指标,其中第0d在预冷24h后取样测定,各项指标重复测定3次。
1.3 测定方法
1.3.1 果实硬度的测定 采用FHM-1型果实硬度计测定果实的硬度。
1.3.2 可溶性固形物含量测定 用便携式速显糖度计测定。
1.3.3 VC含量测定 2,6-二氯靛酚法[6]。
1.3.4 呼吸强度的测定 将样品放入已知体积的塑料密闭容器中,在室温下(20℃)放置1h,用1mL注射器从中取出1mL气体进行测定,呼吸强度用mL CO2/kg·h表示。测定呼吸强度的色谱条件:1.8m×0.25mm填充柱,热传导检测器(TCD),载气为氦气,流速3mL/min,进样口和检测器温度均为120℃,柱温保持在35℃。
1.3.5 PPO、POD活性测定 提取液的制备取5g去皮果肉,加0.1g PVPP于40mL 0.2mol/L磷酸缓冲液(pH=6.4)中,冰浴研磨,4℃冰冻离心机10000×g离心30min,取上清液为酶的粗提液,用于测定POD和PPO活性。
PPO活性测定参照Galeazzi等[7]的方法,并加以改进:将0.1mL粗酶提取液加入到3mL 0.5mol/L的邻苯二酚溶液(用0.2mol/L pH=6.4的磷酸缓冲液配成)中。加酶液后5s开始扫描30s内398nm处吸光值变化,反应温度为25℃,酶活力单位U以△OD398nm·min-1·g-1FW表示,重复3次。
POD活性测定按照Jiang等[8]的方法,稍作修改:将0.5mL粗酶提取液加入2mL 0.1%mol/L愈创木酚(用0.2mol/L pH=6.4的磷酸缓冲液配成)中,在30℃恒温水浴锅中平衡5min,然后加1mL 0.08%H2O2(用0.2mol/L pH=6.4的磷酸缓冲液配成)混匀,1min后扫描1min内460nm处吸光值变化,酶活力单位U以△OD460nm·min-1·g-1FW表示,重复3次。
1.3.6 CAT活性测定 参照Acbi法[9]并修改。取10g果肉,加入1mL预冷的pH7.5 0.05mol/L的磷酸缓冲液(内含50mmol/L二硫苏糖醇和1%PVPP)在冰浴中研成匀浆,10000×g 4℃下离心20min,收集上清液立即用于CAT酶活测定。CAT反应体系包括粗酶液100μL和3mL 20mmol/L H2O2,以蒸馏水作参比。在240nm处测定2min时的样品吸光度值。样品重复3次,CAT酶活性以△OD240nm·min-1·g-1FW表示。
1.3.7 LOX活性测定 参照Cherif[10]的方法,2.7mL 0.2mol/L的磷酸缓冲液中加入0.2mL 0.5%的亚油酸钠溶液(含0.25%的吐温20),然后加入0.1ml酶液(酶液与PPO酶液相同),5s后扫描混合物在234nm下吸光度的变化,酶活性以△OD234nm·min-1·g-1FW表示,重复3次。
1.4 数据处理与分析
实验数据采用Excel软件对实验数据进行统计分析并作图,用DPS软件进行方差分析和F检验,多重比较采用Duncan新复极差法进行测验。显著水平取p<0.05(差异显著)或p<0.01(差异极显著)。
2 结果与分析
2.1 硬度的变化
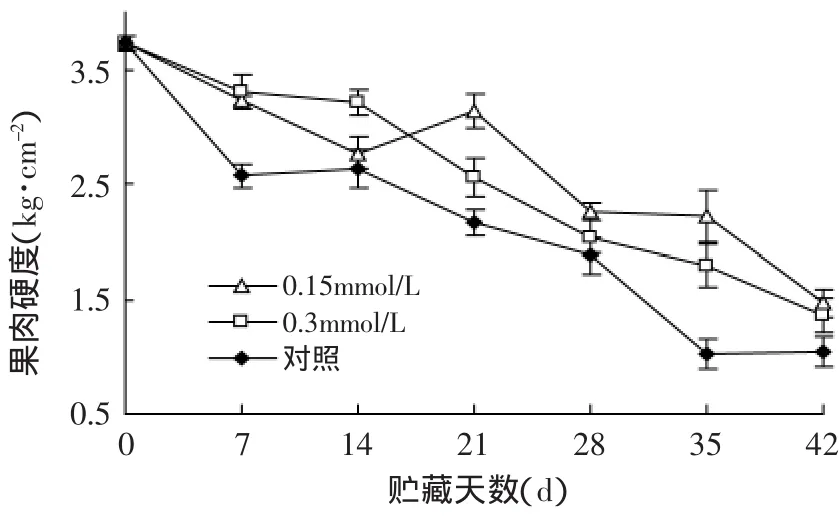
图1 MeJA处理对软枣猕猴桃果肉硬度活性的影响Fig.1 Effect of methyl jasmonate treatments on firmness of Actinidia arguta
硬度能够直接反映出果实软化的程度,与果实可贮性有着密切的联系。如图1所示,果实硬度呈下降趋势,在贮藏期内,MeJA处理的果实硬度始终高于对照,差异达到显著水平(p<0.05),尽管14d前0.3mmol/L MeJA处理的果实硬度高于0.15mmol/L MeJA处理,但总体上来看,还是0.15mmol/L MeJA处理效果最好,对保持软枣猕猴桃果实硬度最有效,可以有效的抑制果实软化进程。
2.2 可溶性固形物的变化
可溶性固形物含量(SSC)高的果实虽然具有较高可食度但其耐贮性较差。可溶性固形物含量低的果实尚不具有可食性,但其具有较高的硬度,比较耐贮藏。本实验中,不同浓度MeJA处理及对照果实的可溶性固形物含量随着贮藏期的延长,均呈明显上升趋势(见图2)。其中以0.15mmol/L MeJA处理果实的可溶性固形物上升趋势最为缓和,且其含量在贮藏过程中一直低于其他处理,与对照相比,除28d差异不显著外,可溶性固形物含量均显著低于对照(p<0.05)。这表明MeJA处理抑制了软枣猕猴桃果实可溶性固形物含量的升高,0.15mmol/L MeJA处理效果最好。
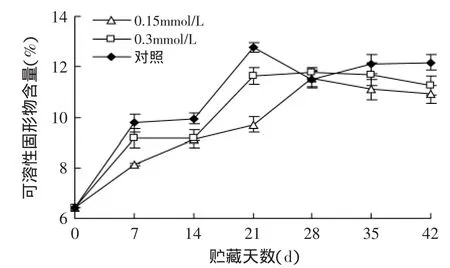
图2 MeJA处理对软枣猕猴桃果实可溶性固形物含量的影响Fig.2 Effect of methyl jasmonate treatments on soluble solids content of Actinidia arguta
2.3 VC含量的变化
经过MeJA处理的软枣猕猴桃果实贮藏中维生素C含量呈反复上升和下降的趋势,由图3可知,不同处理果的维生素C含量在最初7d内上升,随后下降,其中对照果维生素C含量下降速率最快,在贮藏末期,维生素C含量显著低于同期的0.15mmol/L和0.3mmol/L MeJA处理(p<0.05),两种浓度的MeJA处理间差异不显著。由此可见,刚刚采收后的软枣猕猴桃,体内继续合成一些营养物质,为将来的生理代谢活动做储备。随着贮藏时间的延长,果实的生理代谢活动逐渐增强,加快衰老进程,其中维生素C作为抗氧化剂不断被分解氧化。而在贮藏过程中0.15mmol/L和0.3mmol/L MeJA处理的果实中维生素C的含量始终高于对照处理,说明MeJA处理可以抑制果实中维生素C含量的流失,使果实中的维生素C含量始终维持在一个较高的水平。所以MeJA处理有利于保持软枣猕猴桃果实中的维生素C含量。
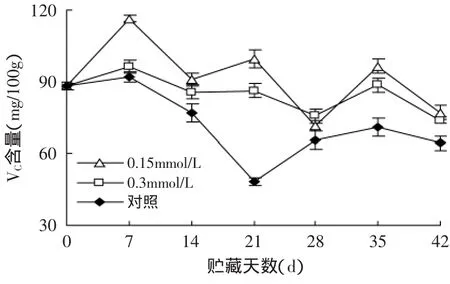
图3 MeJA处理对软枣猕猴桃果实VC含量的影响Fig.3 Effect of methyl jasmonate treatments on Ascorbic acid of Actinidia arguta
2.4 呼吸强度的变化
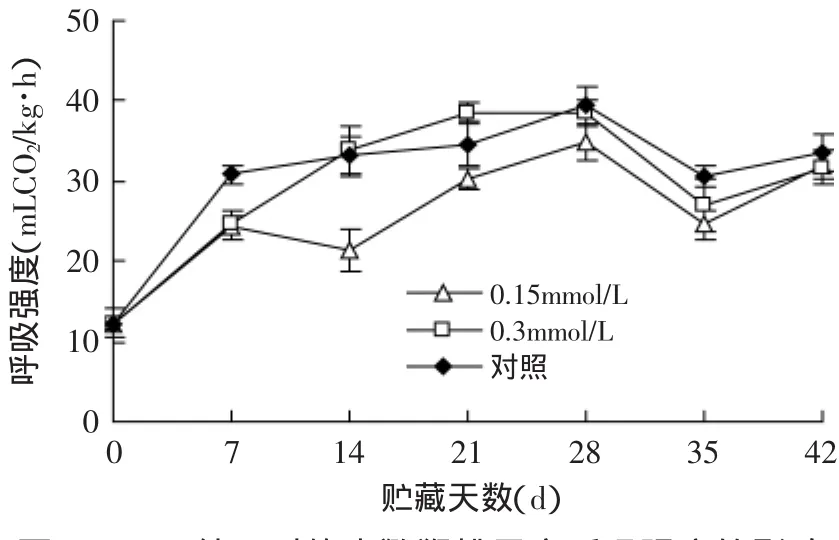
图4 MeJA处理对软枣猕猴桃果实呼吸强度的影响Fig.4 Effect of methyl jasmonate treatments on respiratory density of Actinidia arguta
如图4所示,软枣猕猴桃的呼吸强度呈峰值变化,其在28d呼吸强度达到最大值。在28d时对照处理的呼吸强度最高,0.3mmol/L MeJA处理的次之,0.15mmol/L MeJA处理的呼吸强度最低。在整个贮藏过程中,除42d未达到显著水平外,0.15mmol/L MeJA处理的呼吸强度始终显著低于对照组(p<0.05)。在贮藏过程中软枣猕猴桃果实呼吸强度的增加会加速其营养物质的消耗,使其品质下降,加速其组织的衰老进程。在本实验中,MeJA处理能有效的抑制软枣猕猴桃的呼吸强度,其中0.15mmol/L MeJA处理效果最为明显。
2.5 PPO活性的变化
多酚氧化酶(PPO)是植物中广泛存在的催化酚类物质氧化的酶类[11],在有氧情况下作用于酚类物质,使酚类物质形成醌,再进行一系列脱水—聚合反应,最后形成黑褐色物质产生酶促褐变[12]。通常认为多酚氧化酶是能够引起果蔬产品采后褐变最主要的酶,PPO活性的增加是果实内部组织开始衰老后的普遍反应,是水果和蔬菜组织褐变的主要原因,使果蔬颜色发生变化,影响其品质[13]。贮藏前期各处理的PPO活性均上升,在7d达到峰值后迅速下降(图5)。21d后继续上升,在28d 0.15mmol/L处理组和对照组再次达到峰值,而0.3mmol/L处理组则在35d达到峰值。在整个贮藏过程中,经MeJA处理的软枣猕猴桃PPO活性总体上略低于对照处理,差异不大,说明MeJA处理对软枣猕猴桃果实中PPO活性的影响不大。
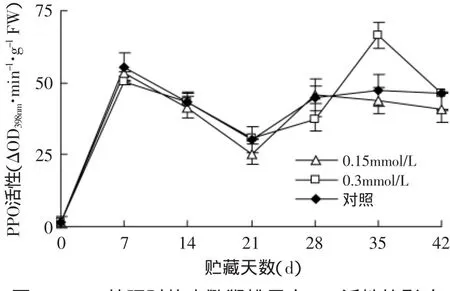
图5 MeJA处理对软枣猕猴桃果实PPO活性的影响Fig.5 Effect of methyl jasmonate treatments on PPO activity of Actinidia arguta
2.6 POD活性的变化
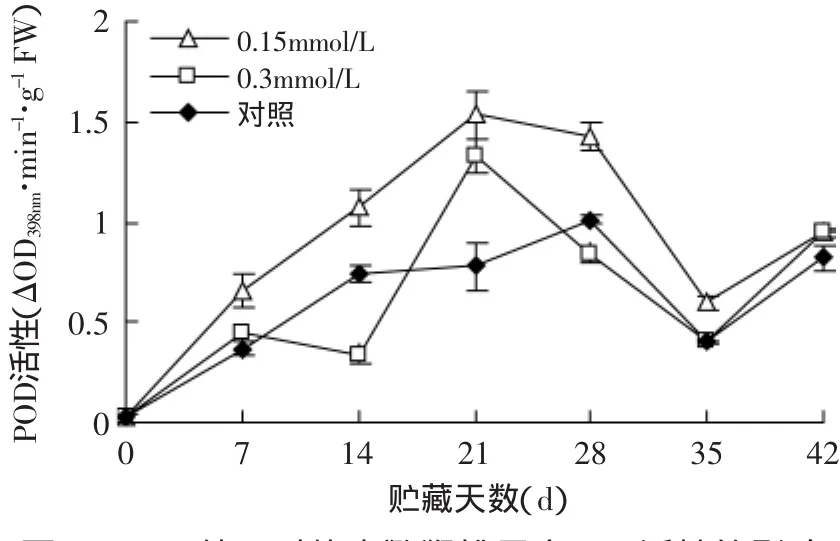
图6 MeJA处理对软枣猕猴桃果实POD活性的影响Fig.6 Effect of methyl jasmonate treatments on POD activity of Actinidia arguta
过氧化物酶(POD)是植物在逆境条件下酶促防御系统的关键酶,它也是细胞内清除活性氧的保护酶,其可避免活性氧在植物体内的产生和积累,是体内自由基维持在一个正常的动态水平。在贮藏过程中,POD活性呈先上升后下降再回升趋势(见图6)。果实在衰老过程中,H2O2作为POD的主要底物,低浓度H2O2可提高POD的活性,高浓度则抑制POD活性[14]。POD活性的下降可能是由于随着贮藏时间的延长,H2O2浓度积累从而抑制了其活性。从图6中可以看出,两种浓度的MeJA处理均在第0~21d出现上升趋势且在第21d达到最大值,之后下降,经0.3mmol/L MeJA处理的果实的POD活性低于0.15mmol/L,对照组POD最大值出现在28d,说明MeJA处理提前了POD活性高峰值的出现。在整个贮藏过程中,0.15mol/L MeJA处理的POD活性过程中均显著高于对照(p<0.05),其有效地增加了果实组织中POD的活性。
2.7 CAT活性的变化

图7 MeJA处理对软枣猕猴桃果实CAT活性的影响Fig.7 Effect of methyl jasmonate treatments on CAT activity of Actinidia arguta
过氧化氢酶(CAT)属于血红蛋白酶,含有铁,它能催化植物体内积累的过氧化氢(H2O2)分解为水和分子氧,从而减少H2O2对果蔬组织可能造成的氧化伤害。在CAT催化H2O2分解为水和分子氧的过程中,该酶起电子传递作用,而H2O2既是氧化剂又是还原剂[15]。CAT活性与植物的抗逆性和耐贮性有着密切的关系。各处理下软枣猕猴桃果实CAT活性变化如图7所示,两种浓度的MeJA处理的CAT活性除28、35d外,均高于对照。此实验结果表明,MeJA对CAT可维持较高的活性。
2.8 LOX活性的变化
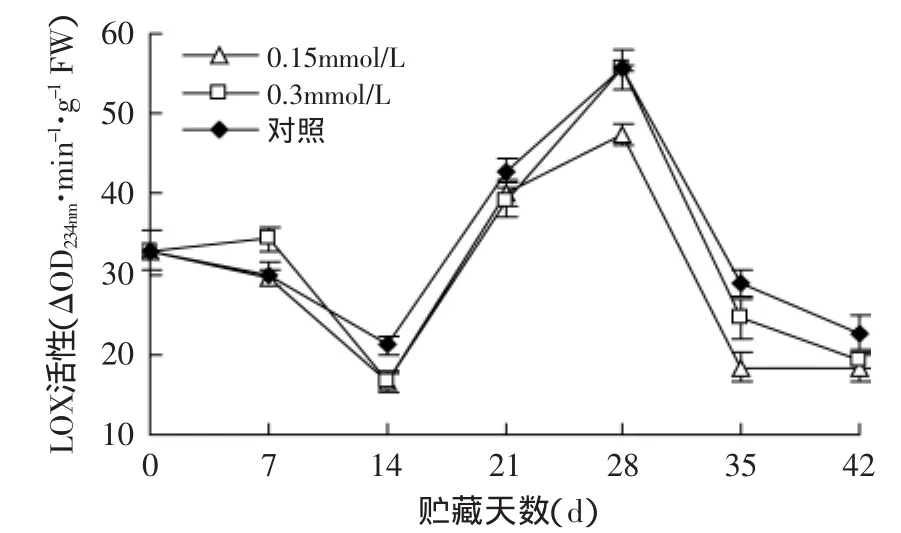
图8 MeJA处理对软枣猕猴桃果实LOX活性的影响Fig.8 Effect of methyl jasmonate treatments on LOX activity of Actinidia arguta
由图8可以看出,软枣猕猴桃果实在贮藏期间各处理的LOX活性呈峰值变化,高峰出现在贮后28d,MeJA处理及对照在快速衰老前均出现了活性高峰,说明此酶与果实软化衰老的启动有关。14~28d,LOX活性增加的原因可能是果实对衰老反应的影响,总体来看,经MeJA处理的LOX活性低于对照,MeJA处理可以抑制LOX活性,减缓软枣猕猴桃衰老进程。
3 讨论与结论
本实验研究结果表明,不同浓度茉莉酸甲酯处理,能够有效的降低软枣猕猴桃的呼吸强度,抑制硬度的下降和可溶性固形物的增加。冯磊等[16]对采用茉莉酸甲酯处理对冷藏水蜜桃品质的研究结果表明采用1μmol/L MeJA处理可以显著的抑制维生素C含量的下降,从而保持了果实的营养品质。本实验与之得出的结论一致,采用茉莉酸甲酯处理可以有效地减缓维生素C的流失。
低温贮藏能够延缓园艺产品采后后熟、抑制病原菌生长和保持品质,但低温贮藏时很容易产生冷害,丧失商业价值。大量的研究结果表明,茉莉酸类物质处理能够诱导增强芒果、木瓜、桃、番石榴、枇杷等多种果实的抗冷性,减轻果实采后冷害的发生,提高果实采后贮藏保鲜效果。膜系统的破坏使原本存在的多酚氧化酶(PPO)和酶类底物相结合,促进组织内部的酶促褐变[17],而MeJA处理对膜系统起到保护作用,可能在一定程度上抑制了果肉的褐变症状。在本实验中,经0.15mmol/L MeJA处理的软枣猕猴桃果实PPO活性也得到了很好的抑制。此外研究还发现茉莉酸类物质能够提高抗性相关酶系的活性,从而提高果实的抗性。植物中含有抗氧化酶等抗氧化系统[18]中以CAT、POD为主要的抗氧化酶。韩晋和田世平[19]研究发现MeJA处理可以提高黄瓜组织中的CAT活性,有效的增强软枣猕猴桃果实组织的抗性。本实验研究与韩晋和田世平的研究一致,CAT活性得到有效的提高。在本实验中,MeJA处理还可以诱导POD活性的增加,这一结论与Yao H J等[20]对采后甜樱桃施加MeJA处理可以显著提高果实中防御反应酶(POD)活性的结论相一致。
综上所述,采后采用浓度为0.15mmol/L的MeJA溶液浸果15min结合低温贮藏(1±1)℃贮藏软枣猕猴桃,在保持果实的良好品质,延缓果实的衰老上有较好的效果。
[1]Gonzalez-Aguilar G A,Fortiz J,Gruz R,et al.Methy jasmonate reduces chilling injury and maintains postharvest quality of mango fruit[J].Joural of Agricultural and Food Chemistry,2000,48:515-519.
[2]Gonzalez-Aguilar G A,Buta J G,Wang C Y.Methy jasmonate and modified atmosphere packaging(MAP) reduce decay and maintain postharvest quality of papaya ‘Sunrise’[J].Postharvest Biology and Techology,2003,28:361-370.
[3]Feng L,Zheng Y H,Zhang Y F,et al.Methy jasmonate reduces chilling injury and maintains postharvest quality in peaches[J].Agricultural Sciences in China,2003(2):1246-1252.
[4]Gonzalez-Aguilar G A,Tiznado-Hernandez M E,Zavaleta-Gatica R,et al.Methy jasmonate treatments reduce chilling injury and activate the defense response of guava fruits[J].Biochemical and Biophysical Research Communications,2004,313:694-701.
[5]Cao S F,Zheng Y H,Yang Z F,et al.Effect of methy jasmonate on the inhibition of Colletotrichum acutatum infection in loquat fruit and the possible mechanisms[J].Postharvest Biology and Techology,2008,49(2):301-307.
[6]韩雅珊.食品化学实验指导[M].北京:中国农业大学出版社,1999:26-77.
[7]Galeazzi M A,Sgarbieri V C,Constantinides S M.Isolation,purification and physiochemical characterization of polyphenoloxidases(PPO) from a dwarf variety of banana(Musa cavendishii L.)[J].Journal of Food Science,1981,46(1):150-155.
[8]Jiang A L,Tian S P,Xu Y.Effect of CA with high-O2or high-CO2concentrations on postharvest physiology and storability of sweet cherry[J].Acta Botanic Sinica,2002,44(8):925-930.
[9]Acbi H.Catalase in vitro[J].Methods Enzymol,1984,105:121-126.
[10]Cherif M Y.Effect of oxygen concentration on plant growth,lipidperoxidation,and receptivity of tomato roots to Pythium F underhydroponicconditions[J].European JournalofPlant Pathology,1997,103(3):255-264.
[11]Constable C P,Ryan C A.A survey of wound and methyl jasmonateinduced leafpolyphnoloxidasein crop plants.Phytochemistry,1998,47(4):507-511.
[12]郑仕宏,周文化,李忠海,等.鲜切砂梨加工技术的研究[J].食品与机械,2006,22(6):66-68.
[13]Thipyapong P,Steffens J C.Tomato Polyphenol Oxidase(Differential Response of the Polyphenol Oxidase F Promoter to Injuries and Wound Signals)[J].Plant Physiology,1997,115(2):409-418.
[14]Burnette F S.Peroxidase and its relationship to food flavor and quality:a review[J].J Food Sci,1977,42:1-5.
[15]刘冰,梁婵娟.生物过氧化氢酶研究进展[J].中国农学通报,2005,21(5):223-224.
[16]冯磊,郑永华,汪峰,等.茉莉酸甲酯处理对冷藏水蜜桃品质的影响[J].食品科学,2003,24(9):135-139.
[17]Jiang Y M,Duan X W,Daryl J,et al.Advances in understanding of enzymatic browning in harvested litchi fruit[J].Food Chemistry,2004,88:443-446.
[18]Blokhina O, Virolainen E, Fagerstedt K V.Antioxidants,oxidative damage and oxygen deprivation stress:a review[J].Annal of Botany,2003,91:179-194.
[19]韩晋,田世平.外源茉莉酸甲酯对黄瓜采后冷害及生理生化的影响[J].园艺学报,33(2):289-293.
[20]Yao H J,Tian S P.Effects of pre-and post-harvest application of salicylic acid or methyl jasmonate on inducing disease resistance of sweet cherry fruit in storage[J].Postharvest Biology and Thechnology,2005,35:253-262.
