介孔活性炭的制备及其高湿储甲烷性能
2013-12-06刘秀伍金淑明段中余
刘秀伍,王 亮,金淑明,段中余,孙 艳
(1. 河北工业大学化工学院,天津 300130;2. 天津大学化工学院,天津 300072)
随着全球的经济发展和人口增长,能源危机和环境污染日益成为两个最受关注的热点.煤和石油一直是能源的主要来源,随着这些不可再生性资源的日渐匮乏,迫使人们寻找新能源和可再生能源.天然气作为一种清洁能源,由于储量丰富、价格便宜,在21世纪中国能源结构中将占更大的份额[1].全球常规天然气的储量为3.274×1015,m3,预计可以消耗60,a,而近年来勘探的天然气水合物的储量是常规甲烷储量的2.6 倍[2-3].因此,天然气的使用年限会大大延长,是公认的近期未来主要能源之一,是一种可靠的汽车燃料和氢燃料的替代品.天然气的主要成份甲烷常温(25,℃)下是气体,密度仅为0.656,g/dm3,作为汽车代用燃料以及从天然气开采地到各用户单位之间的运输,就需要有效的存储技术.天然气的存储和运输,是实现天然气利用的重要前提,一般用气的工业城市和企业与气源距离较远,采取什么运输方式将天然气安全地输送给用户,是一个非常重要的问题[4].
目前运输存储方式有:管道运输、压缩天然气(CNG)、液化天然气(LNG)、吸附天然气(ANG)、天然气水合物(NGH).管道运输安全性能高,输送产品的质量有保证,对环境污染小,但初始投资大,只有大规模气量陆地运输才具有经济价值,对于中小气田和零散用户非常不经济;CNG 是将常规天然气加压到16~25,MPa 进行存储,此时CNG 的密度为常压常温下的200 多倍,如20,MPa 下CNG 的能源密度约为汽油的30%,其需要许多耐压设备、多级压缩设备,造成总成本高、安全性差[5-6].LNG 是将甲烷液化并存储于常压低温储罐,能量密度为汽油的72%.其设备投资大,液化成本高,主要应用于大规模海上储运[7-8].ANG 是容器中加入多孔性的吸附剂,常温3.5,MPa 时,ANG 可达150,V/V,存在能量密度低、吸附热效应大、天然气杂质组分对储气容量有影响等问题[9-12].降低甲烷存储成本的有效方法是降低存储压力,而天然气水合物(NGH)已经引起了学者们的广泛关注.NGH 法甲烷储量可以达到164,V/V,而存储压力只有CNG(天然气压缩存储)的一半,存储成本降低26%[13-18].
甲烷水合物晶体可以在特定的温度和压力下形成,但在纯水中生成速率缓慢,水合物实际储量远低于理论值,因此水合物储气需要解决如何快速形成达到理论储量的气体水合物.将水合物在多孔介质孔道内生成是提高天然气储气密度的有效途径,因多孔材料具有丰富的表面积而为水和天然气提供了良好的气液接触场所,使得水合物的生成速率大大提高,并且在不需搅拌的情况下就可以大量生成水合物[19-22].前期关于湿储甲烷的研究表明,当孔径小于1,nm 时并不能增强甲烷水合物的吸附,多孔材料的孔径最好在2~5,nm 范围,材质以非极性碳材料为最佳,以合成的介孔碳分子筛CMK-3 为湿储甲烷介质,达到41%(质量分数)的甲烷存储密度,但合成介孔碳分子筛CMK-3 的成本太高,不宜工业应用[23-27].通过积累制备活性炭的经验,发现细胞组织粗糙的植物原料易于活化出介孔,所以本实验以廉价的农业废弃物玉米芯为原料,采用KOH 化学活化法制备高性能介孔活性炭,并进行湿储甲烷研究.
1 实 验
1.1 活性炭制备
在氮气氛下由室温程序升温到400,℃,加入玉米芯原料恒温30,min 之后冷却至室温,得到炭化料,然后按照一定比例与KOH 饱和水溶液混合,搅拌均匀,于100,℃干燥12,h,在氮气保护下由室温程序升温到800~900,℃恒温60~120,min.用去离子水洗至中性,在120,℃下烘干得到活性炭.
1.2 活性炭表征
N2吸附等温线采用体积法在77,K 的温度下测量得到,相对压力的测量范围为10-6~0.995.样品测量前在473,K 真空氛下脱除气体12,h.比表面积用BET 方法计算,孔容以吸附等温线在相对压力0.95时的吸附量来计算;孔径分布以吸附等温线用局部密度函数方法计算.热重分析仪采用日本岛津公司生产,型号为TA-50,分析条件为:氮气作载气,氮气流量为20,mL/min,升温速率为10,℃/min,由室温升温到800,℃.
1.3 湿储甲烷
样品首先在300,℃的真空下干燥12,h,而后在干燥的样品中加入适量的去离子水.所得湿样品放到高压吸附装置上,采用体积法测得甲烷吸附曲线.高压吸附装置的实验原理如图1 所示[25-27].采用Keller公司生产的PAA-23/8465.1-200 仪器来测量压力.参比槽的体积采用滴定法测量,吸附槽的体积用He 在tr温度下计算得到.tr温度偏差为±0.05,℃,td为±0.1,℃.测量中使用的气体He 和CH4的纯度都高于99.995%.测量过程中温度保持在275,K,压力范围为0~11,MPa.测量前冷却到-20,℃系统抽真空.

图1 甲烷及甲烷水合物曲线测定装置Fig.1 Apparatus of collecting the methane and methane hydrate isotherms
2 结果与讨论
2.1 活性炭合成的影响因素
以玉米芯为原料,KOH 活化法制备活性炭必须经过炭化、活化2 个关键步骤,因而本研究首先对玉米芯原料进行热重分析,依据其结果来确定炭化的温度和时间,之后分析活化温度、活化时间、碱炭质量比对活性炭性能参数的影响.
2.1.1 炭化温度及时间的确定
炭化过程在惰性气氛中进行,实质是原料中有机物热解(热分解反应和缩聚反应)的过程.原材料经过热分解放出挥发组分而变成炭化产物,得到适宜于活化的初始孔隙和具有一定机械强度的炭化料.为了确定玉米芯进行炭化的温度和时间,对其进行热重分析,其结果如图2 所示.

图2 玉米芯TGA-DTA曲线Fig.2 TGA-DTA curves of corncobs
由图2 可以看出,在20~100,℃玉米芯原料的失重是由其原料所含水分的损失所致;在100~220,℃的范围内原料质量基本没有变化,说明在这个温度范围内原料水分已经在100,℃基本脱除完毕,此温度区间原料没有任何变化;在220~400,℃温度范围内,玉米芯剧烈失重,这是由于在这个温度范围内原料发生热分解反应和缩聚反应,碳元素以外的物质(氢、氧等)以气体的形态被除去,碳元素中的一部分也以CO2和CO 的形式释放出去,在335,℃失重速率达到最大值.当温度高于400,℃后,失重速率变化缓慢,反应结束,炭化温度为 400,℃时原料失重率为66.7%.
在400,℃炭化30,min 后得到的炭化产物失重率为68.5%,这与400,℃时原料的失重率66.7%接近,表明经过30,min 的炭化时间可使原料充分炭化.所以选择炭化温度为400,℃,炭化时间为30,min.
2.1.2 活化温度和时间的影响
较低活化温度使活化反应进行缓慢,如活化温度低于钾金属的沸点762,℃,钾金属不能以气态形式穿透石墨微晶层片而形成新的微孔,使活性炭微孔不能充分发展.活化温度过高,活化反应速度过快,使孔壁面被烧穿而形成大孔甚至坍塌.因此以活化时间均为1,h,碱炭质量比为3,考察750,℃、800,℃、850,℃、900,℃、950,℃活化温度对活性炭性能的影响,其结果如图3 所示.
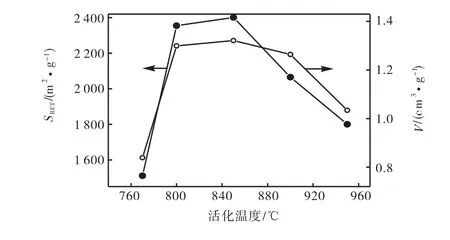
图3 活化温度对活性炭比表面积和孔容的影响Fig.3 Effect of activation temperature on surface area and pore volume of activated carbons
由图3 可知,750,℃活化的比表面积SBET和孔容V 最小,而850,℃活化得到的活性炭比表面积和孔容最高,比表面积达到最大值2 401,m2/g,孔容为1.321,cm3/g.其原因在于新的孔结构形成和先前产生孔的结构破坏是同步进行的.温度低于850,℃时,随着活化温度的提高,活化反应速度加快,产生大量的孔,即生成新孔速度起决定作用.当活化温度超过850,℃后,破坏先前生成孔的速度逐步变得明显,从而引起活化产物的比表面积和孔容下降.850,℃活化温度是化学活化法的最佳活化温度,并且温度的控制对孔隙结构的影响较大.
2.1.3 活化时间的影响
活化时间也是影响活性炭性能的重要因素之一,活化时间过短不能使活化剂KOH 与炭化料充分反应,因此孔结构不能完全发展;活化时间过长,会使活化初期形成的孔被烧穿,从而降低了活性炭比表面积和微孔容.在活化温度为800,℃,碱炭质量比为3 时,不同的活化时间制备的活性炭的比表面积变化情况如图4 所示.由图中可以看出随着活化时间的增长,活性炭的比表面积增大,当活化时间为1.5,h 时,比表面积和孔容最大,之后随着活化时间的增长反而减小.
2.1.4 碱炭质量比的影响KOH 与炭化料的混合比例对活性炭性能影响尤为显著.一般碱炭混合比例越高,活性炭比表面积和孔容就越高.KOH 与炭化料混合比例很低时,由于活化剂含量太少,炭化料不能被充分活化,开创出的孔隙就会比较少.增大KOH 含量,就会有充足的活化剂参加反应,从而可形成发达孔结构,使活性炭的比表面积和孔容显著提高.

图4 活化时间对活性炭比表面积和孔容的影响Fig.4 Effect of activation time on surface area and pore volume of activated carbons
在活化温度为800,℃,活化时间为1,h 的条件下,不同的碱炭质量比制备的活性炭的比表面积和孔容变化情况如图5 所示.由图5 可知活性炭比表面积随碱炭比的增加呈先增大后减小的趋势,当碱炭比为4.5 时,活性炭的比表面积最大.而孔容则随碱炭比的增大而增加.当碱炭比较低时,炭化料不能够被充分活化,开创出的孔隙较少,使其比表面积和孔容增大;碱量较多时,则会继续和炭反应而造成部分孔壁消失,使孔变大孔容增加,但比表面积减小.
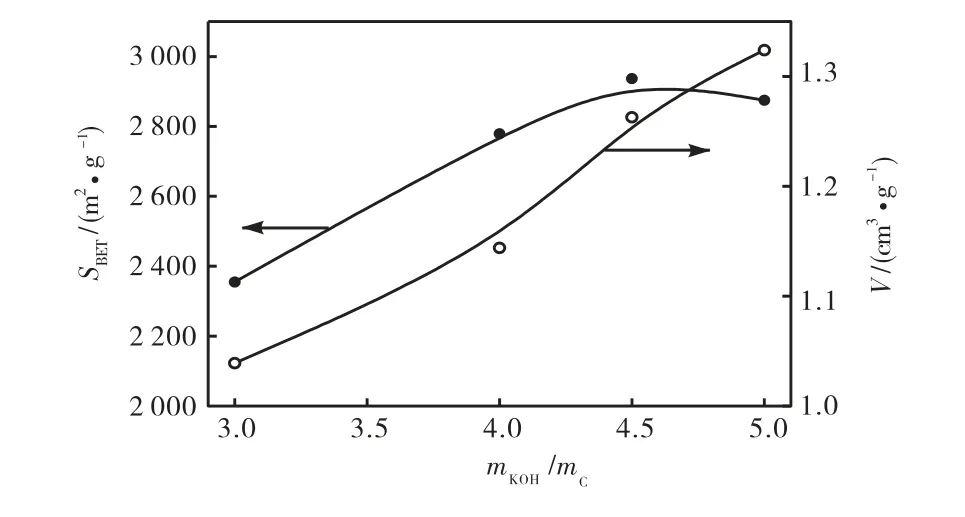
图5 碱炭质量比对活性炭比表面积和孔容的影响Fig.5 Effect of chemical ratio on surface area and pore volume of activated carbons
活性炭表面同时受到活化温度、活化时间和碱炭比的影响,它们之间有着很强的交互作用.当活化温度和碱炭比较低时,活化反应速度较低,需要较长活化时间才能使微孔充分发展;而在较高活化温度和碱炭比下,较短活化时间即可形成发达的微孔结构.不同碱炭比、活化温度,对应的适宜活化时间也不同.为了找出活性炭制备的最优条件,又对控制不同碱炭比(4.0、4.5、5.0)、活化温度(800,℃或850,℃)、活化时间(1.0,h 或1.5,h)进行实验,结果如表1 所示.
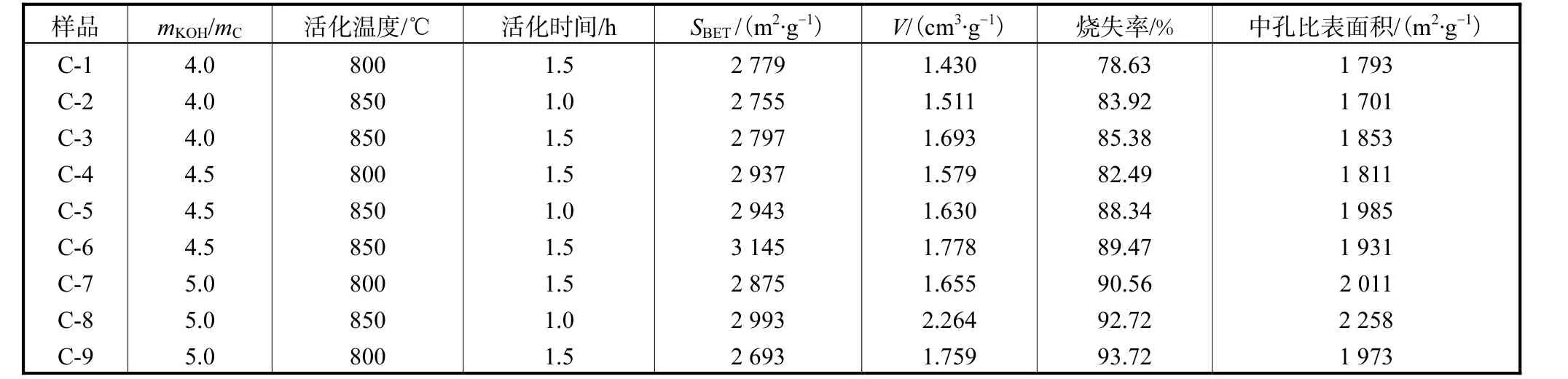
表1 活性炭样品的活化条件与性能参数Tab.1 Activation conditions with KOH and properties of carbons produced
从表1 中可以看出,表中各个条件下合成的活性炭都有非常高的比表面积和孔容,在碱炭比 4.5、850,℃活化1.5,h 合成的C-6 活性炭比表面积最大,达到3 145,m2/g,孔容为1.778,cm3/g.在碱炭比5、850,℃活化1.0,h 合成的C-8 活性炭孔容最大,达到2.264,cm3/g,比表面积为2 993,m2/g.由于下面需要对介孔内湿储甲烷进行研究,孔容大在孔内能够生成更多的甲烷水合物,因此选用C-8 活性炭作为湿储甲烷的吸附剂,其77,K 氮气吸附等温线和孔径分布图如图6和图7所示.从图7 中可以看出C-8活性炭的孔径大部分在2~3,nm 之间,是非常适合甲烷气体水合物生成的.本实验合成活性炭介孔所占比例较大的原因可能是由于原料玉米芯的组织结构疏松,从而比较容易活化出介孔结构.
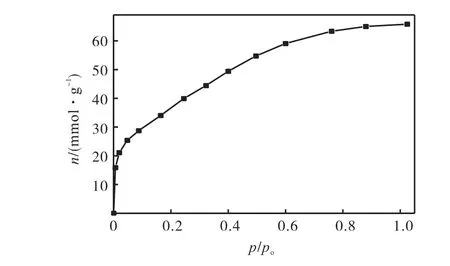
图6 活性炭在77 K对N2的吸附等温线Fig.6 N2 adsorption isotherm at 77,K on C-8,activated carbon

图7 C-8活性炭孔径分布Fig.7 Pore size distribution of C-8 activated carbon
2.2 湿储甲烷研究
2.2.1 在预吸附不同水量的C-8 活性炭CH4存储
在C-8 活性炭上预吸附不同质量的水,所得的样品分别在275,K 下吸附CH4,得到的吸附曲线如图8所示.CH4的平衡吸附量用质量分数表示,即每100,g 干燥的C-8 活性炭上吸附CH4的克数.样品中的含水量用水炭比Rw表示,代表水与干燥C-8 活性炭的质量比.
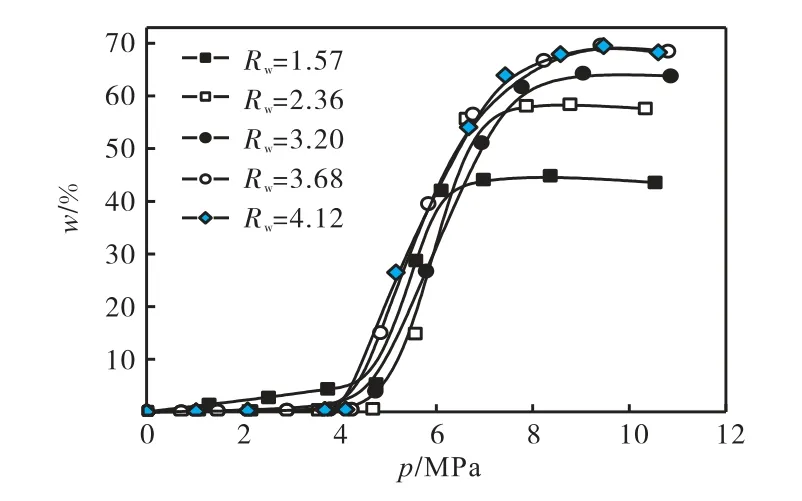
图8 不同预吸附水量C-8活性炭甲烷吸入等温线Fig.8 Methane sorption isotherms on C-8 sample with presorbed various water amounts
与前面相关研究相比,预吸附水的C-8 活性炭对CH4储量更高,在Rw=3.86 时CH4在C-8 活性炭上的最大吸附量比CMK-3 储量高135%[23].当预吸附水量增加时,CH4吸附量增加且平衡时间也随之延长,如在Rw=4.13 时每个点的平衡时间比Rw=1.84时长了几个小时.比较不同水炭比的吸入等温线,CH4的最大吸附量分别是44.85%、58.42%、64.31%、69.66%和69.51%,此时预吸附的水和CH4的摩尔比分别为3.11、3.59、4.42、4.70 和5.27.因而在此条件下不同水炭比甲烷与水关系式可以写为CH4·3.11H2O、CH4·3.59H2O 、 CH4·4.42H2O 、 CH4·4.70H2O 和CH4·5.27H2O,H2O 和CH4的摩尔比是随Rw增加而增加的,但都小于5.75,其原因可能是首先水在孔内形成笼型结构吸入甲烷,由于C-8 活性炭的孔径大部分在 2~3,nm 之间,而Ⅰ型甲烷水合物为边长1.2,nm 的立方体结构,因而在水形成笼型结构后吸入甲烷后,孔内仍有未充满的剩余孔空间可依靠吸附作用来吸入甲烷,结果使活性炭对甲烷的吸入量增大,是吸附和水合物共同作用的结果,因而造成甲烷吸入量比形成Ⅰ型水合物理论值大.另外,与其他预吸附水量甲烷吸入等温线相比,Rw=1.57 的甲烷吸入曲线上都出现了一个特殊的现象,即在吸附量达到突变前,甲烷的吸入量大于其他曲线甲烷吸附量,这是因为预吸入的水量小于活性炭的孔容(其他预吸入水量大于活性炭孔容),所以造成部分未被水填充的孔内可以吸附甲烷,致使达到水合物生成压力前其甲烷吸入量比其他曲线高.
与相同条件下干活性炭吸附甲烷相比,预吸附水的湿活性炭有更大的甲烷吸入量,其比较结果如图9所示.按照IUPAC 的分类,干燥C-8 样品上的吸附曲线属于Ⅰ型,在 9.03,MPa 下最大吸附量为21.44%.当样品预吸附水后,在某一个特定的压力下CH4吸附量会突然增加.当Rw增加时,突增发生点的压力减小但吸附量却随之增加.但是当压力小于突增点压力时,预吸附水的样品的CH4吸附量要小于干燥样品的吸附量.这种现象与先前研究结果相同,说明在这个压力下开始在C-8 活性炭的孔道中生成甲烷水合物.当Rw=3.68 时,在9.40,MPa 下CH4达到最大吸附量69.66%,是其干燥样品最大吸附量的3.25 倍.
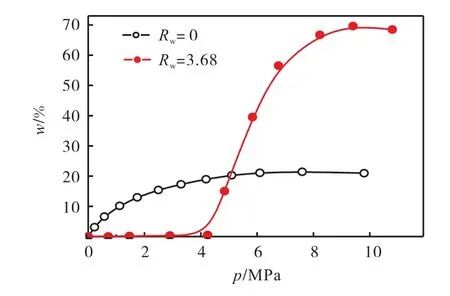
图9 预吸附水前后C-8活性炭甲烷吸入曲线Fig.9 Methane sorption isotherms for C-8 sample with and without presorbed water
2.2.2 预吸附水的C-8 活性炭上的甲烷生成和分解
为了研究甲烷水合物在C-8 活性炭上的生成和分解性质,笔者测量了275,K 下Rw=3.68 的CH4吸入-解析曲线,实验结果如图10 所示.

图10 275,K预吸附水C-8活性炭甲烷吸入-解析曲线(Rw=3.68)Fig.10 Methane sorption and desorption isotherms for C-8 sample with Rw=3.68 at 275,K
由图10 可知吸入与解析曲线并不重合,而是呈现出一个明显的滞回,因而甲烷水合物的生成压力与分解压力是不同的.在吸入分支上CH4吸附量的突变点(4.8,MPa)下甲烷吸入量急剧上升,而在脱附分支上在3.0,MPa 的压力下,CH4吸附量急剧下降.由于C-8 活性炭甲烷吸入-解析的这种特性和高吸附量,当这种材料用在燃料汽车上吸附存储时,可在较大压力范围内使存储的甲烷提供平稳的放气量.
3 结 论
(1) 合成适合甲烷湿储活性炭的最优条件是:在400,℃炭化30,min,碱炭质量比5∶1、850,℃活化1.0,h 合成高性能活性炭,孔容达到2.264,cm3/g,比表面积为2 993,m2/g,孔径主要分布在2~3,nm 之间.
(2) 合成的C-8 是非常好的甲烷湿储吸附剂,其Rw=3.68 时在9.40,MPa 下CH4达到最大吸附量69.66%,是其干燥样品最大吸附量的3.25 倍,并可在较大压力范围内使存储的甲烷提供平稳的放气量,有望作为新型甲烷水合物存储吸附剂应用于天然气汽车上.
[1]Li J C,Dong X C,Jian X,et al. Forecasting the growth of China’s natural gas consumption[J]. Energy,2011,36(3):1380-1385.
[2]Makogon Y F,Holditch S A,Makogon T Y. Natural gas-hydrates:A potential energy source for the 21st century[J]. J Petrol Sci Eng,2007,56(1/2/3):14-31.
[3]Makogon Y F. Natural gas hydrates:A promising source of energy[J]. J Nat Gas Sci Eng,2010,2(1):49-59.
[4]Helena P,Zárante B. Evaluating carbon emissions reduction by use of natural gas as engine fuel[J]. J Nat Gas Chem Eng,2009,1(6):216-220.
[5]Nikolaou M. Optimizing the logistics of compressed natural gas transportation by marine vessels[J]. J Nat Gas Chem Eng,2010,2(1):1-20.
[6]Beronich E L,Abdi M A,Hawboldt K A. Prediction of natural gas behaviour in loading and unloading operations of marine CNG transportation systems[J]. J Nat Gas Chem Eng,2009,1(1/2):31-38.
[7]Miana M,Hoyo R D,Rodrigálvarez V,et al. Calculation models for prediction of liquefied natural gas(LNG)ageing during ship transportation[J]. Applied Energy,2010,87(5):1687-1700.
[8]Lin W S,Zhang N,Gu A Z. LNG(liquefied natural gas):A necessary part in China’s future energy infrastructure[J]. Energy,2010,35:4383-4391.
[9]Blanco A A G,Oliveira J C A,López R,et al. Study of the pore size distribution for activated carbon monoliths and their relationship with the storage of methane and hydrogen , colloids and surfaces A :Physicochem[J]. Eng Aspects,2010,357:74-83.
[10]Ji S,Min J,Young S L. Effects of fluorination modification on pore size controlled electrospun activated carbon fibers for high capacity methane storage[J]. Journal of Colloid and Interface Science,2009,339:31-35.
[11]Rios R B,Bastos-Neto M,Amora M R Jr,et al. Experimental analysis of the efficiency on charge/discharge cycles in natural gas storage by adsorption[J]. Fuel,2011,90(1):113-119.
[12]Hirata S C,Couto P,Lara L G.,et al. Modeling and hybrid simulation of slow discharge process of adsorbed methane tanks[J]. International Journal of Thermal Sciences,2009,48:1176-1183.
[13]Gudmundsson J S,Børrehaug A. Natural gas hydrate:An alternative to liquified natural gas[J]. Petroleum Review,1996,50:232-235.
[14]Javanmardi J,Nasrifar K H,Najibi S H,et al. Economic evaluation of natural gas hydrate as an alternative for natural gas transportation[J]. Appl Therm Eng,2005,25(11/12):1708-1723.
[15]Gbaruko B C,Igwe J C,Gbaruko P N,et al. Economic evaluation of natural gas hydrate as an alternative for natural gas transportation,gas hydrates and clathrates:Flow assurance,environmental and economic perspectives and the Nigerian liquified natural gas project[J]. J Petrol Sci Eng,2007,56(1/2/3):192-198.
[16]Abdalla B K,Abdullatef N A. Simulation and economic evaluation of natural gas hydrates [NGH] as an alternative to liquefied natural gas [LNG] [J]. Catal Today,2005,106(1/2/3/4):256-258.
[17]Hao W F,Wang J Q,Fan S S,et al. Evaluation and analysis method for natural gas hydrate storage and transportation processes[J]. Energy Conver Manage,2008,49(10):2546-2553.
[18]Kim N J,Lee J H,Cho Y S,et al. Formation enhancement of methane hydrate for natural gas transport and storage [J]. Energy,2010,35(6):2717-2722.
[19]Buffett B A,Zatsepina O Y. Formation of gas hydrate from dissolved gas in natural porous media[J]. Marine Geology,2000,164(1/2):69-77.
[20]Najibi H,Chapoy A,Tohidi B. Methane/natural gas storage and delivered capacity for activated carbons in dry and wet conditions[J]. Fuel,2008,87(1):7-13.
[21]Al-Asheh S,Banat F,Lattieff F. Sorptive storage of natural gas onto dry and wet phillipsite:Study of dynamics,storage and delivery[J]. Appl Therm Eng,2010,30(14/15):2257-2263.
[22]Chen Q,Liu C L,Ye Y G. Experimental study on geochemical characteristic of methane hydrate formed in porous media[J]. J Nat Gas Chem,2009,18(2):217-221.
[23]Liu X W,Zhou L,Li J W,et al. Methane sorption on ordered mesoporous carbon in the presence of water[J].Carbon,2006,44:1386-1392.
[24]Liu X W,Zhou L,Chang H,et al. Methane sorption on large-pore MCM-41 in the presence of water[J]. J Porous Media,2006,9(8):769-777.
[25]Zhou L,Liu X W,Sun Y,et al. Methane sorption in ordered mesoporous silica SBA-15 in the presence of water[J]. J Phys Chem B,2005,109:22710-22714.
[26]周亚平,周 理. 超临界氢在活性炭上的吸附等温线研究[J]. 物理化学学报,1997,13(2):119-127.Zhou Yaping,Zhou Li. Study on the adsorption isotherms of supercritical hydrogen on activated carbon[J].Acta Physico-Chimica Sinica , 1997 , 13(2): 119-127(in Chinese).
[27]周 理,周亚平. 关于氢在活性炭上高压吸附特性的实验研究[J]. 中国科学:B 辑,1996,26(5):473-480.Zhou Li,Zhou Yaping. Experimental study for the high pressure adsorption properties of hydrogen on activated carbon[J]. Science in China :Series B,1996,26(5):473-480(in Chinese).
