Ag-Cu2O复合薄膜的制备及其光催化活性
2013-12-05魏守强
史 敬, 魏守强
(沈阳理工大学环境与化学工程学院,辽宁沈阳 110159)
引 言
近年来,半导体光催化技术得到了快速的发展。在该领域的研究中,TiO2因其光催化能力强,无毒,且简便易得,成本低廉,一直受到人们的高度关注[1-5]。但由于其禁带宽度较宽(3.2eV),只能吸收波长较短的紫外光,太阳光的利用效率很低。Cu2O作为窄禁带半导体光催化剂的一种(2.0eV),因其响应波长范围在可见光区而倍受青睐。但是由于其导带上的光生电子(e-)和价带上的空穴(h+)复合率较高,导致其光催化活性较低。通过半导体复合[6-7]和贵金属修饰[8-9]等手段可以改善其光催化活性。
由于Ag相对价廉易得,毒性小且具有杀菌作用,因此利用Ag改性提高半导体光催化活性对于水中有机污染物的去除具有重要的现实意义。Ag修饰Cu2O的方法主要包括电子束辐射法[8]和电沉积法[9]。本文以导电玻璃为基体,通过阴极电化学反应首先在其表面上沉积出Cu2O薄膜,再以AgNO3溶液为Ag源,通过简单浸渍的手段,制备Ag-Cu2O复合薄膜,并以光催化降解甲基橙为探针反应考察其光催化活性。
1 实验部分
1.1 实验材料
实验所用的乙酸铜、乙酸钠、硝酸银和甲基橙(国药化学试剂有限公司)均为分析纯试剂,未经进一步处理直接使用;溶液用蒸馏水配制。
1.2 薄膜制备
以99.99%纯铜板为阳极,以2cm×5cm透明导电玻璃(ITO)为阴极(使用前经乙醇和蒸馏水洗涤),两电极间距2cm,用HDV-7C型恒电位仪(福建三明市无线电二厂)控制 Jκ在0.2A/dm2,电解液组成为0.016 mol/L乙酸铜和0.1mol/L乙酸钠,用乙酸调节溶液pH至5.8,θ控制在60℃,在磁力搅拌器搅拌下反应2min,得到导电玻璃基 Cu2O薄膜。
将制备的Cu2O薄膜置于0.2mol/L的AgNO3溶液中,控制浸渍 t分别1、3、5和10min,即得到不同Ag含量的Ag-Cu2O薄膜。
1.3 薄膜表征
实验采用日本理学D/max-rB型X-射线衍射仪(XRD)分析样品的物相,辐射源为 CuK,管压为40kV,管流为 100mA,步长为 0.02°,扫描速度为8°/min。采用日立S3400扫描电子显微镜(SEM)观察样品的表面形貌,用配套的能谱仪(EDS)分析薄膜成分。采用723PC型分光光度计测吸光度(上海光谱有限公司)。
1.4 光催化性能测试
光催化实验在d为2.5cm×8.0cm的圆柱形石英玻璃管中进行。待处理溶液为15mL,其中甲基橙质量浓度为10mg/L。将有效使用A为4cm2的薄膜置于靠近器壁处的待处理溶液中。以300W金属卤化灯作为模拟自然光源,光源与薄膜间的l为10cm;光催化反应过程中每隔 10min取样,用723PC型分光光度计测定样品469.5nm处的吸光度。根据比尔-朗伯定律计算出相应时刻反应溶液中甲基橙的浓度。甲基橙的降解率按照下式计算:

式中:η为降解率,%;A0为处理前溶液吸光度;A为处理t时间后溶液吸光度。
2 结果与讨论
2.1 薄膜的表征
图1为以乙酸铜和乙酸钠溶液为电解液,在导电玻璃基体上电沉积制备的薄膜,在AgNO3溶液中浸渍3min后的XRD谱图。
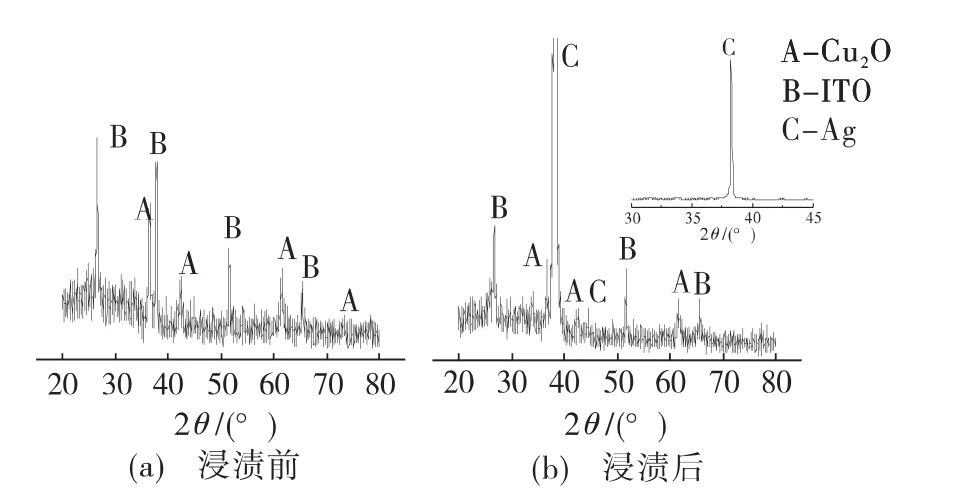
图1 Cu2O薄膜在AgNO3溶液中的XRD谱图
由图1(a)可知,得到的沉积物确实为Cu2O而无杂质相Cu的生成。其原因在于所使用的电流密度较低,不能将Cu2+还原为Cu。Cu2O的生成反应可表示为:
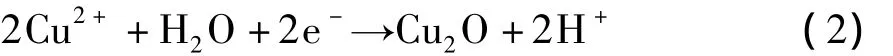
从图1(b)中可以观察到,除来自基体和沉积在上面的Cu2O的衍射峰外,还有明显的银物相特征峰。这表明,Cu2O薄膜表面在AgNO3溶液中浸渍后有金属Ag生成。由于Cu2+/Cu+和Ag+/Ag氧化还原电对的电极电势分别为 0.153和 0.799V,Cu2O表面的Cu+可以将溶液中的Ag+还原为Ag,而自身被氧化为Cu2+。相应的反应可表示为:
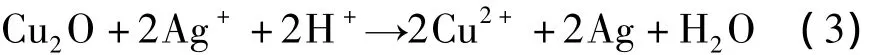
Cu2O和Ag-Cu2O薄膜的表面形貌由图2所示。

图2 薄膜的SEM照片
由图2(a)中可以看出,电沉积制备的Cu2O薄膜表面由许多细小的颗粒聚集而成,较为平整光滑,这样的结构可能不利于Cu2O薄膜作为催化剂时对反应物的吸附。由图2(b)可以看出,经Ag修饰后的Cu2O薄膜(浸渍3min),其表面出现大量的丝状结构,这可能是Ag在Cu2O表面的覆盖所致。这种结构的优势在于既可以改善Cu2O薄膜的吸附能力,又不会因为Ag的覆盖而严重影响其对入射光的吸收。表1给出了Ag-Cu2O薄膜中Ag质量分数的EDS分析结果。由表1可知,元素Ag确实存在于Cu2O表面,而且随着Cu2O在AgNO3溶液中浸渍时间的延长而增加。

表1 浸渍时间对Ag-Cu2O薄膜中Ag的影响
2.2 薄膜的光催化活性
图3给出了分别以Cu2O和Ag-Cu2O[w(Ag)为1.83%]为催化剂时,甲基橙的浓度随光照时间的变化情况(其中c0和c分别为甲基橙的起始和处理t时间后的浓度)。为便于比较,图3中同时给出了甲基橙在Ag-Cu2O上的暗态吸附数据。

图3 甲基橙在Cu2O和Ag-Cu2O薄膜上的光催化降解
由图3可以看出,当单一的Cu2O用作光催化剂时,反应10min后,甲基橙的浓度仅有轻微的降低,然后几乎保持不变。这表明Cu2O薄膜对甲基橙的吸附能力十分有限,几乎没有任何的光催化活性。Cu2O薄膜弱的吸附能力可能与其相对平整光滑的表面结构有关,而低的光催化活性可归因于其对甲基橙微弱的吸附能力和光生电子-空穴对的易于复合,且后者更为关键[10]。图3所示结果同时表明,对于Ag修饰后的Cu2O(即Ag-Cu2O)薄膜,其对甲基橙的吸附能力有了一定的提高,并且对甲基橙的降解显示出较高的光催化活性。Ag的修饰使Cu2O表面变成丝状结构,活性点的增加改善了其对甲基橙的吸附,有利于后续甲基橙的降解反应;更重要的原因,光生电子可以由Cu2O的导带向Ag转移[11-12],使光生电子-空穴对得以分离,降低了其复合几率,相应的电荷转移过程可表示为:


转移至Ag上的电子与Ag表面的吸附氧反应生成O2-·、HO2·以及OH·等活性氧物种,这些活性氧物种和Cu2O体内的空穴均可以氧化降解吸附的甲基橙,从而显示出较高的光催化活性。
2.3 Ag对Ag-Cu2O薄膜光催化活性的影响
图4为改变Cu2O在AgNO3溶液中的浸渍时间所得到的不同Ag质量分数的Ag-Cu2O薄膜对甲基橙的暗态吸附和光催化降解效果的比较,吸附和反应t均为60min。由图4可以看出,当Ag的质量分数由1.06%增加到22.46%时,薄膜对甲基橙的吸附去除率由3%增加到15%,表明薄膜的吸附能力也相应增强;而催化活性是先增加,在Ag的质量分数为1.83%时达到最高,之后随着Ag质量分数的增加而降低。Ag-Cu2O薄膜中Ag质量分数增加,吸附的甲基橙分子就越多,越有利于甲基橙的降解,但Ag质量分数过高,不利于底层Cu2O对入射光的吸收,同时过量的Ag也会成为光生电子和空穴的复合中心[13],从而导致Ag-Cu2O薄膜的光催化活性降低。

图4 w(Ag)对Ag-Cu2O薄膜暗态吸附性能和光催化活性的影响
3 结论
采用阴极电沉积法在导电玻璃上制备Cu2O,随后以AgNO3溶液为Ag源,通过浸渍步骤成功制备出Ag-Cu2O复合薄膜。和单一的Cu2O相比,Ag-Cu2O显示出较强的吸附能力和较高的光催化活性。Ag-Cu2O的吸附能力和光催化活性与Ag-Cu2O薄膜中Ag的质量分数有关,在所研究的Ag质量分数范围内,w(Ag)为1.83%时光催化活性最高。
[1] Fujishima A,Rao T N,Tryk D A.Titanium dioxide photocatalysis[J].J.Photochem.Photobiol.C:Photochem.Rev.,2000,(1):1-21.
[2] Arconada N,Duran A,Suarez S,et al.Synthesis and photocatalytic properties of dense and porous TiO2-anatase thin films prepared by sol-gel[J].Appl.Catal.,B:Environ.,2009,86:1-7.
[3] Liao D L,Badour C A,Liao B Q.Preparation of nanosized TiO2/ZnO composite catalyst and itsn photocatalytic activity for degradation of methyl orange[J].Journal of Photochemistry and Photobiology A:Chemistry,2008,194(1):11-19.
[4] 施利毅,古宏晨,李春忠,等.TiO2-SnO2复合光催化剂制备和性能[J].催化学报,1999,20(3):338-342.
[5] Ismail A A.Synthesis and characterization of Y2O3/Fe2O3/TiO2nanoparticles by sol-gel method[J].Appl.Catal.B:Environ.,2005,(5):115-121.
[6] Han C,Li Z,Shen J.Photocatalytic degradation of dodecyl-benzenesulfonate over TiO2-Cu2O under visible irradiation[J].Journal of Hazardous Materials,2009,168:215-219.
[7] Wei S,Ma Y,Chen Y,et al.Fabrication of WO3/Cu2O composite films and their photocatalytic activity[J].J Hazardous Mater,2011,194:243-249.
[8] Lin X,Zhou R,Zhang J,et al.A novel one-step electron beam irradiation method for synthesis of Ag/Cu2O nanocomposites[J].Appl Surf Sci,2009,256:889-893.
[9] Pan Q,Wang M,Wang H,et al.Novel method to deposit metal particles on transition metal oxide films and its application in lithium-ion batteries[J].Electrochim Acta,2008,54:197-202.
[10] Hu,Nian J,Teng H.Electrodeposited p-type Cu2O as photocatalyst for H2evolution from water reduction in the presence of WO3[J].Sol.Energy Mater.Sol.Cells,2008,92:1071-1076.
[11] 尤先锋,陈锋,张金龙,等.银促进的TiO2光催化降解甲基橙[J].催化学报,2006,27(3):270-274.
[12] 侯兴刚,吴晓玲,刘安东.Ag/TiO2薄膜光催化性能的研究[J].北京师范大学学报(自然科学版),2005,41(6):604-607.
[13] 刘守新,曲振平,韩秀文,等.Ag担载对TiO2光催化活性的影响[J].催化学报,2004,25(2):133-137.
