NaLn4-x(SiO4)3F∶xRE3+(Ln=La,Gd;RE=Tb,Dy,Sm,Tm)荧光材料的发光性能
2013-12-04郑成祥梁利芳郑金菊蒙丽丽张丽霞
郑成祥,梁利芳*,郑金菊,蒙丽丽,庞 起,张丽霞
(1.广西师范学院化学与生命科学学院,广西南宁 530001;2.玉林师范学院化学与材料学院,广西玉林 537000)
1 引 言
通过单一芯片荧光体转换的白光LED是当前的研究热点之一,其转换方式主要有三种:一是蓝色芯片结合黄色荧光粉;二是紫外芯片(300~410 nm)结合红蓝绿三种荧光粉;三是紫外芯片结合单一基质荧光粉。其中无机荧光材料在白光LED的研究中起着重要的作用。目前对白光LED用无机发光材料的研究主要集中在碱土金属的硅铝酸盐、硅铝氮化物、硫属化合物、钨钼酸盐等基质化合物,以氟氧化物为基质研究白光LED用荧光材料也成为研究热点之一[1]。在不同的配位状态下,氟离子(136 pm)和氧离子(140 pm)的半径十分接近,氟氧离子的互相取代可以发生在各种结构的化合物中,而这种取代不仅导致大量化合物的产生,同时在结构和性质上也引起明显的变化[2]。从某种程度上来说,氟氧化物兼具氧化物和氟化物的特点,激活离子在其中的发光性能也会有所不同,而氟化物的低声子能量的特点能减少激活离子激发态的猝灭,利于提高发光效率[3]。目前关于氟氧化物基质荧光粉的研究主要集中在以下几类:氟铝酸盐M3AlO4F(M=Sr,Ca,Ba)[4-9]、Ca2Al3O6F[10]、Ca12All4O32F2[2];稀土氟氧化物 LnOF(Ln=La,Gd,Y)[11-13];氟磷酸盐 M5(PO4)3F(M=Ba,Sr,Ca)[14]、Ca2RF4PO4(R=Gd,Y)[15];氟硅酸盐[16-17]等。由于各种稀土离子在配位环境下具有丰富的4f-4f或5d-4f能级跃迁,因此通过掺杂稀土离子进入非光学活性基质有可能获取性能优良的荧光发射,得到符合白光LED用的荧光粉。而以NaLn4-x(SiO4)3F(Ln=La,Gd)为基质,Tb3+、Dy3+、Sm3+和 Tm3+等稀土离子作为激活剂的发光材料尚未见有报道。
本文利用简单的高温固相法合成稀土离子掺杂的氟硅酸盐基NaLn4-x(SiO4)3F∶xRE3+(Ln=La,Gd;RE=Tb,Dy,Sm,Tm)系列荧光粉,研究Tb3+,Dy3+,Sm3+,Tm3+等各种掺杂稀土离子在紫外光激发下的发光性能,探讨能被近紫外芯片激发的新型白光LED用的氟氧化物基质发光材料。
2 实 验
2.1 样品的制备
按化学计量比分别称取一定量的SiO2,Ln2O3(Ln=La,Gd),RE2O3(RE=Tm,Dy,Sm)或Tb4O7和NaF(过量50%,NaF既是反应物又是助熔剂),所有试剂均为分析纯。将4种物质混合于玛瑙研钵中研磨约0.5 h,然后装入刚玉坩埚中,放置于马弗炉中升温加热,在950℃保持2 h,冷却后得目标产物。
2.2 样品的表征
采用日本理学D/MAX2500PC型X射线衍射仪(转靶18 kW)对粉末样品进行物相分析,辐射源为Cu靶Kα1射线 (λ=0.154 1 nm)。采用日本日立公司F-2500荧光分光光度计进行荧光性能测试,激发和发射狭缝均为2.5 nm,扫描范围为220~700 nm。所有测试均在室温下进行。
3 结果与讨论
3.1 样品的XRD分析
由于掺杂离子 Sm3+(96.4 pm)、Tb3+(92.3 pm)Dy3+(90.8 pm)和 Tm3+(86.9 pm)等与基质离子 La3+(106.1 pm)或 Gd3+(93.8 pm)均为稀土离子,电荷相同,半径相近,所以掺杂离子在合成时比较容易进入基质的晶格并部分取代基质离子的位置。图1为Tb3+、Tm3+、Dy3+以及Sm3+等掺杂的 NaLn4(SiO4)3F(Ln=La,Gd)样品的XRD图谱。4个样品的衍射峰均符合 NaLa4-(SiO4)3F 的标准谱(JCPDS Card No.21-1364),没有观察到杂相峰,说明样品的晶体结构均属于六方晶系。NaGd3.80(SiO4)3F∶0.20Tm3+的衍射峰相对于NaLa4(SiO4)3F的标准谱红移比较明显,这是由于基质离子Gd3+和掺杂离子Tm3+的半径均比La3+离子小很多,根据布拉格方程2dsinθ=nλ,晶面间距变小将导致衍射角变大。XRD测试结果表明,所合成样品中稀土掺杂离子进入了基质晶格,并主要取代稀土基质离子的位置。

图1 合成样品的 XRD图谱。(a)NaLa3.84(SiO4)3F∶0.16Tb3+;(b)NaLa3.96(SiO4)3F∶0.04Sm3+;(c)NaGd3.80(SiO4)3F∶0.20Tm3+;(d)NaLa3.64(SiO4)3F∶0.36Dy3+。Fig.1 XRD patterns of the obtained-samples.(a)NaLa3.84-(SiO4)3F ∶0.16Tb3+.(b)NaLa3.96(SiO4)3F ∶0.04Sm3+.(c)NaGd3.80(SiO4)3F ∶0.20Tm3+.(d)NaLa(SiO)F∶0.36Dy3+ .3.6443
3.2 NaLa4-x(SiO4)3F∶xTb3+的发光性能
Tb3+离子的基态为7FJ(J=6,5,4,3,2,1,0),激发态一般为5D3和5D4。在低浓度掺杂的情况下,会同时观察到5D3→7FJ和5D4→7FJ两种发射;但当掺杂浓度增大时,由于相邻Tb3+离子之间的5D3和5D4能级出现交叉弛豫,比如Tb3+(5D3)+Tb3+(7F6)→Tb3+(5D4)+Tb3+(7F0),会使5D3→7FJ发射猝灭,而5D4→7FJ发射增强。
图2 是 NaLa4-x(SiO4)3F∶xTb3+(x=0.04,0.16)在254 nm激发下的发射光谱和在544 nm监测下的激发光谱。由图可知,样品能够被254 nm紫外光有效激发。当Tb3+离子掺杂浓度比较低时(如x=0.04,图2(a)所示),观察到一些比较弱的发射峰,中心分别位于 414,437,457,489,544,585,622 nm,其中414,437,457 nm 分别归属于 Tb3+离子的5D3→7F5、5D3→7F4和5D3→7F3跃迁,而489,544,585,622 nm 分别归属于Tb3+离子的5D4→7F6、5D4→7F5、5D4→7F4和5D4→7F3跃迁。当Tb3+离子掺杂浓度比较高时(如x=0.16,图2b(2)所示),由于所掺杂的Tb3+离子在晶格的分布比较密,处于激发态的5D3能级容易向近邻的Tb3+离子发生能量共振传递[18],因而观察不到5D3→7FJ跃迁,而只观察到强烈的5D4→7FJ发射。其中544 nm(5D4→7F5)的跃迁发射峰最强,489 nm(5D4→7F6)次之,其余两个发射峰比较弱,此时样品主要表现为绿光发射。对于绿光发射而言,Tb3+离子可以掺杂到较高浓度而不引起荧光浓度猝灭。
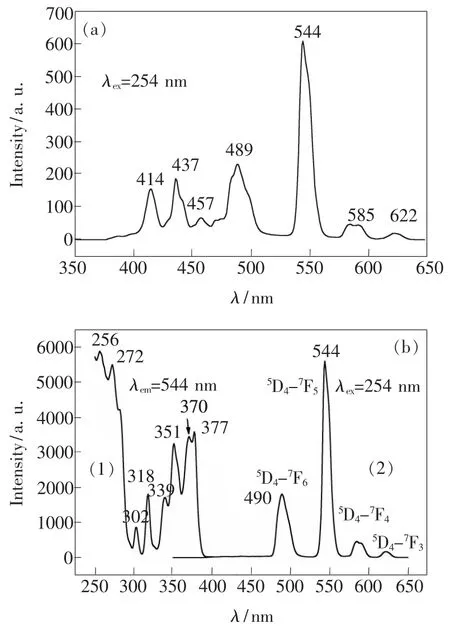
图 2 (a)NaLa3.96(SiO4)3F∶0.04Tb3+的发射光谱;(b)NaLa3.84(SiO4)3F∶0.16Tb3+的激发光谱(1)和发射光谱(2)。Fig.2 (a)Emission spectrum of NaLa(SiO)F∶0.04Tb3+ .3.9643(b)Excitation(1)and emission(2)spectra of Na-La(SiO)F∶0.16Tb3+ .3.8443
图 2b(1)是 NaLa3.84(SiO4)3F∶0.16Tb3+在544 nm检测下的激发光谱。激发光谱由两部分组成,300 nm之前为强的吸收宽峰,300~400 nm之间为吸收锐峰。位于 302,318,339,351,370,377 nm的激发峰归属于Tb3+离子的4f-4f跃迁吸收峰,而300 nm之前的强吸收宽峰应该为Tb3+离子的4f8→4f75d1的跃迁吸收。由于电子在能级间跃迁需要遵守一定的选择定则,而无论是氧化物还是氟化物基质,Tb3+离子的4f75d1组态都比O2--Tb3+电荷迁移态处于更低的能量位置(40 000~50 000 cm-1),因此,为了消除Tb3+离子的“宇称禁戒”,与4f组态混入的相反宇称能级是自身的4f75d1组态,而不是电荷迁移态。文献说明在200~300 nm范围出现 Tb3+离子的4f8→4f75d1跃迁吸收,其中包括4f8→4f75d1自旋允许的跃迁吸收(ΔS=0)和自旋不允许的跃迁吸收(ΔS=1)[19-21]。前者能量比较高,吸收强度比较大;而后者能量比较小,吸收强度也比较小,两者之间的能量差大约在6 000 cm-1左右。例如在Ca2Ba3(PO4)3Cl∶Tb3+体系中[19],4f8→4f75d1自旋允许和自旋不允许的跃迁吸收峰分别为228 nm 和264 nm;而在 SrF2∶Tb3+和 LaOF∶Tb3+体系中[20-21],则分别为216 nm和258 nm以及212 nm和240 nm。和文献相比,图2b(1)所观察到的4f8→4f75d1吸收峰有点红移(两个强的吸收峰分别为256 nm和272 nm,而弱的肩峰为282 nm),很可能是在氟硅酸盐体系中晶体场对Tb3+离子5d轨道的分裂比较大,造成4f8→4f75d1吸收峰发生红移。
3.3 NaLn4-x(SiO4)3F∶xDy3+(Ln=La,Gd)的发光性能
图 3(a)是 NaLa3.96(SiO4)3F∶0.04Dy3+的激发光谱,监测波长为479 nm。从图中可以观察到位于295,325,350,364,388 nm 的系列锐峰,这些锐峰分别归属于 Dy3+离子的6H15/2→4D7/2、6H15/2→ 6P3/2、6H15/2→6P7/2、 6H15/2→6P5/2和6H15/2→4M21/2的能级跃迁,其中 350 nm处的6H15/2→6P7/2跃迁吸收峰强度最大[19]。图谱在254 nm附近基本没有吸收峰,这是因为O2--Dy3+电荷迁移态以及 Dy3+离子的5d能级均处在50 000 cm-1以上,因此用短紫外辐射不能有效地激发 NaLa3.96(SiO4)3F∶0.04Dy3+,但是用近紫外辐射可以激发该荧光粉。
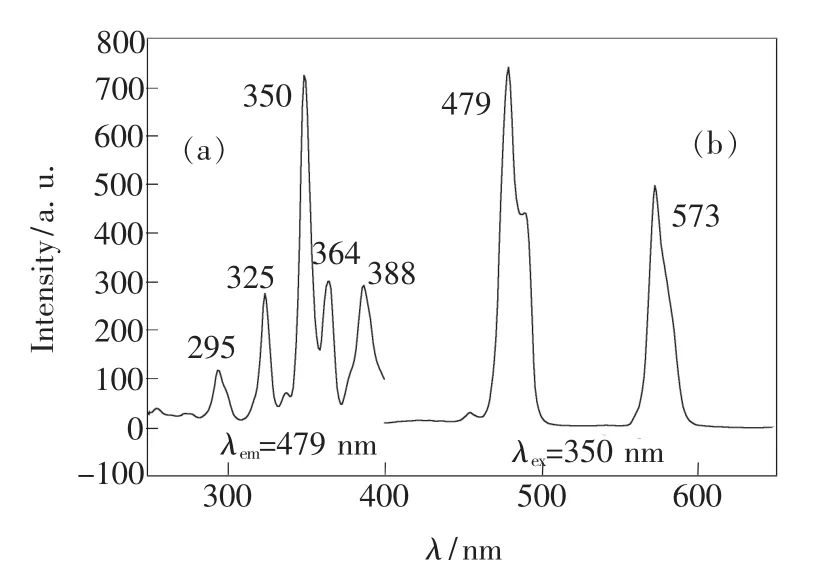
图 3 NaLa3.96(SiO4)3F∶0.04Dy3+的激发光谱(a)和发射光谱(b)Fig.3 Excitation(a)and emission(b)spectrum of NaLa3.96(SiO4)3F∶0.04Dy3+
图3(b)是 NaLa3.96(SiO4)3F∶0.04Dy3+在350 nm激发下的发射光谱。由图可知,在479 nm和573 nm处有强的发射峰,而且前者的峰强大于后者。479 nm处的蓝光发射峰归属于Dy3+离子的4F9/2→6H15/2能级跃迁,属于磁偶极跃迁(ΔJ=3);而572 nm处的黄光发射峰归属于Dy3+离子的4F9/2→6H13/2能级跃迁,属于电偶极跃迁(ΔJ=2),受晶体场的影响比较大。只有当Dy3+离子占据无反演对称中心的低对称性格位时,4F9/2→6H13/2(572 nm)才可能成为主要能级跃迁。NaLa3.96(SiO4)3F∶0.04Dy3+的4F9/2→6H13/2(572 nm)的能级跃迁强度仅次于4F9/2→6H15/2(479 nm),说明 Dy3+离子占据的格位偏离反演对称中心[14]。
图4 是 NaGd3.96(SiO4)3F∶0.04Dy3+在 275 nm激发下的发射光谱和在监测481 nm波长的激发光谱。比较图4和图3可以发现,NaGd3.96(SiO4)3F∶0.04Dy3+的 发 射 光 谱 与 NaLa3.96(SiO4)3F ∶0.04Dy3+相似,但两个发射峰位置有点红移,分别位于481 nm 和 575 nm,而且 NaGd3.96(SiO4)3F∶0.04 Dy3+的发光强度明显小于 NaLa3.96(SiO4)3F∶0.04Dy3+。NaGd3.96(SiO4)3F∶0.04Dy3+和 NaLa3.96(SiO4)3F∶0.04Dy3+的激发光谱有所不同的,NaGd3.96(SiO4)3F∶0.04Dy3+在 246,253,275 nm 处多出 3 个峰,而且最强激发峰为275 nm。这3个激发峰归属于Gd3+离子的能级跃迁,其中275 nm对应于离子的8S7/2→6IJ能级跃迁[22]。由于掺杂的Dy3+离子主要进入基质离子La3+或Gd3+的格位,Dy3+离子半径(90.8 pm)与 Gd3+离子半径(93.8 pm)相近,比La3+离子半径(106.1 pm)小,所以 Dy3+离子取代La3+离子格位时会造成更大的晶格局域环境变化,而这有利于Dy3+离子的发光,所以NaLa3.96(SiO4)3F∶0.04Dy3+的发光比 NaGd3.96(SiO4)3F∶0.04Dy3+的强。

图 4 NaGd3.96(SiO4)3F∶0.04Dy3+的激发光谱(a)和发射光谱(b)Fig.4 Excitation(a)and emission(b)spectra of NaGd3.96-(SiO4)3F∶0.04Dy3+
另外,在 NaLn4-x(SiO4)3F∶xRE3+(Ln=La,Gd;RE=Tb,Dy,Sm,Tm)荧光体系中,Tb3+离子可以大浓度掺杂而不引起猝灭,而Dy3+离子在摩尔分数超过1%时会出现浓度猝灭。在NaLa4-x(SiO4)3F∶xDy3+体系中,当 x=0.04(摩尔分数1%)时荧光最强;而在NaGd4-x(SiO4)3F∶xDy3+体系中,x=0.02(摩尔分数 0.5%)时荧光最强。
3.4 NaLa4-x(SiO4)3F∶xSm3+的发光性能
图5 是 NaLa3.96(SiO4)3F∶0.04Sm3+体系在403 nm激发下的发射光谱和监测600 nm波长的激发光谱。在403 nm激发下,NaLa3.96(SiO4)3F∶0.04Sm3+发射出橙光。由谱图可以观察到在564,600,648 nm处有3个发射峰,其中600 nm为最强峰。这3个发射峰分别归属于Sm3+离子的4G5/2→6H5/2(564 nm)、4G5/2→6H7/2(600 nm)和4G5/2→6H9/2(648 nm)跃迁,其中4G5/2→6H5/2(ΔJ=0)和4G5/2→6H7/2(ΔJ=1)跃迁均为电偶极和磁偶极允许,尤其是4G5/2→6H7/2(ΔJ=1),基本不受配位环境的影响,即便是在对称性很低的环境下也依然保持着磁偶极跃迁。但是4G5/2→6H9/2跃迁(ΔJ=2)只是电偶极允许,受配位环境影响比较大,只有在对称性比较低的配位环境中才能产生。所以掺杂离子的晶体场配位环境对4G5/2→6H9/2(648 nm)跃迁的影响大于4G5/2→6H5/2(564 nm)和4G5/2→6H7/2(600 nm)跃迁,如果Sm3+离子占据具有反演中心的对称格位,648 nm的发射会很弱。由图5(b)可以看出,NaLa3.96(SiO4)3F∶0.04Sm3+的648 nm的发射强度比较弱,说明Sm3+离子占据的格位偏离反演中心的程度比较小[23]。
由图5(a)可以看到,在监测波长为600 nm时,样品的激发光谱由两部分构成:在300~500 nm范围的多个锐峰以及小于250 nm的谱带(因检测条件的限制,没有得到完整的谱带)。300~500 nm范围的多个锐峰均对应于Sm3+离子的4f-4f跃迁,其中 403nm为最强激发峰,归属于6H5/2→4L13/2;而小于250 nm的谱带很可能是O2--Sm3+的电荷迁移带吸收引起[24]。

图 5 NaLa3.96(SiO4)3F∶0.04Sm3+的激发光谱(a)和发射光谱(b)Fig.5 Excitation(a)and emission(b)spectra of NaLa3.96-(SiO4)3F∶0.04Sm3+
3.5 NaLn4-x(SiO4)3F∶xTm3+(Ln=La,Gd)的发光性能
Tm3+常常被用作蓝光发射的激活离子,NaLa3.96(SiO4)3F∶0.04Tm3+在 357 nm 激发下的发射光谱如图6(a)所示,在453 nm出现一个发射峰,归属于Tm3+离子的1D2→3F4能级跃迁。图6(b)是 NaGd3.98(SiO4)3F∶0.02Tm3+体系在 275 nm激发下的发射光谱以及监测615 nm波长的激发光谱。NaGd3.98(SiO4)3F∶0.02Tm3+的荧光光谱与 NaLa3.96(SiO4)3F∶0.04Tm3+有很大不同。激发光谱由若干个激发峰组成,分别位于229,254,275,312 nm附近,其中在275 nm处的吸收峰强度最大,这些激发峰对应于Gd3+离子能级吸收跃迁。Tm3+离子的3P2和1S0能级分别位于262 nm 和126 nm[25],229 nm的激发带很可能是O2--Tm3+的电荷迁移带[26]。275,312 nm 处的吸收峰分别归属于 Gd3+离子的8S7/2→6IJ和8S7/2→6PJ能级跃迁[22]。发射光谱在 416,438,470,486,544,593,613 nm 附近有 7个发射峰,其中前面4个峰归属于Tm3+离子的1D2→3F4和1G4→3H6能级跃迁发射,后3处的发射峰很可能是铽离子(544 nm)和铕离子(593,613 nm)的污染造成。
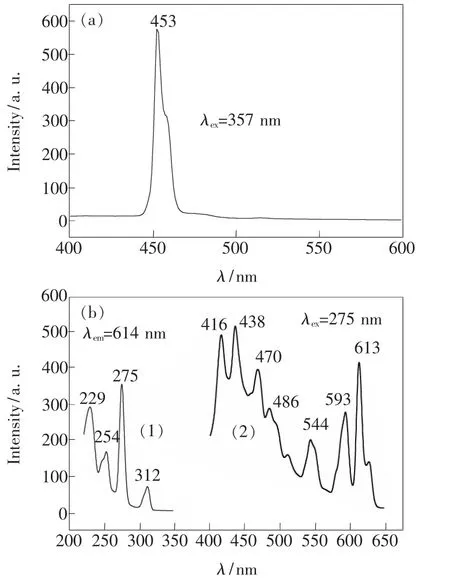
图 6 (a)NaLa3.96(SiO4)3F∶0.04Tm3+的发射光谱;(b)NaGd3.98(SiO4)3F∶0.02Tm3+的激发光谱(1)和发射光谱(2)。Fig.6 (a)Emission spectrum of NaLa3.96(SiO4)3F ∶0.04Tm3+.(b)Excitation(1)and emission(2)spectra of NaGd(SiO)F∶0.02Tm3+ .3.9843
3.6 样品的CIE色坐标分析
图7标示出了所合成样品的CIE色坐标。掺杂 Tm3+离子的两个样品 NaLa3.96(SiO4)3F∶0.04Tm3+(a)和 NaGd3.98(SiO4)3F ∶0.02Tm3+(b),色坐标分别为(0.152,0.043)和(0.263,0.213),后者靠近白光;掺杂Dy3+离子的两个样品 NaLa3.96(SiO4)3F∶0.04Dy3+(c)和 NaGd3.96-(SiO4)3F∶0.04Dy3+(d),色坐标分别为(0.282,0.325)和(0.305,0.332),两者均落入白光区;掺杂 Tb3+离子的两个样品中,NaLa3.84(SiO4)3F∶0.16Tb3+(f)的色坐标(0.272,0.589)明显大于NaLa3.96(SiO4)3F ∶0.04Tb3+(e) 的 色 坐 标(0.229,0.396),说明掺杂离子的浓度对样品的色坐标影响比较大;NaLa3.96(SiO4)3F∶0.04Sm3+(g)的色坐标(0.557,0.440)则落在橙光区。

图7 样品的CIE色坐标图Fig.7 The CIE chromaticity coordinates of the samples
4 结 论
利用简单的高温固相法合成了稀土离子掺杂的NaLn4-x(SiO4)3F∶xRE3+(Ln=La,Gd;RE=Tb,Dy,Sm,Tm)系列荧光粉。在紫外光激发下,NaLn4-x(SiO4)3F∶xRE3+(Ln=La,Gd;RE=Tb,Dy,Sm,Tm)发出所对应掺杂稀土离子的特征发射。NaLa4-x(SiO4)3F∶xTb3+主要为544 nm(5D4→7F5)绿光发射;NaLn4-x(SiO4)3F∶xDy3+主要为479 nm的蓝光发射(4F9/2→6H15/2)和572 nm的黄光发射(4F9/2→6H13/2),前者的强度稍大于后者,整体表现为白光辐射;NaLa4-x(SiO4)3F∶xSm3+的600 nm(4G5/2→6H7/2)为最强发射峰;NaLa4-x(SiO4)3F∶xTm3+只在 453 nm(1D2→3F4)处有一个发射峰,而 NaGd3.98(SiO4)3F∶0.02Tm3+在400~500 nm范围出现Tm3+离子的多个发射峰。Tb3+离子可以高浓度掺杂而不引起荧光浓度猝灭,而Dy3+、Sm3+和Tm3+离子容易引起浓度猝灭,只能低浓度掺杂。NaGd4-x(SiO4)3F∶xRE3+(RE=Dy,Tm)在275 nm处出现Gd3+离子的8S7/2→6IJ能级跃迁吸收。
[1]Ye S,Xiao F,Pan Y X,et al.Phosphors in phosphor-converted white light-emitting diodes:Recent advances in materials,techniques and properties[J].Mater.Sci.Eng.R,2010,71(1):1-34.
[2]Huang K W,Chen W T,Chu C I,et al.Controlling the activator site to tune europium valence in oxyfluoride phosphors[J].Chem.Mater.,2012,24(11):2220-2227.
[3]Zakaria D,Fouriner M T,Mahiou R,et al.On Eu3+luminescence in the hexagonal NaYF4phase[J].J.Alloys Compd.,1992,188(1):250-254.
[4]Park S M,Vogt T.Defect monitoring and substitutions in Sr3-xAxAlO4F(A=Ca,Ba)lattices and phosphors[J].J.Phys.Chem.C,2010,114(26):11576-11538.
[5]Shang M M,Li G G,Kang X J,et al.Tunable luminescence and energy transfer properties of Sr3AlO4F∶RE3+(RE=Tm/Tb,Eu,Ce)phosphors[J].ACS Appl.Mater.Interf.,2011,3(7):2738-2746.
[6]Anant A,Setlur,Emil V,et al.Energy-efficient,high-color-rendering LED lamps using oxyfluoride and fluoride phosphors[J].Chem.Mater.,2010,22(13):4076-4082.
[7]Park S M,Vogt T.Near UV excited line and broad band photoluminescence of an anion-ordered oxyfluoride[J].J.Am.Chem.Soc.,2010,132(13):4516-4517.
[8 ]Im W B,Brinkley S,Hu J,et al.Sr2.975-xBaxCe0.025AlO4F:A highly efficient green-emitting oxyfluoride phosphor for solid state white lighting[J].Chem.Mater.,2010,22(9):2842-2849.
[9]Fang Y,Li Y,Qiu T,et al.Photoluminescence properties and local electronic structures of rare earth-activated Sr3AlO4F[J].J.Alloys Compd.,2010,496(1-2):614-619.
[10]Xia Z G,Liu R S.Tunable blue-green color emission and energy transfer of Ca2Al3O6F∶Ce3+,Tb3+phosphors for near-UV white LEDs[J].J.Phys.Chem.C,2012,116(29):15604-15609.
[11]Armelao L,Bottaro G,Bovo L,et al.Luminescent properties of Eu-doped lanthanum oxyfluoride sol-gel thin films[J].J.Phys.Chem.C,2009,113(32):14429-14434.
[12]Fujihara S,Tokumo K.Chemical processing for inorganic fluoride and oxyfluoride materials having optical functions[J].J.Fluorine Chem.,2009,130(12):1106-1110.
[13]Im W B,George N,Kurzman J,et al.Efficient and color-tunable oxyfluoride solid solution phosphors for solid-state white lighting[J].Adv.Mater.,2011,23(20):2300-2305.
[14]Nagpure I M,Shinde K N,Dhoble S J,et al.Photoluminescence characterization of Dy3+and Eu2+ion in M5(PO4)3F(M=Ba,Sr,Ca)phosphors[J].J.Alloys Compd.,2009,481(1-2):632-638.
[15]Huang Y L,Yosuke N,Taiju T,et al.The new red-emitting phosphor of oxyfluoride Ca2RF4PO4∶Eu3+(R=Gd,Y)for solid state lighting applications[J].Opt.Exp.,2011,19(7):6303-6311.
[16]Feng G,Jiang W H,Chen Y B,et al.A novel red phosphor NaLa4(SiO4)3F∶Eu3+[J].Mater.Lett.,2011,65(1):110-112.
[17]Zhang X M,Seo H J.Photoluminescence properties of Ce3+,Mn2+co-doped Sr2LiSiO4F phosphor[J].Phys.B,2010,405(10):2436-2439.
[18]Blasse G,Grabmaier B C.Luminescence Materials[M].Berlin:Springer-Verlag,1994:Chapter 4-5.
[19]Shang M M,Geng D L,Yang D M,et al.Luminescence and energy transfer properties of Ca2Ba3(PO4)3Cl and Ca2Ba3-(PO4)3Cl∶A(A=Eu2+/Ce3+/Dy3+/Tb3+)under UV and low voltage electron bean excitation [J].Inorg.Chem.,2013,52(6):3102-3112.
[20]Zhang C M,Hou Z Y,Chai R T,et al.Mesoporous SrF2and SrF2∶Ln3+(Ln=Ce,Tb,Yb,Er)hierarchical microspheres:Hydrothermal synthesis,growing mechanism,and luminescent properties[J].J.Phys.Chem.C,2010,114(15):6928-6936.
[21]Shang M M,Geng D L,Kang X J,et al.Hydrothermal derived LaOF∶Ln3+(Ln=Eu,Tb,Sm,Tm,and/or Ho)nanocrystals with multicolor-tunable emission properties[J].Inorg.Chem.,2012,51(20):11106-11116
[22]Ptacek P,Schäfer H,Zerzouf O,et al.Crystal phase control of NaGdF4∶Eu3+nanocrystals:influence of the fluoride concentration and molar ratio between NaF and GdF3[J].Cryst.Growth Des.,2010,10(5):2434-2438.
[23]Park S M.Structure-composition-luminescence correlations in Sr2.5-3x/2Ba0.5SmxAl1-yInyO4F(0.001≤x,y≤0.1)oxyfluorides[J].J.Solid State Chem.,2012,186(1):204-207.
[24]Park S M.Luminescent properties of Sr2.5-3x/2Ba0.5SmxAlO4F oxyfluorides[J].J.Lumin.,2012,132(4):875-878.
[25]Carnall W T,Fields P R,Rajnak K.Electronic energy levels in the trivalent lanthanide aquo ions.I.Pr3+,Nd3+,Pm3+,Sm3+,Dy3+,Ho3+,Er3+,and Tm3+[J].J.Chem.Phys.,1968,49(10):4424-4442.
[26]Liu X M,Yan L S,Lin J.Synthesis and luminescent properties of LaAlO3∶RE3+(RE=Tm,Tb)nanocrystalline phosphors via a sol-gel process[J].J.Phys.Chem.C,2009,113(19):8478-8483.
