鹀科8种鸟类遗传多样性及亲缘关系的AFLP分析
2013-12-03姜云垒王海
李 时, 姜云垒, 刘 宝, 王海
张立世1, 张天末3
(1. 吉林农业大学 动物科学技术学院, 长春 130118; 2. 东北师范大学 分子表观遗传学教育部重点实验室, 长春 130024;3. 大连理工大学 生命科学与技术学院, 辽宁 大连 116024)
鹀科(Emberizidae)隶属于雀形目, 全世界共72属321种, 我国分布6属31种[1], 其中东北地区分布19种[2]. 由于鹀科鸟类间相似的形态结构特征, 因此, 研究人员对鹀科鸟类的分类和亲缘关系等问题的研究目前仍存争议[3-7].
Alstörm等[7]研究表明, 苇鹀与芦鹀间的亲缘关系较近, 与红颈苇鹀的亲缘关系较远; 梁刚等[8]利用CoⅠ基因(细胞色素c 氧化酶亚基Ⅰ)序列对这3种鹀进行的系统发育研究表明, 苇鹀与红颈苇鹀比其和芦鹀的亲缘关系更近. 关于栗斑腹鹀与三道眉草鹀和白头鹀间的亲缘关系研究目前尚存争议[9-10].
研究表明, 扩增片段长度多态性(AFLP)在鹀属种系发生及亲缘关系中具有较高的物种区分能力, 可较好地区分不同物种或相同物种不同分布区内的个体[11]. 因此, 本文选取芦鹀、 苇鹀、 红颈苇鹀、 栗斑腹鹀、 三道眉草鹀、 白头鹀、 雪鹀和铁爪鹀为研究对象, 以大山雀作为外群, 利用AFLP技术分析8种鹀的亲缘关系及遗传多样性, 并构建系统进化树, 为解决上述8种鹀的分类及亲缘关系提供理论依据.
1 材料和方法
1.1 材 料
共使用33个样本, 均为2007~2009年从野外采集成熟个体的肌肉样, 代表了鹀科的8种鸟类, 并选择大山雀作为外群. 样本及其来源列于表1, 每个物种选取2个以上的个体作为实验样本. 样本浸泡在无水乙醇中, 于-20 ℃保存.
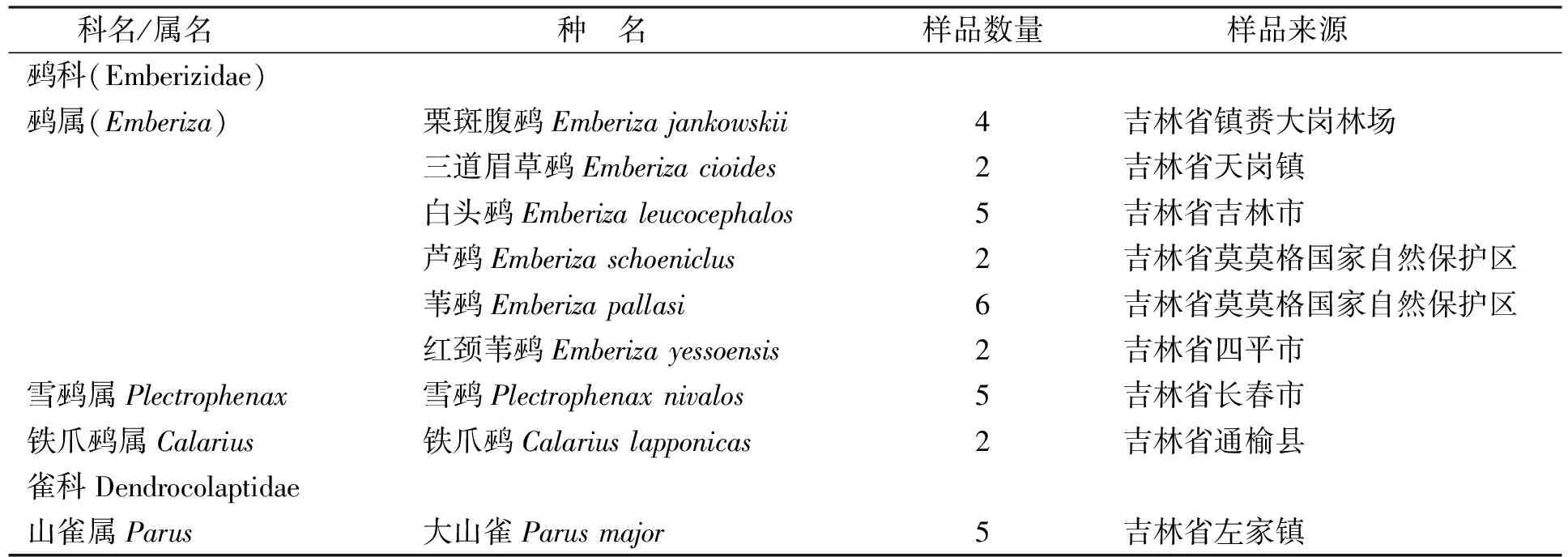
表1 样本及其来源
DNA提取所用蛋白酶K、 苯酚和氯仿均购自大连宝生物;AFLP引物和接头均由上海生工生物合成;PCR扩增所需药品试剂均购自上海生工生物; 采用美国MJResearch公司生产的MJResearchPTC-200和德国Biometra公司生产的T1型PCR扩增仪扩增; 采用北京六一仪器厂生产的DYY-100型电泳仪进行电泳检测.
1.2 方 法
1.2.1 基因组DNA提取 采用蛋白酶K消化、 酚-氯仿抽提、 无水乙醇沉淀的方法提取基因组DNA[12], 用琼脂糖凝胶电泳法测定DNA分子量约为50 000, 且胶孔不发亮,DNA主带清晰, 无弥散带,RNA去除干净,DNA纯度较高, 符合AFLP技术要求, 如图1所示. 将提取的DNA溶液稀释10倍后, 通过比较DNA主带与λDNAMarker(10ng/μL)间的亮度估测样本DNA的质量浓度, 提取后的DNA加超纯水稀释至100ng/μL, 于-20 ℃保存.
1.2.2AFLP分析 采用AFLP技术[13]优化反应体系和反应条件.
1.2.2.1 基因组DNA的酶切和接头连接 取300ng基因组DNA, 用EcoRⅠ和Mse Ⅰ进行双酶切, 酶切片段与EcoRⅠ和MseⅠ接头连接, 反应体系为20μL: 300ng基因组DNA, 2.0μL10×T4连接缓冲液, 1μgBSA, 2.5pmolEcoRⅠ接头, 50pmolMse Ⅰ接头, 50.01nkatEcoRⅠ酶, 50.01nkatMse Ⅰ酶, 8.335nkatT4连接酶, 加超纯水至20μL. 酶切连接时间为8h, 其中37 ℃酶切4h, 8 ℃连接4h. 酶切连接所用接头见表2.
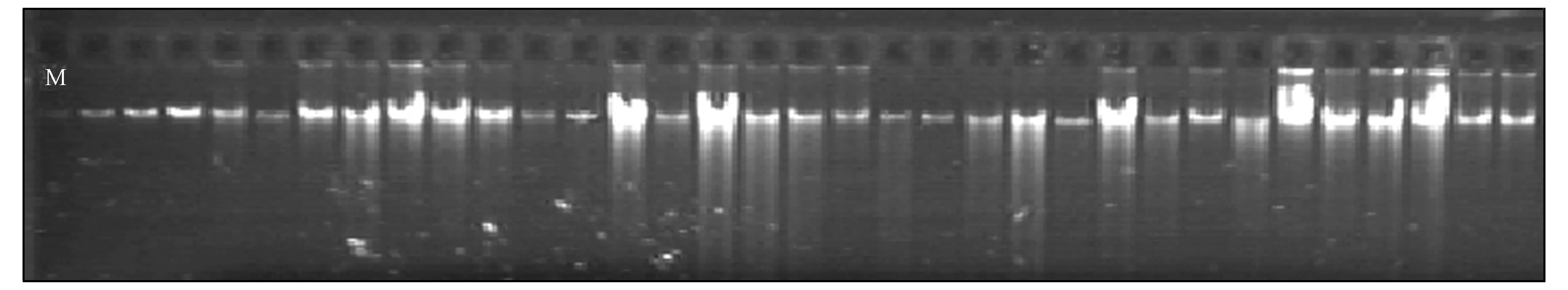
M为λDNA Marker.图1 DNA琼脂糖凝胶电泳Fig.1 DNA agsrose electrophoresis

表2 连接所用的接头
1.2.2.2 限制性片段的扩增 采用3′端带有1个选择性碱基的引物组(EcoR Ⅰ+A/MseⅠ+C)预扩增限制性片段, 反应体系为25 μL: 2 μL连接产物, 2.5 μL 10×PCR缓冲溶液, 2.5 mmol dNTP, 30 ngEcoR Ⅰ+A, 30 ngMseⅠ+C, 16.67 nkat Taq酶, 加超纯水至25 μL. PCR反应条件为: 94 ℃预变性5 min; 94 ℃ 45 s, 56 ℃ 30 s, 72 ℃ 80 s, 共29个循环; 72 ℃延伸10 min.EcoR Ⅰ+A的引物序列为5′-GACTGCGTACCAATTCA-3′;MseⅠ+C的引物序列为5′-GATGAGTCCTGAGTAAC-3′. 选择性扩增引物带有3个选择性碱基, 从64对引物中筛选9对条带清晰且多态性较好的引物组合进行选择性扩增, 分别为M-CAT/E-ACT,M-CAT/E-ACC,M-CTA/E-ACC,M-CTA/E-ACT,M-CTC/E-ACC,M-CTG/E-ACT,M-CTG/E-ACC,M-CTT/E-ACT和M-CTT/E-ACC. 选择性扩增的反应体系为15 μL: 20倍稀释的预扩增限制性片段产物2 μL, 1.5 mmol dNTP, 1.5 μL 10×PCR缓冲溶液, 3 ngEcoR Ⅰ, 18 ngMseⅠ, 8.335 nkat Taq酶, 加超纯水至15 μL. PCR反应条件为: 94 ℃预变性2 min; 94 ℃ 30 s, 65 ℃ 30 s, 72 ℃ 80 s, 每个循环退火温度降低1 ℃; 9个循环后, 再进行34个循环扩增, 条件为94 ℃ 30 s, 55 ℃ 30 s, 72 ℃ 80 s; 72 ℃延伸10 min.
1.2.2.3 电泳检测 取15 μL选择性扩增产物, 加7 μL 3×上样缓冲液, 上样于质量分数为5%的聚丙烯酰胺变性胶上进行电泳, 缓冲液为1×TBE, 电泳条件为: 55 W恒定功率, 电泳3 h. 用银染方法显示AFLP谱带, 如图2所示.

(A) M-CAT/E-ACT(B) M-CTG/E-ACT图2 引物组合扩增的AFLP指纹谱Fig.2 AFLP fingerprinting amplified with primer
1.2.3 数据统计分析 每条扩增条带记为一个分子标记, 每两个样品间的分子标记进行比对, 当位点有扩增条带时赋值为1, 否则赋值为0, 仅统计清晰的扩增条带, 将整个AFLP扩增谱转化成“1”和“0”的信息矩阵. 利用NTSYSpc-2.10e软件提供的Jaccard系数计算不同物种间的相似性系数:
式中:NAB为两个个体的共有条带数;NA和NB分别为个体A和B的条带数.

括号中的数字代表该鸟的样本编号.图3 8种鹀的UPGMA聚类树Fig.3 UPGMA tree of 8 buntings
2 结 果
利用改良后的AFLP方法研究从64对引物中筛选9对多态性较好的鹀科3属8种鸟类的亲缘关系, 共得到438条清晰条带, 其中鹀科内多态性条带为316, 占72.1%; 属内多态性条带为239, 占54.6%; 栗斑腹鹀、 三道眉草鹀和白头鹀的多态性条带为190, 占43.4%; 芦鹀、 苇鹀和红颈苇鹀的多态性条带为35, 占8.0%.
本文以大山雀作为外群, 利用NTSYSpc-2.10e软件构建了8种鹀的UPGMA系统进化树, 如图3所示. 由图3可见, 8种鹀分为两类, 其中A类包括所有鹀属鸟类, B类包括铁爪鹀属的铁爪鹀和雪鹀属的雪鹀, 所选的外群大山雀为一类, 其与鹀科鸟类间的相似性系数仅为0.272 6.
在A进化支中可分为两支, 一支包括栗斑腹鹀、 三道眉草鹀和白头鹀, 其中栗斑腹鹀和三道眉草鹀间的亲缘关系较近, 相似性系数为0.779 7, 二者与白头鹀间的亲缘关系均较远, 相似性系数为0.637 8. 另一分支包括芦鹀、 苇鹀和红颈苇鹀, 其中苇鹀和红颈苇鹀间的亲缘关系较近, 相似性系数为0.952 1, 与芦鹀间的亲缘关系较远, 相似性系数为0.883 0. 两支间的相似性系数为0.449 5.
在B类中, 铁爪鹀和雪鹀为一支, 二者的相似性系数为0.568 2, B进化支与A进化支间的相似性系数为0.460 0.
3 讨 论
3.1 鹀属亲缘关系和遗传多样性
由于栗斑腹鹀分布范围狭窄, 且身体和头部羽色与三道眉草鹀和白头鹀相似, 并与三道眉草鹀的繁殖分布区相互重叠. 因此, 文献[9]认为栗斑腹鹀为三道眉草鹀和白头鹀的杂交种. 文献[10]研究栗斑腹鹀的分布及其繁殖习性表明, 白头鹀并未在栗斑腹鹀繁殖区内出现, 认为栗斑腹鹀不一定为三道眉草鹀与白头鹀的杂交种. 本文研究表明, 栗斑腹鹀与三道眉草鹀和白头鹀为同一支系, 且与三道眉草鹀的亲缘关系较近, 与白头鹀和其他鹀属鸟类亲缘关系较远, 该结果与文献[7-8]的研究结果基本一致, 但并不能证明栗斑腹鹀为三道眉草鹀和白头鹀的杂交种.
在鹀属的另一进化支中, 苇鹀与红颈苇鹀的相似性系数为0.952 1, 又与芦鹀的相似性系数为0.883 0, 表明苇鹀与红颈苇鹀的亲缘关系较近, 与芦鹀的亲缘关系稍远. 其中栗斑腹鹀与三道眉草鹀和白头鹀间的多态性条带较多, 芦鹀、 苇鹀和红颈苇鹀间的多态性条带较少, 表明其具有较低的遗传多样性.
3.2 铁爪鹀和雪鹀
本文将铁爪鹀和雪鹀从鹀属中分离, 单独分为一个进化支, 与鹀属间的相似性系数仅为0.460 0, 与文献[13-14]研究结果相符.
[1] 郑光美. 世界鸟类分类与分布名录 [M]. 北京: 科学出版社, 2002: 232-239.
[2] 高玮. 中国东北地区鸟类及其生态学研究 [M]. 北京: 科学出版社, 2006: 272-282.
[3] Paynter R A, Storer R W. Subfamily Emberizinae, Buntings and American Sparrows [C]//Paynter R A, Jr. Check-List of Birds of the World. Vol.13 Mus Comp Zool. Cambridge: MA, 1970: 3-214.
[4] Avise J C, Patton J C, Aquadro C F. Evolutionary Genetics of Birds Ⅱ. Conservative Protein Evolution in North American Sparrows and Relatives [J]. Syst Biol, 1980, 29(4): 323-334.
[5] Yuri T, Mindell D P. Molecular Phylogenetic Analysis of Fringillidae, “New World Nine-Primaried Oscines” (Aves: Passeriformes) [J]. Mol Phylogenet Evol, 2002, 23(2): 229-243.
[6] Ericson P G P, Johansson U S. Phylogeny of Passerida (Aves: Passeriformes) Based on Nuclear and Mitochondrial Sequence Data [J]. Mol Phylogenet Evol, 2003, 29(1): 126-138.
[7] Alstörm P, Olsson U, Lei F M, et al. Phylogeny and Classification of the Old World Emberizini (Aves, Passeriformes) [J]. Mol Phylogenet Evol, 2007, 47(3): 960-973.
[8] LIANG Gang, LI Tao, YIN Zuo-hua, et al. Molecular Phylogenetic Analysis of Some Fringillidae Species Based on Mitochondrial CoⅠ Gene Sequences [J]. Zoological Research, 2008, 29(5): 465-475. (梁刚, 李涛, 尹祚华, 等. 利用CoⅠ基因序列对雀科鸟类的分子系统发育关系初探 [J]. 动物学研究, 2008, 29(5): 465-475.)
[9] Yamashina Y. Notes onEmberizajankowskiiTaczanowski with Special Reference to Its Speciation [J]. J Fac Sci Hokkaido Univ Ser Ⅵ: Zool, 1957, 13: 164-171.
[10] FU Tong-sheng, CHEN Peng. The Distribution and Breeding Habits ofEmberizajankowskii[J]. Acta Zool Sin, 1966, 18(2): 195-198. (傅桐生, 陈鹏. 栗斑腹鹀的分布及其繁殖习性 [J]. 动物学报, 1966, 18(2): 195-198.)
[11] JIANG Yun-lei, LI Shi, WANG Hai-tao, et al. AFLP Markers Analysis of Genetic Diversity inEmberiza[J]. Journal of Jilin University: Science Edition, 2007, 45(4): 686-690. (姜云垒, 李时, 王海涛, 等. AFLP分子标记在鹀属遗传多样性分析中的初探 [J]. 吉林大学学报: 理学版, 2007, 45(4): 686-690.)
[12] YAN Fei-huan, ZUO Zheng-hong, CHEN Mei, et al. Analysis of Genetic Diversity and Relationship among Some Chinese Domestic Ducks and Wild Ducks Using AFLP [J]. Journal of Xiamen University: Natural Science, 2005, 44(5): 729-733. (鄢绯寰, 左正宏, 陈美, 等. 我国部分家鸭和野鸭遗传多样性及亲缘关系的AFLP分析 [J]. 厦门大学学报: 自然科学版, 2005, 44(5): 729-733.)
[13] Vos P, Hogers R, Bleeker M, et al. AFLP a New Technique for DNA Fingerprinting [J]. Nucleic Acids Research, 1995, 23(21): 4407-4414.
[14] Tordoff H B. Relationships in the New World Nine-Primaried Oscines [J]. The Auk, 1954, 71(3): 273-284.
