诱变选育雄烯二酮高产菌株及其发酵条件研究
2013-12-03黄丽君张洪斌胡雪芹
黄丽君,张洪斌,胡雪芹
(合肥工业大学制药工程系,合肥230009)
雄烯二酮(androstenedione)是甾体激素类药物的重要中间体[1],对机体起着非常重要的调节作用,目前主要通过微生物选择性降解植物甾醇侧链所得。微生物法制取雄烯二酮具有产品纯度高,不受原材料限制,易于大规模生产等优点[2,3],但是也普遍存在底物植物甾醇在水相中溶解度小,菌种转化能力低等缺点。
为了选育发酵性能优良菌种,本文研究采用新型的N+注入法与NTG法对分枝杆菌进行联合诱变,以选育优良的雄烯二酮高产菌株。
亚硝基胍(NTG)是一种高效的化学诱变剂,在适当的条件下,菌体的死亡率低而诱变率高,对每一细胞可以诱发一次至多次突变,因此有超诱变剂之称[4]。离子注入是20世纪80年代兴起的一种材料表面处理技术。中国科学家独辟蹊径,将离子注入这一高新技术应用于农作物品种改良并获得成功,由此开始了注入离子与生物体系相互作用过程的探索[5,6],目前广泛应用于生物诱变育种中。利用低能离子注入具有生理损失小、突变范围广、突变程度高的特点,希望能够筛选到高产突变菌株[7]。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种来源
分枝杆菌(Mycobacterium sp.),由本实验保藏。
1.1.2 试剂和仪器
植物甾醇和雄烯二酮(购于湖北远成药业);其他试剂均为分析纯,水为去离子水。SPX-250型生化培养箱(上海跃进医疗器械厂);岛津GC-2014气相色谱仪(日本岛津);HC-3018R高速冷冻离心机(科大创新股份有限公司中佳分公司);HQL300B恒温摇床(武汉中科科学仪器厂)。
1.1.3 培养基
斜面培养基:高氏Ⅰ号培养基3.75%,甘油2.0%,pH值7.2。
筛选培养基:植物甾醇1%,硝酸钾0.1%,磷酸氢二钾0.05%,硫酸镁 0.05%,氯化钠 0.05%,硫酸亚铁0.001%,琼脂2%,pH值7.2。
种子培养基:BPD复合酵母膏1.5%,葡萄糖0.6%,磷酸氢二铵0.06%,硝酸钠0.54%,pH值7.2。
转化培养基:有机相为大豆油10%,植物甾醇1%,水相为红糖1.5%,麦芽糖1.08%,磷酸氢二铵0.06%,硝酸钠0.54%,pH值7.2。
1.1.4 培养条件
斜面培养基:温度30℃ ~32℃,生长周期5~7 d。
种子培养基:温度30℃ ~32℃,转速250 r/min,生长周期60 h。
转化培养基:温度30℃ ~32℃,接种量10%,转速250 r/min,发酵周期 7 d。
1.2 实验方法
1.2.1 菌悬液的制备
挑取1环斜面培养基上已活化好的菌株,接入灭菌的、装有玻璃珠的三角瓶中,置于31℃,250 r/min的恒温摇床中震荡30 min,获得菌悬液,并将其稀释至细胞浓度约为107~108个/mL左右,备用。
1.2.2 NTG诱变方法
NTG配制:NTG结晶50 mg,加助溶剂丙酮1 mL溶解,用pH值6.0的磷酸盐缓冲液配制成2.5 mg/mL原液。
诱变处理:取0.8 mL菌悬液,按 NTG终浓度0.2、0.4、0.6、0.8、1.0 mg/mL 依次加入NTG 原液,用缓冲液补至1 mL,对照只加缓冲液,31℃水浴处理30 min,用生理盐水稀释以终止反应,涂皿分离。统计单菌落个数并计算致死率。
1.2.3 N+注入诱变
选择经NTG诱变后产率最高的突变株作为出发菌株,制备菌悬液。取5 mL适量稀释后的菌悬液和5 mL 30%的甘油混合,摇匀后取0.1 mL均匀涂布于无菌平皿中,由无菌风吹干后进行N+注入,以经过真空处理而不注入离子束的菌株作为对照。该工作在中国科学院合肥分院离子束生物工程重点实验室进行,选择注入能量为10keV,注入剂量为(20~80)×1011ions/cm2,靶室真空度为10-3Pa。N+注入完毕后,用1 mL无菌水反复冲洗平板上的菌膜使其混合均匀,然后移取0.1 mL于筛选固体培养基中,31℃倒置培养5~7d,统计单菌落个数并计算致死率。
1.2.4 平板初筛方法
筛选培养基是由无机培养基添加1%的植物甾醇制成的,除了植物甾醇几乎不含有任何碳源成分,因此只有能够利用植物甾醇的菌株才能在平板中正常生长。将诱变后的菌悬液各取0.1 mL均匀涂布于筛选培养基中,挑选长势良好的突变株用于下一级筛选。
1.2.5 摇瓶复筛方法
将初筛出来的菌株逐一接种至种子培养基,培养60 h后以10%的接种量转接至发酵培养基中,31℃,250 r/min恒温培养7 d。利用薄层色谱法初步判断转化情况,气相色谱内标法准确测定产率,来验证菌体的转化能力。
1.2.6 遗传稳定性实验
为了检测突变菌株的遗传稳定性,将复筛所得到的高产突变株每7 d传代1次,连续7代,摇瓶发酵测定产率。
1.3 发酵条件研究
发酵培养基初始 pH 值分别调为6.5、7.0、7.5、8.0、8.5,接种量为10%,于31℃、250 r/min的恒温摇床培养7 d后测定产率。
确定最佳pH值后,向发酵培养基中分别接种6%、8%、10%、12%、14%、16%的种子液,于 31℃、250 r/min的恒温摇床培养7 d后测定产率。
确定最佳pH值和接种量后,调整摇床转速分别为180 r/min、200 r/min、220 r/min、240 r/min、260 r/min、280 r/min,于31℃恒温摇床培养7d后测定产率。
1.4 检测方法
1.4.1 薄层色谱法(TLC)定性分析
用乙酸乙酯以2:1的比例充分萃取发酵液,9000 r/min离心10 min。取上清液,用定量毛细管取样5 μL,点于高效G硅胶板。以乙酸乙酯:石油醚=3:7为展开剂展开。展层结束后自然风干薄板,用10%H2SO4为显色剂喷涂,100℃下加热显色至明显,与标准品比对(见图1)。

图1 薄层层析分析图Fig 1 TLC analysis
1.4.2 气相色谱内标法(GC)定量检测
岛津GC-2014气相色谱系统:色谱柱为REX-5不锈钢柱;载气为N2;载气流速为1 mL/min;进样口温度为300℃,柱温300℃,FID检测器温度为280℃。含量采用内标法[8]计算,内标物为胆固醇。
相对校正因子的计算:准确称量相同摩尔量的胆固醇的雄烯二酮标准品,溶于乙酸乙酯中,用20 mL容量瓶定量。进样得测量结果,计算出相对校正因子。

经计算得出相对校正因子为1.313。
样品制备:将反应结束后的发酵液,用2倍体积的乙酸乙酯充分萃取,然后将萃取液旋蒸至少于20 mL,用20 mL容量瓶定量,准确加入与理论产值相同摩尔量的胆固醇标品,进样得测量结果,计算产品产率。

2 结果与分析
2.1 诱变及筛选结果
2.1.1 NTG诱变结果
统计各剂量组生成的单菌落个数,计算不同剂量组的致死率,并每组随机挑选一定数量长势良好的单菌落,以出发菌株为对照,进行摇瓶发酵筛选后,得到不同剂量组下的正突变率(高于出发菌株5%以上)。NTG浓度对雄烯二酮产生菌诱变效果的影响见表1。

表1 NTG诱变处理的致死率和正突变率Table 1 The positive lethal rate and mutant rate after NTG mutation
从表1可以看出,致死率随着NTG浓度的增加而提高,正突变率先随着诱变菌株死亡率的增加而提高,又后逐渐降低,在NTG浓度为0.6 mg/mL时,正向突变率最大,此时致死率为75.2%。现代育种理论认为,诱变的微生物致死率在70%~75%时,能够得到较好的诱变效果,负突变率较低,能得到大量的正突变菌株。因此确定NTG诱变时的最佳浓度为0.6 mg/mL。
在此基础上对原始菌株进行多次诱变,共筛选出100株长势良好的突变菌株,进行摇瓶发酵实验,并测定产物产率。结果表明,这100株突变菌株中产率明显提高的有3株,产率分别为65.5%、60.4%、61.9%。将其中产率最高的突变株连续传代7次,产率基本保持不变,证明其遗传稳定性良好,将其编号为Mycobacterium sp.N-1,作为N+注入诱变的出发菌株。
2.1.2 N+注入诱变
以NTG诱变后得到的最高产菌株Mycobacterium sp.N-1为出发菌株,进行N+注入诱变。N+注入剂量对雄烯二酮产生菌诱变效果的影响见表2。
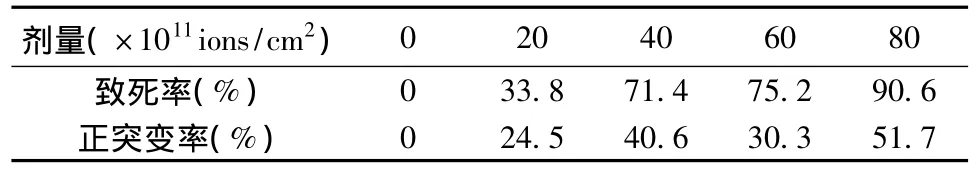
表2 N+注入诱变处理后的致死率和正突变率Table 2 The positive lethal rate and mutant rate after N+implantation mutation
从表2可以看出,随着N+注入剂量的增加,菌株死亡率也逐渐增加,当离子剂量为60×1011ions/cm2时,致死率达到75.2%。因此根据现代育种理论选择离子强度10keV,离子剂量60×1011ions/cm2作为该菌株的最佳离子注入参数。
在此基础上对菌株Mycobacterium sp.N-1进行多次诱变,共筛选出100株长势良好的突变菌株,进行摇瓶发酵实验,并测定产物产率。这100株突变菌株中产率明显提高的有3株,产率分别为86.5%、83.9%、82.0%。将产率最高的突变株编号为Mycobacterium sp.N-2,进行连续传代实验。
2.2 遗传稳定性实验
对得到的高产菌株N-2进行遗传稳定性考察。具体实验过程:高产菌株单菌落→种子培养基→摇瓶发酵测雄烯二酮产率,结果如表3所示。连续传代7次后产率比较稳定,可见菌株N-2是一株稳定高产的雄烯二酮产生菌。

表3 突变株N-2的遗传稳定性实验结果Table 3 The experimental results of genetic stability for mutation strain N-2
2.3 诱变效果
挑选经N+注入诱变后性状大、长势良好的单菌落进行摇瓶发酵复筛。结果发现在注入剂量为60×1011ions/cm2的实验组中筛选得到高产突变株Mycobacterium sp.N-2,其产率与原始菌株相比提高了37.8%。图2为突变株N-2转化产物的GC图谱,可见雄烯二酮出峰时间在8.9 min左右,胆固醇出峰时间在17.9 min左右。另外底物植物甾醇转化完全,且几乎无副产物生成,这对后续纯化工艺非常有利。而原始菌株在相同的反应时间内并不能将产物转化完全,并且随着转化时间的延长,副产物的量也随之增加。

图2 突变株N-2转化产物的GC图谱Fig 2 GC chromatograms of mutation strain N-2 bioconversion
2.4 发酵条件研究结果
2.4.1 初始pH值对发酵的影响
培养基的pH值对微生物的生命活动有着很大的影响,主要是对酶的活性产生影响。菌体内含有的酶均有其最适pH值,pH值过高或过低都会使其活性降低,甚至有可能导致酶彻底失活而使转化不能进行。分别考察pH值6.5、7.0、7.5、8.0、8.5时对诱变菌株发酵过程的影响,实验结果如图3。从图中可知,pH值对菌株转化能力有较大影响,初始pH值为7.5时最有利于生长和转化。

图3 初始pH值对发酵过程的影响Fig 3 Effect of initial pH on fermentation process
2.4.2 接种量对发酵的影响
适当的接种量是正常发酵的关键因素。分别考察接种量为6%、8%、10%、12%、14%、16%时对菌株发酵过程的影响,实验结果如图4。从图中可知,菌株的最适接种量为12%。接种量低于12%,菌体生长较慢,发酵周期长,在相同的时间内发酵产率低。接种量高于12%时菌体虽然生长过快,但是过快的菌体生长会导致营养基质和溶氧不足,菌体容易衰老和自溶,反而不利于产物的生物合成。

图4 接种量对发酵过程的影响Fig 4 Effect of incubation volume on fermentation process
2.4.3 摇床转速对发酵的影响
摇床转速的大小能够影响到培养基中通气量的多少,而分枝杆菌是好氧菌,若供氧不足会影响微生物的生理代谢和产物生成量。分别考察摇床转速为180 r/min、200 r/min、220 r/min、240 r/min、260 r/min、280 r/min 时对发酵过程的影响,实验结果如图5。从图中可知,随着转速的不断增加,菌株降解底物的能力也不断增加。最终确定最适摇床转速为260 r/min,此时产率最高。

图5 转速对发酵过程的影响Fig 5 Effect of rotating speed on fermentation process
3 结论
目前,雄烯二酮的研究内容集中在寻找新的产雄烯二酮菌株[9]或通过基因工程手段对菌株进行分子改造[10],或者采用不同的诱变技术进行选育[11]。Olga V Egorova等人利用菌株对抑菌剂的耐受性筛选出一株突变菌株Mycobacterium sp.VKM Ac-1815D,并对其发酵条件进一步优化,将其产率提高到 70%左右[12]。Vrushali Gulla等人[13]利用UV、NTG、丝裂霉素等方法对一株偶发分枝杆菌进行诱变选育,得到高产菌株Mycobacterium fortuitum subsp.fortuitum NCIM 5239,产率能达到71.3%。本研究采用NTG法与新型诱变育种手段低能N+注入联合诱变选育雄烯二酮高产菌株,其中N+注入诱变在分枝杆菌选育中首次应用,并取得了很好的效果,筛选到一株比原始菌株产率提高了将近37.8%的高产突变株Mycobacterium sp.N-2,且遗传性状较为稳定。同时通过单因素实验确定高产突变菌株的最佳发酵条件为初始pH值7.5,接种量12%,摇床转速260 r/min。实验证实这两种诱变方法联合应用在分枝杆菌的育种中是切实可行的。
[1]杨 英,姜绍通.微生物降解甾醇侧链转化雄甾-4-烯-3,17-二酮的研究进展[J].微生物学通报,2006,33(6):142-145.
[2]袁超东,董艳苓,杜连祥.分枝杆菌降解大豆甾醇侧链的发酵研究[J]. 天津轻工业学报,2003,18(4):11-13.
[3]王志龙.甾醇侧链切除的微生物转化技术[J].工业微生物,2006,36(3):49-54.
[4]赵 凯,王 颖,王 旋,等.NTG和UV复合诱变选育紫杉醇高产菌株的研究[J].黑龙江大学自然科学学报,2008,25(1):74-76.
[5]余增亮.离子束与生命科学—一个新的研究领域[J].物理,1997,26(6):333-338.
[6]虞 龙,余增亮.一种新型诱变技术在Vc前体(2-KL G)产生菌遗传改良中的作用[J].高技术通讯,2002,11:41-46.
[7]赵洪英,李 彦,裴鸿娇,等.N+离子束注入庆大霉素产生菌诱变效应研究[J]. 天津理工学院学报,2001,17(1):14-17.
[8]Vidal M,Becerra J,Mondaca M A,et al.Selection of Mycobacterium sp.strains with capacity to biotransform high concentrations of β-sitosterol[J].Appl Microbiol Biotechnol,2001,57:385-389.
[9]Lin Y L,Song X,Fu J,et al.Microbial transformation of phytosterol in corn flour and soybean flour to 4-androstene-3,17-dione by Fusarium moniliforme sheld[J].Bioresource Technology,2009,100:1864-1867.
[10]Wei W,Fan S Y,Wang F Q,et al.A new steroid-transforming strain of Mycobacterium neoaurum and cloning of 3-ketosteroid 9α-hydroxylase in NwIB-01 [J].Appl Biochem Biotechnol,2010,162:1446-1456.
[11]Malaviya A,Gomes J.Androstenedione production by biotransformation of phytosterols[J].Bioresource Technology,2008,99(15):6725-6737.
[12]Olga V E,Seraphima A G,Irina F P,et al.Production of androstenedione using mutants of Mycobacterium sp.[J].J Chem Technol Biotechnol,2002,77:141-147.
[13]Vrushali G,Tushar B,Shridhar P.Bioconversion of soysterols to androstenedione by Mycobacterium fortuitum subsp.fortuitum NCIM 5239,a mutant derived from total sterol degrader strain[J].J Chem Technol Biotechnol,2010,85:1135-1141.
